矮牵牛花朵大小及相关性状遗传分析
张林霞,张 蔚,张书婷,孙苗苗,张晓敏,李志能,刘国锋
(1.广州市林业和园林科学研究院,广东 广州 510405;2.西南大学 园艺园林学院,重庆 400715;3.湖北省农业科学院 经济作物研究所,湖北 武汉 430064)
花朵大小是影响植物观赏价值的重要性状,同时与传粉者造访的概率[1]以及种子大小[2]密切相关,具有重要的商业价值和生物学意义。多数研究表明,植物花朵大小属于数量性状,相对于质量性状而言,其遗传背景比较复杂,常受微效多基因控制,是多个基因共同作用的结果,且这种相互作用的形式高度可变[3-5]。传统的遗传学研究方法在数量性状的研究上无法获得理想的效果,从而在很大程度上阻碍了花朵大小遗传调控机制的解析。目前,针对数量性状的分析主要有主基因+多基因混合遗传模型分析以及数量性状基因座(Quantitative trait loci,QTL)分析。近年来,有关花大小的QTL分析在月季[6-7]、报春花[8]、百合[9]等植物中取得一定进展。主基因+多基因混合遗传模型分析也在蓝雪花[10]、连翘[11]、德国鸢尾[12]等植物的花大小遗传研究中获得了一定成果。
矮牵牛(Petunia hybridaVilm.)为茄科碧冬茄属植物,具有突出的观赏价值,在园林绿化和家庭园艺中被广泛应用,享有“花坛植物之王”的称号。而且,由于其易于繁殖、生长周期较短、花叶器官显著、遗传连锁图谱较小等一系列原因,是研究众多性状遗传规律的理想材料,作为遗传学研究的重要材料具有悠久的历史[13]。迄今,国内外关于矮牵牛的研究主要集中在花色、花香、花器官发育等性状上[14],关于花朵大小的遗传研究相对较少,且研究结果不尽相同[15]。鉴于此,以矮牵牛大花型和小花型高代自交系为亲本构建四世代遗传群体(P1、P2、F1、F2),探究矮牵牛花朵大小的遗传规律,同时对F2分离群体的23 个数量性状(包括花朵大小)进行观测和相关性分析,揭示矮牵牛花器官大小与其他数量性状之间的关系,为挖掘矮牵牛花朵大小调控基因、揭示花器官大小调控机制奠定基础。
1 材料和方法
1.1 材料
亲本1(P1)和亲本2(P2)均为性状稳定的高代自交系,由广州市林业和园林科学研究院植物研究所经长期自交选育而来,其中P1表型为大花(花径9.0~10.3 cm),P2表型为小花(花径4.0~4.9 cm)。W115(Mitchel Diploid)由荷兰阿姆斯特丹大学Ronald 教授赠送,课题组自交保存,表型为中花(花径5.0~5.5 cm)。
1.2 试验方法
1.2.1 遗传群体构建 2020 年以P1为母本、P2为父本进行人工杂交,获得杂交一代(F1)种子,种植F1并从中随机选取单株进行自交获得F2,同时与W115杂交。2021 年于广州市林业和园林科学研究院观赏植物种质资源圃温室内播种四世代遗传群体(P1、P2、F1、F2)以及F1与W115 杂交群体。亲本材料各定植25~30 株,F1群体定植25 株,F2群体定植306 株,F1与W115 杂交群体定植133 株。所有试验植株均处于相同的栽培环境和水肥管理条件下。
1.2.2 性状观测 盛花期对各群体所有植株的花径进行测量,每株随机选取3~6 朵盛开的花。在F2群体中随机选取大花(花径≥9.0 cm)、中花(花径7.5~8.0 cm)、小花(花径≤5.0 cm)植株各15 株,每株随机选取3~6 朵盛开的花,分别测量花径、花冠筒长、花梗长、花梗直径、萼片长、萼片宽、雌蕊长、雄蕊长,同时测量苞片长、苞片宽、第1 位叶叶长、第1位叶叶宽、第1位叶叶柄长、第4位叶叶长、第4位叶叶宽、第4位叶叶柄长、上部茎直径、中部茎直径、株高和叶片数。叶片数为植株主枝基部第1片真叶开始至第1 朵花的叶片数量[16],其他性状测定方法参考《植物新品种特异性、一致性和稳定性测试指南矮牵牛》(NY/T 2508—2013)。
1.2.3 叶绿素含量测定 参照王学奎[17]的方法进行叶绿素含量测定。随机选取F1与W115杂交群体中大花和中花植株的苞片(第1 对)和叶片(苞片下第1—4 位叶片混合),去除叶脉后剪碎,称取0.1 g,加入4 mL 80%乙醇,置于黑暗环境中直至所有组织变白。以80%乙醇为空白对照,用紫外分光光度计测定溶液在665 nm 和649 nm 波长下的吸收值(A665和A649)。叶绿素a和叶绿素b含量采用公式计算。
叶 绿 素a 含 量(Ca)=(13.95A665-6.88A649)×(V/1 000)/W;
叶 绿 素b 含 量(Cb)=(24.96A649-7.32A665)×(V/1 000)/W;
总叶绿素(a+b)含量=Ca+Cb。
式中:V为提取液总体积(mL),W为样品质量(g)。每组样品至少3个生物学重复。
1.3 数据分析
利用Excel 2019 软件分别计算23 个表型性状的均值、最大值、最小值以及变异系数。方差分析及图表绘制采用GraphPad 8.0。利用Origin 2021 软件计算Pearson 相关系数,并绘制相关性图。利用SEA v2.0.1软件[18],选择群体类型为G4F2(P1、P2、F1、F2四世代群体)建立遗传模型,计算24 个遗传模型的极大似然值和AIC 值,选择AIC 值较小的模型作为备选模型,对备选模型进行适合性检验(U12、U22、U32、nW2、Dn),根据AIC 值最小原则和适合性检验结果选取最适遗传模型,采用最小二乘法对最适遗传模型的一阶遗传参数和二阶遗传参数进行估计。
2 结果与分析
2.1 花朵大小遗传分析
2.1.1 花朵大小表型分析 对矮牵牛四世代群体花径进行统计,结果如表1 所示,亲本1 的花径为9.0~10.3 cm,平 均9.5 cm;亲 本2 的 花 径 为4.0~4.9 cm,平均4.5 cm。F1群体的花径分布在7.3~8.4 cm,平均7.8 cm,全部植株的花径均介于两亲本之间,表现为中亲优势。亲本花径的变异系数在3.33%~4.92%,F1群体变异系数为3.86%,性状较为稳定;F2群体的花径分布在4.0~10.9 cm,变异幅度相对较大,变异系数为14.64%。根据F2群体绘制花径频数分布图并添加正态分布拟合曲线(图1),结果表明,F2群体表现为连续性分布,具有明显的数量性状遗传特性,适合进行数量性状遗传分析。
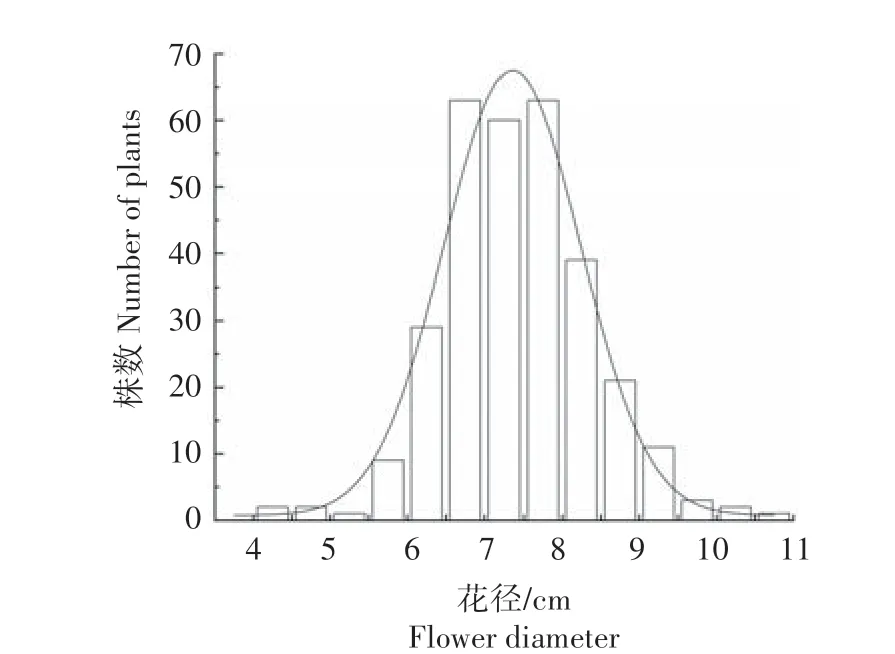
图1 矮牵牛F2群体花径频数分布Fig.1 Frequency distribution of flower diameter in petunia F2 population
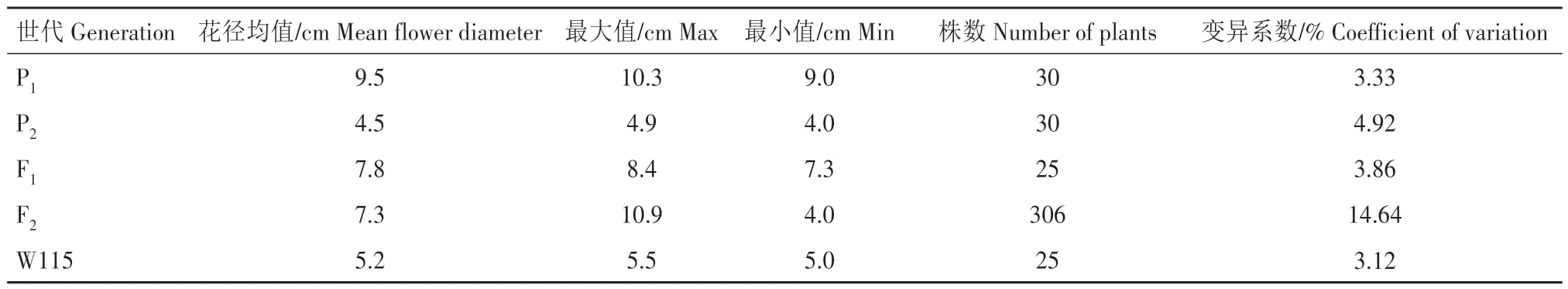
表1 矮牵牛四世代花径性状统计Tab.1 Statistics of flower diameter in four generations of petunia
2.1.2 主基因+多基因混合遗传模型分析 利用主基因+多基因混合遗传模型中的24个遗传模型对四世代遗传群体进行分析,根据AIC 值最小原则获得3 个备选模型(表2),分别是2MG-A、2MG-EAD、1MG-A。对备选模型进行适合性检验(U12、U22、U32、nW2、Dn),选取遗传模型达到显著性水平(P<0.05)的数值个数最少的作为最优模型,结果表明,备选模型均未达到显著水平,采用AIC 值最小原则为标准选取最适模型,即2MG-A。
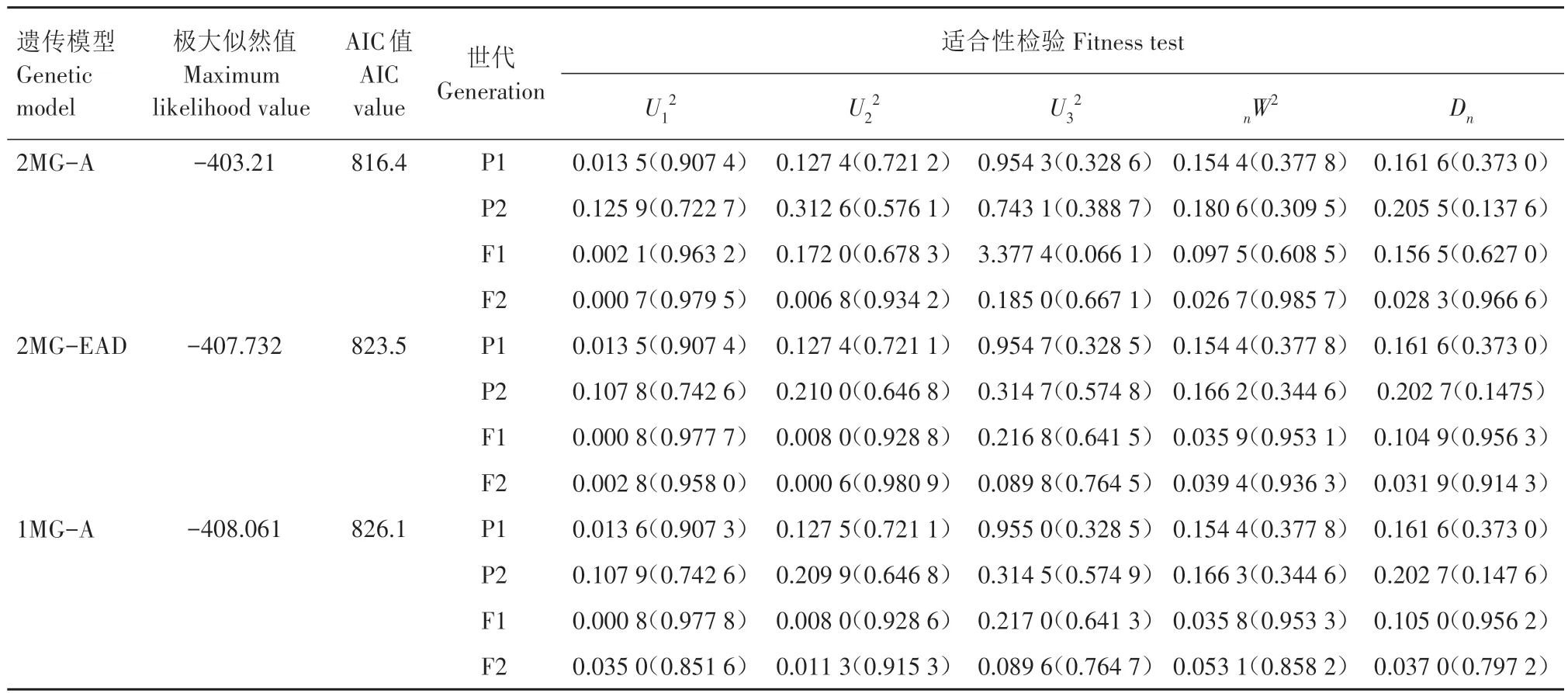
表2 各遗传模型极大似然值、AIC值和适合性检验Tab.2 Maximum likelihood value,AIC value and fitness test for each genetic model
通过最小二乘法估计一阶遗传参数和二阶遗传参数(表3),第1对主基因与第2对主基因的加性效应均表现为增效,第1 对主基因加性效应值为1.32,第2 对主基因加性效应值为0.95,主基因遗传率为95.38%。
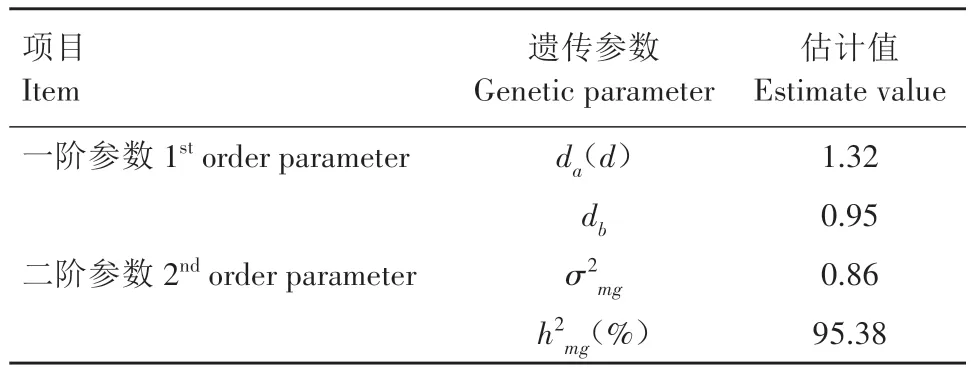
表3 矮牵牛F2群体花径遗传参数估计Tab.3 Estimation of floral diameter genetic parameters in F2 population of petunia
2.1.3 花朵大小遗传特点的杂交验证 为进一步验证花朵大小的遗传特点,将大、小花杂交F1(平均花径7.8 cm,与W115 相比,仍为大花)与W115(平均花径5.2 cm,中花)进行杂交,结果表明,后代出现明显的大花和中花性状分离。后代群体一共133株,其中大花植株61 株(花径7.3~8.6 cm),中花植株72株(花径5.2~5.8 cm),经卡方检验,表明大花植株与中花植株的分离比符合1∶1(χ2=0.014,P=0.907),说明矮牵牛的大花性状相对中花性状可能由一对主基因控制,且大花为显性。
2.2 其他性状分析
2.2.1 表型分析 为了探究矮牵牛花朵大小与其他数量性状之间的关系,分别测量大花、中花、小花的花部、叶部以及植株整体的性状指标,部分性状如图2 所示。通过对矮牵牛F2群体的23 个性状进行统计,计算其平均值、最大值、最小值以及变异系数(表4),结果表明,矮牵牛各部位性状均表现出了不同程度的变异,整体变异系数在7.67%~59.93%,平均变异系数为22.38%。花部性状变异系数在7.67%~34.52%,其中雌蕊长度变异系数最小,表现最为稳定;苞片宽度变异系数最大,稳定性较差。叶部性状变异系数在13.43%~59.93%,其中第1 位叶长宽比和第4 位叶长宽比变异系数较小,说明叶片形状特征较为稳定。植株整体性状变异系数在14.90%~18.13%,总体较为稳定。

图2 F2代群体不同花朵大小植株及各部位形态对比Fig.2 Comparison of plants with different floral sizes and their organs in F2 population
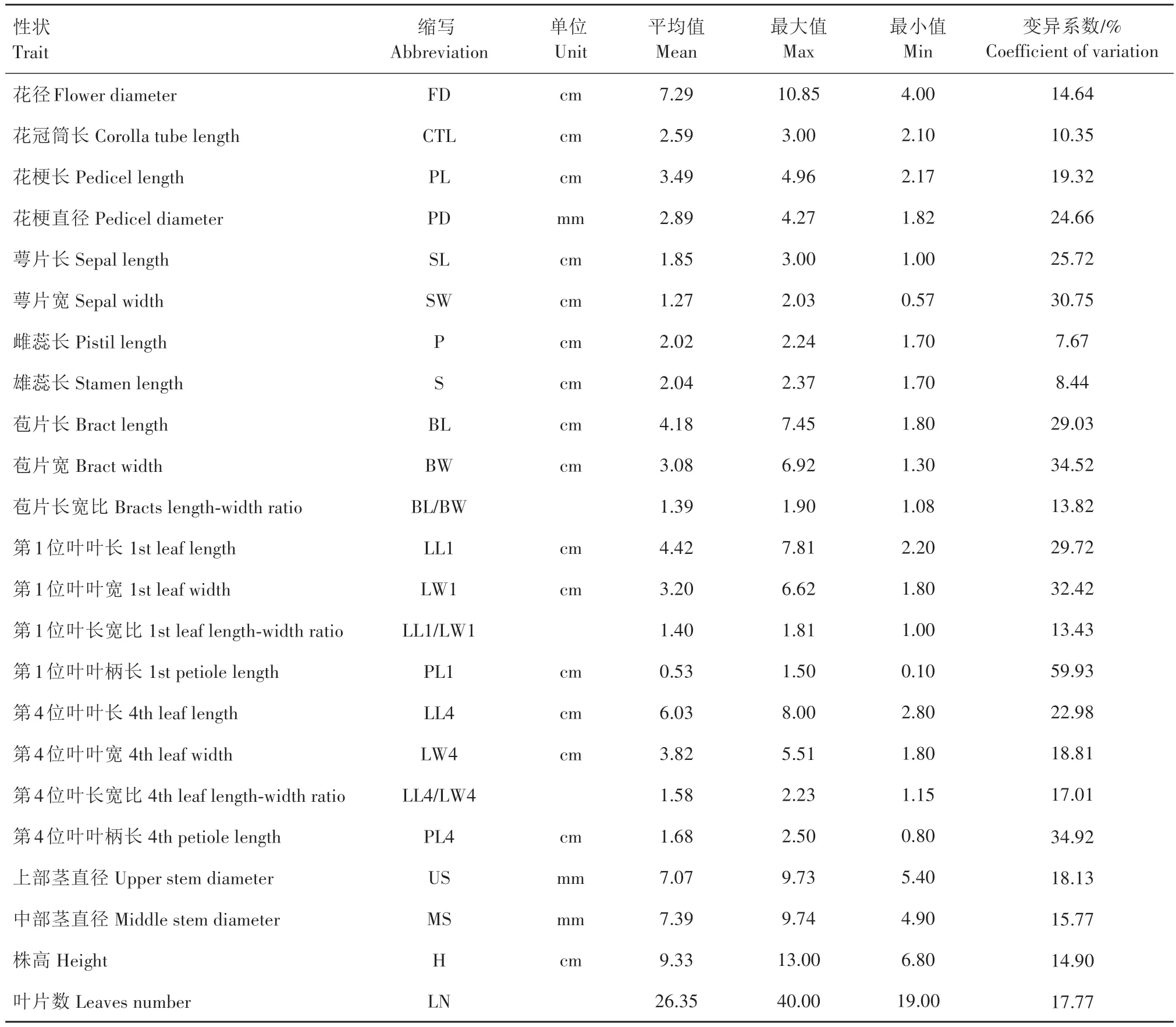
表4 矮牵牛F2群体花朵大小及相关性状统计Tab.4 Statistics of flower size and related characters in F2 population of petunia
2.2.2 不同花朵大小相关性状差异分析 对矮牵牛大花、中花、小花植株的23 个性状特征进行方差分析(图3),结果表明,在花部性状中,花径、花梗直径、萼片长、萼片宽、雄蕊长在大花、中花、小花之间均存在显著差异(P<0.05)或极显著差异(P<0.01);大花花冠筒长、雌蕊长与中花之间无显著差异(P>0.05),但与小花之间呈极显著差异(P<0.01);花梗长的变化幅度较小,仅在中花和小花之间存在显著差异(P<0.05)。苞片长与宽在中花植株中最大,且与大花和小花植株存在极显著差异(P<0.01)。
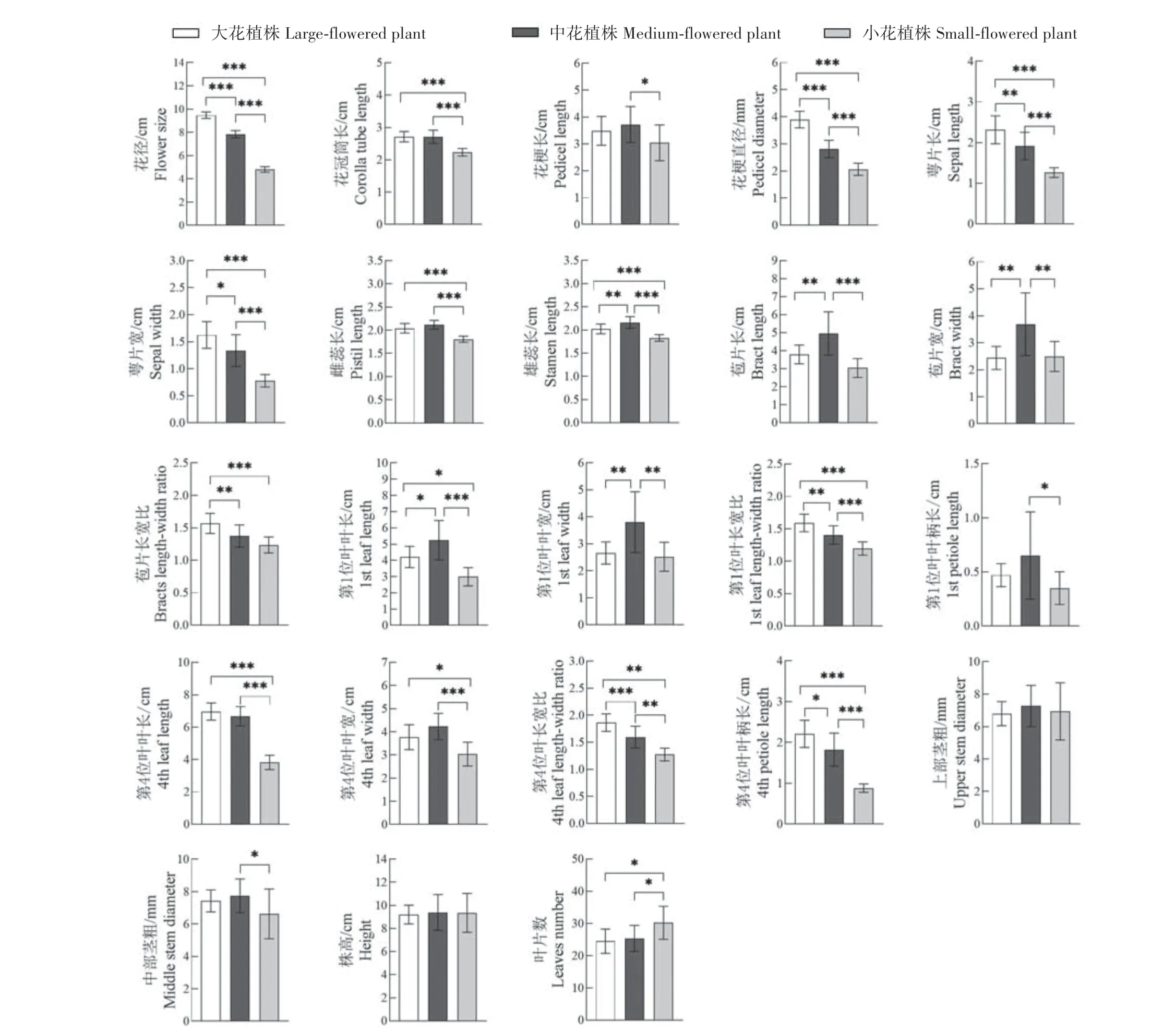
图3 F2群体不同花朵大小植株的性状差异分析Fig.3 Difference analysis of quantitative traits in plants of F2 population with different floral sizes
在叶部性状中,第1 位叶叶长和叶宽在中花植株中最大,且与大花和小花植株呈显著(P<0.05)或极显著性(P<0.01)差异,叶柄长仅在中花和小花植株中呈显著差异(P<0.05);第4 位叶叶长和叶宽在大花和中花植株之间无显著差异(P>0.05),但大花和中花植株均与小花植株相比呈现显著差异(P<0.05),叶柄长在大花、中花和小花植株中呈显著(P<0.05)或极显著差异(P<0.01)。
从植株整体性状来看,植株高度以及植株的上部茎粗在大花、中花、小花植株间均无显著差异(P>0.05),中部茎粗仅在中花和小花植株间存在显著差异(P<0.05);大花和中花植株的叶片数无显著差异(P>0.05),但小花植株的叶片数却明显多于大花和中花植株,且存在显著差异(P<0.05)。有研究表明,植物第1 个花序前的叶片数量可以用于量化开花时间[19],小花植株的叶片数显著多于中花和大花植株,说明花朵小的植株开花相对较晚。
2.2.3 花朵大小及其他性状相关性分析 对23 个数量性状进行Pearson 相关分析,结果(图4)表明,各数量性状间大多存在显著性相关,说明各性状之间相互关联。

图4 F2群体数量性状的相关性分析Fig.4 Correlation analysis of quantitative traits in F2 generation population
从花径与其他性状间的相互关系来看,花径(FD)与花冠筒长(CTL)、花梗直径(PD)、萼片长(SL)、萼片宽(SW)、雌蕊长(P)、雄蕊长(S)、苞片长宽比(BL/BW)、第1 位叶叶长(LL1)、第1 位叶长宽比(LL1/LW1)、第4 位叶叶长(LL4)、第4 位叶叶宽(LW4)、第4 位叶长宽比(LL4/LW4)、第4 位叶叶柄长(PL4)、中部茎粗(MS)均呈显著正相关(P<0.05),与植株高度(H)和叶片数(LN)呈显著负相关(P<0.05)。根据Pearson 相关系数r的大小,与花径相关性排名前5 位的分别是花梗直径(r=0.91)、第4位叶叶柄长(r=0.88)、第4位叶叶长(r=0.87)、第1位叶长宽比(r=0.80)、第4 位叶长宽比(r=0.80),说明F2群体出现了花越大花梗越粗、中部叶片及叶柄越长的现象。
在花部性状中,各性状间大部分呈现正相关,说明花径增大会导致整个花器官变大,其中花径与花梗直径(r=0.91)、萼片长度(r=0.78)、萼片宽度(r=0.73)之间联系最为紧密。花部性状与叶部性状大部分均呈现正相关,花朵越大的植株叶片也越大,说明花器官与营养器官的大小存在一定相关性。花部性状与植株高度和叶片数均呈现负相关,说明花器官越大,植株越矮,开花时间越早。在叶部性状中,大部分性状间呈现正相关,其中叶片长度与宽度联系紧密,说明花径的变化对叶片大小影响较大。
2.2.4 花朵大小对叶绿素含量的影响 在大、小花杂交F1与W115 的杂交后代群体中,发现大花植株和中花植株的叶片和苞片颜色存在明显差异,其中中花植株的叶片和苞片均为正常的绿色,而大花植株的叶片和苞片为浅绿色或黄绿色,且这一性状表现与花朵大小紧密相关(图5A—C)。叶绿素含量的测定结果显示,中花植株叶片与苞片的叶绿素a、叶绿素b 及总叶绿素含量均显著高于大花植株(P<0.01),其中叶片的叶绿素a、b 及总叶绿素含量分别是大花植株的2.15、2.12、2.15 倍,苞片的叶绿素a、b及总叶绿素含量分别是大花植株的2.63、2.77、2.67倍(图5D)。

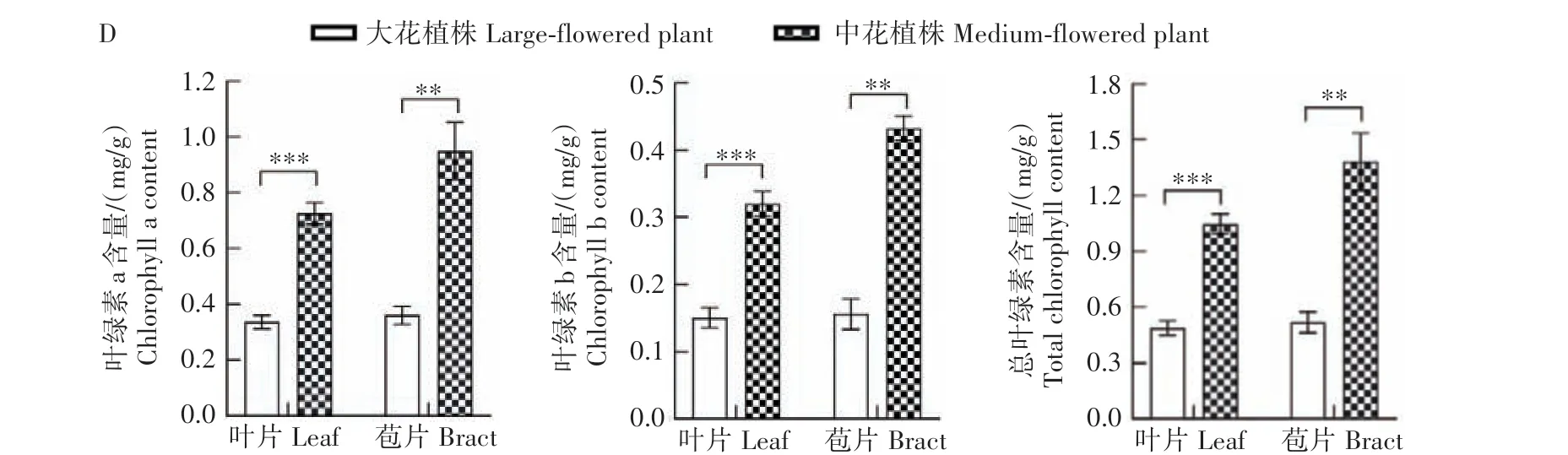
图5 杂交群体不同花朵大小植株叶片与苞片颜色及叶绿素含量Fig.5 The color of leaves and bracts and chlorophyll content from plants with different floral sizes in hybrid population
3 结论与讨论
矮牵牛生育周期短、花器官显著,且花朵大小变异丰富,是研究花朵大小遗传的理想材料[20]。本研究通过构建矮牵牛大花自交系(平均花径9.5 cm)和小花自交系(平均花径4.5 cm)的杂交组合及F1、F2分离群体,利用主基因+多基因混合遗传模型对F2群体花径进行遗传分析,结果表明,最佳遗传模型为2MG-A,即大花对小花性状由2 对主基因控制,且具有加性效应,第1 对主基因加性效应(d=1.32)高于第2 对主基因加性效应(d=0.95),主基因遗传率为95.38%。
本研究结果与前人的研究有所不同,早在1984年,EWART[21]提出矮牵牛的Grandiflora(G)基因是唯一调控大花表型的基因,他认为该基因为不完全显性,市场上大花型商业品种均为Gg杂合基因型,而且GG纯合型植株具有极低的生活力和育性。本研究中的大花亲本(P1)自交后代全部为大花植株(花径为9.0~10.3 cm),可以判定为纯合大花基因型,根据观察,其育性确实有所降低,但植株生长健壮,生活力表现正常,与小花植株没有明显差异。另外,HUSSEIN 等[22]通过双列杂交试验发现,矮牵牛5.0~7.0 cm 的花径是受多基因系统控制的数量性状,调控基因至少存在5个,并且存在加性和显性效应[22]。GALLIOT 等[23]利用P.a.axillaris(花径5.0~5.5 cm)和P.inflata(花径2.5~4.0 cm)的BC1群体进行QTL 分析,结果发现,4 个QTL 影响花朵大小,合计可解释68.7%的亲本花径差异;VENAIL 等[24]以P.a.parodii×P.a.axillaris的F2群 体 为 材 料,利 用CAPS 和SSR 标记进行花冠筒长度和花径QTL 分析,结果定位到3 个花冠筒长度QTL 和4 个花径QTL;CAO 等[15,25]分别利用P.axillaris×P.exserta和P.integrifolia×P.axillaris的重组自交系(RIL)群体,通过SNP 和SSR 标记对花径、花冠长度等性状进行QTL 分析,结果在2个群体中分别获得4个和2个控制花径的QTL。这些研究结果表明,矮牵牛花朵大小的遗传与多数植物相似,偏向于数量性状的遗传特点,但主效调控基因的数目可能并不多。本研究发现,矮牵牛大花对小花由2对主基因控制,没有多基因遗传效应,可能与构建群体的亲本基因型有关,它们是由同一系列商业品种自交分离选育而来,遗传背景差异相对较小。
由于基因的多效性或基因的连锁效应,植物性状之间往往存在一定程度的相互关联[26]。本研究探究了矮牵牛花朵大小与植株其他性状之间的相关性,结果发现,F2群体中花冠大小与其他性状之间存在着紧密的联系,尤其是花部器官大小以及营养器官大小之间,几乎均呈显著或极显著相关。这些性状之间的强相关性说明控制矮牵牛花朵大小的基因具有多效性,不仅参与调控花器官大小,同时还参与营养器官的生长发育,即决定花朵大小的基因也会影响植物的叶片[27]、种子[28]等器官的发育,这在其他植物的研究中已经得到部分证实。除此之外,本研究还发现,在大花植株与W115的杂交群体中出现了植株叶片及苞片颜色伴随花朵大小分离的现象,即所有大花植株的叶片及苞片颜色均比中花植株浅,叶绿素含量也显著降低。有研究表明,细胞分裂素的生物合成及信号传导对花朵大小具有重要的调控作用,通过转基因提高内源细胞分裂素水平或者外源施加细胞分裂素均能使植物花朵变大[29]。然而,NISHIJIMA 等[30]研究发现,大花矮牵牛花瓣中的细胞分裂素水平反而低于小花,可能是由于其细胞分裂素脱氢酶基因PhCKX1和PhCKX2的表达量上调所致。CKX基因的表达受细胞分裂素信号传导机制调控,其功能是降解细胞分裂素,从而反馈抑制过激的细胞分裂素信号。此外,细胞分裂素在叶绿素的生物合成和降解中也扮演着重要角色,它通过调控叶绿素合成相关基因的表达,以维持叶绿素的稳态平衡,细胞分裂素水平提高促进叶绿素的合成,而细胞分裂素受体功能缺失会降低叶绿素的含量[31]。由此,推测控制矮牵牛大花的关键基因可能是细胞分裂素信号传递相关基因,而大花植株叶片及苞片叶绿素含量低于中花植株,可能是由于过激的细胞分裂素信号引起内源细胞分裂素含量降低所致。
综上,本研究构建了矮牵牛大花与小花的杂交分离群体,并且发现其大花对小花性状由2 对主基因控制,为后续定位克隆矮牵牛花朵大小调控基因奠定了良好基础。另外,发现矮牵牛花朵大小与其他花部器官以及营养器官的大小呈现显著的相关性,而且叶片和苞片的叶绿素含量与花朵大小性状紧密关联,这些结果对于研究矮牵牛花朵大小基因的分子调控机制及花径遗传改良具有重要指导意义。
——矮牵牛

