基于靶向代谢组学分析糖尿病肾脏疾病血清中苯丙氨酸代谢途径代谢物的变化*
杨 洁,米 焱,王彩丽
(内蒙古科技大学包头医学院第一附属医院,内蒙古 包头 014010)
糖尿病(diabetes mellitus,DM)是一组以高血糖、胰岛素抵抗和胰岛β细胞功能障碍为主要特征的慢性代谢性疾病[1]。糖尿病在其发生、发展的过程中会伴随各种急慢性并发症的出现,如视网膜、外周神经、微血管病变以及急性肾损伤(acute kidney injury,AKI)和慢性肾脏疾病(chronic kidney disease,CKD)。其中,糖尿病肾脏疾病(diabetic kidney disease,DKD)是糖尿病最严重和最常见的慢性并发症之一,也是糖尿病致死、致残的重要原因。2019年糖尿病地图指出,有15.0%~25.0%的Ⅰ型糖尿病和30.0%~40.0%的Ⅱ型糖尿病患者出现肾脏方面的损伤,而一旦形成DKD,多数患者又将最终发展成终末期肾脏病(end-stage renal disease,ESRD),患病率达33.6%[2]。因此,糖尿病及其并发症,尤其是糖尿病肾脏疾病已成为一个不可忽视的世界性的健康问题。近年来,因DKD而导致的终末期肾病比例呈上升趋势,DKD已成为导致终末期肾病需要肾脏替代治疗的重要病因。因此,了解DKD发病机制及早期诊治,是降低DKD致死、致残率,提高患者生存质量的关键。
DKD是指由糖尿病导致的可累及全肾的慢性肾脏疾病,其病理改变包括早期肾小球肥大、肾小球基底膜增厚、足细胞损伤、肾小球系膜基质扩张和肾小管损伤,后期导致肾小球硬化和肾小管间质纤维化及肾血管病变,最终介导肾损伤。目前DKD的发病机制尚未明确,可能与多因素共同作用有关,但已有研究证实,糖/脂代谢紊乱、氧化应激、炎症反应、血流动力学异常、遗传等多种因素均可导致DKD的发病。我国糖尿病患者代谢综合征并发率高达60.0%~80.0%,多项研究已证实除年龄、高血压、高血糖等是DKD的独立危险因素,代谢综合征也与DKD的发病过程息息相关。
DKD患者体内存在糖、脂和氨基酸代谢等多种代谢通路异常,其中苯丙氨酸作为芳香族氨基酸中的重要一员,其代谢途径及代谢产物在肾组织损伤中的重要作用及变化规律尚没得到系统性的观察及研究。因此,本研究采用超高效液相色谱串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法从DKD组及健康对照组的血清样本中检测并筛选出具有重要生物学意义和统计学差异的苯丙氨酸代谢通路及其差异性代谢产物,观察代谢产物的变化规律,阐明DKD患者体内的代谢过程和变化机制,并用于发现DKD早期诊断的生物标志物。
1 对象与方法
1.1对象 选取2021年5月至2021年10月期间包头医学院第一附属医院肾内科住院部诊断为DKD的患者20例,同期20例健康体检者作为正常对照(NC组)。疾病组纳入标准:符合疾病诊断指南标准[3-5]。健康对照组身体健康、无胃肠道症状,无肥胖、高血压、糖脂代谢紊乱等病史。排除标准:年龄<18岁;患有胃肠道疾病或者进行过腹部手术;处于怀孕期或哺乳期;患有心脏病、肝胆系统疾病、泌尿系统感染、恶性肿瘤、传染病、风湿病、甲状腺疾病、其他内分泌科疾病;近3个月体质量改变>10.0%;可伴或不伴高血压、血脂代谢异常。患者及健康体检者均签署知情同意书。
1.2方法
1.2.1血液样本收集与处理 所有研究对象禁食12 h,收集清晨空腹静脉血进行离心,取上清液于无菌冻存管中,进行标记,放在-80 ℃冰箱备用。
1.2.2临床资料收集 (1)一般资料:性别,年龄,糖尿病病史,高血压病史,高脂血症病史,降压药、降糖药、降脂药等药物使用情况等;(2)实验室检查资料:24 h尿蛋白(urine protein,UP)定量、血肌酐(serum creatinine,Scr)、尿素(Urea)、尿酸(uric acid,UA)、白蛋白(albumin,ALB)、估算肾小球滤过率(glomerular filtration rate,eGFR)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HD)、空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(glycosylated hemoglobin,HbAlc)、甲状旁腺激素、血红蛋白(hemoglobin,HB)、白细胞计数、血小板计数、红细胞计数、空腹及餐后2 h胰岛素及C肽等。
1.2.3靶向代谢组学代谢物的提取 (1)从-80 ℃冰箱中取出血浆标本在冰上解冻,涡旋5~8 min;(2)量取20 μL样品,向样品加入120 μL 50%甲醇,震动充分混匀,提取样品中的代谢物,常温静置10 min;(3)提取液置于-20 ℃过夜,沉淀样品中的蛋白质;(4)4 000 r/min离心20 min,转移上清液代谢物提取液到96孔板;(5)每个样品等量取出10 μL稀释液混合成QC样品;(6)所有代谢样品在上样前置于-80 ℃冰箱保存;(7)对所提取的样本进行随机上机排序检测,在样品前、中、后分别插入QC样品作为实验技术重复评估。在正负离子模式下将样品分别进行质谱扫描检测。
1.2.4液相部分 (1)液相体系:SCIEX,UK公司的超高压液相;(2)色谱分析柱:ACQUITY UPLC T3(100 mm×2.1 mm,1.8 μm,Waters,UK);(3)柱温:35 ℃;流速:0.4 mL/min;(4)流动相:A相:水(1%甲酸);B相:乙腈(1%甲酸);(5)液相梯度设置见表1。
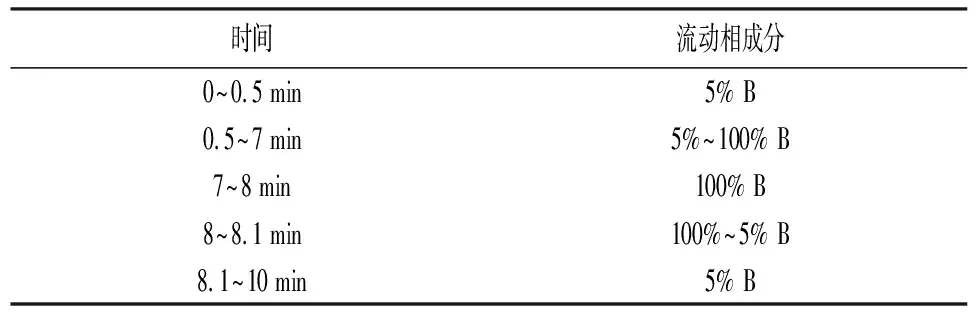
表1 液相梯度设置
1.2.5质谱部分 采集所用的高分辨率质谱仪为TripleTOF 5 600 plus(SCIEX,UK)飞行时间质谱。每个样本进行一次正离子模式采集和一次负离子模式采集。离子源的遮蔽气压为30 PSI(磅每平方英寸),气体1(辅气)和气体2(鞘气)压力均设置为60 PSI。源温度650 ℃。正负离子模式下电压分别为正5 000 V、-4 500 V。采集数据的模式为IDA(信息依赖性采集)模式。
在一个采集循环中,一级采集范围为60~1 200 D,一级采集时间为150 ms,然后从一级图谱中挑选带一个正电荷(负离子模式下为带一个负电荷)并且每秒信号积累强度超过100的前12个信号离子进行二级碎裂扫描。整个采集循环耗时0.56 s。
该质谱仪检测器有4个通道,脉冲射频电的频率为11 kHz;检测器的检测频率为40 GHz;四个通道分别记录每次扫描的粒子信号,共4次后合并转化成数据。扫描的动态排除时间设置为4 s。
在采集过程中,每间隔20个样本进行一次仪器准确度校正。同时,每间隔10个样本进行一次QC品的扫描。用QC间的质量差距来校正整批实验的系统误差。
1.2.6差异代谢物筛选 (1)对代谢物进行单变量分析,主要计算代谢物强度在两表型间的比值,利用T检验进行统计学分析,对检验结果作多重检验分析,主要利用BH(Benjamini-Hochberg)矫正;(2)对代谢物进行多变量分析,主要利用偏最小二乘法判别分析(PLS-DA),得到每个代谢物的变量重要性(VIP);(3)取FC>2倍差异、q<0.05、VIP>1为筛选结果与分析的标准。
1.3统计学方法 多元统计分析:将所得结果导入Simca-P(11.5 version,Umetrics AB,Umea,Sweden)软件,分别采用无监督分析方法(主成份分析,PCA)及偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA),得到不同分组情况下,样本间的聚类情况,找出与分组相关的体内小分子化合物,根据化合物在样本聚类中的贡献度大小,对采用模式识别分析得出的化合物中在各组间的差异进行了两两间检验分析,从不同临床意义的角度出发,找出组间差异性较大的化合物。结合生物学意义,发现对机理阐释、疾病诊断、用药治疗有意义的潜在生物标志物。代谢组学分析:将相关积分值进行中心化和比例换算,应用MarketView软件同时进行判别分析,寻找出特征差异性代谢物。样品分布得分图用于展示不同组间差异。根据多元统计分析中变量的载荷大小,结合F检验、t检验,筛查出组间具有差异有统计学意义的化合物作为潜在生物标志物,再根据质谱同位素匹配结果和HMDB、METLIN、KEGG等数据库的检索结果及对照品及串质谱的鉴别结果,对潜在的生物标志物进行鉴定。以P<0.05为差异有统计学意义。
2 结果
2.1代谢物检测质控 总离子流图(total ion chromatogram,TIC)能够宏观反映所有代谢物在液相色谱分离情况,把控样品整体质谱信号强度。从图上可以看出,各色谱峰的分离效果良好且峰的数量较多,相应强度较高,说明LC-MS分析条件能满足代谢组学的分析要求,血清质量样本可以满足实验要求,质谱信号稳定性较好。见图1。

图1 总离子流图TIC
2.2两组研究者差异代谢物分析 两组研究者组间比较,综合多种类聚类分析结果,最终发现差异性代谢产物苯丙氨酸(L-Phenylalanine)、L-色氨酸(L-Tryptophan)、马尿酸(Hippuric-acid)、5-羟基吲哚-3-乙酸(5-HydroxyIndole-3-acetic-acid)、5-羟色胺(5-Hydroxytryptamine)、犬尿酸(Kynurenine)、吲哚丙酸(3-Indolepropionic-acid)明显上调(P<0.05),氯胺酮(Kynurenic-acid)、DL-3-吲哚乳酸(DL-Indole-3-lactic-acid)、马尿酸(Hippuric-acid)、5-羟基吲哚-3-乙酸(5-HydroxyIndole-3-acetic-acid)、D-苯乙酰基-L-谷氨酰胺(Phenlacetyl-L-Glutamine)、吲哚丙酸(3-Indolepropionic-acid)Fold change>2,差异具有统计学意义(P<0.05)。其中苯丙氨酸(L-Phenylalanine)、马尿酸(Hippuric-acid)、D-苯乙酰基-L-谷氨酰胺(Phenlacetyl-L-Glutamine)是苯丙氨酸代谢途径中的代谢产物,可作为苯丙氨酸代谢途径中的差异代谢物,为后续研究提供生物标志物。见表2。
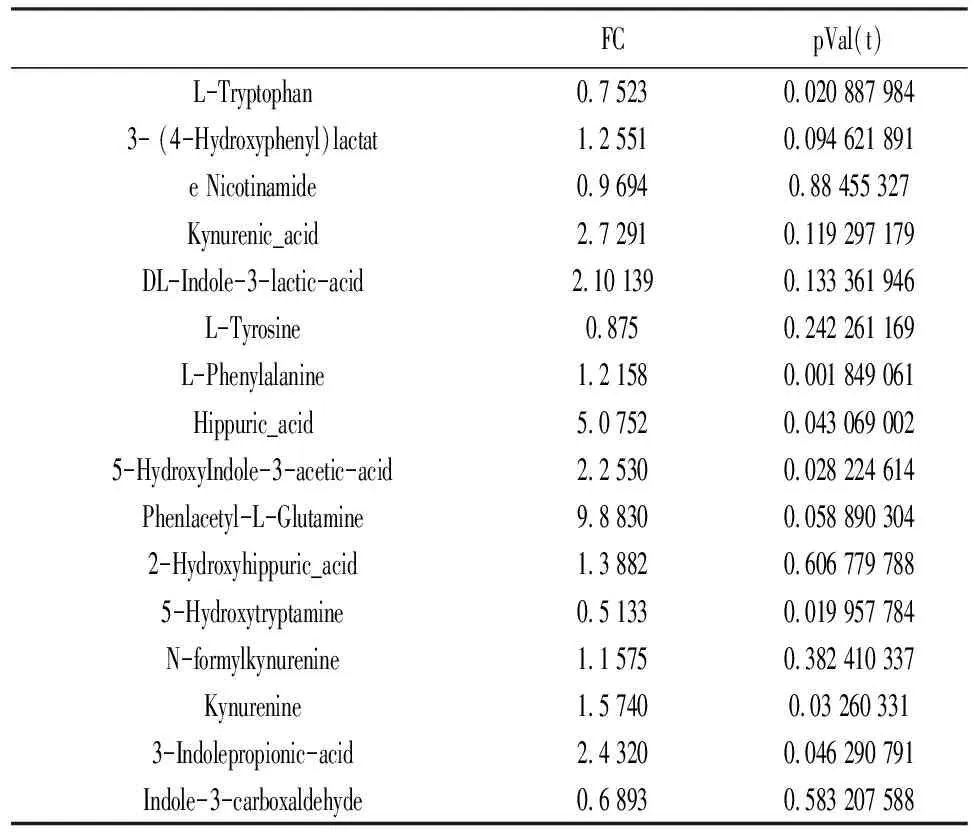
表2 两组研究者代谢物差异分析
2.3主成份分析
2.3.1总体样本主成份分析 对本实验中所有血清样本(包括质控样品)进行PCA分析,PCA得分图(图2)结果显示,组内和组间代谢物的聚类和离散,PC1值为95.57%,PC2值为3.2%,DKD组、NC组和QC相比,代谢情况分离趋势明显,代谢物存在明显差异。而观察QC组血清的代谢情况,发现聚集趋势较明显,提示其血清代谢情况差异较小。
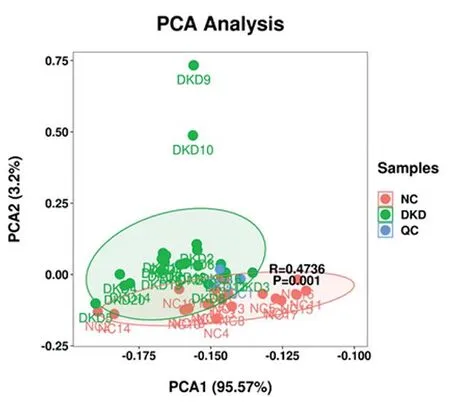
图2 各组样品与质控样品质谱数据的PCA得分图
2.3.2聚类分析结果 为了表示差异代谢物以及样本之间的聚类关系,以颜色及深浅代表样本中代谢物的表达量大小。我们对代谢物的定量信息进行聚类热图分析。其中在纵轴方向,可以对样本进行聚类分析,在横轴方向可以对各组样本进行聚类分析。
首先对数据进行归一化处理,对所有样品进行聚类热图分析,并使用R程序脚本绘制聚类热图(图3)。图中聚类热图显示,在不同组间的样本中同一代谢物的聚类情况。
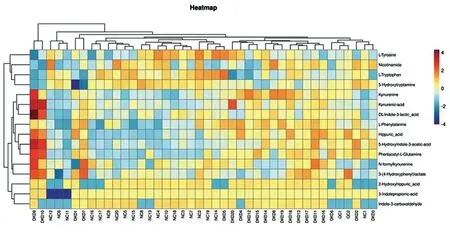
图3 样品代谢物含量聚类热图
2.4差异代谢物统计
2.4.1DKD与NC组之间的PCA分析 分析DKD和NC两组PCA结果(图4),显示NC组血清样品聚类很好,DKD组血清样品离散,提示NC组的代谢情况异质性小,而DKD组血清代谢情况发生变化,且疾病个体异质性较大。进一步分析两组间的差异,观察到两组样品存在交叉现象,表明DKD组与NC组相比,血清代谢情况存在相同之处。
2.4.2DKD与NC组的PLS-DA分析 DKD与NC组比较的PLS-DA模型参数R2为0.924,Q2为0.891,接近0.9,说明该模型显示的实验数据稳定可靠,该模型为出色模型,可用于后续差异代谢物的筛选。见图5。
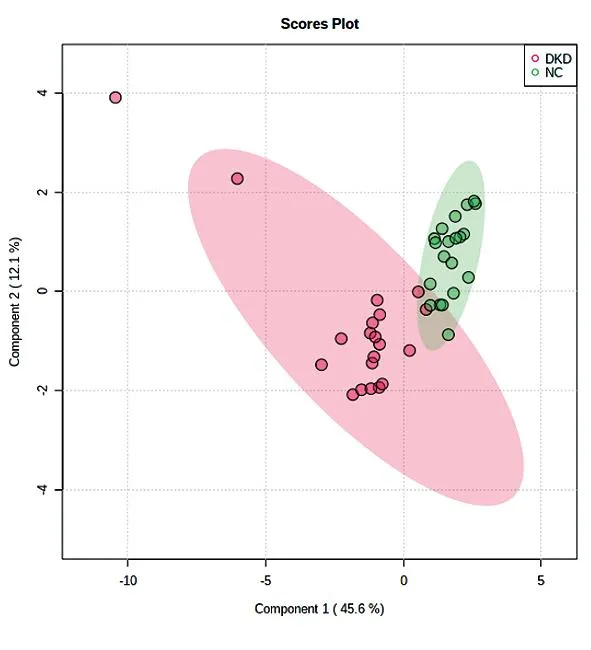
图5 DKD与NC组血清样品PLS-DA得分图
2.4.3DKD、NC两组间差异代谢物热图 为了清晰、直观了解DKD、NC两组间差异代谢物变化规律,我们对差异显著的代谢物进行归一化处理,并绘制聚类热图(图6)。
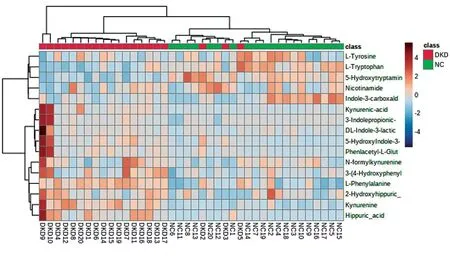
图6 两组间血清差异代谢物比较的热图
2.5DKD与NC组血清差异代谢物的代谢通路富集分析 本实验利用KEGG数据库对差异代谢物进行注释、分类和富集分析。按照KEGG中通路类型进行进一步分类,随后根据差异代谢物分类结果完成代谢通路富集。DKD与NC组对比,排名前25的代谢通路罗列,分别是谷胱甘肽代谢通路、苯丙氨酸和酪氨酸代谢通路、乙酸苯酯代谢通路、苹果酸-天冬氨酸通路、咖啡因代谢通路、牛磺酸代谢通路、酮体代谢通路、葡萄糖-丙氨酸循环、尿素循环、丙氨酸代谢通路、天冬氨酸代谢通路、精胺和亚精胺合成通路、精氨酸和脯氨酸代谢通路、亚麻酸和α亚麻酸代谢通路、烟酸和烟酰胺代谢通路、辅酶Q合成通路、核黄素代谢通路、硫酸/亚硫酸盐代谢通路、色氨酸代谢通路、组氨酸代谢通路。见图7。
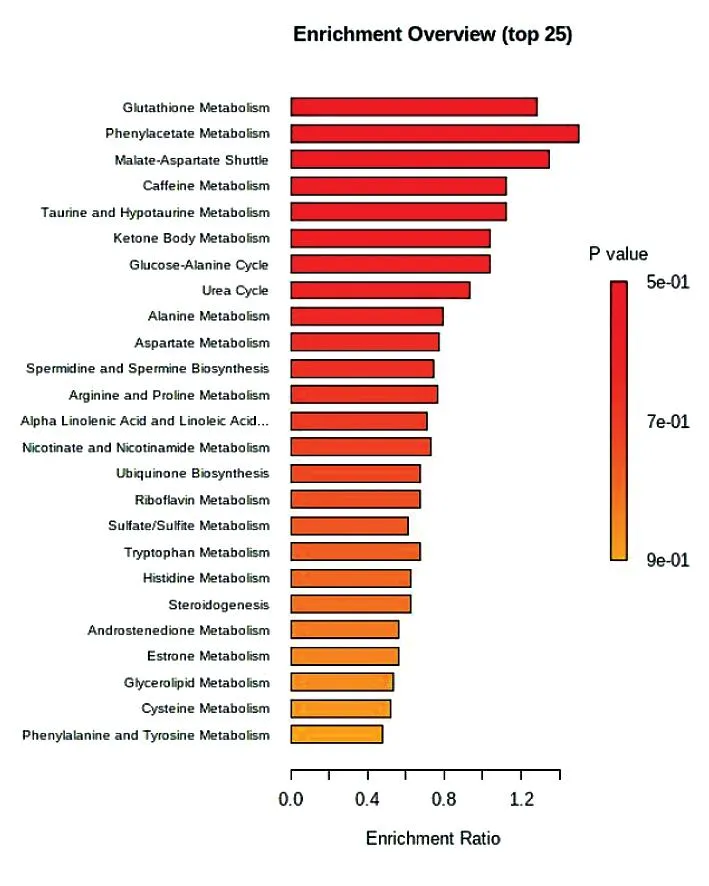
图7 DKD与NC组间差异代谢物KEGG分类富集图
2.6DKD组的差异性血清代谢物与临床指标的相关性分析 DKD患者血清代谢物与临床指标相关,其中5-羟色胺、L-色氨酸与eGFR、HB、ALB呈正相关,与Urea、UA、SCr呈负相关,苯丙氨酸、犬尿酸、马尿酸、吲哚丙酸、5-羟基吲哚-3-乙酸、D-苯乙酰基-L-谷氨酰胺与血肌酐、空腹血糖、糖基化血红蛋白呈正相关。见图8。
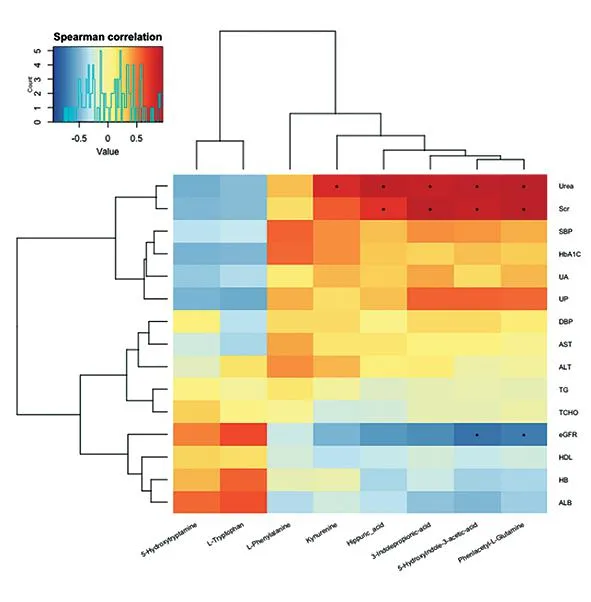
图8 DKD与NC组的差异性血清代谢物与临床指标的相关性分析
3 讨论
糖尿病肾病是糖尿病主要的慢性微血管并发症之一,发病率为30%~40%,是目前糖尿病患者的主要致死因素,也是近年来逐渐增多的终末期肾病(ESRD)的病因之一[6-8]。预计到2030年全世界糖尿病患者将增加到3.66亿[9](占全球人口4.4%)。
DKD的典型病理表现是:早期出现肾小球肥大、肾小球基底膜均质性增厚,中后期出现Kimmelstiel-wilson结节(K-W结节),微血管瘤形成,明显透明样变以及纤维帽样或肾小囊滴状病变等。DKD的病理生理机制比较复杂,其疾病基础是糖、脂肪、氨基酸代谢紊乱,在特定遗传背景和环境因素作用下,通过血流动力学异常、胰岛素抵抗(IR)和炎性介质活化等机制引起肾脏损伤。
肾脏是一个复杂的器官,具有分泌和代谢功能,肾脏损伤直接影响血液和尿液中代谢物的水平,反过来,生物体内代谢物水平和种类的变化,间接反映肾脏损伤的原因、机制、进展、预后。但大多数DKD患者早期无任何临床表现,或被糖尿病症状掩盖,往往不能及时发现。早期DKD,一旦肾脏受累出现持续性蛋白尿,肾脏病变往往是不可逆转的,最终在短时间内进入ESRD。目前临床上对于DKD的诊断主要依靠检测尿微量白蛋白排泄率、肾小球滤过率和肾活检等。近年来对微量白蛋白尿的出现是否能代表肾脏损害,同时出现后是否必然进展到明显蛋白尿,最终导致肾衰竭有较多争议,并且肾活检存在一定的风险性和操作难度[10]。因此寻找更灵敏、确切的生物标志物进行DKD早期诊断,监测疾病进展和分层治疗很有必要。
代谢组学是将生物体作为一个动态的整体来研究内在或外在因素造成的代谢改变情况、代谢物质种类、数量及规律,主要特点包括了整体性及动态性,反映出了生物体状况的分子集合与自身功能之间的关系[11]。几乎所有可对生物体健康造成影响的因素,如基因、环境、营养、饮食、药物干预等,都可在代谢组学信息中得到反映。基于代谢组学样品制备快速,其关键技术质谱和核磁共振光谱也应用成熟,数据经生物统计学和生物信息学处理,为新诊断标志物的发现提供了有效的手段和方法。
代谢组学以分子量<1 000 KD的小分子化合物为研究对象,以研究对象及研究目的区分为4个层次:代谢物靶标分析、代谢物指纹分析、代谢物轮廓分析及代谢组分析。代谢物靶标分析是指对一个或多个特定的组进行定性及定量的分析;代谢物指纹分析可同时进行多个代谢物分析,但不具备单一组分分离鉴定的能力;代谢轮廓分析可在限定条件下快速定性及半定量分析特定组织内的代谢产物;代谢组分析则是指定量分析特定组织内的所有代谢产物,并对该产物在干预下或病理生理条件下的动态变化规律进行研究。
代谢组学的研究流程包括采集样品、样品预处理、数据采集分析及解释,主要以分析技术及数据分析为研究平台。气相色谱-质谱(GC/MS)和核磁共振(NMR)为主要分析技术。代谢组学的数据分析通常以多/单维数据统计,例如:主成份分析(PCA)、偏最小二乘法-判别分析(PLS-DA)、正交偏最小二乘法-判别分析(OPLS-DA)等。
糖尿病是由多因素综合导致的糖、蛋白质、电解质、脂肪等一系列代谢紊乱综合征,代谢组学利用现代分析技术获得内源性代谢产物谱图对机体功能状态进行分析,因而对于糖尿病的研究非常契合。纵观前人研究结果可知,代谢组学可对糖尿病发病机制、诊断相关并发症等帮助甚大,还可对糖尿病患者药物干预作用进行评价。
已有研究表明在明显器质性病变之前,糖尿病患者体内的某些相关代谢物已经发生了变化。氨基酸水平的变化也可反映DN患者的肾脏损伤。但关于DKD患者体内代谢产物变化规律的研究较少,并且由于疾病分期不明确,很多代谢产物的变化规律在不同研究中并不一致[12]。大量研究表明脂肪酸、磷脂、氨基酸代谢与DKD病变存在密切关系,其水平变化可提示早期DKD病变,随后在对患者的生物学标本进行分析时验证了在细胞试验中得出的结论[13]。
在本次研究中,通过代谢组学研究,对比差异代谢产物分析发现,相关代谢产物如5-羟色胺、L-色氨酸与估算肾小球滤过率、HB、ALB呈正相关,与Urea、UA、SCr呈负相关,苯丙氨酸、犬尿酸、马尿酸、吲哚丙酸、5-羟基吲哚-3-乙酸、D-苯乙酰基-L-谷氨酰胺与血肌酐、空腹血糖、糖基化血红蛋白呈正相关。由此可见,以上代谢产物参与到DKD发生、发展的过程中。而在血清差异代谢物筛选中,L-色氨酸、苯丙氨酸、马尿酸、5-羟基吲哚-3-乙酸、5-羟色胺、犬尿酸、吲哚丙酸、氯胺酮、DL-3-吲哚乳酸、D-苯乙酰基-L-谷氨酰胺,这些代谢物的差异具有显著的统计学意义,可作为差异代谢物,其中苯丙氨酸、马尿酸、D-苯乙酰基-L-谷氨酰胺是苯丙氨酸代谢途径中的代谢产物,可作为苯丙氨酸代谢途径中的差异代谢物,为后续研究提供生物标志物。
在对DKD与NC组对比的差异代谢物的代谢通路进行分析发现,共有的代谢通路包括苯丙氨酸和酪氨酸代谢、亚精胺和精胺的生物合成、苯乙酸代谢、谷胱甘肽代谢、酮体代谢、精氨酸和脯氨酸代谢等25条代谢通路。这些代谢通路可能参与了T2DM到DKD疾病的发生、发展过程中,后续可以靶向研究这些通路,为DKD的诊治提供依据。
苯丙氨酸代谢异常已在糖尿病患者中被证实[14],然而其在DKD进展中的作用尚未见相关报道。本研究首次探讨苯丙氨酸代谢途径是与DKD进展相关的途径,并且提示3种相关的血清代谢产物苯丙氨酸、马尿酸、D-苯乙酰基-L-谷氨酰胺与肾功能的恶化呈正相关。
总之,本研究应用靶向代谢组学的手段,探讨苯丙氨酸代谢途径及其差异性代谢产物的变化规律,并分析其与临床指标的相关性,阐明DKD患者体内的代谢过程和变化机制,并用于发现DKD早期诊断的生物标志物,为DKD诊断物的发现和机制研究提供了有效途径。

