基于量值传递的仁术健胃颗粒工艺过程研究
贵书琪,郑艳萍,成 俊,,赵开军,彭 雲,黄 芳
(1.南京中山制药有限公司,江苏省中药经典名方工程技术研究中心,江苏 南京 210046; 2.中国药科大学中药学院,江苏 南京 211198; 3.江苏弘典中药产业研究院有限公司,南京市工程技术研究中心,江苏 南京 210042)
脾胃病科学术带头人单兆伟教授四十余年来通过系列临床及基础研究总结提出慢性萎缩性胃炎胃黏膜癌前期病变的主要病机特点是“气虚血瘀热郁”,制定“益气活血清热” 为主要治疗法则,开发仁术健胃颗粒[1]。该方由炙黄芪、酒黄芩、薏苡仁、莪术、麸炒白术、白花蛇舌草、半边莲、仙鹤草组成。大量文献研究表明,仁术健胃颗粒治疗慢性萎缩性胃炎胃黏膜癌前病变具有良好的疗效,该药作为江苏省中医院院内制剂已有二十余年的应用基础[2-4]。
前期该药已转让南京中山制药有限公司,为了更加全面保留药效成分,提高临床药效,经进一步制剂研究,增加了醇提、超微粉碎[5-7]、挥发油提取包合[8]、喷雾制粒[9]等先进工艺制剂技术。与此同时还开展了Ⅱ期临床试验和Ⅲ期临床验证,证实其对慢性萎缩性胃炎胃黏膜癌前病变具有良好的临床疗效。目前,对仁术健胃颗粒质量和工艺相关的研究很少,相关的成分定量分析只有黄芪甲苷的报道[10],无量值传递方面的文章。本研究通过对生产过程中各个关键环节取样,成分分析,研究饮片-中间体-成品药效成分的转移过程,并与原工艺生产颗粒(江苏省中医院院内制剂仁术健胃颗粒) 进行比较,以期为仁术健胃颗粒后续开发研究和相关制剂的质量控制提供依据。
1 材料
1.1 仪器 仁术健胃颗粒生产设备为南京中山制药有限公司中试颗粒剂生产线,已通过《药品生产质量管理规范》(GMP) 认证,证书编号JS20191043。高效液相色谱系统,包括LC-20AT 泵、ELSD-16 蒸发光散射检测器、LC-40D泵、SPD-M40 二极管阵列检测器、Labsolutions 工作站等(日本岛津公司); KH-500E 超声波清洗器(昆山禾创超声仪器有限公司); PL602-L、ML104/02、XSR105DU/A、XPR2/A 电子分析天平(瑞士Mettler-Toledo 公司); DK-98-ⅡA 电热恒温水浴锅 (天津市泰斯特仪器有限公司);FLBP-250 万能高速粉碎机(上海菲力博食品机械有限公司); RODI-220A1 纯水机(厦门锐思捷水纯化技术有限公司); BT-9300H 激光粒度分布仪 (丹东百特仪器有限公司)。
1.2 试剂与药物 黄芪甲苷(批号110715-202118,纯度96.8%)、黄芩苷(批号110715-202122,纯度94.2%)、甘油三油酸酯(批号111692-202007,纯度99.6%)、吉马酮(批号111665-201906,纯度99.8%) 对照品均购自中国食品药品检定研究院。仁术健胃颗粒(苏药制药Z04001773,批号2103004、2108014、2109017)。甲醇、磷酸、乙腈、二氯甲烷为色谱纯; 其他试剂均为分析纯; 水为纯化水。
炙黄芪(批号200801)、酒黄芩(批号200902) 均购自安徽亳药千草国药股份有限公司; 薏苡仁 (批号200901)、白花蛇舌草(批号200801) 均购自国药集团北京华邈药业有限公司; 莪术(批号200801) 购自广西三丰现代农业有限公司; 麸炒白术(批号200904) 购自安徽亳药千草中药饮片有限公司; 半边莲(批号201001)、仙鹤草(批号201001) 均购自安徽金国源中药股份有限公司,经南京中山制药有限公司质量部专家检测均符合2020 年版《中国药典》 规定,南京中山制药有限公司赵开军执业药师鉴定为正品。
2 方法与结果
2.1 生产工艺验证研究
2.1.1 生产工艺 在仁术健胃颗粒(批件号2003L04442)处方量基础上,放大投料,连续生产3 批。处方中,薏苡仁、白术粉碎成超微粉; 莪术水蒸气蒸馏法提取挥发油,β-环糊精包合,得到药渣Ⅰ及水溶液另置,备用; 炙黄芪、半边莲、白花蛇舌草用乙醇回流提取,提取液过滤,回收乙醇,滤液浓缩至适量,得到清膏Ⅰ和药渣Ⅱ; 药渣Ⅱ、药渣Ⅰ与酒黄芩、仙鹤草加水煎煮,与莪术油提取后的水溶液过滤,浓缩,得到清膏Ⅱ; 清膏Ⅰ与清膏Ⅱ合并,浓缩成清膏Ⅲ; 取清膏Ⅲ,加入薏苡仁和白术超微粉、莪术油β-环糊精包合物,得中间体; 中间体与适量糊精、甜菊糖苷混合,制成颗粒,干燥,整粒,包装,即得。
2.1.2 生产结果 根据“2.1.1” 项下生产工艺流程进行生产,得到生产数据,计算清膏密度(密度计测定)、清膏得率、干膏率、超微粉粒径(激光粒度分布仪测定)、超微粉出率、包合物出率、成品率,公式为清膏得率=(清膏Ⅲ数量/饮片投料量) ×100%、干膏率= (干膏质量取样/湿膏质量取样) ×100%、超微粉出率= (白术薏苡仁混合超微粉质量/白术薏苡仁饮片总质量) ×100%、包合物出率= [挥发油包合物量/ (莪术挥发油量+β-环糊精量) ] ×100%、成品率= [成品数量/理论产量(即固体辅料总量+清膏Ⅲ折合干膏量) ] ×100%,中间体批号分别为2102、2103、2104,颗粒相应批号分别为210701、210702、210703,结果见表1,可知从提取、打粉、包合到制粒整个过程生产数据相对稳定。

表1 生产数据结果
2.2 指标成分检测方法建立
2.2.1 色谱条件
2.2.1.1 条件1 (黄芪甲苷) Waters Symmetry ®色谱柱(4.6 mm×250 mm,5 μm); 流动相甲醇-水(76 ∶24); 体积流量1.0 mL/min; 蒸发光散射检测器; 漂移管温度82 ℃; 载气流量1.95 L/min; 柱温30 ℃; 进样量20 μL。分离度大于1.5,理论塔板数按黄芪甲苷峰计,不低于5 000。
2.2.1.2 条件2 (黄芩苷) YMC-Pack ODS-A 色谱柱(4.6 mm×250 mm,5 μm); 流动相甲醇-水-磷酸 (47 ∶53 ∶0.2); 体积流量1.0 mL/min; 柱温35 ℃; 进样量10 μL; 检测波长280 nm。分离度大于3.0,理论塔板数按黄芩苷峰计,不低于8 000。
2.2.1.3 条件3 (甘油三油酸酯) YMC-Pack ODS-A 色谱柱(4.6 mm×250 mm,5 μm); 流动相乙腈-二氯甲烷(65 ∶35); 体积流量1.0 mL/min; 蒸发光散射检测器; 漂移管温度82 ℃; 载气流量1.95 L/min; 柱温30 ℃; 进样量10 μL。分离度大于5.0,理论塔板数按甘油三油酸酯峰计,不低于30 000。
2.2.1.4 条件4 (吉马酮) YMC-Pack ODS-A 色谱柱(4.6 mm×250 mm,5 μm); 流动相乙腈(A) -0.1% 磷酸水(B),梯度洗脱 (0 ~15 min,55% A; 15 ~40 min,55% ~70% A; 40 ~42 min,70% ~85% A); 体积流量1.0 mL/min; 柱温25 ℃; 进样量10 μL; 检测波长215 nm。分离度大于6.0,理论塔板数按吉马酮峰计,不低于60 000。
2.2.2 对照品溶液制备 取黄芪甲苷对照品适量,精密称定质量,加甲醇制成每1 mL 含0.4、0.2 mg 的对照品溶液。取黄芩苷对照品适量,60 ℃下减压干燥4 h,精密称定质量,加70%乙醇制成每1 mL 含20、60 μg 的对照品溶液。取甘油三油酸酯对照品适量,精密称定,加乙腈-正丁醇(65 ∶35) 制成每1 mL 含50、150 μg 的对照品溶液。取吉马酮对照品适量,精密称定,加甲醇制成每1 mL 含10、40 μg 的对照品溶液。
2.2.3 供试品溶液制备
2.2.3.1 黄芪甲苷 取仁术健胃颗粒约4 g,研细,平行2份,精密称定,置索氏提取器中,加甲醇35 mL,冷浸过夜,再加甲醇适量,加热回流4 h,提取液回收甲醇并浓缩至干,残渣加水10 mL,微热使溶解,用水饱和正丁醇振摇提取3 次,每次20 mL,合并正丁醇提取液,氨液提取2次,每次20 mL,弃去氨液,将正丁醇液蒸干,残渣加水3~5 mL 溶解,放冷,通过D101 大孔吸附树脂柱(内径1.5 cm,长12 cm),以50 mL 水洗脱,弃去水液,再用40%乙醇30 mL 洗脱,弃去40%乙醇洗脱液,再用70%乙醇50 mL 洗脱,收集洗脱液,蒸干,甲醇溶解并转移至2 mL 量瓶内,加甲醇至刻度,摇匀,0.22 μm 微孔滤膜过滤,即得。精密称取第1 次醇提液、第2 次醇提液、清膏Ⅰ、清膏Ⅲ适量,平行2 份,回收溶剂并浓缩至干,其余步骤同上,得相应中间体的供试品溶液。取炙黄芪饮片适量,按照2020 年版《中国药典》 炙黄芪黄芪甲苷含量测定项下方法制备。
2.2.3.2 黄芩苷 取仁术健胃颗粒约1 g,研细,平行2份,精密称定,加70% 乙醇40 mL,加热回流3 h,放冷,过滤,滤液置于100 mL 量瓶中,用少量70%乙醇分次洗涤容器和残渣,洗液滤入同一量瓶中,加70% 乙醇至刻度,摇匀,精密量取1 mL,置10 mL 量瓶中,加70%乙醇至刻度,摇匀,0.22 μm 微孔滤膜过滤,即得。精密称取第1 次水提液、第2 次水提液、清膏Ⅱ、清膏Ⅲ适量,平行2 份,分别加入适量70%乙醇超声处理20 min,放冷,过滤,滤液置于100 mL 量瓶中,用少量70%乙醇分次洗涤容器和残渣,洗液滤入同一量瓶中,加70%乙醇至刻度,摇匀(其中清膏Ⅲ在此基础上稀释10 倍后进样),0.22 μm 微孔滤膜过滤,即得。取酒黄芩饮片中粉约0.3 g,平行2 份,精密称定,其余步骤同上,即得。
2.2.3.3 甘油三油酸酯 取仁术健胃颗粒约4 g,研细,平行2 份,精密称定,置具塞锥形瓶中,精密加入乙腈-正丁醇(65 ∶35) 50 mL,称定质量,浸泡2 h,超声处理1 h,放冷,流动相补足减失的质量,摇匀,过滤,取续滤液过0.22 μm 微孔滤膜,即得。精密称取白术薏苡仁混合超微粉和饮片粉末适量,平行2 份,其余步骤同上,即得。
2.2.3.4 吉马酮 取仁术健胃颗粒约1 g,研细,平行2份,精密称定,置具塞锥形瓶中,精密加入甲醇20 mL,称定质量,超声提取45 min,放冷,甲醇补足减失的质量,摇匀,过滤,取续滤液过0.22 μm 微孔滤膜,即得。精密称取莪术挥发油、挥发油包合物及饮片粉末适量,平行2份,其余步骤同上,即得,其中挥发油续滤液稀释50 倍后进样。
2.2.4 阴性样品溶液制备 按照仁术健胃颗粒工艺,分别制备缺炙黄芪、缺酒黄芩、缺薏苡仁、缺莪术阴性颗粒的阴性样品,再按“2.2.3” 项下方法处理,即得。
2.2.5 专属性考察 精密吸取对照品、供试品(210701)、阴性样品溶液适量,在“2.2.1” 项色谱条件下进样测定,结果见图1,可知供试品溶液中各成分色谱峰分离度理想,阴性样品溶液在相应位置处未见色谱峰,表明该方法专属性良好。
2.2.6 线性关系考察 精密称取黄芪甲苷对照品适量,甲醇制成1.461 7 mg/mL 对照品溶液,依次稀释至1.169 3、0.974 5、0.779 6、0.584 7、0.389 8、0.194 9、0.097 4、0.048 7 mg/mL,在“2.2.1.1” 项色谱条件下进样测定。以进样量自然对数值为横坐标(X),峰面积自然对数值[11]为纵坐标(Y) 进行回归。
精密称取黄芩苷对照品适量,70%乙醇制成152.886 6 μg/mL 对照品溶液,依次稀释至129.953 6、76.443 3、57.332 5、38.221 7、19.110 8、9.555 4、4.777 7 μg/mL,在“2.2.1.2” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归。
精密称取甘油三油酸酯对照品适量,乙腈-正丁醇(65 ∶35) 制成220.713 6 μg/mL 对照品溶液,依次稀释至154.499 5、108.149 7、75.704 8、52.993 4、31.796 0、19.077 6 μg/mL,在“2.2.1.3” 项色谱条件下进样测定。以进样量自然对数值为横坐标(X),峰面积自然对数值为纵坐标(Y) 进行回归。
精密称取吉马酮对照品适量,甲醇制成80.838 0 μg/mL对照品溶液,依次稀释至40.419 0、10.104 8、5.052 4、2.021 0、1.010 5、0.505 2 μg/mL,在“2.2.1.4” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归。结果见表2,可知各成分在各自范围内线性关系良好。
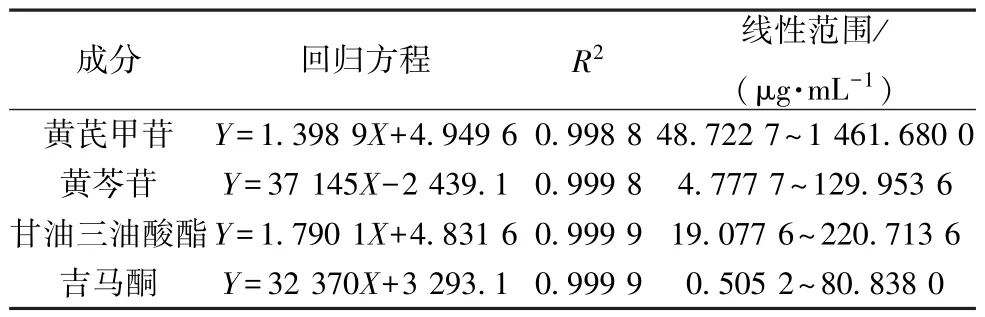
表2 各成分线性关系
2.2.7 精密度试验 精密吸取同一份供试品溶液(210701),在“2.2.1” 项色谱条件下进样测定6 次,测得黄芪甲苷、黄芩苷、甘油三油酸酯、吉马酮峰面积RSD 分别为2.58%、0.21%、1.72%、0.55%,表明仪器精密度良好。
2.2.8 稳定性试验 取同一份供试品溶液(210701),于0、2、4、8、12、24 h 在“2.2.1” 项色谱条件下进样测定,测得黄芪甲苷、黄芩苷、甘油三油酸酯、吉马酮峰面积RSD 分别为2.99%、0.35%、1.55%、1.09%,表明溶液在24 h 内稳定性良好。
2.2.9 重复性试验 取仁术健胃颗粒(210701) 适量,按“2.2.2” 项下方法平行制备供试品溶液6 份,在“2.2.1”项色谱条件下进样测定,测得黄芪甲苷、黄芩苷、甘油三油酸酯、吉马酮含量RSD 分别为2.60%、0.66%、2.74%、1.44%,表明该方法重复性良好。
2.2.10 加样回收率试验 取各成分含量已知的仁术健胃颗粒(210701) 适量,按80%、100%、120% 水平加入对照品,按“2.2.2” 项下方法制备供试品溶液,平行3 份,在“2.2.1” 项色谱条件下进样测定,计算回收率。结果,黄芪甲苷、黄芩苷、甘油三油酸酯、吉马酮平均加样回收率分别为88.18%、100.39%、94.12%、101.30%,RSD 分别为2.03%、1.56%、2.76%、1.93%。
2.3 检测分析结果 按“2.1” 项下生产工艺制备3 批仁术健胃颗粒生产过程各环节取样样品,按“2.2” 项下方法进行相应成分分析,图2 ~5 为饮片、不同中间体以及江苏省中医院(简称“省中” ) 生产的仁术健胃颗粒色谱图,南京中山制药有限公司(简称“中山” ) 仁术健胃颗粒和阴性样品色谱图见图1,表3 中山和省中成品颗粒含量比较结果及其计算所得服用量。由表3 可知,中山与省中仁术健胃颗粒对比,每次服用相同生药量(中山本品每次服用量12 g 相当于省中本品每次服用量20 g) 的情况下,黄芩苷每次服用量相近; 黄芪甲苷每次服用量中山为3.05 ~4.01 mg,省中为0.75~1.66 mg,差异较大; 在中山仁术健胃颗粒中检测出甘油三油酸酯和吉马酮,而在省中仁术健胃颗粒中则未检测到。

图2 黄芪甲苷HPLC 色谱图
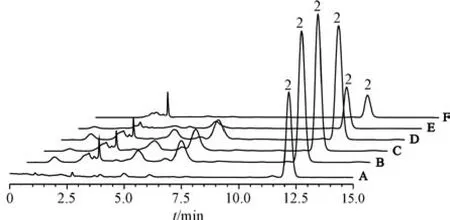
图3 黄芩苷HPLC 色谱图
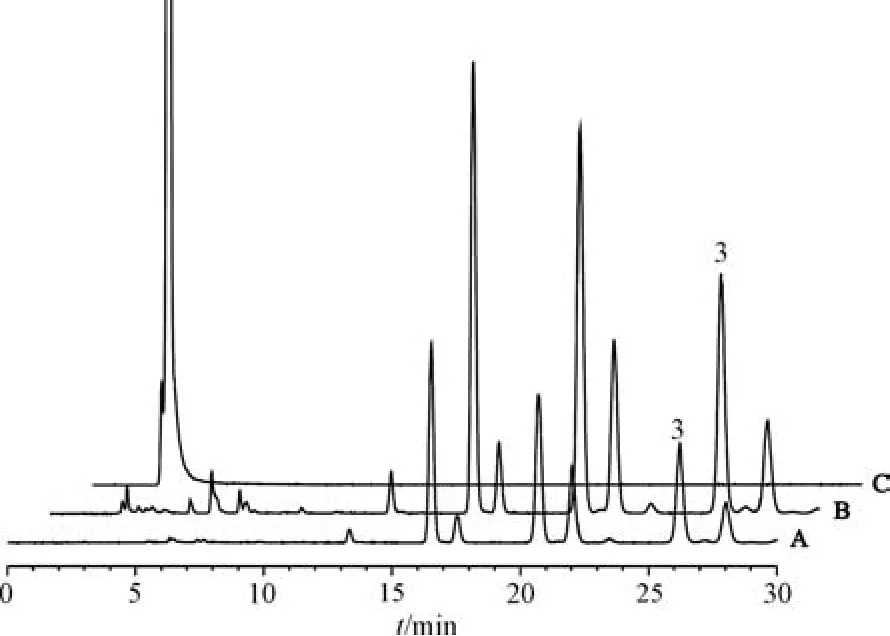
图4 甘油三油酸酯HPLC 色谱图
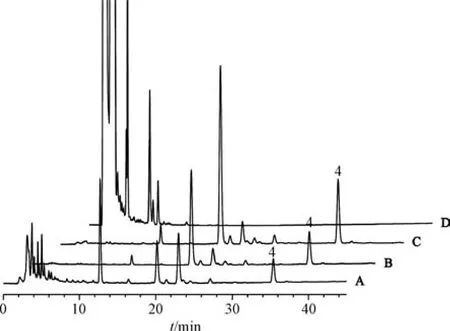
图5 吉马酮HPLC 色谱图
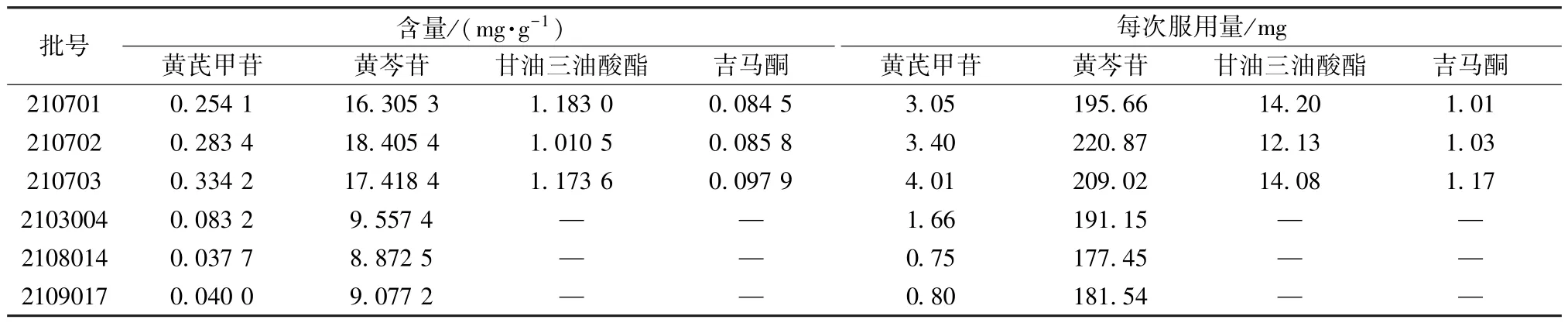
表3 不同批次颗粒含量比较及其每次服用量
2.4 生产过程控制研究
2.4.1 转移率 炙黄芪饮片3 批投料量均为19.2 kg,白术、薏苡仁饮片用量比例1 ∶1,分别为白术、薏苡仁混合超微粉实际投料量/各批次超微粉出率×1/2,其他饮片3批投料量均为14.4 kg,计算成分总量、转移率,公式为成分总量=平均含量×投料量或产出量、转移率= (当前环节成分总量/转移环节成分总量) ×100%,结果见表4。
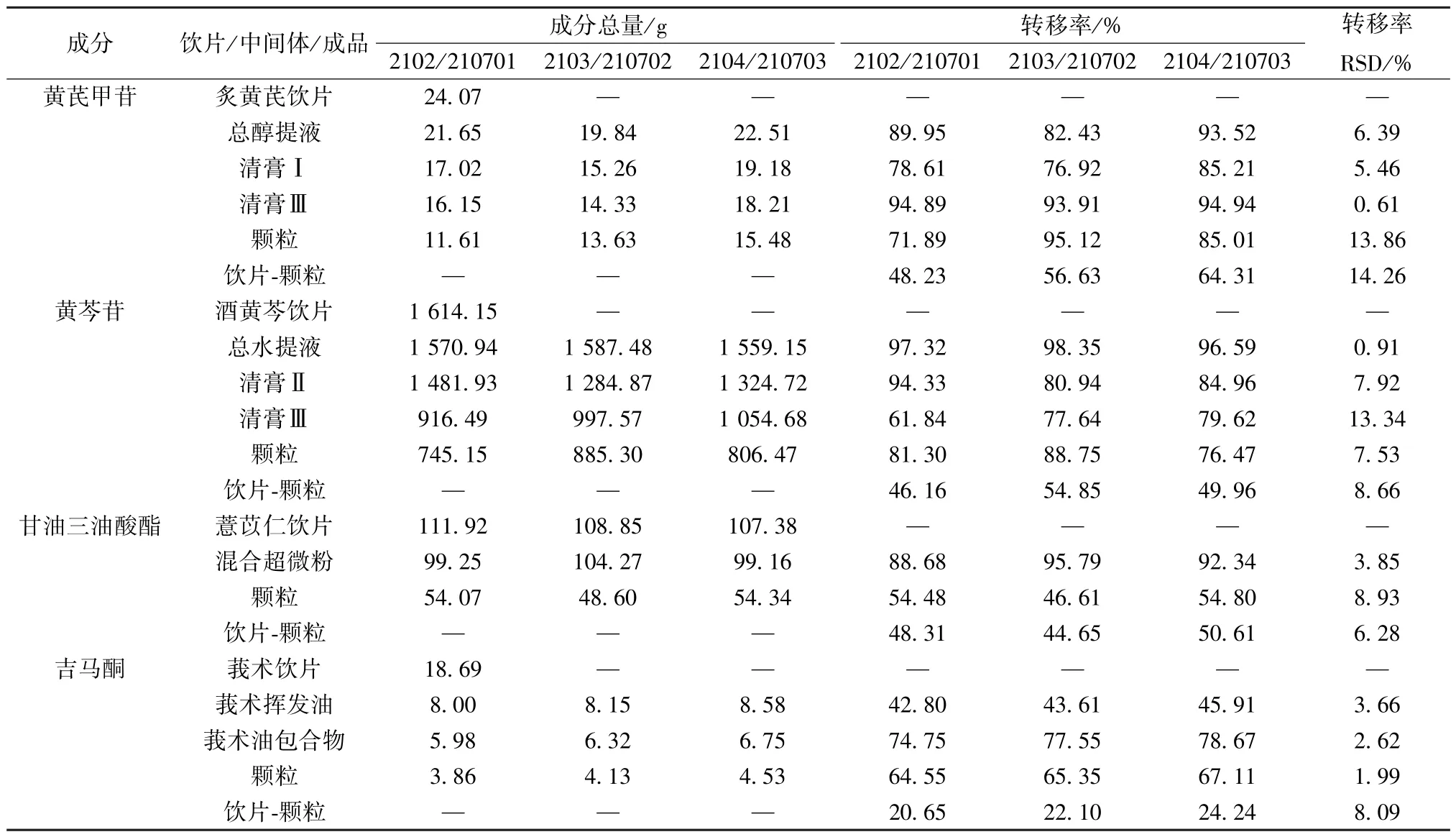
表4 转移率测定结果
2.4.2 结果分析 由表4 数据得到各指标成分转移率的变化趋势,见图6。仁术健胃颗粒生产过程中提取浓缩、打粉、包合、制粒各个环节转移率均相对稳定; 从清膏Ⅰ与清膏Ⅱ混合后浓缩到清膏Ⅲ黄芪甲苷转移率稳定,RSD 仅为0.61%,而此过程批号2102 黄芩苷转移率仅为61.84%,其余批次均在77%以上,RSD 达13.34%; 从清膏Ⅲ到仁术健胃颗粒黄芩苷转移率较平行,而该过程黄芪甲苷转移率分别为71.89%、95.12%、85.01%; 制粒过程中甘油三油酸酯转移率仅为45% ~55%; 莪术油提取阶段吉马酮的转移率均小于50%。
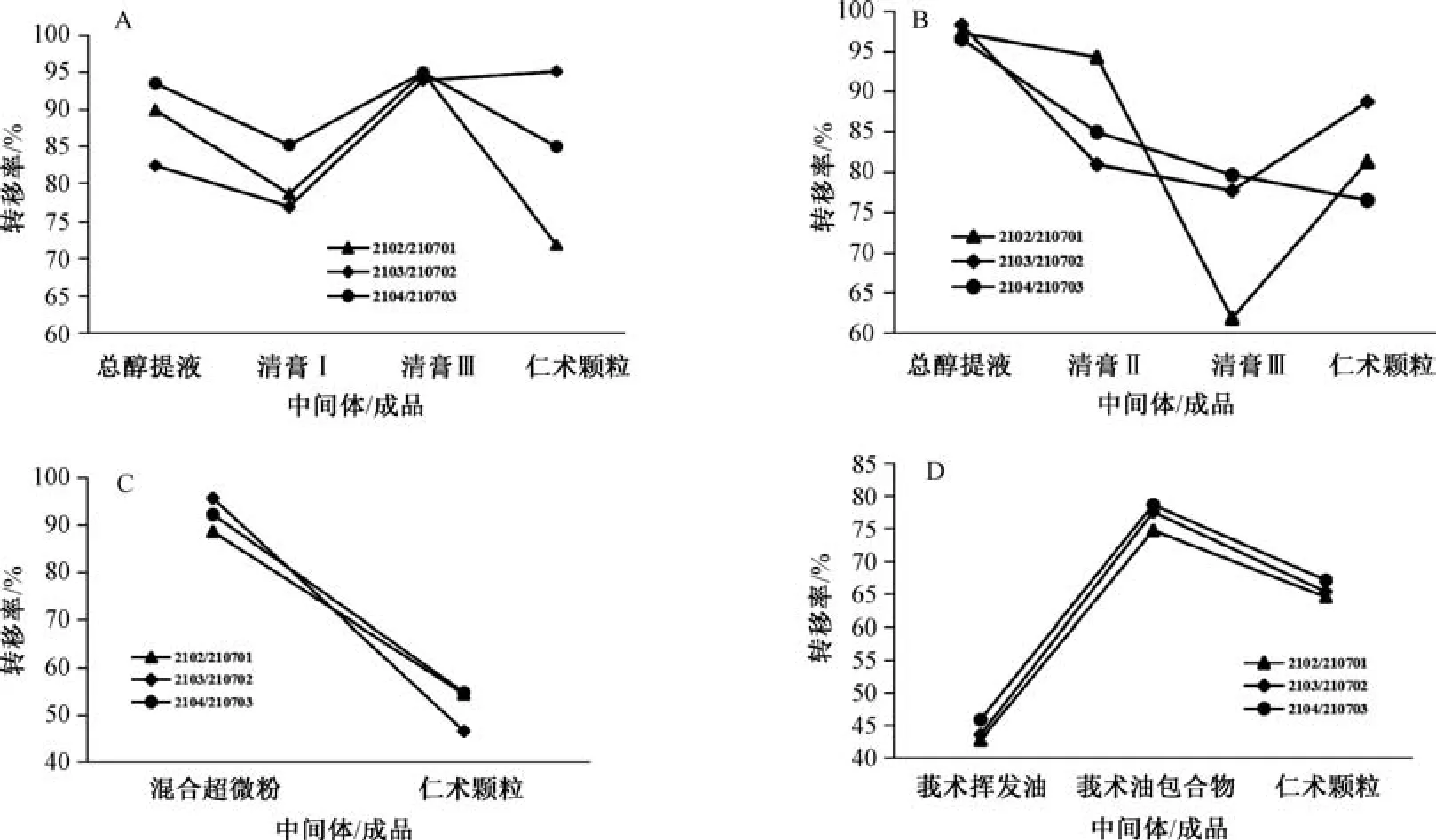
图6 黄芪甲苷(A)、黄芩苷(B)、甘油三油酸酯(C)、吉马酮(D) 转移率变化
3 讨论
3.1 指标成分选择 就处方配伍组成而言,君药黄芪益胃气健脾; 黄芩清胃中湿热; 薏苡仁消瘤抗癌; 莪术化瘀软坚。以上诸药配伍,共奏补气、活血、改善微循环之功,增强胃粘膜免疫力,阻断胃癌前病变的发展,促进肠化、异型增生的康复[12]。另外,黄芪、黄芩、薏苡仁、莪术分别代表醇提、水提、超微粉碎、挥发油包合4 个关键控制点。就成分选择而言,4 种成分在相应阴性样品中无干扰,较稳定,且黄芪甲苷、黄芩苷、甘油三油酸酯为2020 年版《中国药典》 中规定的对应饮片含量测定成分[13]。研究表明黄芪甲苷是黄芪发挥益气功效的主要物质[14]; 黄芩苷具有抑菌抗炎、解热的功效[15]; 薏苡仁油中甘油三油酸酯具有抗肿瘤作用[16]; 吉马酮具有改善血液流变性、抗血小板聚集等作用[17]。另外,4 种成分均能改善慢性萎缩性胃炎模型大鼠的胃黏膜病理病变,抑制胃癌细胞增殖并诱导其凋亡[18-23]。综上所述,本研究选取的指标成分可能为仁术健胃颗粒发挥药效的物质,并且能够较为全面反映各个环节药效成分的量值传递情况。
3.2 含量测定 本研究中4 种指标成分极性差异较大,故供试品溶液制备过程及色谱条件等不一。对提取溶剂、提取时间进行了考察,对洗脱条件、载气流量等条件进行了筛选,提高了检测成分的分离度及方法的准确度[24]。
本研究中,黄芪甲苷的回收率相对较低,主要是由于仁术健胃颗粒成分复杂,不适用2020 年版《中国药典》 黄芪中测定黄芪甲苷的前处理方法。本研究方法供试品前处理步骤繁琐,影响因素较多,处理过程中各个环节误差叠加,导致回收率偏低。2020 年版《中国药典》 规定,样品中待测定成分含量在100 μg/g、1 mg/g、10 mg/g 时,加样回收率限度分别为85% ~110%、90% ~108%、92% ~105%,结合表3 可知本研究结果满足4 种成分的检测需求。
3.3 转移率 黄芪甲苷和黄芩苷提取过程转移率均达到80%以上,而从总醇(水) 提液到清膏Ⅰ(Ⅱ) 的黄芪甲苷和黄芩苷转移率均有所下降; 清膏Ⅰ与清膏Ⅱ混合浓缩到清膏Ⅲ过程中,批号2102 清膏Ⅲ黄芩苷的转移率相比其余批次差异较大。导致上述结果的可能原因一方面是浓缩时温度和压力控制不当,皂苷类成分如黄芪甲苷容易起泡,一部分成分随着溶剂进入回收溶剂罐内。另一方面,在将浓缩液放出取样称重时,浓缩罐内难免会残留一部分清膏。因此浓缩作为一个关键控制点,应该严格把控。
另外,从清膏Ⅰ与清膏Ⅱ混合后浓缩到清膏Ⅲ黄芪甲苷转移率约为94%,相对于该步骤黄芩苷转移率(61.84% ~79.62%) 明显偏高,其原因可能为醇提后药渣Ⅱ仍含有一部分的黄芪甲苷而后继续水提最终转移至清膏Ⅲ中。
甘油三油酸酯在超微粉碎过程转移率达88%以上,影响的主要因素是超微粉出率。吉马酮在莪术油包合过程中转移率也不低,这也进一步说明超微粉碎及挥发油包合这2种先进的工艺技术能够充分保留药效成分。影响甘油三油酸酯总转移率的关键步骤是制粒过程,而莪术油的提取过程是限制吉马酮量值传递的首要因素。
制粒时药液的黏度与流量、进出风口的温度等控制不当会发生粘壁现象,底料中的白术薏苡仁超微粉和莪术油包合物以及药液中的清膏Ⅲ中成分的损耗是导致这一环节三批转移率偏低和不太稳定的主要原因,应引起重视。
3.4 与省中院内制剂比较 结果表明,在服用中山和省中颗粒时每次服用黄芩苷量相近,而黄芪甲苷差异较大,主要原因是省中在该制剂工艺中所有药材均使用水提取,而中山根据药材成分性质,对酒黄芩使用水提,对炙黄芪使用醇提,提取更为完全。超微粉碎及莪术油的提取保留了一些不溶于水的极性比较小的成分如甘油三油酸酯和吉马酮,所以在省中本品中检测不到两者。另外,中山工艺中对醇提后的药渣和莪术药渣还进一步用水提取,工艺精细巧妙而又不失科学。
4 结论
本研究对仁术健胃颗粒采用量值传递规律的方法进行研究,此种质量控制模式依托各生产环节的衔接,每个环节设有“输入质量” 与“输出质量”[25],加以科学合理的指标进行评估,强调了中药复方研究过程的整体性和全程可追溯性。从与省中仁术健胃颗粒院内制剂比较得出,中山在其基础上对工艺进行了深入研究,更大程度上保留了药效成分,提高了临床疗效,是中药现代化制剂研究的典范,对传统复方中成药二次开发具有指导作用。

