肝细胞癌双硫死亡相关LncRNA预后模型的构建和验证
方 霞,孙江云,袁丰华
(1. 赣南医科大学基础医学院;2. 赣南医科大学第一临床医学院,江西 赣州 341000)
肝癌是全球范围内常见的癌症,具有快速生长、易发生远处转移及高死亡率等特点,主要的病理类型为肝细胞癌[1]。目前,肝癌最主要的治疗策略仍然是根治性切除[2]。由于肝细胞癌发病隐匿且进展迅速,多数患者在诊断时已为晚期,导致治疗难度增加,且治疗效果差[3]。尽管存在一些治疗方法,如经导管动脉化疗栓塞、射频热消融和靶向药物(如索拉非尼),用于治疗晚期且无法进行手术切除的肝细胞癌患者,但这些方法疗效较差[4]。因此,迫切需要在现有治疗方法的基础上寻找更有效的治疗靶点或方法,以提高肝细胞癌治疗的疗效并改善患者预后。
调节性细胞死亡是一种经过精确调控的正常细胞死亡过程,在维持组织稳态、免疫调节、抑制肿瘤发展中起重要作用[5-6]。然而,当细胞死亡调控失衡或异常时,可能会导致肿瘤形成。肿瘤细胞通过突变或异常表达凋亡调控因子(如p53)逃避细胞凋亡的触发,导致肿瘤细胞无限增殖[7]。双硫死亡是一种新发现的涉及多种代谢途径的细胞死亡方式,它与已知的铁死亡和铜死亡不同,是溶质载体家族7成员11(Solute carrier family 7 member 11,SLC7A11)高表达的肿瘤细胞在葡萄糖饥饿环境下,细胞内的二硫化物含量异常增加,导致肌动蛋白细胞骨架中二硫键含量增加,进而引发肌动蛋白丝过度收缩,最终破坏细胞骨架结构并导致肿瘤细胞死亡的过程[8]。这种细胞死亡方式可能会成为靶向抑制肿瘤的新方法。
长链非编码RNA(Long noncoding RNAs,LncRNA)是指核苷酸分子大于200的RNA,不具备编码功能,参与细胞的生长、分化、凋亡等生理和病理过程[9]。LncRNA 在肿瘤发生发展中也起着至关重要的作用。研究表明,LncRNA 在肝细胞癌中异常表达,通过与其他蛋白质或RNA 相互作用,影响肿瘤细胞增殖和死亡[10]。例如LncRNA HEPPAL 通过降低SLC7A11 表达促进肝细胞癌的铁死亡[11]。目前,双硫死亡相关的LncRNA 在肝细胞癌中的作用研究较少。本文利用生物信息学技术筛选与HCC 预后有关的双硫死亡LncRNA,构建风险预后模型,并验证该模型的可行性,为寻找与双硫死亡相关的生物学靶点以及进一步研究双硫死亡相关LncRNA 在HCC中的生物学作用提供理论依据。
1 材料和方法
1.1 数据获取和处理 从癌症基因组图谱(The cancer genome atlas,TCGA)数据库(https://portal.gdc. cancer. gov/)获取肝细胞癌数据集的RNA-seq和相关临床信息数据,包括50 例正常样本和374 例肿瘤样本,提取HCC 的mRNA 和LncRNA 的表达数据,从相关文献中得到10 个双硫死亡相关基因包括:GYS1、NDUFS1、OXSM、LRPPRC、NDUFA11、NUBPL、NCKAP1、RPN1、SLC3A2、SLC7A11[8,12-13],提取双硫死亡基因的表达量,使用Limma 包进行共表达分析,筛选标准为Pearson 相关性系数|cor|>0.4和P<0.001。
1.2 构建并验证HCC 双硫死亡相关LncRNA 的预后模型 对TCGA 肝细胞癌数据集中的生存数据进行筛选,保留HCC 患者的年龄、性别、生存时间、生存状态、肿瘤分级、分期,去除生存状态和生存时间未知的样本,并将表达数据与生存数据进行整合。使用Caret 包将HCC 数据按1∶1 随机分为训练集和验证集,在训练集中进行单因素Cox 回归分析(P<0.05),Glmnet 包[14]进行LASSO 回归分析,用多因素Cox回归构建模型。计算每个患者的风险值公式为:score=∑i=1n Coef i*xi,其中xi和Coef i分别代表每个样品的LncRNA 表达量和风险系数。根据训练集中风险值的中位数将OS 患者分成高、低风险组,并在验证集和整个数据集中进行内部验证,使用survminer 包[15]绘制生存曲线、受试者工作特征(ROC)曲线和C 指数(C-index)评估模型的可行性,scatterplot3d 包进行主成分分析(PCA),评估分组的效果。运用单因素和多因素Cox回归评估风险评分是否为独立预后因素。
1.3 高、低风险组基因的功能富集分析 使用clusterProfiler 包[16]对高、低风险组差异基因进行GO和KEGG 富集分析,并对高、低风险组的基因进行GSEA 功能富集分析,探究这些基因在HCC 中参与的生物学功能,过滤条件为P<0.05。
1.4 高、低风险组基因的免疫细胞功能及免疫治疗效果分析 使用GSVA 和GSEABase 包计算不同风险组之间免疫功能的差异,并从癌症免疫图谱(TCIA)数据库(https://tcia. at/home)获得免疫治疗评分数据,评估高、低风险组免疫治疗效果。
2 结果
2.1 构建HCC 双硫死亡相关LncRNA 的预后模型 提取TCGA 肝细胞癌RNA-Seq 数据中mRNA 和LncRNA,得到13 162 个LncRNA,利用Pearson 相关性分析13 162 个LncRNA 和10 个双硫死亡相关基因,得到320 个双硫死亡相关的LncRNA,未发现与OXSM相关的LncRNA(图1A)。随后,利用双硫死亡LncRNA 构建预后模型,使用Caret 包将TCGA 肝细胞癌患者样本划分为训练集和验证集,对训练集进行单因素Cox 回归分析(P<0.05)得到了40 个与HCC 预后相关的双硫死亡LncRNA(图1B),使用LASSO 回归和多因素Cox 回归分析进一步筛选,最终得到6 个双硫死亡相关LncRNA(ELFN1-AS1、AL049840.2、MKLN1-AS、CYTOR、AL161645.1 和AC069307.1)(图1C、图1D)。
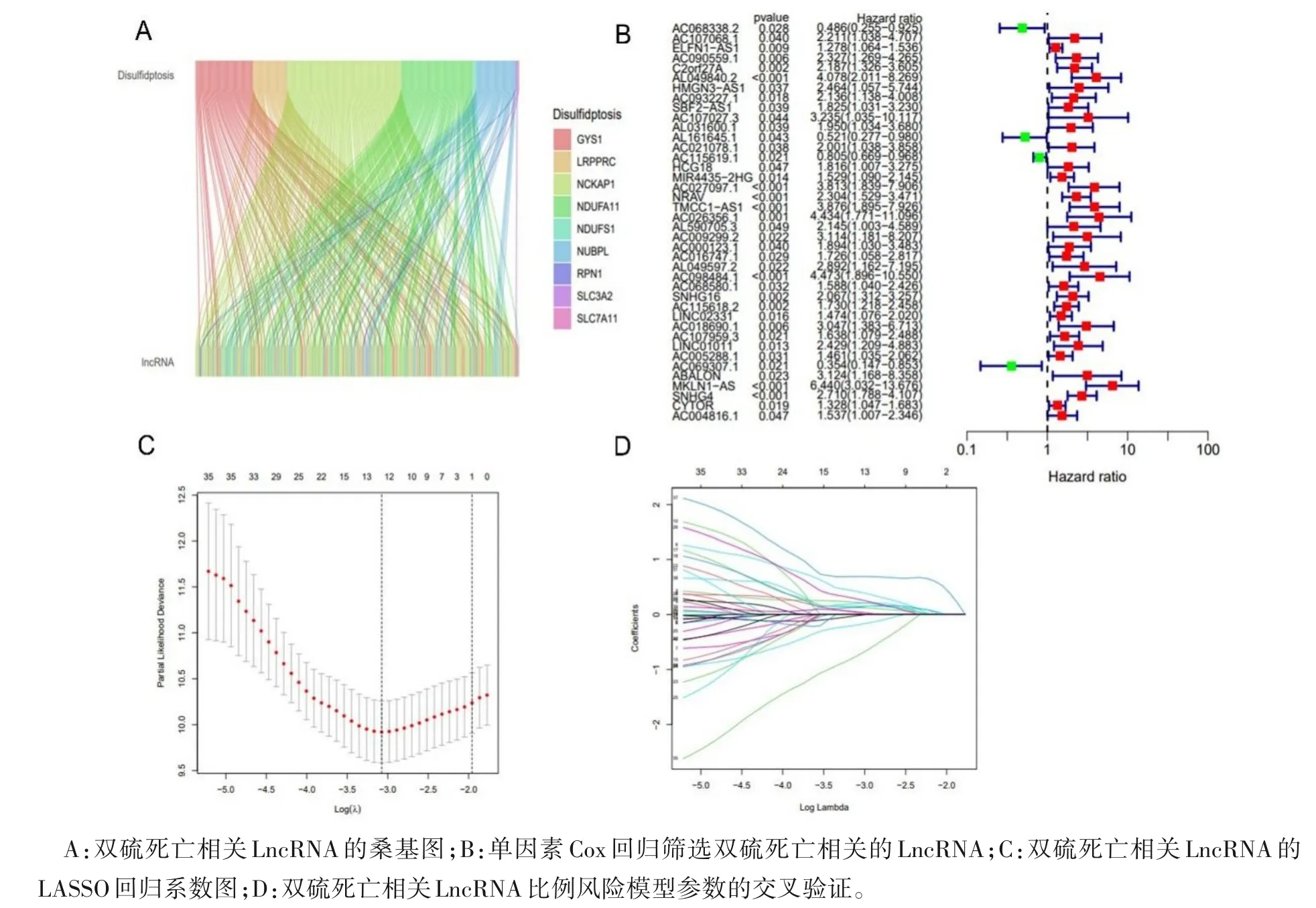
图1 HCC双硫死亡相关LncRNA的预后模型
2.2 评估HCC 双硫死亡相关LncRNA 的预后模型效果 使用Kaplan-Meier(K-M)生存曲线分析高、低风险组的预后情况,结果显示,在整个数据集、训练集和验证集中,总体生存期(Overall survival,OS)差异均有统计学意义(P<0.05),高风险组的总生存期比低风险组的总生存期短(图2A、图2B、图2C)。此外,对高、低风险组进行风险评估,风险评分分布图(图2D、图2E、图2F)和生存状态散点图(图2G、图2H、图2I)显示,随着风险评分增加的患者死亡逐渐增加。 风险热图结果表明,ELFN1-AS1、AL049840.2、MKLN1-AS、CYTOR 在高风险组中高表达,而AL161645.1 和AC069307.1 在高风险组中低表达(图2J、图2K、图2L)。
单变量和多变量Cox 回归分析评估模型的临床意义,结果显示,风险评分和肿瘤分期是临床独立预后因素(P<0.05)(图3A、图3B)。ROC 曲线结果显示,风险评分在AUC 值上明显优于其他临床特征(图3C)。在1 年、3 年和5 年的时间点上,风险评分的ROC 曲线下面积分别为0.745、0.709 和0.735(图3D)。相比其他临床因素,风险评分的C 指数值更高(图3E)。此外,通过主成分分析结果表明,风险模型中LncRNA 双硫死亡基因的表达具有更分散的分布特征(图3F、图3G、图3H、图3I),说明该模型中将患者分为高风险组和低风险组质量较好。

图3 评估HCC双硫死亡相关LncRNA预后模型临床效果
2.3 高、低风险组基因的功能富集分析 对高、低风险组差异基因进行GO 和KEGG 富集分析,GO 富集分析显示,生物学过程主要富集在外部封装结构组织,细胞组分主要富集在含胶原的细胞外基质,分子功能主要富集在细胞外基质成分(图4A),KEGG 主要富集在PI3K/AKT 信号通路(图4B)。此外,对高、低风险组差异表达基因进行功能富集分析,发现高风险组主要富集在细胞外基质受体途径(图4C),而低风险组主要富集在药物代谢细胞色素p450途径(图4D)。
2.4 高、低风险组基因的免疫细胞功能分析 通过GSEABase 包分析高、低风险组免疫功能之间的差异,结果显示,高风险组抗原呈递细胞共刺激(APC_CO_stimulation)、趋化因子受体(CCR)、主要组织相容性复合体Ⅰ类呈递(MHC_class_Ⅰ)、副炎症(Parainflammation)和辅助性T细胞2(Th2)的表达高于低风险组(图5),高风险组的TIDE 评分高于低风险组(图6)。
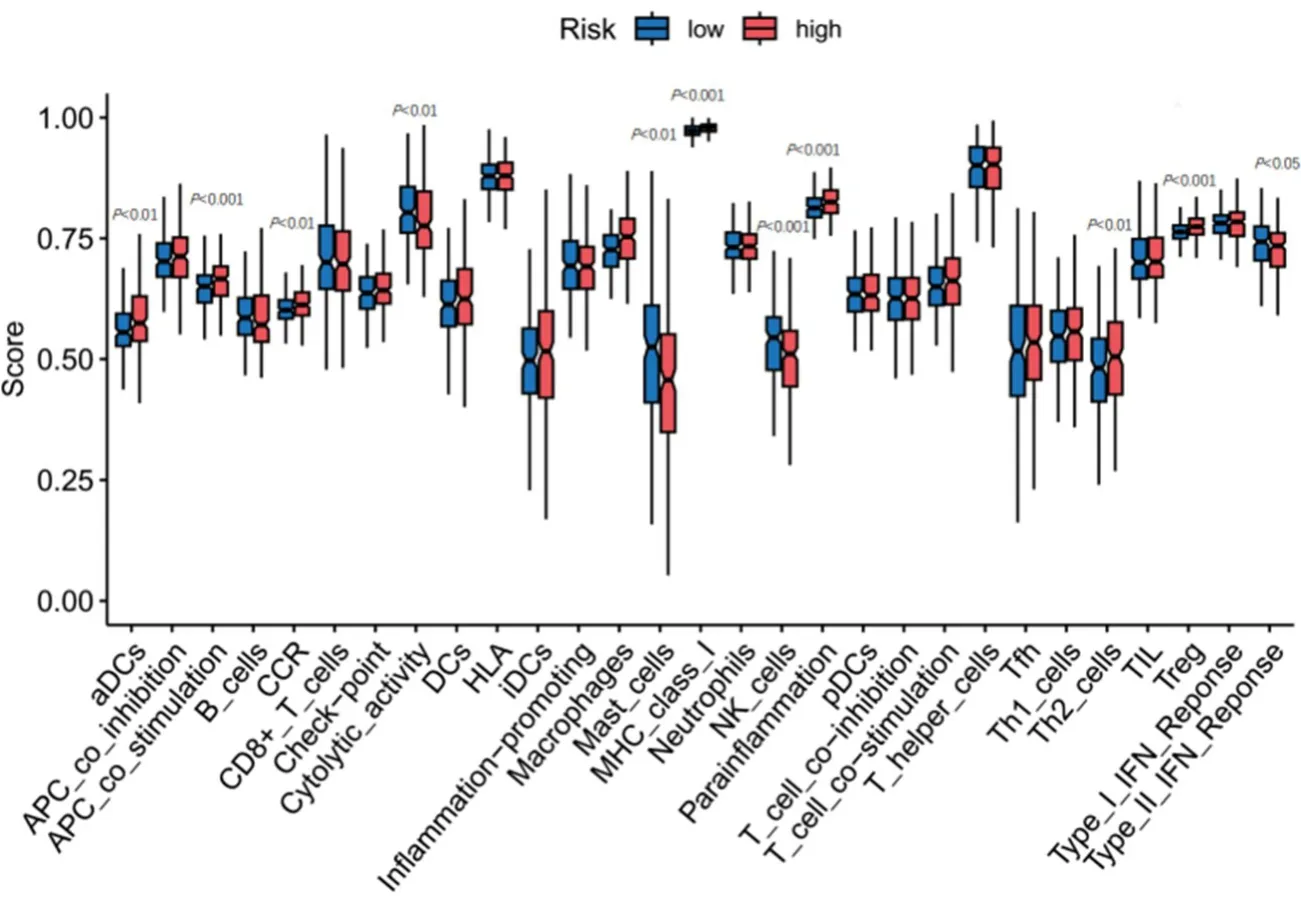
图5 基因免疫细胞功能分析
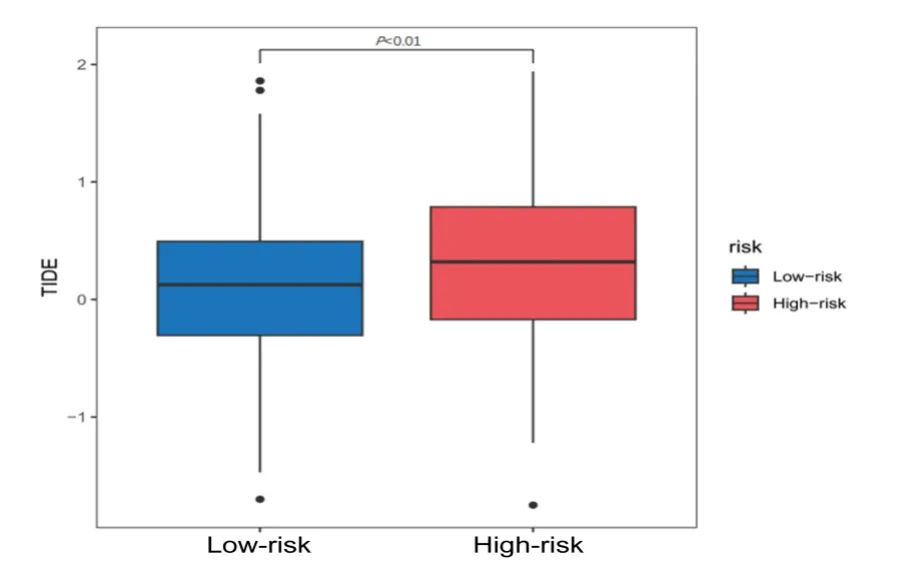
图6 TIDE评分比较
3 讨论
肝细胞癌是一种常见的恶性肿瘤,具有快速生长、易发生远处转移及高死亡率等特点,严重威胁患者生命健康[17],虽然很多学者不断研究新的治疗策略及药物靶点,但因为晚期肝癌的治疗限制性以及对靶向药物的耐药性,治疗效果差,患者生存率较低。因此,研究肝细胞癌的发生发展机制及寻找HCC有效的治疗靶点对于改善患者预后至关重要。
LncRNA 是一类核苷酸分子长度大于200 的非编码RNA,参与调控多种细胞生物学过程,包括细胞增殖、凋亡及转录后水平的分化等[18]。在细胞增殖过程中,LncRNA 可以调节与细胞周期相关的基因表达,影响细胞的增殖能力;在细胞凋亡过程中,通过调节与凋亡相关基因家族(如Bcl-2 家族)的表达,可改变细胞对凋亡的敏感性;在转录后水平的分化过程中,LncRNA 还可通过影响mRNA 的剪切和修饰影响基因表达,进而影响其生物学功能[19]。
目前已有多项研究证明,LncRNA 参与调节肿瘤代谢及细胞信号通路影响多种肿瘤的发生发展[20-21]。LncRNA 在肝癌中表达异常,促进肝癌的恶性增殖及血管生成,且与细胞的铁死亡及铜死亡密切相关[22-23]。双硫死亡是一种与糖代谢、线粒体呼吸及能量代谢等多个代谢途径相关的细胞死亡方式。有研究[24]表明,LRPPRC(Leucine-Rich alpha-2-Glycoprotein-1)作为一种参与双硫死亡的基因,能通过调控能量代谢途径影响线粒体自噬。LncRNASNHG17与LRPPRC相互作用,增强c-Myc 蛋白的表达,从而促进肝细胞癌的发展[25]。然而双硫死亡相关LncRNA 在HCC 中作用研究尚少,具体作用机制尚不清楚。通过查阅文献及应用共表达分析得到双硫死亡相关LncRNA,并利用单因素Cox回归、lasso回归和多因素Cox 回归构建了6 个双硫死亡相关LncRNA 预后模型,包括ELFN1-AS1、AL049840.2、MKLN1-AS、CYTOR、AL161645.1 和AC069307.1。已有研究[26-27]表明,ELFN1-AS1 可促进结肠癌及视网膜细胞瘤的恶性进展。MKLN1-AS 在HCC 中高表达且与患者不良预后相关[28],与本研究结果一致。CYTOR 可通过调节miR-125b-5p/KIAA1522 轴影响肝癌细胞的增殖、细胞周期和凋亡[29]。其中AL049840.2、AL161645.1 和AC069307.1 的作用尚未有研究报道。
随后,为了验证该模型的可行性,应用K-M 生存曲线分析得知模型中的高风险组总生存率低于低风险组,在1 年、3 年和5 年的风险评分的ROC 曲线下面积分别为0.745、0.709和0.735,这些值均大于0.65,表明该风险评分具有较高的预测准确性,主成分分析及C指数分析也证明该模型具有良好的预测价值。高风险组功能富集分析结果表明,双硫死亡相关LncRNA 功能主要富集在与细胞外基质受体途径有关,此途径已证实在肿瘤细胞生长、侵袭、转移和血管生成过程中起重要作用[30]。
在免疫功能方面,通过免疫功能差异分析发现高风险组中抗原呈递细胞共刺激(APC_CO_stimulation)、趋化因子受体(CCR)、主要组织相容性复合体Ⅰ类呈递(MHC_class_Ⅰ)、副炎症和辅助性T细胞2(Th2)高表达,表明双硫死亡相关LncRNA 可影响肿瘤免疫功能。并且,高风险组的TIDE 高于低风险组,表明高风险组免疫逃逸潜能大于低风险组,免疫治疗效果更差。
双硫死亡是一种新的细胞死亡方式,可能成为靶向治疗肿瘤的新方法。LncRNA 通过多种形式影响肿瘤的发生发展。本文基于TCGA 数据库构建的双硫死亡相关LncRNA 预后模型具有良好预测性能,为HCC的临床治疗和研究提供新思路。

