唑来膦酸与辛伐他汀治疗T2DM合并骨质疏松患者的疗效分析
何 笛,王煜东,杨 璐,夏 利
2型糖尿病(T2DM)合并骨质疏松(OP)是一种常见的并发症,因患者长期高血糖导致糖化终产物堆积,损伤骨胶原纤维和基质,使骨强度降低所致[1]。T2DM合并OP表现为骨量减少,骨质结构破坏,骨质强度下降,容易发生骨折[2]。唑来膦酸已在骨质疏松症、癌骨转移、高血钙症中发挥出重要作用。辛伐他汀是一种降低胆固醇的药物,也被称为他汀类药物,可以有效降低低密度脂蛋白胆固醇(LDL-C)的水平,从而降低冠心病、心肌梗死等心血管疾病发生的风险[3]。本研究将唑来膦酸联合辛伐他汀应用在T2DM合并OP患者中,通过对190例患者进行分析比较,旨在为提高患者疗效提供依据。
1 资料与方法
1.1 一般资料 选取2019年7月至2022年7月本院收治的T2DM合并OP患者190例为研究对象。分为研究组95例,对照组95例,2组一般资料比较差异无统计学意义(P>0.05)。本研究方案经本院伦理委员会审查批准。
1.1.1 纳入标准 ①符合《原发性骨质疏松症诊治指南(2011年)》[4]中诊断标准;②初诊,糖尿病病程不超过3年,均服用降糖药物控制血糖,未应用胰岛素;③患者及家属均知情同意并签署承诺书者。
1.1.2 排除标准 ①重要脏器存在器质性改变者;②近期接受抗骨质疏松治疗者;③存在其他原因导致的骨代谢病患者;④对研究药物过敏者;⑤合并恶性肿瘤者;⑥认知障碍不能配合本研究者;⑦有其他并发症。
1.2 方法
1.2.1 对照组 静脉滴注唑来膦酸(南京海润医药有限公司,国药准字H20051986)5 mg/100 mL,速度为30 mL/h,治疗1次。
1.2.2 研究组 在对照组基础上加入辛伐他汀(浙江京新药业股份有限公司,国药准字H20000009)40 mg,晚上7点服用,治疗10个月。
1.3 观察指标
1.3.1 胰岛细胞指标 于治疗前、治疗10个月后通过稳态模型进行计算,包括胰岛素分泌指数(HOMA-β)、胰岛素抵抗指数(HOMA-IR)。HOMA-β=20×空腹胰岛素/(空腹血糖-3.5),HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.3.2 骨密度、骨代谢指标 采集患者治疗前、治疗10个月后清晨空腹肘静脉血3 mL,通过3 000 r/min离心15 min后,取上层血清低温保存待测。使用DCS-600EXV骨密度仪(日本日立阿洛卡)检测患者骨密度Ward三角区、腰椎骨L1—4、股骨颈骨密度。使用电化学发光免疫法检查骨吸收标志物1型胶原C端β特殊序列(β-CTX)指标,试剂盒购自武汉菲越生物科技有限公司;使用酶联免疫吸附法检测骨硬化蛋白及骨保护素(OPG),试剂盒购自上海酶联生物科技有限公司;使用放射免疫法检查骨钙素(OC),试剂盒购自北京福瑞润泽生物技术有限公司;使用全自动生化仪(博科 BK-1200)检测骨碱性磷酸酶活力(BALP)。
1.3.3 血清微小RNA-16(miR-16)、微小RNA-30a(miR-30a)测定 采集所有患者的清晨空腹外周静脉血3 mL,通过3 500 r/min离心10 min后,收集上层血清放置在低温环境下保存待测。通过北京奥维亚生物公司生产的试剂盒进行核糖核酸(RNA)提取并逆转录成互补RNA(cRNA),而后行基因扩增,使用primer5软件进行基因检测的合成及设计引物,内参为U6。U6:上游引物5′-ccatgctcttctactcct-3′,下游引物5′-CACTGATGTCGGTTAGTT-3′。miR-16引物,上游为5’-GCGGTTAATGCTAATCGTGAT-3’,下游为5’-GTGCAGGGTCCGAGGT-3’。miR-30a引物,上游为5’-GTTGAGCTCTTGCTCCAGCC-3’,下游为5’-CGTGGATCAGTTTCCTG-3’。通过ABI7500型实时定量多聚酶链式反应(PCR)仪进行qPCR反应,反应条件为95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 60 s,共40个循环,通过2-△△CT公式计算2种因子的相对表达量。
1.3.4 不良反应 包括恶心呕吐、乏力、头晕、发热、便秘、腹痛等情况。

2 结果
2.1 2组患者一般资料比较 研究组男性43例(45.3%),对照组男性45例(47.4%),2组一般资料比较差异无统计学意义(P>0.05),见表1。
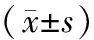
表1 一般资料比较
2.2 2组患者胰岛细胞指标比较 2组患者治疗10个月后HOMA-β水平高于治疗前(P<0.05),HOMA-IR低于治疗前(P<0.05),见表2。
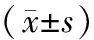
表2 2组患者胰岛细胞指标比较
2.3 2组患者骨密度、骨代谢指标比较 2组患者治疗10个月后Ward三角区骨密度、腰椎骨L1—4骨密度、股骨颈骨密度、OPG、BALP、OC、骨硬化蛋白与治疗前相比均升高(P<0.05),β-CTX与治疗前相比均降低(P<0.05),见表3和表4。

表3 2组患者骨密度指标比较
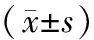
表4 2组患者骨代谢指标比较
2.4 2组患者miR-16、miR-30a比较 2组患者治疗10个月后miR-16、miR-30a与治疗前比较均降低(P<0.05),见表5。
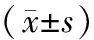
表5 2组患者miR-16、miR-30a比较
2.5 2组患者不良反应比较 2组患者恶心呕吐、乏力、头晕、发热、便秘、腹痛发生率,见表6。

表5 2组患者不良反应比较[n(%)]
3 讨论
T2DM合并OP患者表现为局部酸痛或钝痛,加重时可出现夜间疼痛,部分患者由于骨质疏松,身高会出现缩短[5]。
研究[6]表明,将辛伐他汀应用在绝经后骨质疏松女性骨折患者中效果显著,能够有效促进骨折愈合,改善骨密度及骨代谢。本研究结果显示,治疗10个月后研究组HOMA-β较对照组高,HOMA-IR较对照组低,这是因为HOMA-β即胰岛素的分泌响应能力,血糖水平越高,胰岛β细胞分泌的胰岛素就越多[7]。HOMA-IR即机体的胰岛素敏感性,血糖升高后,胰岛素会促进组织细胞摄取葡萄糖并利用其作为能量来源,胰岛素抵抗意味着细胞对胰岛素的反应减弱,需要更多的胰岛素才能完成相同的生理反应[8]。辛伐他汀可通过抑制肝脏内胆固醇合成,增加肝脏胆固醇的摄取和降解,从而促进胆固醇转化为类固醇激素前体的代谢途径,使胰岛β细胞合成和分泌胰岛素的能力增强[9]。辛伐他汀还可以通过抑制解酸性磷酸酶活性,从而降低细胞内蛋白酪氨酸磷酸化水平,促进胰岛素信号通路的传递和胰岛素作用于细胞的效应,改善机体对胰岛素的敏感性和胰岛素抵抗程度,从而降低HOMA-IR。治疗10个月后研究组Ward三角区、腰椎骨L1—4及股骨颈骨密度均较对照组高,且β-CTX较对照组低,OPG、BALP、OC、骨硬化蛋白较对照组高,究其原因在于辛伐他汀可以抑制破骨细胞前体细胞的分化和成熟,抑制骨吸收因子的产生和释放,并促进骨密度的增加[10]。伐他汀可以改善机体代谢异常,降低胰岛素抵抗,提高机体对钙质的吸收和利用,从而调节骨代谢,降低β-CTX水平。另外,辛伐他汀通过抑制骨吸收、增加OPG水平、协同提高BALP和OC水平、增加骨密度等多种途径促进骨形态的发育和修复,从而对T2DM合并OP患者的治疗产生积极作用。治疗10个月后研究组miR-16、miR-30a较对照组低,这是由于miR-16是一种高度保守的miRNA分子,主要通过抑制mRNA的翻译或增强mRNA降解来影响基因表达[11]。miR-30a也是一种常见的miRNA分子,具有广泛的生物学功能,在心血管疾病、癌症等多种疾病中起着重要作用[12]。辛伐他汀可以通过调节Bcl-2/Bax和Caspase家族等基因表达,促进骨细胞的生存和增殖,从而降低miR-16和miR-30a的表达。除此之外,研究组不良反应发生率较对照组低,这可能是因为辛伐他汀的半衰期较长,需要控制服药时间,通常建议在晚上服用,以充分发挥降低胆固醇的疗效,并减少不良反应的发生。

