铂耐药上皮性卵巢癌组织中CXCL5的表达与患者临床特征的关系
何 滢,马晓玲,高璐璐,祖逸峥,张瑞琪 ,哈春芳,4
卵巢癌是女性生殖系统三大常见恶性肿瘤之一,其死亡率位居所有妇科恶性肿瘤之首[1]。因为卵巢所特有的解剖位置及结构,就诊时70%的患者已处于晚期。目前晚期上皮性卵巢癌的标准诊治流程为初始肿瘤细胞减灭术后给予 6个疗程的含铂方案化疗[2]。但经初始治疗后患者3年累积复发率高达70%,5年总生存率不足50%[3]。铂类耐药是目前卵巢癌复发的主要原因之一[4]。因此,化疗耐药已成为提高卵巢癌治愈率的关键限制因素。已有实验证实,CXCL5即CXC趋化因子配体-5在非小细胞肺癌、肝细胞癌、胰腺癌等多种恶性肿瘤中异常表达[5],可促进非小细胞肺癌放疗敏感[6],还可作为肾癌、乳腺癌中促溶酶药物耐药的生物标志物[7]。课题组前期采用转录组测序筛选出上皮性卵巢癌患者差异基因5个,其中CXCL5基因表达最为明显并行qRT-PCR 验证。故本研究探讨 CXCL5 在铂耐药上皮性卵巢癌中的表达情况及其与临床特征之间的关年2月就诊于宁夏医科大学总系,旨在为临床上卵巢癌铂类耐药探索有效的靶向治疗提供理论依据。
1 资料与方法
1.1 一般资料 本研究选取2015年1月至2021年12月在宁夏医科大学总医院妇科行满意肿瘤细胞减灭术联合铂类为主规范化疗(至少6次),并且治疗结束后随访时间不少于6个月的134名上皮性卵巢癌患者。其中根据停止化疗6个月后是否复发分为铂耐药组(实验组)70例和铂敏感组(对照组)64例,铂耐药组平均年龄为(56.14±8.97)岁,铂敏感组平均年龄为(54.50±6.91)岁。所有入选者的组织石蜡标本均为手术切除组织蜡块,由宁夏医科大学总医院病理科制备。全部病例均经组织病理学明确诊断,该实验已获得宁夏医科大学总医院伦理委员会的批准与授权,实验参与者均已签署知情同意书。
1.1.1 纳入标准 ①符合《中华妇产科学》(第3版)中相关卵巢癌诊断标准的患者;②于宁夏医科大学总医院进行初始肿瘤细胞减灭术且术后病理确诊为上皮性卵巢癌的患者;③于宁夏医科大学总医院术后接受至少6个疗程含铂方案化疗的患者;④治疗结束后随访时间大于6个月且病例资料完整可靠的患者。
1.1.2 排除标准 ①非上皮性卵巢癌的恶性肿瘤患者;②合并严重内科疾病的患者;③术后未规范化疗的患者;④随访时间小于6个月或失访的患者。
1.2 铂耐药复发的诊断标准[8]经规范治疗达到临床症状缓解的患者出现肿瘤标志物CA125升高、胸腹水,查体或影像学资料发现包块、不明原因肠梗阻,其中2项阳性或几项阳性提示卵巢癌复发。
1.3 铂耐药组各相关因素分组依据 根据课题组前期研究改良的Suidan 评分[2],将CA125、HE4分为高低水平组,CA125组又分为CA125<545.6 U/mL组和 CA125≥545.6 U/mL组;HE4组又分为HE4<246.7 pmol/L组和HE4≥246.7 pmol/L组。参考人民卫生出版社出版的第九版《诊断学》,将NEUT、PLT分为高低水平组,NEUT组又分为NEUT<7.0×109/L组和NEUT≥7.0×109/L组;PLT组又分为PLT<300×109/L组和PLT≥300×109/L组。患者首次治疗时的影像学检查(超声、CT等)[9]或未行新辅助化疗手术探查体现的腹水量,以500 mL为界值,分为腹水量<500 mL组和腹水量≥500 mL组。
1.4 主要试剂 兔来源多克隆CXCL5抗体 (美国Affinity Biosciences 公司) ,HRP标记山羊抗兔和二氨基联苯胺(DAB)浓缩液及稀释液购自北京中杉金桥生物技术有限公司。
1.5 实验方法 采用免疫组织化学的方法进行石蜡组织中抗原检测。所有肿瘤组织标本均经10%甲醛固定,石蜡包埋,连续3μm切片。将载玻片以30°角度放置在60 ℃漂烘机上烘干30 min后插入染色架,并放入60 ℃烤箱过夜。用二甲苯脱蜡后用依次递减浓度酒精脱去二甲苯并水化;微波抗原修复后加入适量内源性过氧化物酶阻断剂来消除内源性过氧化物酶;加入适量的山羊血清封闭液完全覆盖组织块,在室温孵育30 min后再加入适当比例稀释的一抗 (稀释浓度为1∶200 ),放入4 ℃冰箱过夜后室温孵育1h,用PBS溶液清洗2~3次(每次5 min);然后滴加黄色加强剂,放入保温盒里15 min,PBS溶液清洗2次后甩干放入保温盒里滴加二抗,盖上保温盖放置1个小时,清洗2遍后DAB显色液显色;苏木素染液复染;梯度乙醇脱水;凝胶封片;显微镜观察组织染色情况,并在相同条件下拍照记录。
1.6 结果判读 CXCL5以细胞浆或细胞膜呈现黄色或棕黄色颗粒为阳性表达,所有结果均需由两位病理医师独立阅片判读,每张切片在(200×)高倍镜下随机选取5个视野(必须保证所有图像在同一条件下采集),用软件Image J进行图像分析,测量阳性细胞的平均光密度(AOD),计算5个视野的平均数值作为本张切片的平均光密度值。

2 结果
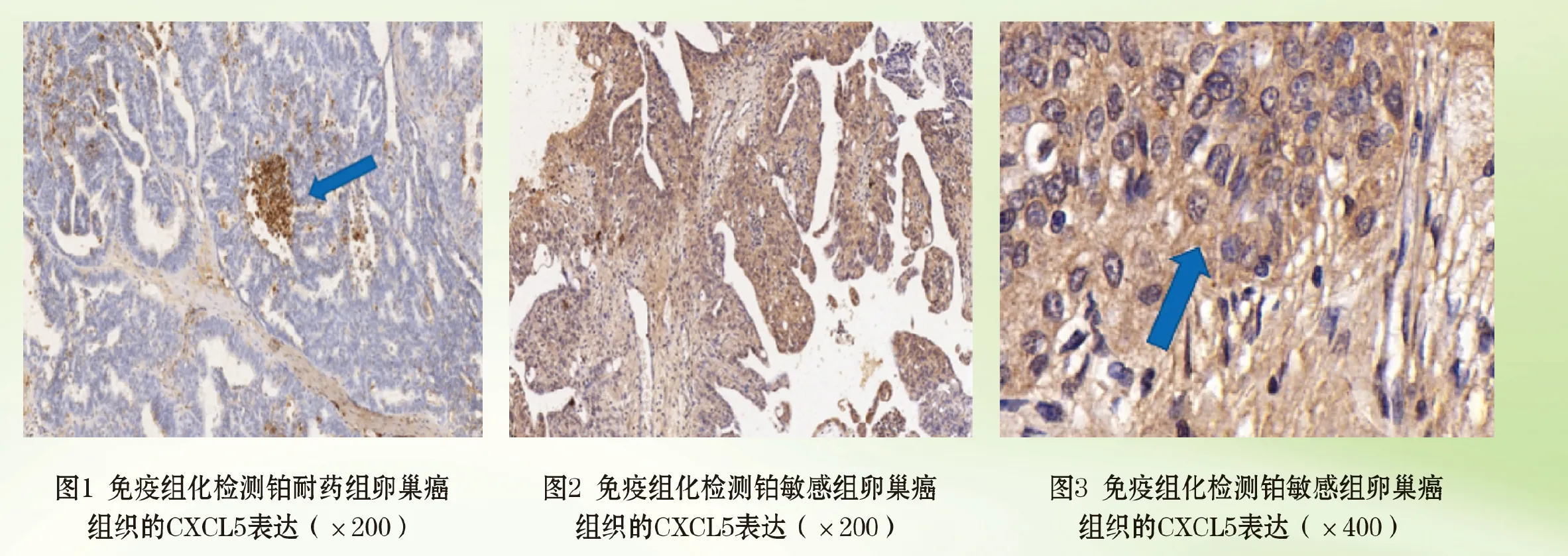
2.1 CXCL5在卵巢癌患者组织中的表达情况 免疫组织化学检测结果显示,CXCL5表达主要在卵巢癌上皮细胞的细胞质中。CXCL5在铂耐药卵巢癌细胞中弱表达或无表达,而在血管中高表达,染色为浅棕色;在铂敏感卵巢癌细胞中强表达,染色为深棕色或棕褐色,见图1至图3(封二)。
2.2 铂耐药组与铂敏感组患者卵巢癌组织中CXCL5表达水平比较 本实验采用阳性细胞的平均光密度(AOD)来表示2组患者卵巢癌组织中CXCL5的相对表达水平。CXCL5在铂耐药组卵巢癌组织中的表达水平明显低于铂敏感组卵巢癌,差异具有统计学意义(P<0.05),见表1。
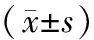
表1 铂耐药组与铂敏感组患者卵巢癌组织中CXCL5的表达比较
2.3 铂耐药组患者卵巢癌组织中CXCL5的表达与一般临床特征的关系 铂耐药组患者卵巢癌组织中CXCL5的表达在年龄、绝经状态、病灶大小间差异无统计学意义(P>0.05) ,而在是否接受新辅助化疗和总化疗次数(总化疗次6次与总化疗次数>6次)组间差异有统计学意义(P<0.05)。其中,CXCL5 蛋白在未接受新辅助化疗的铂耐药患者卵巢癌组织中的表达明显高于接受新辅助化疗的铂耐药患者(P<0.05),在总化疗次数为 6 次组铂耐药患者卵巢癌组织中的表达明显高于总化疗次数>6次组的铂耐药患者(P<0.05)。提示CXCL5在铂耐药上皮性卵巢癌患者组织中的表达与新辅助化疗和总化疗次数有关且呈负相关(P<0.05),而与年龄、绝经状态、病灶大小无相关性(P>0.05) ,见表2。
2.4 铂耐药组患者卵巢癌组织中CXCL5的表达与术前血清学指标的关系 铂耐药组患者卵巢癌组织中CXCL5的表达与血清中CA125的表达水平差异无统计学意义(P>0.05) ,而与HE4、NEUT、PLT的表达水平比较差异有统计学意义(P<0.05)。其中,CXCL5在HE4低水平组患者卵巢癌组织中的表达水平明显高于HE4高水平组患者(P<0.05),但在NEUT高水平组患者的表达水平明显高于NEUT低水平组患者(P<0.05),在PLT高水平组患者卵巢癌组织中的表达水平明显高于PLT低水平组患者(P<0.05)。提示CXCL5 在铂耐药上皮性卵巢癌患者组织中的表达与血清中HE4、NEUT、PLT的表达水平有关,且与HE4呈正相关(P<0.05),与 NEUT、PLT呈负相关(P<0.05),而与CA125无相关性(P>0.05),见表3。
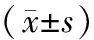
表2 铂耐药患者卵巢癌组织中CXCL5的表达与一般临床特征的相关性
表3 铂耐药组患者卵巢癌组织中CXCL5的表达与术前血清学指标的相关性
2.5 铂耐药组患者卵巢癌组织中CXCL5的表达与临床病理特征的关系 铂耐药组患者卵巢癌组织中CXCL5的表达与肿瘤单双侧、脉管阳性差异无统计学意义(P>0.05) ,而与FIGO分期、组织分化程度、腹水量比较差异有统计学意义(P<0.05)。其中,CXCL5在FIGO分期Ⅰ~Ⅱ期组的患者卵巢癌组织中的表达水平明显高于FIGO分期Ⅲ~Ⅳ期组的患者(P<0.05),在中-高分化组的患者卵巢癌组织中的表达水平明显高于低分化组的患者(P<0.05),在腹水量<500 mL组患者卵巢癌组织中的表达水平明显高于腹水量≥500 mL组的患者(P<0.05)。提示CXCL5在铂耐药上皮性卵巢癌患者组织中的表达与与FIGO分期、组织分化程度、腹水量有关(P<0.05),且与FIGO分期、腹水量呈负相关(P<0.05),组织学分化程度呈正相关(P<0.05),而与肿瘤单双侧、脉管阳性无相关性(P>0.05),见表4。
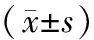
表4 铂耐药患者卵巢癌组织中CXCL5的表达与临床病理特征的相关性
3 讨论
卵巢癌仅占女性癌症的 3%,却是女性癌症死亡的第五大原因之一[10]。据报道,卵巢癌的发病率为12.5/10万妇女,发病率在过去20年里下降了不到1%,死亡率基本没有改变[10]。铂耐药是导致卵巢癌患者治疗失败甚至死亡的重要原因,即使患者治疗初期对铂类药物敏感,但是经过多次复发后,最终都会对铂类药物产生耐药性[11]。因此,探索新的治疗靶点从而克服铂类耐药是提高癌症治疗效果的迫切需要。
CXCL5是CXC趋化因子的家族成员,作为中性粒细胞强大的诱导剂和炎症介质,可介导血管增生,促进细胞迁移、吞噬、钙离子内流和呼吸爆发,在纤维化、细胞增殖及凋亡等活动中具有重要作用[12]。Zhao等人[13]证实,CXCL5可激活ERK/Elk-1/Snail通路和AKT/GSK3β/β-catenin/MMP7通路,进而通过CXCL5/CXCR2轴诱导癌细胞发生上皮-间充质转化,增强了结直肠癌细胞的迁移和侵袭能力。目前有关CXCL5在卵巢癌中作用的研究较少,本研究证实在上皮性卵巢癌患者组织中低水平的CXCL5提示卵巢癌患者有产生铂耐药的可能。
人附睾蛋白4(HE4)是近年来发现的一种新的生物标志物,在检测上皮性卵巢癌方面具有更高的敏感性和特异性,并且在疾病早期发展过程中比 CA125更早升高[14]。Lee等人[15]进行体外研究发现,HE4 能够激活ERK和AKT途径诱导癌细胞产生化疗耐药,并且这与患者更差的预后相关。本研究结果显示,CXCL5在铂耐药卵巢癌患者组织中的表达水平与患者术前血清HE4水平有明显相关性,且两者呈负相关关系,这与既往研究基本一致。
中性粒细胞从脉管系统向肿瘤微环境的迁移主要由CXC趋化因子(如CXCL5)介导,CXCL5从血管系统向组织招募并激活中性粒细胞,进而杀死微生物和/或启动组织修复重塑[16]。据报道,CXCL5的高水平与肿瘤内中性粒细胞浸润显著相关[17]。本研究中,CXCL5在铂耐药卵巢癌患者组织中的表达水平与患者NEUT水平有明显相关性,且两者呈正相关关系,这与以往的研究结果相符。
对于新辅助化疗可否导致上皮性卵巢癌铂耐药这一问题尚有争议。Rauh Hain[18]等人研究发现,新辅助化疗导致患者术后发生铂耐药的机率增高。有学者在影响铂耐药相关因素的研究中发现,患者的化疗次数越多其发生铂耐药的风险越高[19]。这与本研究结果基本一致。有研究发现[20],卵巢癌术后发生铂耐药复发与临床分期晚和组织分化程度的降低有关,其原因可能是随着组织分化程度的降低,癌细胞更容易发生上皮-间充质转化(EMT),肿瘤更容易发生转移;随着临床分期的推迟,肿瘤细胞生长脱落,造成腹盆腔种植转移。本研究结果表明,CXCL5在FIGO分期晚、组织学分化低的铂耐药卵巢癌患者组织中的表达水平较低,这与既往研究结果相似。本实验研究发现,CXCL5在≥500ml腹水量的铂耐药卵巢癌患者组织中的表达明显低于<500 mL腹水量的患者。有大量证据表明,至少三分之一的卵巢癌症患者腹腔积聚的恶性腹水有助于肿瘤细胞增殖、进展、化疗抵抗和免疫逃避,促进疾病在腹部的转移,这往往提示着预后不良[21]。
综上所述,铂耐药上皮性卵巢癌患者组织中CXCL5的低表达与新辅助化疗、总化疗次数、HE4、NEUT、PLT、FIGO分期、组织学分化程度、腹水量有关。提示CXCL5的低表达可能与上皮性卵巢癌铂耐药相关。近年来,CXCL5的预后价值仍然存在争议,到目前为止报道的大多数研究在离散的结果和样本量方面都是有限的。本研究是回顾性的单因素分析研究,缺少动物模型和细胞模型验证,会在一定程度上影响研究结果的准确性,后续需进一步扩大样本量并拓展实验对研究成果进行验证。

