盐胁迫下不同形态硒对王族海棠硒累积、离子稳态及生理生化的影响
杨艳 田治国

摘要: 设置150 mmol/L盐胁迫处理(SS)及盐胁迫下施用纳米硒(Se0)、亚硒酸钠(Se4+)、硒代半胱氨酸(Se2-)及复合处理(Se0+Se4+、Se0+Se2-、Se4++Se2-、Se0+Se4++Se2-),以无盐胁迫处理(CK)为对照,探索了不同形态硒对盐胁迫下王族海棠硒累积、离子稳态及相关生理生化的影响。结果表明,盐胁迫下王族海棠光合生理受到显著影响,氧化产物累积增加、离子稳态失衡。盐胁迫下不同形态硒及其组合处理均在一定程度上增加了光合色素(叶绿素a、叶绿素b、类胡萝卜素)含量、改善了光合特征参数(Pn、Ci、Tr、Gs),提高了抗氧化酶(SOD、CAT、POD)活性,降低了脂质过氧化物(LPO)、超氧阴离子自由基(O-2·)、过氧化氢(H2O2)含量,上调表达了相关盐调控基因( AOX、SOS1、NHX1 ), 整体而言以Se0+Se4+、Se0+Se4++Se2-处理 效果较佳。此外,盐胁迫下,Se0+Se4+、Se0+Se4++ Se2-处理的Se、K含量显著增加、Na含量显著降低,使得K含量/Na含量提高,均以Se0+Se4+优于Se0+Se4++Se2-处理。綜上,盐胁迫下不同形态硒及其组合处理可保护王族海棠光合色素降解和提高光合效率、激活抗氧化防御系统、诱导盐调控基因表达上调,并通过增加Se、K含量和降低Na吸收维持离子稳态从而缓解盐分胁迫,以纳米硒与亚硒酸钠组合处理(Se0+Se4+)效果最佳。
关键词: 硒;盐胁迫;氧化应激;光合特征;抗氧化酶系统;盐调控基因
中图分类号:S685.990.1 文献标志码:A
文章编号:1002-1302(2024)02-0136-08
植物在完成生长史的过程中皆处于不断变化的环境中,时刻变化的环境产生胁迫效应从而往往不利于植物的生长和发育[1]。一般而言,环境胁迫分为生物胁迫和非生物胁迫,其中盐胁迫是限制土壤健康、植物生长及其生产力的主要非生物威胁之一[2]。大量研究表明,盐胁迫对植物生长、养分吸收、激素代谢及核酸复制均具有显著负面影响[3-4];其通常伴随着渗透胁迫和离子稳态失衡,会导致活性氧(ROS)产生,ROS过量积累可对膜脂、蛋白质、核糖核酸和类囊体结构造成重大损伤[5]。此外,发育受限和盐胁迫与光合作用密切相关,研究表明高盐度会造成叶绿素降解、叶绿体超微结构损伤以及光合装置中的蛋白酶失活[6]。因此,盐胁迫下诱导抗氧化系统和维持光合性能对于植物的正常生长发育至关重要。近20年来,通过分子生物学选育耐盐植株取得了良好的应用效果,但由于环境差异及性状衰退等问题,使得品种收益稳定性欠佳。
硒(Se)是生物体所必需的多功能生物营养元素,同时也是谷胱甘肽过氧化物酶、硒蛋白质和一些挥发性硒化合物的核心枢纽物质[7],在抗氧化、抗肿瘤、增强免疫力等方面具有重要作用。自然系统中,硒同时以负Ⅱ价[Se(-Ⅱ)]、正Ⅳ价[Se(Ⅳ)]、正Ⅵ价[Se(Ⅵ)]和零价[Se(0)]无机、有机形态存在[8],Se在土壤中的存在形态与土壤的团粒结构、氧化还原电位、酸碱度、气候等因素密切相关,不同形态的硒其有效性亦存在较大差异[9]。最常见的无机硒化合物为亚硒酸钠(Na2SeO3)、硒酸钠(Na2SeO4)和硒化氢(H2Se),对生物体而言,有机硒毒性低且吸收效率高,无机硒具有一定的生理毒性,难以快速吸收,但其生物利用度往往较好[10]。目前外源硒已逐渐应用于农业生产中,并且在重金属修复、盐胁迫、干旱胁迫及提升作物品质中表现出优良的施用效果[11]。然而目前非生物胁迫下施用上述形态硒的效果及其组合应用效果尚不清楚。
王族海棠(Malus royalty)为蔷薇科苹果属(Malus)落叶乔木[12],其树姿优美,高贵典雅,且果实富含类黄酮、多酚及氨基酸等生物活性物质,是集观叶、观花及用果于一体的景观绿化经济树种[13]。王族海棠可植于道路、庭院、草地、林缘及建筑物旁,是目前我国绿化常用的园艺植物之一。然而,包括王族海棠在内的大多数海棠品种虽耐旱、耐寒、耐瘠薄,但对土壤中盐胁迫耐受性较低、敏感性强[14]。目前,一些栽培措施已应用于降低海棠种植土壤的盐分含量,包括使用生物炭、土壤改良剂、生物有机肥、喷施拮抗元素及植物激素等,其中外源施入有益元素是最具成本效益的优选措施之一[11]。此外,目前关于Se对植物环境胁迫的研究主要集中于重金属胁迫,关于盐胁迫的研究较少,其应用效果尚不清楚。本研究基于盆栽试验探索了盐胁迫下3种不同形态硒单施及组合施用对海棠缓解效应及相关耐受机制的影响。研究结果可为硒合理应用于园林植物栽培提供理论依据。
1 材料与方法
1.1 试验材料
试验于2022年4—6月在常州大学园艺试验棚中进行。王族海棠(Malus royalty)购自江苏长景园林有限公司,为1年龄嫁接苗。供试培养基质为海棠专用园艺土与蛭石的混合基质(体积比为2 ∶ 1)。
供试硒分别为亚硒酸钠(Na2SeO3)、硒代半胱氨酸(C3H7NO2Se),硒分别为正四价、负二价,二者均购自默克化学试剂。纳米硒(SeNPs)为零价态,采用聚乙烯吡咯烷酮与壳聚糖作为稳定剂高压制成,其粒径为18 nm,购自北京奥佳精密研究中心。氯化钠(NaCl)为分析纯,购自默克化学试剂。
1.2 试验设计
试验采用完全随机区组设计,共设置9个处理。CK:原土培养;SS:原基质中加入150 mmol/L的氯化钠;接着基于SS处理施入不同形态硒处理:零价纳米硒(Se0)、四价亚硒酸钠(Se4+)、负二价硒代半胱氨酸(Se2-),相应的二元处理为:Se0+Se4+、Se0+Se2-、Se4++Se2-,三元处理为Se0+Se4++Se2-。每个处理重复3次。上述硒处理皆溶于蒸馏水再超声(35 kHz)处理15 min制备为相应硒溶液,各处理总硒浓度皆为33 mmol/L。
盆栽装置为圆柱形塑料桶,每盆装土10 kg,单桶单株移栽。为保证土壤养分均衡及海棠幼苗正常生长,连续4周每周往桶中加入园林植物培养液100 mL。移栽30 d,海棠苗正常生根后进行相应盐胁迫处理,盐胁迫施入NaCl溶液400 mL,非盐胁迫处理施入蒸馏水。硒处理皆采用外源喷施施入,每次喷施5 mL,1周2次,连续3周,总量30 mL;非硒处理以去离子水替代。其他管理措施同王族海棠植物的常规培育方法,盆栽培育周期为50 d。
1.3 测定分析
1.3.1 植株元素含量测定
培养50 d后,将培养器具剖开以获取完整植株,将海棠地上部、根系分开105 ℃杀青30 min,70 ℃烘干至恒质量。将烘干的植株进行粉碎处理,过0.25 mm网筛封装待测,称取500 mg样品采用HNO3-HCl进行酸解萃取,采用电感耦合等离子体光谱仪(ICP-MS,ICAPQc,Thermo Fisher Scientific)采用ICP-MS法测定样品中的Se、K、Na浓度。
1.3.2 光合色素及光合特征测定
培养50 d后,称取约500 mg鲜样采用液氮研磨、丙酮-乙醇(体积比为2 ∶ 1)浸提,之后基于UV-2450型紫外分光光度计(Pharma Spec,Shimadzu,Japan)采用紫外分光光度法测定叶绿素a、叶绿素b及类胡萝卜素含量,具体步骤参照李合生的方法[15]。
培养第49天,晴天10:30使用便携式光合作用测量系统(TARGAS-1,PPSystems,Nebraska,USA)测定叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)等指标,相关参数设置及操作参照高战武等的方法[16]。
1.3.3 抗氧化酶活性及氧化产物含量的测定
培养50 d后,植株收获时王族海棠叶片的脂质过氧化物(LPO)含量、过氧化氢(H2O2)含量及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性及超氧阴离子自由基(O-2·)含量均采用上海酶联生物科技有限公司生产的ELISA检测试剂盒测定,试剂盒型号分别为 ml092625、ml076322、 ml503401、ml022785、ml095259、ml094977。
1.3.4 盐调控基因及硒转运基因表达分析
培养第50天,基于Plant Genomic DNA Kit试剂盒采用十六烷基三甲基溴化铵(CTAB)法对王族海棠叶片基因组RNA进行快速抽提,用Nanodrop 2000分光光度计(Thermo Scientific,Wilmington,DE) 检测其品质,采用Roche试剂盒将RNA反转录合成cDNA。实时 聚合酶链反应(PCR)通过PCR仪(CFX96Touch BIO-RAD1, ABI,USA)进行。以海棠 EF-1α 为对照基因,试验所用基因的引物序列见表1。具体反应体系、反应程序步骤参照Peng等的方法[17],采用2-ΔΔCT断层扫描法计算 AOX、SOS1、NHX1及Seltr1 基因的相对转录丰度。
1.4 数据处理与统计分析
借助Microsoft Excel 2010對相关试验数据进行初步整理,用DPS v14.0软件进行方差分析与显著性检验,采用Origin 2020软件完成图形绘制。
2 结果与分析
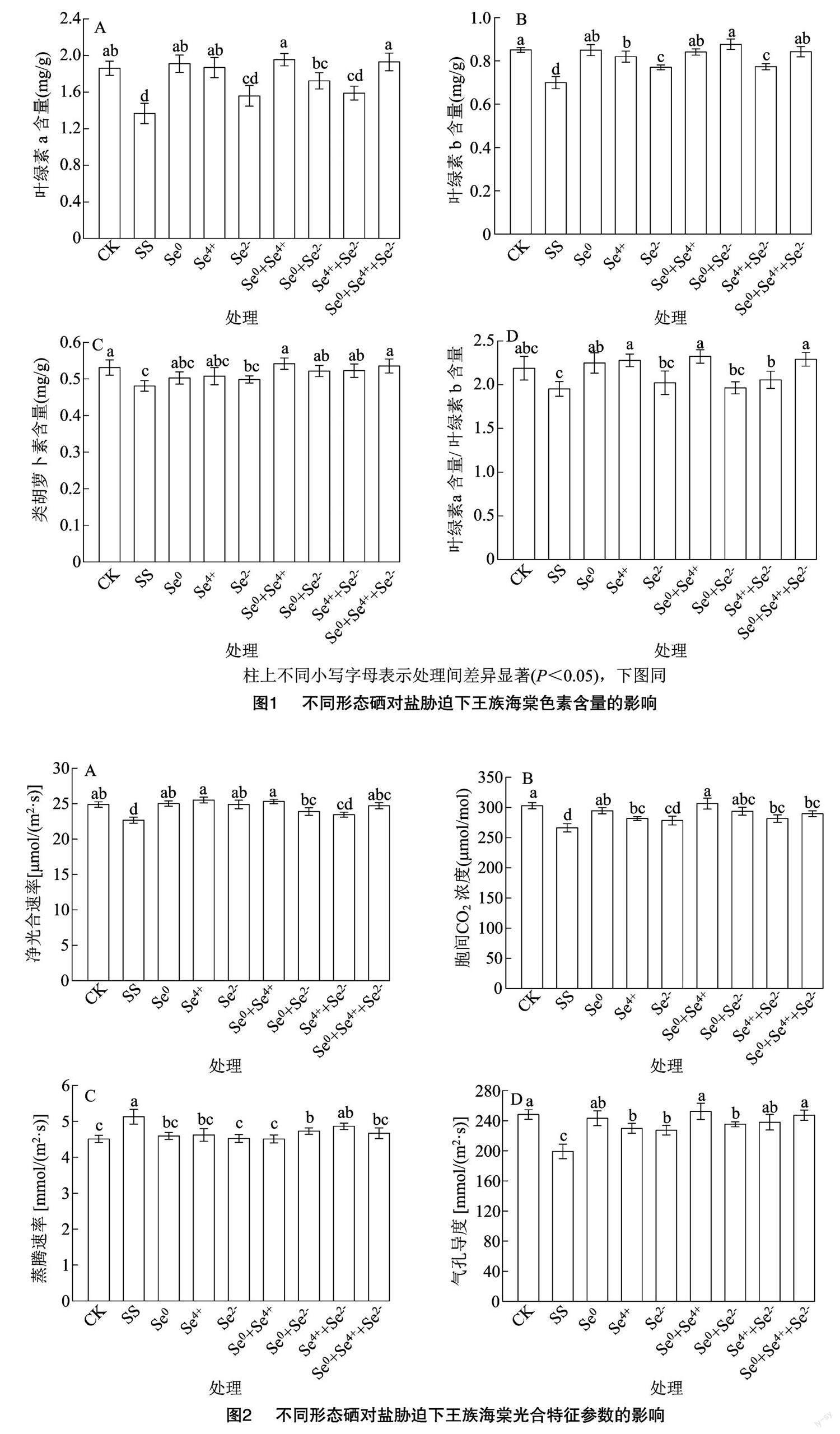
2.1 不同形态硒对盐胁迫下王族海棠光合色素含量的影响
由图1-A可知,与CK处理相比,盐胁迫处理(SS)叶绿素a含量显著降低26.61%;与SS处理相比,盐胁迫下相关硒处理(Se0、Se4+、Se2-、Se0+Se4+、Se0+Se2-、Se4++Se2-、Se0+Se4++Se2-)增加14.10%~43.07%,其中Se2-、Se4++Se2-与SS处理无显著差异,其他硒处理均显著大于SS处理。由图1-B可知,各处理叶绿素b含量表现为SS< Se2-<Se4++Se2-<Se4+<Se0+Se4+<Se0+Se4++ Se2-<Se0<CK<Se0+Se2-,与SS处理相比,其他处理显著提高10.49%~25.31%;与CK处理相比,Se4+、Se2-、Se4++Se2-处理分别显著降低3.62%、9.39%、9.10%,余下硒处理与CK均无显著差异。由图1-C可知,各处理类胡萝卜素含量差异整体较小,以SS处理最低,其显著小于CK、Se0+Se4+、Se4++Se2-、Se0+Se2-、Se0+Se4++Se2-处理;与CK相比,相关硒处理变幅为-2.00%~6.12%,其中与Se2-处理差异显著。而在叶绿素 a含量/叶绿素b含量中,仍以SS处理最低,其与CK、Se2-、Se0+Se2-无显著差异,其他处理较其显著增加5.29%~19.00%。
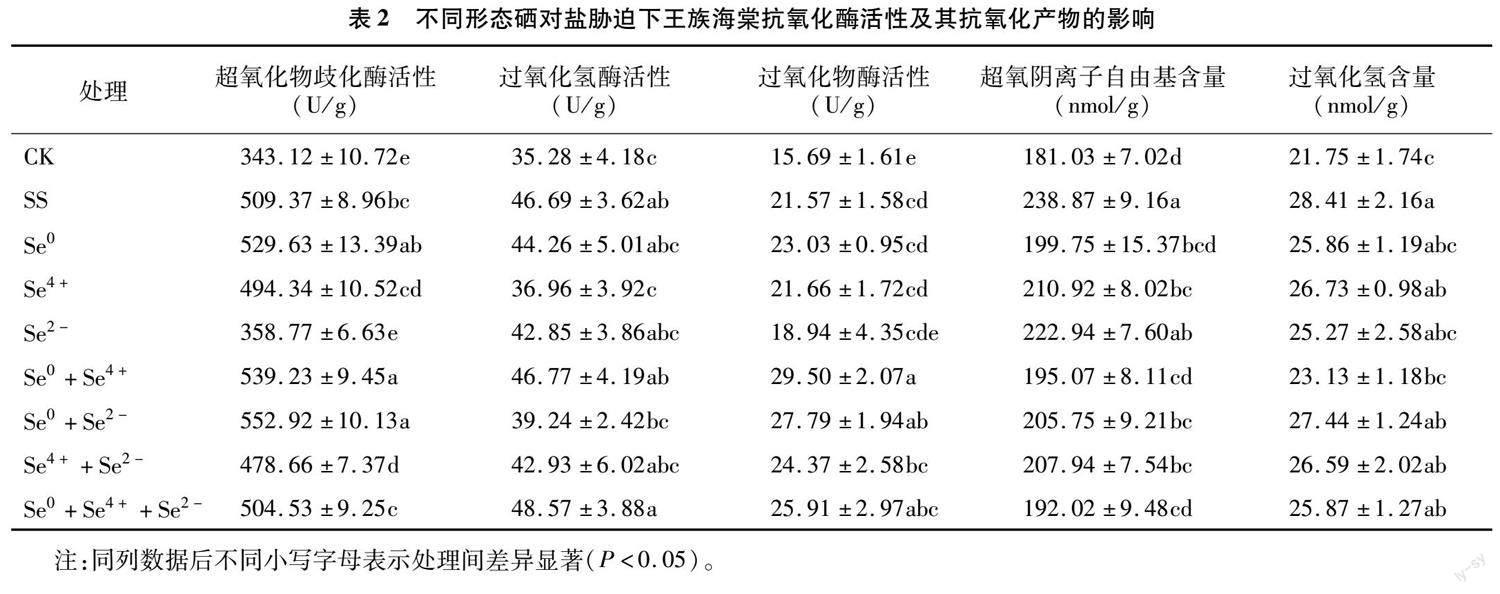
2.2 不同形态硒对盐胁迫下王族海棠光合特征参数的影响
由图2-A可知,王族海棠叶片的净光合速率(Pn)中,以单盐胁迫处理(SS)最低,CK处理较其显著提高9.78%;硒处理较SS处理增加3.43%~12.59%,但SS处理与Se4++Se2-处理无显著差异。由图2-B可知,胞间CO2浓度(Ci)中,以Se0+Se4+处理最高,CK处理其次,二者与Se0、Se0+Se2-处理无显著差异,均显著大于余下处理。由图2-C可知,王族海棠叶片的蒸腾速率(Tr)中,以SS处理最高,其他处理较其降低5.20%~12.06%,其中 Se4++Se2-与SS处理无显著差异。 由图2-D可以知,气孔导度(Gs)中,仍以单盐胁迫处理最低,CK及其他施硒处理较其显著提高14.15%~26.73%;就相关硒处理而言,以Se0+Se4+、Se0+Se4++Se2-处理较高,显著大于Se4+、Se2-、Se0+Se2-处理。
2.3 不同形态硒对盐胁迫下王族海棠叶片抗氧化系统的影响
由表2可知,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性均整体表现为CK处理显著小于SS及相应硒处理(Se0、Se4+、 Se2-、Se0+Se4+、Se0+Se2-、Se4++Se2-、Se0+Se4++ Se2-),与SS处理相比,硒处理下的SOD、CAT、POD活性变幅分别为-29.57%~8.55%、-20.84%~4.03%、-12.19%~36.76%,且酶活性较大值主要集中出现在Se0+Se4+、Se0+Se4++Se2-处理。在超氧阴离子自由基(O-2·)和过氧化氢(H2O2)含量中,均以SS处理显著大于CK处理;就O-2·含量而言,与SS处理相比,硒处理下降6.67%~16.91%,其中除Se2-与CK处理无显著差异外,其他硒处理均显著降低;就H2O2含量而言,与SS处理相比,硒处理下降3.41%~18.59%,其中Se0+Se4+显著降低。
2.4 不同形态硒对盐胁迫下王族海棠叶片脂氧过氧化水平及盐调控基因表达的影响
由图3-A可知,在脂质过氧化物(LPO)含量中,以SS处理最高,CK、Se0、Se4+、Se0+Se4+、Se0+Se4++Se2-较其分别显著降低51.06%、42.74%、44.18%、35.93%,余下处理与SS处理无显著差异。由图3-B可知,AOX的相对表达量中, 各处理表现为SS<Se2-<Se4++Se2-<Se4+<Se0<Se0+Se4++ Se2-<Se0+Se2-<CK<Se0+Se4+,其中与SS处理相比,其他处理提高1.88%~49.18%。由图3-C可知, SOS1 相对表达量中,以CK处理表达水平最高,相关盐胁迫处理较其降低6.66%~48.43%,但Se0+Se4+、Se0+Se2-与CK处理均无显著差异;就盐胁迫相关处理而言,与SS处理相比,一元处理(Se0、Se4+、Se2-)略有增加但两两处理间均无显著差异,而多元处理(Se0+Se4+、Se0+Se2-、Se4++Se2-、Se0+Se4++Se2-)均显著大于SS处理。由图3-D可知, NHX1 相对表达水平以SS处理最低,其他处理较其显著提高117.44%~212.21%;就相关盐胁迫处理而言,以Se0+Se4+处理最高,其显著大于CK、SS、Se2-、Se4++Se2-处理。
2.5 不同形态硒对盐胁迫下王族海棠Se及K、Na含量的影响
由图4-A可知,在王族海棠植株Se含量中,未施硒处理(CK、SS)Se含量均较低,二者无显著差异且均显著低于相关施硒处理。就施硒处理而言,各处理Se含量表现为Se4+<Se0<Se2-<Se4++Se2-<Se0+Se2-<Se0+Se4+<Se0+Se4++Se2-,其中Se0+Se4++Se2-处理较其他硒处理显著提高6.44%~55.84%。各处理的硒转运蛋白调控基因( Seltr1 )与植株Se含量变化趋势存在一定相似性,但Se0处理下 Seltr1 表达水平与CK、SS处理无显著差异(图4-B)。由图4-C可知,在王族海棠植株K含量中,与CK处理相比,SS处理显著降低27.50%,相关硒处理显著提升19.79%~30.30%,其中以Se0+Se4+處理涨幅最大。各处理海棠植株中Na含量与K含量大体呈相反趋势,即SS处理下Na含量最高, 较CK处理显著提高769.13%, 较硒处理显著提高60.04%~172.38%(图4-D)。而在K含量/Na含量中,相比于CK处理,施硒处理显著降低59.16%~76.90%;相对于SS处理,盐胁迫下施硒处理显著提高176.94%~389.56%(图4-E)。在植株养分含量的线性相关分析中,Se含量与Na含量的线性模型为y=-0.273 4x+85.718 0(r2=0.926 7,P=0.022 8)(图4-F)。
3 讨论与结论
盐分胁迫是影响土壤可持续化及植物发育代谢的典型非生物威胁之一,光合作用是受盐胁迫影响的主要生理过程[2,5,18]。本研究中,与无盐胁迫处理(CK)相比,外源施用150 mmol/L NaCl处理(SS)下王族海棠叶片光合色素(叶绿素a、叶绿素b、类胡萝卜素)、净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)均显著降低,蒸腾速率(Tr)显著提高,这意味着盐胁迫严重抑制了王族海棠叶片的光合进程。前人研究表明,硒可以通过促进呼吸链中的呼吸与电子传递以加速叶绿素的生物合成;因此,盐胁迫下施硒维持植物的光合能力可能与抑制光合色素降解和保护叶绿体超微结构有关[19]。此外,进一步研究结果显示,各光合生理指标极值整体出现在Se0+Se4+、Se0+Se4++Se2-处理,初步表明盐胁迫下纳米硒与亚硒酸钠组合施用可有效 抑制光合色 素的分解及维持光合作用进程。
盐胁迫会诱导活性氧(ROS)过量累积,使得超氧阴离子自由基(O-2·)、过氧化氢(H2O2)等氧化产物累积,最终引起膜脂过氧化[5-6,20-21]。超氧化物歧化酶(SOD)是消除ROS的首道抗氧化酶,其可催化O-2·歧化为H2O2,随后H2O2被过氧化氢酶(CAT)催化为H2O2和O2,过氧化物酶(POD)则负责清除多余的ROS[18,22],上述抗氧化酶分工合作,在保护细胞免受氧化应激损害过程中扮演着重要角色。本研究中,与CK相比,SS处理下SOD、CAT、POD活性及O-2·、H2O2含量显著提高。抗氧化酶活性增加有利于清除ROS,这意味着盐胁迫激活了抗氧化系统,然而O-2·、H2O2过量累积不利于细胞的生理代谢,脂质过氧化物(LPO)含量显著提高再次从侧面反映了细胞处于损伤状态[8,23]。与SS处理相比,相关硒处理的SOD、CAT、POD活性更高,O-2·、H2O2、LPO含量相对降低,其中极值整体出现在Se0+Se4+处理,且其O-2·、H2O2、 LPO含量与CK处理均无显著差异。
耐盐交替氧化酶基因(AOX)、盐超敏基因( SOS1 )以及Na+/H+逆向转运蛋白基因( NHX1 )参与调控抗氧化系统和ROS稳态[20,24]。AOX在ROS代谢中发挥作用,其与LPO含量密切相关,随着AOX表达下调,LPO则过量积累,从而加剧氧化应激带来的影响[2,25]。 SOS1 在催化Na+/H+交换过程中发挥着枢纽作用[26]。 NHX1 有助于将Na+通过外质体途径转运至液泡实现区室化,其转录水平深刻影响着植物的耐盐性[8]。本研究中,外源施用 150 mmol/L NaCl处理下 AOX、SOS1以及NHX1 均发生下调表达,表明Na+积累于胞质溶胶中,且外质体途径受限。而外源硒处理下,K含量升高、Na含量降低以及K含量/Na含量升高;此外,施硒显著提高了王族海棠植株的Se含量,相关性分析结果显示Se含量与Na含量呈显著负相关(r2=0.926 7,P<0.05),表明硒可以通过介导盐调控基因的表达、硒吸收及调节离子平衡以缓解盐分胁迫。此外,硒代半胱氨酸相关处理的Se含量较高,这与前人的研究结论一致,即有机硒是最容易被植物根系吸收累积的主要硒形态[10,27]。
本研究结果表明,纳米硒处理下王族海棠植株Se含量较高,但纳米硒处理的硒转运基因( Seltr1 ) 表达水平与未施用硒处理(CK、SS)无明显差异。Li等的研究表明, 由于纳米材料直径 微小能随着其他物质吸收进入甜椒体内,且其更容易被细胞吸收利用[28], 因此纳米硒可能随着水分、养分进入王族海棠体内而不经过硒转运蛋白介导。综上,盐胁迫下施用不同形态硒及其组合可抑制光合色素降解和提高光合效率、激活抗氧化防御系统、调控盐调控基因的表达使Na2+区室化,并通过增加Se、K吸收和降低Na累积维持离子稳态从而缓解盐分胁迫。且整体来看以纳米硒与亚硒酸钠组合施用(Se0+Se4+)效果最佳。
参考文献:
[1] Zhang H M,Zhu J H,Gong Z Z,et al. Abiotic stress responses in plants[J]. Nature Reviews Genetics,2022,23(2):104-119.
[2]Fang S M,Hou X,Liang X L. Response mechanisms of plants under saline-alkali stress[J]. Frontiers in Plant Science,2021,12:667458.
[3]張 琦,张文静,袁宪凯,等. 褪黑素对盐胁迫下普通菜豆芽期核酸修复的调控机制[J]. 植物学报,2023,58(1):108-121.
[4]刘云芬,彭 华,王薇薇,等. 植物耐盐性生理与分子机制研究进展[J]. 江苏农业科学,2019,47(12):30-36.
[5]黎远东,江海霞,谢丽琼. 植物盐胁迫适应性机制研究进展[J]. 植物遗传资源学报,2022,23(6):1585-1593.
[6]Hussain S,Hussain S,Ali B,et al. Recent progress in understanding salinity tolerance in plants:story of Na+/K+ balance and beyond[J]. Plant Physiology and Biochemistry,2021,160:239-256.
[7]Chao W,Rao S,Chen Q W,et al. Advances in research on the involvement of selenium in regulating plant ecosystems[J]. Plants,2022,11(20):2712.
[8]司振兴,梁郅哲,钱建财,等. 植物对硒的吸收、转运及代谢机制研究进展[J]. 作物杂志,2023(2):1-9.
[9]孙协平,张 鑫,罗友进,等. 四种价态硒对“青脆”李幼苗根系部分生理特性的影响[J]. 北方园艺,2021(3):41-46.
[10] Xu H Z,Yan J P,Qin Y,et al. Effect of different forms of selenium on the physiological response and the cadmium uptake by rice under cadmium stress[J]. International Journal of Environmental Research and Public Health,2020,17(19):6991.
[11]Liu H D,Xiao C M,Qiu T C,et al. Selenium regulates antioxidant,photosynthesis,and cell permeability in plants under various abiotic stresses:a review[J]. Plants,2022,12(1):44.
[12]孙晓刚,年 昊,殷佳慧,等. 丛枝菌根真菌对铅胁迫下王族海棠生长和光合特性的影响[J]. 山东农业科学,2022,54(8):79-86.
[13]鲍梦圆,王海歌,徐心雨,等. 海棠生物活性物质及健康功能研究进展[J]. 中国食品工业,2023(3):92-94,97.
[14]胡爱双,张小栋,王文成,等. 盐胁迫对不同耐盐性八棱海棠株系生理特性的影响[J]. 果树学报,2021,38(3):335-343.
[15]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[16]高战武,范春燕,鄢上钦,等. 盐碱胁迫下外源油菜素内酯与AM真菌对羊草光合特性及抗氧化酶系统的影响[J]. 山东农业科学,2022,54(5):44-52.
[17]Peng Z,Tian J,Luo R L,et al. MiR399d and epigenetic modification comodulate anthocyanin accumulation in Malus leaves suffering from phosphorus deficiency[J]. Plant,Cell & Environment,2020,43(5):1148-1159.
[18]白凤麟,樊雨荷,李 琳. 硒、硅对盐胁迫下小麦光合生理及养分累积的影响[J]. 江苏农业科学,2023,51(3):68-75.
[19]章建红,沈登锋,洪春桃,等. 盐胁迫对薄壳山核桃幼苗光合作用及叶绿体超微结构的影响[J]. 浙江农业科学,2022,63(11):2569-2574.
[20]刘佳欣,张会龙,邹荣松,等. 不同类型盐生植物适应盐胁迫的生理生长机制及Na+逆向转运研究进展[J]. 生物技术通报,2023,39(1):59-71.
[21]柯勇超,刘 昱,赵燕春. 园林植物盐胁迫生理和分子机制研究进展[J/OL]. 分子植物育种:1-10. (2022-01-06)[2023-04-23]. http://kns.cnki.net/kcms/detail/46.1068.S.20220106.1038.002.html.
[22]Tavanti T R,de Melo A A R,Moreira L D K,et al. Micronutrient fertilization enhances ROS scavenging system for alleviation of abiotic stresses in plants[J]. Plant Physiology and Biochemistry,2021,160:386-396.
[23]Jiang C Q,Zu C L,Lu D J,et al. Effect of exogenous selenium supply on photosynthesis,Na+ accumulation and antioxidative capacity of maize (Zea mays L.) under salinity stress[J]. Scientific Reports,2017,7:42039.
[24]Nemat A A M M,Abogadallah G M,Hassan N M. Role of CaCl2 in osmoregulation and up-regulation of the salt stress related genes NHX1 and SOS1 in wheat during NaCl stress[J]. Agrochimica,2016,60(1):29-42.
[25]Joshi S,Nath J,Singh A K,et al. Ion transporters and their regulatory signal transduction mechanisms for salinity tolerance in plants[J]. Physiologia Plantarum,2022,174(3):e13702.
[26]康紅霞,伍国强,魏 明,等. Na+/H+逆向转运蛋白在植物应答非生物逆境胁迫中的作用[J]. 植物生理学报,2022,58(3):511-523.
[27]Yin H Q,Qi Z Y,Li M Q,et al. Selenium forms and methods of application differentially modulate plant growth,photosynthesis,stress tolerance,selenium content and speciation in Oryza sativa L.[J]. Ecotoxicology and Environmental Safety,2019,169:911-917.
[28]Li Y X,Zhu N L,Liang X J,et al. A comparative study on the accumulation,translocation and transformation of selenite,selenate,and SeNPs in a hydroponic-plant system[J]. Ecotoxicology and Environmental Safety,2020,189:109955.
收 稿日期:2023-06-19
基金项目:国家自然科学基金(编号:31700612);江苏省高校科学研究项目(编号:2019SJA1090)。
作者简介:杨 艳(1979—),女,江苏徐州人,硕士,讲师,主要从事园林植物与观赏园艺研究。E-mail:yangyantnh@cczu.edu.cn。
通信作者:田治国,博士,副教授,主要从事园林植物生理生态研究。E-mail:Tiangz@163.com。

