天香百合、药百合黄酮醇合成酶FLS基因克隆和表达分析
刘筱琳,孙婷婷,杨 捷,何恒斌
(北京林业大学 园林学院,花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,城乡生态环境北京实验室,北京 100083)
百合(Liliumspp.)是百合科百合属多年生球根植物,是全球最具经济价值和广泛栽培的花卉作物之一[1]。中国作为一个花卉种质资源大国,其原产百合属植物有55种,占据全球百合属百分之五十左右[2],目前在中国种植较多的有亚洲百合杂种、麝香百合杂种及东方百合杂种等,其中东方百合以其花大艳丽、气味芳香等特点被人们青睐,并成为国际花卉市场的主流产品。在鲜切花市场内,索邦、西伯利亚等杂交品种较为常见[3]。观赏植物最重要品质性状之一是花色,直接影响植物的观赏价值和商业价值,特别是随着人们生活水平的提升,对有着新奇花色植物的需求量逐年提高,所以百合的花色改良基因工程研究已刻不容缓[4]。在百合中花色主要的呈色物质是类黄酮和类胡萝卜素[5],类黄酮是花朵呈色的重要色素之一,主要包括花青素苷、黄酮和黄酮醇3大类[6]。目前对百合花色相关的分子研究较少,有关研究主要包括对花青素苷的合成基因及相关调控基因的分离与功能验证方面[7-12]。作为类黄酮化合物代谢途径的两个分支,黄酮醇与花青素苷的生物合成共享着前期合成路径,底物二氢黄酮醇同时被黄酮醇合成途径上的黄酮醇合成酶(FLS)与花青素苷合成途径中的二氢黄酮醇4-还原酶(DFR)竞争[13-14]。另外,黄酮醇也是主要的辅色素之一,能够提高花青素苷的稳定性,影响花色形成[15]。因此,黄酮醇合成酶是类黄酮代谢途径中关键的节点酶之一[16]。
目前已从矮牵牛(Petuniaspp.)[17]、拟南芥(Arabidopsisthaliana)[18]、玉米(Zeamays)[19]、金花茶(Camellianitidissima)[20]、甜樱桃(PrunusaviumL.)[21]、葡萄风信子(Muscariarmeniacum)[22-24]、郁金香(Tulipafosteriana)[25]、玫瑰(Rosarugosa)[26]、红花檵木(Loropetalumchinensevar.rubrum)[27]等多种植物中克隆得到FLS基因。在龙胆(Gentianascabra)[28]、海棠(Maluscrabapple)[29]、拟南芥[30]、苹果(M.domestica)[31]、葡萄风信子[32]等植物中的功能分析表明FLS基因的过表达能够促进植物黄酮醇的积累,抑制花青素苷的合成;矮牵牛[17]和洋桔梗(Eustomagrandiflorum)[33]中FLS基因的表达受到抑制时,黄酮醇含量显著降低同时出现花青素积累,过表达DFR会导致FLS基因表达量降低和红色花的形成[34]。然而,百合中FLS基因的研究较少,其在花青素合成过程中作用机制尚不清楚。
由于百合在鲜切花市场上的重要性,国内外通过各种杂交选育,已经培育出多个优良的观赏百合品种。其中市面最常见的切花百合品种为东方百合中的索邦和西伯利亚,而东方百合是从天香百合(L.auratum)、鹿子百合(L.speciosum)、日本百合(L.japonicum)和湖北百合(L.henryi)的杂种中选育出来的,药百合(L.speciosumvar.gloriosoides)是鹿子百合的一个变种,主要分布在中国安徽、广西等区域。本研究以市场上常见的东方系百合主要亲本中的天香百合、药百合这两种野生百合为研究材料,克隆它们的FLS基因并进行序列特征分析比对,对其氨基酸序列进行同源性比对与进化分析,运用实时定量PCR技术分析其FLS基因的表达模式,为进一步探讨百合中FLS基因对花色形成的影响奠定基础,并且为开展百合花色育种,选育更适宜中国审美的东方系百合提供理论依据。
1 材料与方法
1.1 材料
天香百合和药百合均种植于北京林业大学温室。根据开花不同阶段花被片着色,将花发育过程分为4个取材阶段:时期1,完全未着色的花蕾;时期2,花被片上斑点开始出现;时期3,花被片完全着色但并未开放的花蕾;时期4,完全开放盛开阶段的花。天香百合4阶段命名为S1、S2、S3、S4,药百合取材4个阶段命名为T1、T2、T3、T4。分别采集植株4个发育阶段的花被片和完全盛开阶段的有色部分(S4C、T4C)和无色部分(S4W、T4W)为实验材料(图1)。所有材料均设置3个重复,取材后立即放入液氮速冻,-80 ℃保存备用。

A,天香百合;B,药百合;C,天香百合4个阶段取材;D,药百合4个阶段取材。A, L. auratum; B, L. speciosum var. gloriosoides; C, Four-stage materials of L. auratum; D, Four-stage materials of L. speciosum var. gloriosoides.
1.2 方法
1.2.1FLS基因的克隆
用EASY Spin Plus植物RNA快速提取试剂盒(艾德莱)提取两个品种各阶段花被片的RNA,并利用ReverTra Ace qPCR RT Master Mix(TOYOBO)合成cDNA第一链,放在-20 ℃贮存备用。
根据天香百合和药百合转录组数据中的黄酮醇合成酶基因的CDS区设计特异性克隆引物(表1),以天香百合和药百合第3阶段取材的cDNA第一链为模板,扩增FLS基因的CDS序列,克隆反应体系参照说明书,做50 μL的体系,其中KOD-Plus-Neo高保真酶25 μL,引物F、引物R各1 μL,cDNA 1 μL,ddH2O 22 μL。94 ℃预变性2 min后进行扩增,扩增体系:94 ℃变性10 s,54 ℃退火45 s,72 ℃延伸1 min,40个循环后72 ℃延伸10 min。得到的PCR产物进行电泳检测,选择正确的目标条带用琼脂糖凝胶回收纯化试剂盒进行回收,连接到pTOPO-B载体(艾德莱)上、转化DH5α感受态后挑选阳性克隆菌斑,摇菌后送睿博兴科生物技术公司测序。

表1 引物序列表
1.2.2FLS基因生物信息学分析
利用ExPASy-Translate tool(http://web.expasy.org/translate)在线工具将测序获得的正确CDS序列翻译成氨基酸序列;在线网站NCBI-BLAST(https://blast.ncbi.nlm.nih.gov/)、The Sequence Manipulation Suite(http://www.bio-soft.net/sms/index.html)、Clustal Omega(https://www.ebi. ac.uk/Tools/msa/clustalo/)和DNAMAN软件进行FLS基因氨基酸的序列比对信息分析(表2);运用MEGA7软件将本研究获得的正确FLS基因编码氨基酸序列与已报道的部分植物FLS基因氨基酸进行序列比对并构建演化树(表3);用ExPASy (http://web.expasy.org/)在线网站中的ProtParam工具预测LaFLS和LsFLS氨基酸序列的理化性质;运用DTU Health Tech 在线技术分析网站(https://www.healthtech.dtu.dk/)中的SignalP 6.0工具预测LaFLS和LsFLS蛋白信号肽情况;用TMHMM 2.0研究LaFLS和LsFLS蛋白有无跨膜结构域;用Protscale工具(http://web.expasy.org/protscale/)对LaFLS和LsFLS的亲疏水性进行分析;用TargetP-2.0(http://www.cbs.dtu.dk/services/TargetP/)预测LaFLS和LsFLS 蛋白的亚细胞定位情况。

表2 序列比对基因信息
表3 系统进化树基因信息
1.2.3 烟草亚细胞定位GFP表达载体构建
根据克隆结果设计亚克隆引物FLS(sub-clone)F、FLS(sub-clone)R(表1),由于LaFLS和LsFLS克隆得到的CDS序列几乎相同,所以共用一套亚克隆引物。将比对出来的正确克隆菌液大摇后进行质粒提取,并以浓度合适的质粒为模板进行PCR扩增,扩增程序同1.2.1节。PCR产物用琼脂糖凝胶电泳检测后胶回收正确序列长度的条带,以胶回收产物为模板连接到pSuper1300-GFP表达载体后转化大肠埃希菌感受态细胞,37 ℃培养16 h后挑选圆润单菌落进行PCR检测,选条带正确的菌液送至生工生物工程(上海)股份有限公司测序,将序列拼接比对后的正确菌液进行大摇并提取质粒,将pSuper1300-FLS-GFP和空载(正对照)通过液氮转化法导入GV3101农杆菌(北京博迈德生物技术有限公司),28 ℃培养后选择圆润的单菌落重悬后侵染适龄的野生型本氏烟草(Nicotianabenthamiana)叶表皮细胞,暗培养24~48 h后用共聚焦显微镜(Nikon eclipse Ti)观测定位结果并拍照记录。
1.2.4FLS基因的时空表达分析
根据克隆获得的LaFLS和LsFLS基因序列设计半定量引物,运用Primer3 Input 0.4.0(https://bioinfo.ut.ee/primer3-0.4.0/)在线工具设计荧光定量引物(表1),以不同发育阶段花被片样品的cDNA为模板,从天香百合中筛选出EF基因,从药百合中筛选出TIP41基因,分别作为qRT-PCR的内参基因,并以天香百合和药百合各组织部位样品的cDNA为模板进行qRT-PCR分析,配置20 μL的反应体系,其中2×TaqPCR MasterMix 10 μL、引物F和引物R各1 μL、cDNA 0.5 μL、ddH2O 7.5 μL。qRT-PCR程序:94 ℃预变性5 min,扩增程序:94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,共35个循环,然后72 ℃延伸5 min。
在Bio-Rad CFX Connect Real-Time PCR System荧光定量PCR仪上分别检测两个品种的FLS基因的相对表达量。根据退火实验确定LaFLS和LsFLS的退火温度,将不同阶段花被片取材的cDNA稀释10倍作为模板,参照SYBR®Premix Ex Taq TM Ⅱ(TaKaRa)说明书,配置反应体系20 μL,其中TB Green酶10 μL、稀释10倍的引物F和引物R各4 μL、稀释10倍的cDNA 2 μL。LaFLS扩增程序:95 ℃变性30s,58.4 ℃退火30 s,72 ℃延伸30 s;LsFLS扩增程序:95 ℃变性5 s,59.4 ℃退火30 s,72 ℃延伸30 s。均进行40个循环,每个样品设置3个重复。
2 结果与分析
2.1 LaFLS和LsFLS基因的克隆
从天香百合和药百合中克隆获得的黄酮醇合成酶基因LaFLS和LsFLS编码区长度均为1 035 bp(图2),都含有完整的开放阅读框,且均编码344个氨基酸。
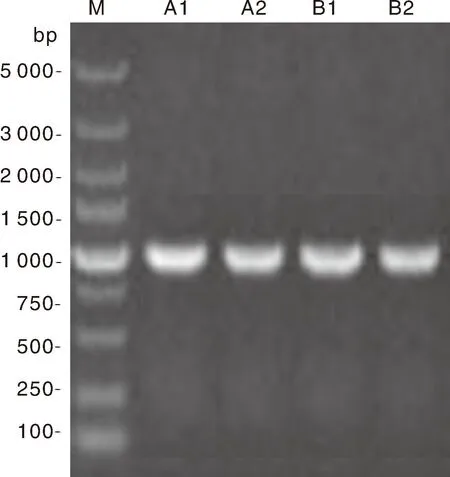
M,DNA Marker;A1、A2,LaFLS的扩增产物;B1、B2,LsFLS的扩增产物。M, DNA Marker; A1, A2, Product of the LaFLS amplification in cDNA; B1, B2, Product of the LsFLS amplification in cDNA.
利用在线工具Clustal Omega对分别来自天香百合和药百合的LaFLS和LsFLS进行序列比对发现有9个碱基差异,其中有4个碱基差异导致4个氨基酸差异,并且第89位变异的氨基酸位于保守的DIOX-N结构域中(图3),这些位于保守结构域的氨基酸差异可能导致FLS催化活性不同,从而影响类黄酮代谢支路间的竞争关系。

A,LaFLS核苷酸及编码氨基酸序列;B, LsFLS核苷酸及编码氨基酸序列。方框表示LaFLS 和LsFLS核苷酸及编码氨基酸序列中的差异。A, Nucleotide and amino acid sequences of LaFLS; B, Nucleotide and amino acid sequences of LsFLS. The frames show the differences between the nucleotide and amino acid sequences of LaFLS and LsFLS.
2.2 LaFLS和LsFLS基因的生物信息学分析
利用DNAMAN软件,将天香百合的LaFLS和药百合的LsFLS基因与NCBI公布的FLS氨基酸序列进行比对,发现LaFLS和LsFLS与其他植物的FLS氨基酸序列同源性高,说明FLS氨基酸序列在不同物种中是高度保守的。另外,利用NCBI Conserved Domain Search在线分析及序列比对显示,LaFLS和LsFLS序列中均含有1个保守的DIOX-N功能域(从43个氨基酸到151个氨基酸)和一段典型的2-酮戊二酸和铁(Ⅱ)依赖性加氧酶结构域(图4),与已报道的FLS基因一致。

下划线位置是DIOX-N结构域,红色方框表示2-酮戊二酸和铁(Ⅱ)依赖性双加氧酶结构域;DHQ底物特异结合位点、2-酮戊二酸和Fe2+位点分别用黑色三角、星号及箭头表示。The underlined position is the DIOX-N domain, and the red box represents the 2-ketoglutaric acid and iron (Ⅱ) dependent dioxygenase domain; DHQ substrate specific binding sites, 2-ketoglutaric acid and Fe2+ sites are indicated by black triangles, asterisks and arrows, respectively.
将克隆得到的LaFLS和LsFLS与东方百合白色花品种西伯利亚(Siberia)和粉色花品种索邦(Sorbonne),以及已报道的二十几个FLS氨基酸序列进行比对,结果显示,LaFLS和LsFLS与东方系百合西伯利亚和索邦的FLS基因相似度最高,并且天香百合、药百合与索邦FLS基因的亲缘关系较近,从进化树也可以看出这几种百合位于一个进化支(图5),反映出天香百合和药百合是东方百合品种的主要亲本,参与了这些品种的培育。其次LaFLS和LsFLS与岷江百合(L.regale)的FLS基因相似度比较高,与单子叶植物郁金香、毛油点草(Tricyrtisspp.)、多花水仙(Narcissustazetta)、洋葱(Alliumcepa)等亲缘关系较近,而与双子叶植物烟草(N.tabacum)、矮牵牛、龙胆、金鱼草(Antirrhinummajus)等亲缘关系较远。

图5 FLS基因系统进化树分析Fig.5 The phylogenetic tree analysis of FLS
SignalP 5.0在线预测结果显示,LaFLS和LsFLS蛋白均无信号肽序列(图6);TMHMM Server v.2.0工具分析 LaFLS和LsFLS蛋白跨膜结构域图像,结果表明,LaFLS和LsFLS蛋白均不存在跨膜结构域(图7)。由ProtScale在线工具预测结果可知,LaFLS和LsFLS氨基酸序列中亲水性最强的位点均是第150位的赖氨酸,分值为-3.078;第225位的苏氨酸为疏水性最强位点,分值为2.144。可以得出LaFLS和LsFLS蛋白的亲水区域均多于疏水区域,为亲水蛋白质(图8)。
图6 FLS蛋白的信号肽分析Fig.6 Analysis of FLS signal peptide
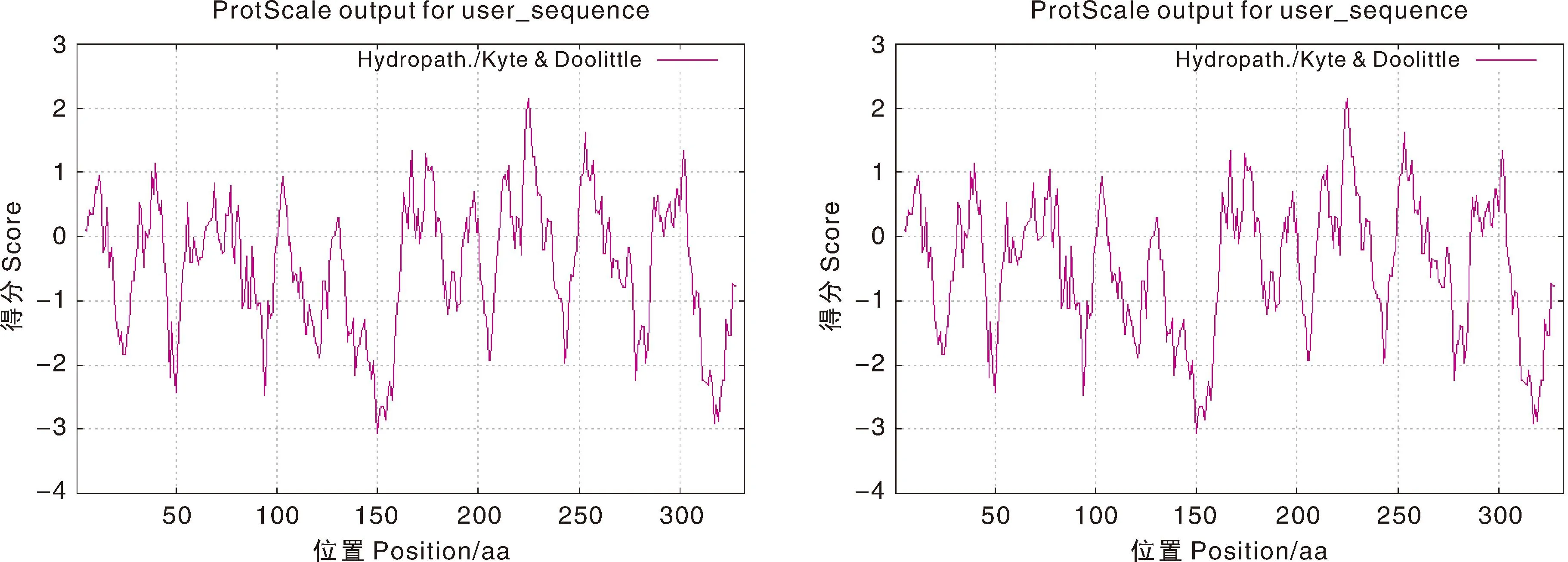
图8 FLS蛋白的亲疏水性分析Fig.8 Hydrophilic-hydrophobic analysis of FLS protein
2.3 LaFLS和LsFLS蛋白亚细胞定位分析
TargetP-2.0(http://www.cbs.dtu.dk/services/TargetP/)预测LaFLS和LsFLS的亚细胞定位情况,在线预测结果显示LaFLS和LsFLS蛋白定位于整个细胞内,在细胞质的可能性比较大,从预测结果推测LaFLS和LsFLS基因可能主要在细胞质中发挥功能。
瞬时表达结果显示(图9),空载质粒的荧光信号在细胞质和细胞核中均有表达,LaFLS-GFP融合蛋白和LsFLS-GFP融合蛋白几乎在整个细胞都有信号,但是主要定位在细胞质和细胞核中,与单子叶植物葡萄风信子MaFLS蛋白的亚细胞定位结果一致[17]。
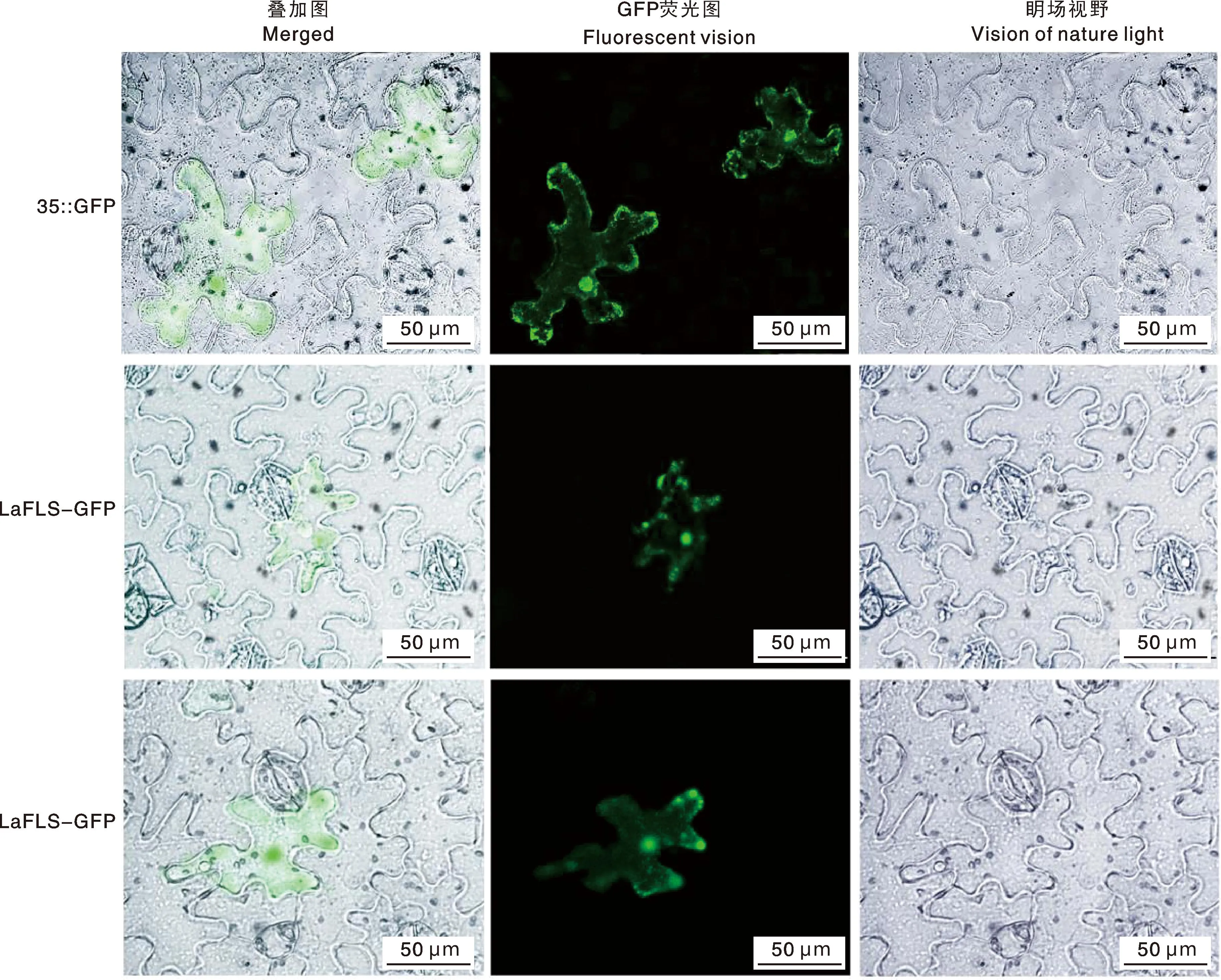
图9 LaFLS和LsFLS蛋白的亚细胞定位分析Fig.9 Subcellular localization analysis of LaFLS and LsFLS proteins
据亚细胞定位结果可以得出,LaFLS和LsFLS主要定位在烟草表皮细胞的细胞质和细胞核,与在线网站预测的结果几乎一致,由此推断LaFLS和LsFLS基因在细胞质和细胞核中都发挥作用。
2.4 LaFLS和LsrFLS基因时空表达模式分析
本研究分别选取天香百合和药百合的7个组织部位、花蕾4个发育时期的花被片,进行FLS基因的表达分析。半定量RT-PCR实验结果表明,LaFLS和LsFLS在两种百合的不同组织中具有相似的表达模式:LaFLS和LsFLS均在叶片、子房、花药中表达量较高,在花柱、花丝中表达量较低(图10),结果说明,LaFLS和LsFLS具有相似的组织特异性,反映了FLS的高度保守性。随着花蕾发育,LaFLS表达量为先增加后降低,在S3时达到最大值,随着花蕾开放表达量又下降,其花被片无色部分的表达量高于有色部分(图11-A);LsFLS在花蕾发育早期表达量上升,在T2阶段斑点出现颜色时减少到较低水平,之后逐渐增加,在T4阶段表达量达到最高,其盛开阶段花被片无色部分FLS的表达量高于其有色部位(图11-B),结果表明,黄酮醇合成酶在百合花被片不同区域的花青素和类黄酮的竞争性积累中发挥功能,从而形成不同花色性状。
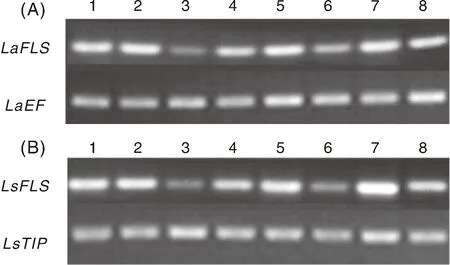
1,上部叶;2,下部叶;3,花柱;4,柱头;5,子房;6,花丝;7,花药;8,花被片;LaEF,天香百合内参基因;LsTIP,药百合内参基因。1, Upper leaf; 2, Lower leaf; 3, Style; 4, Stigma; 5, Ovary; 6, Perianth; 7, Anther; 8, Perianth; LaEF, Reference gene in L. auratum; LsTIP, Reference gene in L. speciosum var. gloriosoides.
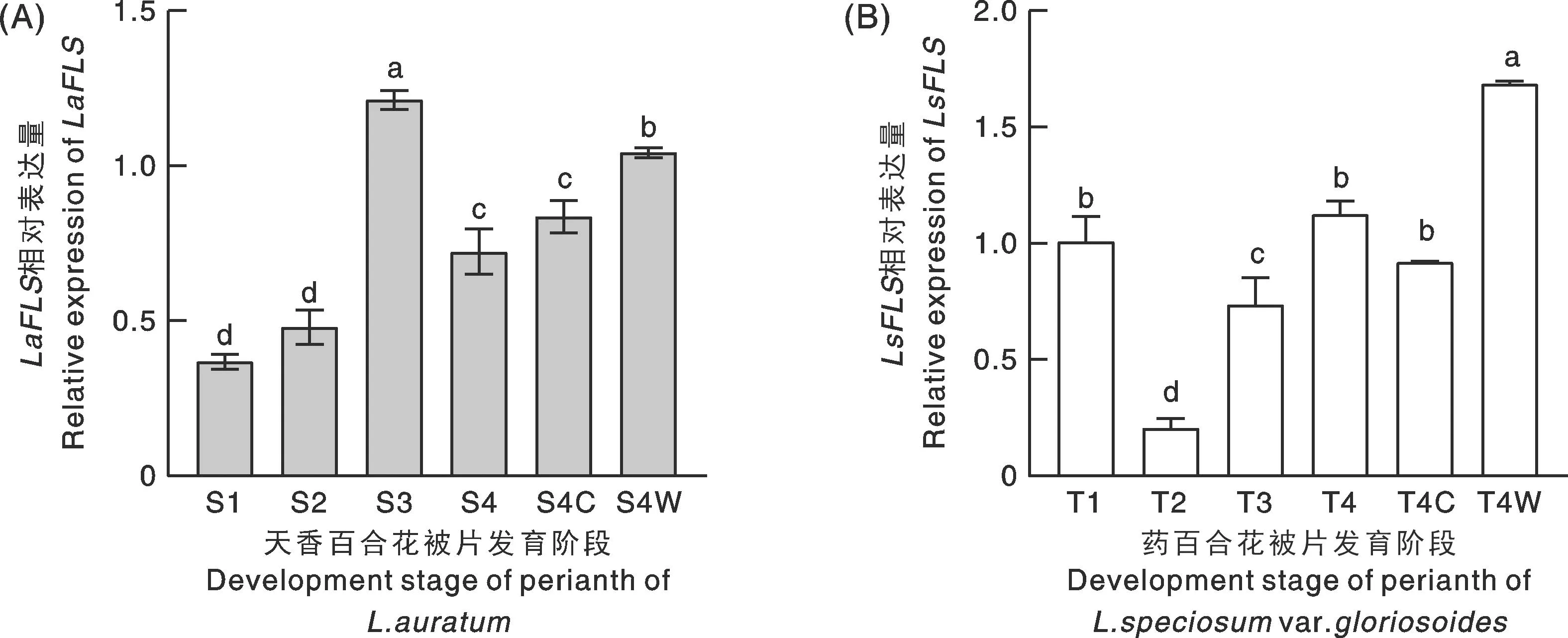
不同小写字母表示差异显著(P<0.05)。Different lowercase letters indicate significant differences (P<0.05).
3 结论与讨论
类黄酮化合物广泛存在于植物界中,作为类黄酮化合物中的重要的次生代谢物之一的黄酮醇在植物诸多生长发育过程中发挥着不可或缺的功能。在黄酮醇的生物合成过程中二氢黄酮醇可以在黄酮醇合成酶(FLS)催化下氧化形成黄酮醇苷元,经过一系列修饰后形成黄酮醇衍生物,也可以在二氢黄酮醇(DFR)的催化下产生无色花青素,最终形成花青素苷[16,35],FLS和DFR基因竞争共同的底物,二者皆为黄酮醇生物合成途径中重要限速酶。
黄酮醇合成酶是类黄酮化合物代谢途径中一个重要的结点酶,属于2-酮戊二酸和铁(Ⅱ)依赖性双加氧酶超家族。LaFLS和LsFLS氨基酸序列高度保守,且存在保守的DIOX-N结构域和典型的2-酮戊二酸和铁(Ⅱ)依赖性双加氧酶结构域,无信号肽和跨膜区域,均为亲水性蛋白,与其他物种的FLS蛋白相似性高。
类黄酮化合物生物合成相关基因的表达受到植物种类、组织以及环境光照的影响,并且在植物体内存在着不同的调控机制。黄酮醇合成酶FLS基因在植物不同发育时期、不同环境及不同组织中的表达量不同[36]。虽然研究表明天香百合和药百合的FLS基因几乎相同,但对比LaFLS和LsFLS的核苷酸序列和氨基酸序列,发现部分位点存在差异,推测这些位点可能会影响底物的偏好性及催化活性,进而影响黄酮醇的合成和不同花色的形成[16]。百合是世界第五大鲜切花,长期的遗传改良产生了丰富的商品种[37],序列比对及系统进化树分析发现,天香百合和药百合FLS基因的氨基酸序列与其杂交子代东方百合粉色花品种索邦、白色花品种西伯利亚FLS基因氨基酸序列几乎一致,但LaFLS与LhSiFLS的亲缘关系更近,而LsFLS与LhSorFLS的亲缘关系近。并且进化树结果表明,药百合的LsFLS、东方百合粉色花品种索邦的FLS与野生种岷江百合LrFLS的亲缘关系比天香百合LaFLS和白色品种西伯利亚FLS基因更近。葛亮等[38]在对百合部分种及品种系统进化关系的研究中发现,岷江百合、湖北百合关系较近,而东方百合杂种系是由湖北百合、来自日本的天香百合、鹿子百合等杂交形成,药百合为鹿子百合的一个变种。药百合、湖北百合及东方百合索邦花被片均有花青素颜色积累,而天香百合和西伯利亚花被片为淡黄色(并分布有紫色斑点)和白色,所以序列部分位点的差异能否对FLS基因表达造成影响,进而对花色呈色差异影响需要进一步研究证明。
通过LaFLS和LsFLS的表达情况来看,两个基因分别具有一定的组织特异性,但总体来讲均在花药、子房的表达量较高,在花蕾发育的过程中LaFLS表达量处于动态变化,LsFLS随着花蕾发育其表达量逐渐增加,表明随着呈色过程可能有黄酮醇的大量积累。已有的报道中,FLS在不同植物中的表达模式差异较大。拟南芥中AtFLS被归为早期基因,在幼嫩组织中表达量较高,而在成熟叶片中表达较低,在植物发育的早期阶段发挥功能[39]。在温州蜜柑(CitrusunshiuBlanco)[40]、覆盆子(Rubusidaeus)[41]等果树研究中表明,FLS基因的表达受发育调控,未成熟果实中FLS酶活性及黄酮醇的积累高于成熟果实,黄酮醇在幼嫩组织中表达量较高,这可能是因为黄酮醇有抵挡紫外线伤害的作用,可以减少紫外线对幼嫩组织的伤害[34]。葡萄(Vitisvinifera)中VvFLS基因在各个组织部位均有表达,随着生长发育不同组织中FLS的表达量产生变化,其中在叶子、花蕾花朵及浆果皮中表达量较高[42];葡萄风信子中MaFLS基因在白色品种的花蕾发育早期表达量逐渐升高,到花蕾变色中后期又降低,而粉色和蓝色品种中FLS基因在晚期表达量最高[22-23],这与天香百合和药百合FLS基因的表达模式几乎一致。黄酮醇作为主要辅色素之一,不仅和二氢黄酮醇-4-还原酶(DFR)竞争底物二氢黄酮醇,还需要其合成黄酮醇以稳定花色[8]。将牡丹(Paeoniasuffruticosa)中正向调控花青苷生物合成的转录因子PsMYB12L在苹果愈伤组织过表达,发现FLS的表达下调,同时上调内源性参与花青素生物合成的基因如DFR、ANS等表达[32],推测在百合中黄酮醇合成酶基因也有类似的表现。因此,LaFLS和LsFLS的基因表达差异、底物偏好性及催化活性等可能关系到天香百合和药百合黄酮醇合成支路对代谢流的竞争能力和黄酮醇积累,进而可能会对花青素苷的积累和花色产生影响,从而使花被片出现不同的表型颜色,这些作用机制和调控机制需要深入研究。

