花椒流胶病拮抗菌的分离鉴定及其生防机制
赵吉桃,何 静,*,丁德东,李彦湘,候彩霞,赵 倩
(甘肃农业大学 a,林学院;b,甘肃省枸杞无害化栽培工程研究中心,甘肃 兰州 730070)
花椒(Zanthoxylumbungeanum)属芸香科花椒属落叶小乔木,主要分布于中国甘肃、四川、浙江等地,是我国重要的经济林树种之一[1]。花椒不仅是重要的调味佐料,还是一种常用的中草药[2],因其具有收益早、用途广、价值高与适应性强等特点,常用作我国一些地区的主要经济树种、抗旱树种与水土保持树种[3]。目前,随着农林业种植面积的不断扩大,花椒病害的发生愈发严重,其中花椒流胶病是发病最为严重的病害,已成为传播性广的系统病害[4]。三线镰刀菌(Fusariumtricinctum)是花椒流胶病的主要病原菌之一[5],由该病原菌引发的流胶病日趋严重,已成为制约花椒产业发展的关键因素。
目前,花椒流胶病的防治主要集中在农业防治和化学防治[6]。椒农常采用清理椒园、合理修剪等农业措施,以及使用多菌灵、啶氧菌酯等杀菌剂进行化学防治,但化学药剂的大量使用会使植株产生一定的耐药性并对椒树周围环境造成极大危害。因此,亟待开辟安全、环保的有效途径用于花椒流胶病的防治。目前,生物防治是一种绿色新颖的防治方法,具有环保、危害性小等诸多优点[7-8],其中以内生真菌作为生防菌株防治植物病害的“以菌治菌”防治手段备受人们青睐。植物内生真菌通常存在于健康植株的各种组织和器官中,且不会引起植株的病害。内生真菌与植物通过“协同进化”作用[9-11],可产生与宿主植物相同或相似的次级代谢产物[12-14],这些物质具有抗菌、抗肿瘤、抗氧化等作用,且能促进植物的生长发育或增强植物抗病害能力[15-17]。如李磊等[18]研究发现,内生生防菌解淀粉芽孢杆菌BacillusamyloliquefaciensHt-q6能够有效控制番茄叶霉病和灰霉病的发生;韩忠明等[19]研究发现,拮抗菌株桃色顶孢霉AcremoniumpersicinumMR-47对防风根腐病病原菌木贼镰刀菌Fusariumequiseti有良好的防治效果。目前,生防菌在花椒流胶病防治方面的相关研究与应用还鲜有报道。
本试验以三线镰刀菌为靶标菌,通过研究花椒内生真菌的抗真菌活性,筛选出具有较强拮抗效果的菌株,为花椒流胶病的生物防治提供一定的理论参考借鉴,该研究结果对补充或开发新型植物病害防治药剂具有重要的科学意义和应用价值。
1 材料与方法
1.1 试验材料
1.1.1 供试植株
3年生大红袍花椒植株,由甘肃农业大学林学院经济林实验地提供。
1.1.2 供试菌种
花椒流胶病病原真菌:三线镰刀菌,用于拮抗真菌筛选。4种供试病原真菌:尖孢镰刀菌(Fusariumoxysporum)、木贼镰刀菌(Fusariumequiseti)、交链格孢菌(Alternariaalternata)、细极链格孢菌(Alternariatenuissima),用于拮抗真菌抑菌谱测定。以上真菌均保存于甘肃农业大学林学院森林保护实验室,经活化后备用。
1.1.3 供试培养基
马铃薯葡萄糖琼脂(PDA)培养基:200 g马铃薯,20 g琼脂,20 g葡萄糖,1 000 mL蒸馏水;马铃薯葡萄糖液体(PDB)培养基:200 g马铃薯,20 g葡萄糖,1 000 mL蒸馏水。
1.1.4 主要试剂
22.5%啶氧菌酯悬浮剂(上海科迪华农业科技有限公司);DNA提取试剂盒Universal Genomic DNA Extraction Kit(北京索莱宝科技有限公司)。
1.2 内生真菌的分离纯化
采用组织分离法[20],取新鲜健康的花椒植株的根、茎、叶和刺,用流水冲洗干净,自然晾干。在无菌环境中,将根、茎、叶和刺分别切成约0.5 cm×0.5 cm的小块,置于质量浓度0.1%的HgCl2溶液中浸泡1 min,用无菌水漂洗3~5次,再用体积分数75%的乙醇溶液浸泡1 min,然后用无菌水漂洗3~5次;在无菌环境中,将消毒后的材料放于无菌滤纸上晾干;然后将植物材料的组织切口处放置于含有0.1%链霉素的PDA平板中培养,每个培养皿放置4块植物组织,设置6个重复。将植物组织消毒后最后一遍冲洗的无菌水洗涤液涂在PDA培养基上作为对照,25 ℃培养2 d后无菌落长出,表明消毒彻底。将样品25 ℃培养至出现菌落,从菌落边缘挑取菌丝分别接种于PDA平板,经反复纯化得到单一菌株,4 ℃保存。
1.3 拮抗菌株的筛选
在PDA平板两侧分别接入供试病原菌菌饼(直径6 mm)和花椒内生真菌菌饼(直径6 mm)作平板对峙试验,两菌饼相距5 cm,以不接内生真菌作空白对照。每试验3次重复,置25 ℃恒温培养箱中培养7 d后,测量并记录病原真菌菌落的径向生长直径,计算抑制率[21]。
r=(dCK-dt)/(dCK-d)。
(1)
式(1)中:r表示抑制率;dCK表示对照菌落直径;dt表示处理菌落直径;d表示菌饼直径。
1.4 花椒内生真菌的鉴定
将分离得到的菌种接种至PDA固体培养基上培养,25 ℃培养5~7 d。培养期间,记录菌落的生长周期、颜色与菌落形态等特征,并对菌丝、孢子和产孢结构等进行显微观察。根据形态观察结果,查阅《真菌鉴定手册》[22]与相关文献进行初步鉴定。
将长满培养皿的菌落用蒸馏水冲洗,移至研钵充分研磨,采用DNA提取试剂盒提取DNA,用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[23]进行PCR扩增。反应体系:5×FastPfu Buffer 10 μL,2.5 mmol·L-1dNTPs 2 μL,上下游引物(5 μmol·L-1)各1 μL,FastPfu Polymerase 0.5 μL,DNA模板10 ng,超纯水补充至50 μL。扩增程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测,并委托阿趣生物公司进行基因测序,测序结果用BLAST进行同源性比对,通过MEGA 7.0软件中的NJ法构建系统发育树。
1.5 抑菌谱的测定
将4种供试病原菌与内生真菌HJ-18分别做平板对峙试验,两菌饼相距5 cm,以不接内生真菌作空白对照,3次重复,置25 ℃恒温培养箱中培养7 d后,测量并记录病原真菌菌落的径向生长直径,计算抑制率。计算公式同式(1)。
1.6 菌株培养滤液的制备
将PDB培养基分别装于150 mL锥形瓶(每瓶75 mL)中高温灭菌30 min。待冷却后,向每个锥形瓶中分别加入1 mL菌株HJ-18孢子悬浮液(1×106CFU·mL-1),置于25 ℃、转速为160 r·min-1的恒温摇床中培养7 d,将培养液于4 ℃、5 595×g条件下离心10 min,取上清液经0.22 μm微孔滤膜过滤3次,得到培养滤液。
1.7 培养滤液稳定性测定
1.7.1 自然光稳定性
将菌株HJ-18培养滤液置于4 000 lx的培养箱中,滤液距光源20 cm,分别照射2、4、6、8、10、12 h,以未经照射的培养滤液为对照,以未经处理的等量无菌水为空白对照,置于25 ℃恒温培养7 d。每组3次重复。相对抑制率计算方法如下:
rR=(dCK-dt)/(dCK-dn)。
(2)
式(2)中:rR表示相对抑制率;dCK表示空白对照菌落直径;dt表示处理菌落直径;dn表示未处理菌落直径。
1.7.2 紫外光稳定性
将菌株HJ-18培养滤液置于距30 W紫外灯20 cm处,分别照射30、60、90、120、150 min,测定培养滤液的相对抑制率,方法同1.7.1节。
1.7.3 热稳定性
将菌株HJ-18培养滤液分别置于20、40、60、80、100 ℃水浴30 min后恢复室温,测定培养滤液的相对抑制率,方法同1.7.1节。
1.7.4 酸碱稳定性
用1 mol·L-1HCl和1 mol·L-1NaOH溶液分别将菌株HJ-18培养滤液pH值调至2、4、6、8、10、12,静置后调至自然pH值(6.5),测定培养滤液的相对抑制率,方法同1.7.1节。
1.8 菌株HJ-18培养滤液对三线镰刀菌菌丝生长的影响
菌株HJ-18培养滤液对三线镰刀菌菌丝生长的抑制率。将1.6节制得的培养滤液按照10%、20%、30%、40%、50%的体积分数加入25 mL PDA培养基中,制成含药平板,以等量PDA培养基为对照,每组3次重复。将三线镰刀菌菌饼接入平板中央,7 d后观察并记录菌落生长直径,并计算抑制率。
菌株HJ-18培养滤液对三线镰刀菌菌丝生长影响的显微结构观察。参考许乐等[24]的方法,略作修改,进行样品的处理,挑取菌株HJ-18培养滤液处理的三线镰刀菌菌丝体,经过戊二醛固定12 h,然后用磷酸缓冲盐溶液(PBS,pH值7.4)处理,再用OSO4固定5 h;依次经45%(体积分数,下同)、55%乙醇溶液梯度脱水处理1 h,用70%乙醇处理过夜;再依次用85%、95%、100%乙醇分别处理30 min;用醋酸异戊酯处理1 h,在CO2临界点干燥、镀金,于扫描电子显微镜下观察菌丝形态变化。以未经培养滤液处理的菌丝为对照。
1.9 盆栽试验
选用生长状况大致相同的1年生健康花椒幼苗,每盆1株。采用接种针和注射器,每枝注射10 mL三线镰刀菌孢子悬浮液(1.0×106CFU·mL-1),发病后将培养7 d的培养液喷施在枝干表面,第0、30天各处理1次,每盆每次喷施200 mL,以等量无菌水为对照,以22.5%啶氧菌酯处理为阳性对照。试验共设5个处理,每个处理10盆,重复3次,分别为:(1)只接种病原菌;(2)病原菌接种后喷施培养液;(3)病原菌接种后喷施无菌水;(4)病原菌接种后喷施22.5%啶氧菌酯100倍液50 mL;(5)培养液处理后再接种病原菌。试验期间进行正常水肥管理,于处理后每隔15 d调查发病情况,第60 d统计发病率,用病情指数计算相对防效。分级标准[25]:0级,全株正常,无流胶点,无病斑;1级,有散生流胶点,只渗出琥珀色胶体;2级,有流胶点,病斑部位变黑,直径≤2 mm;3级,有散生流胶点,病斑部位变黑,直径<5 mm;4级,有散生流胶点,病斑部位变黑,直径≥5 mm。病情指数和相对防效计算方法如下:
I=[∑(n×i)/(N×imax)]×100;
(3)
E=(ICK-It)/ICK。
(4)
式(3)、(4)中:I表示病情指数;n表示各级病株数;i表示该病级值;N表示调查总株数;imax表示最高级值;E表示相对防效;ICK表示空白对照组病情指数;It表示处理组病情指数。
1.10 数据统计与分析
采用SPSS 25.0软件对数据进行统计分析,采用Origin 2021软件绘图,用新复极差法进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 花椒内生真菌的分离和纯化
采用组织分离法从花椒根、茎、叶和刺中共分离得到108株内生真菌菌株,筛选出对F.tricinctum具拮抗作用的菌株24株。其中,拮抗效果最强的菌株为HJ-18,培养7 d后,其对F.tricinctum的抑制率达58.85%(图1)。
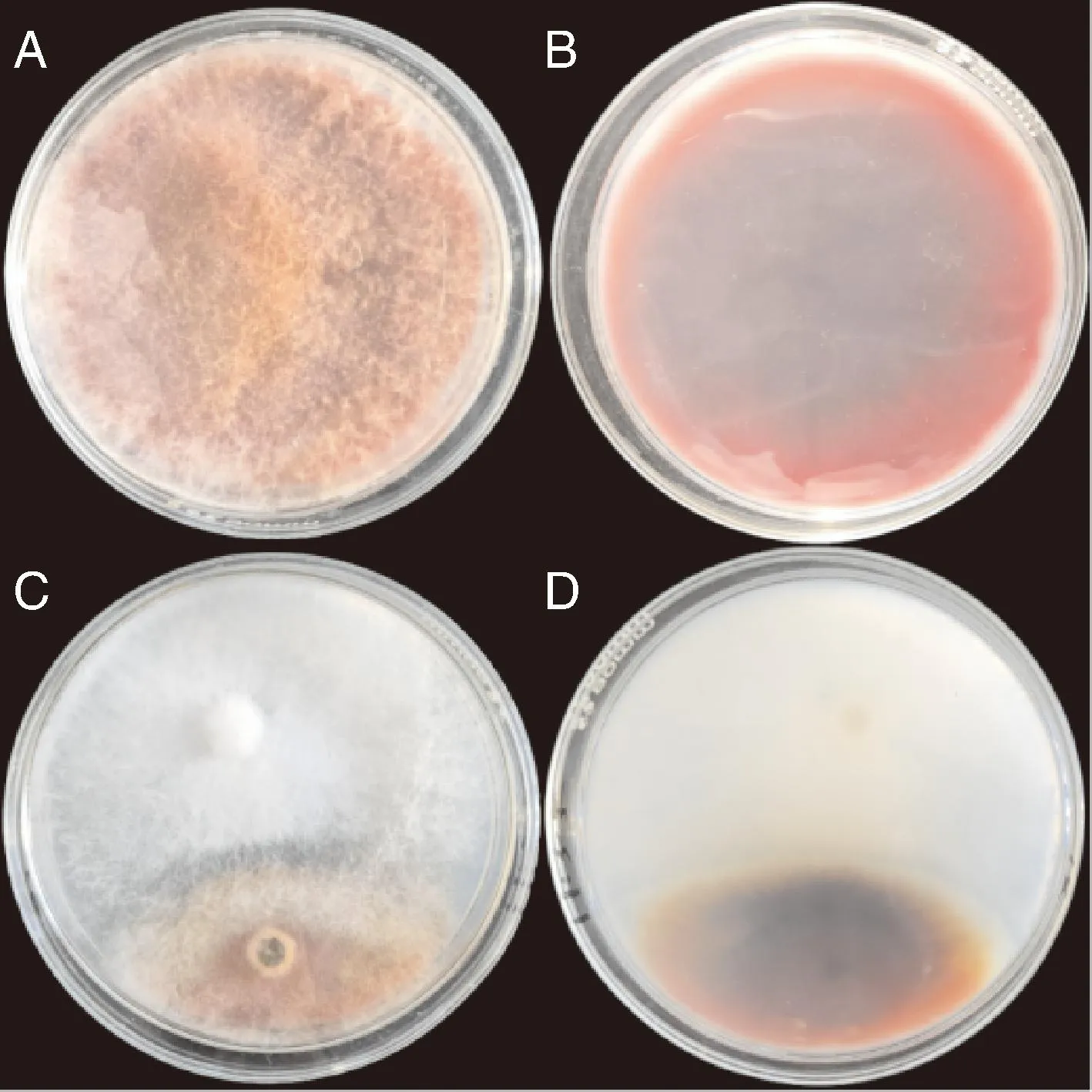
A,对照(正面);B,对照(反面);C,对峙效果(正面);D,对峙效果(反面)。培养时间为7 d。A, Control (front); B, Control (reverse); C, Confrontation effect (front); D, Confrontation effect (reverse). Culture time was 7 days.
2.2 拮抗菌的鉴定
2.2.1 形态学鉴定结果
拮抗菌株HJ-18形态如图2所示,培养7 d之内,菌落呈现乳白色,菌丝蓬松稀疏,呈雪白色绒毛状;培养10 d,菌落呈现淡黄色,中间区域长出伞状物,有特殊性气味产生(图2-A、2-B)。菌丝有隔(图2-C),可产生孢子,呈球形或椭圆形(图2-D)。
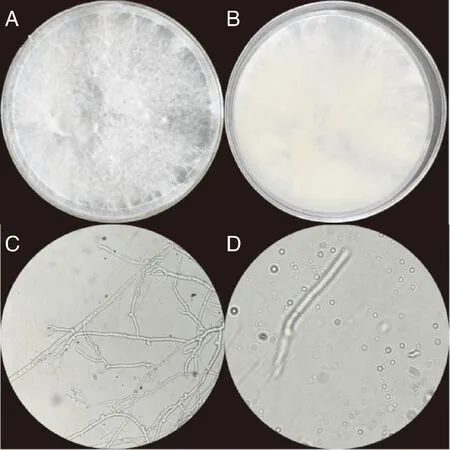
A,菌落形态(正面);B,菌落形态(反面),C,菌丝;D,孢子。A, Colony morphology (front); B, Colony morphology (reverse); C, Mycelium; D, Spore.
2.2.2 分子生物学鉴定结果
系统发育树结果(图3)表明,菌株HJ-18与裂褶菌(Schizophyllumcommune)(登录号MN218205.1)具有高度相似性,同源性达100%,初步鉴定其为裂褶菌,GenBank登录号为OP502072。
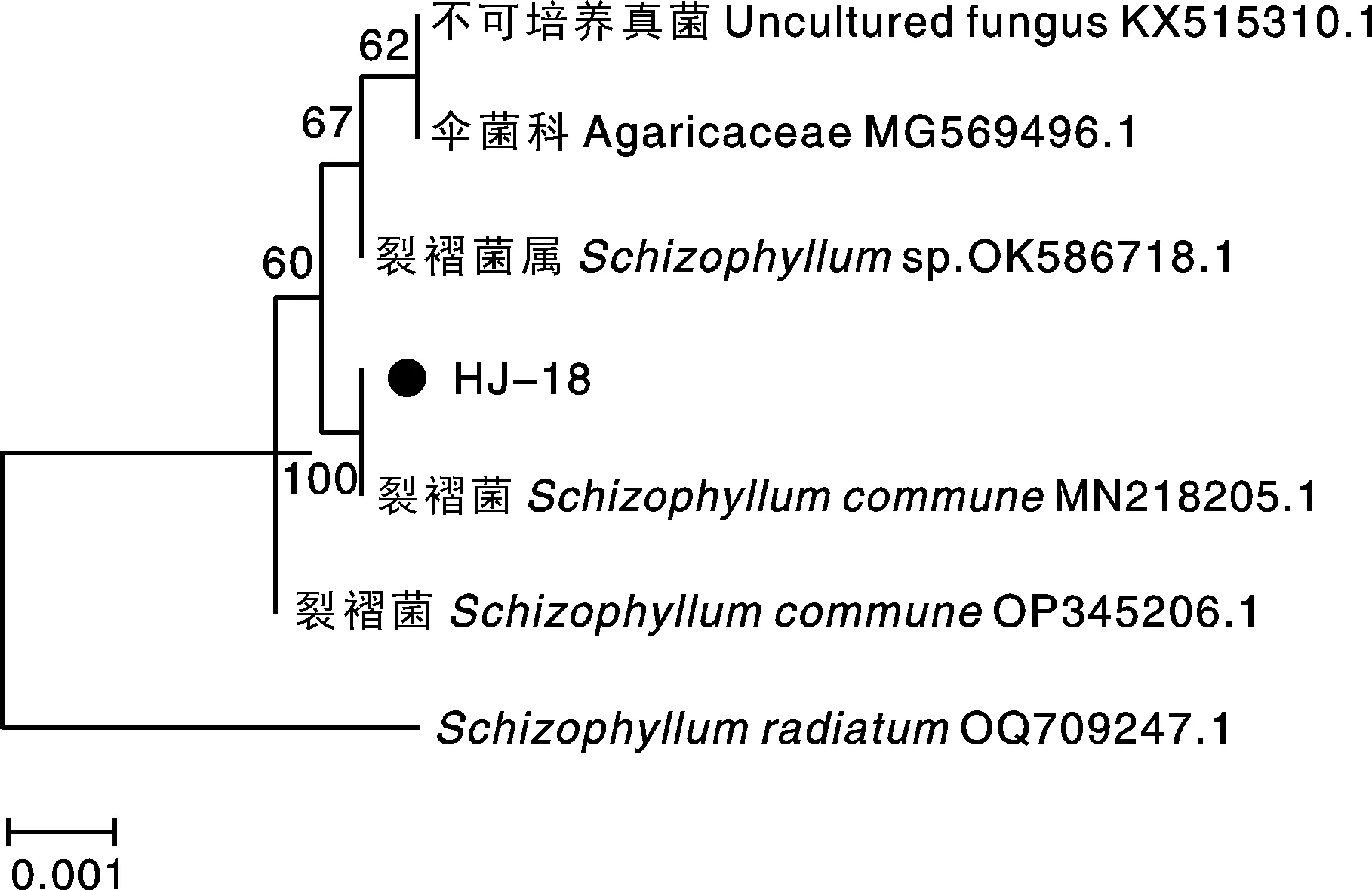
图3 菌株HJ-18基于ITS序列的系统发育树Fig.3 The phylogenetic tree of strain HJ-18 based on ITS sequence
2.3 抑菌谱
抑菌谱结果(图4)表明,菌株HJ-18对4种病原菌都有一定的抑制作用,其中对尖孢镰孢菌抑制效果最好,抑制率达45.80%,对细极链格孢菌抑制效果最差,抑制率为30.58%。
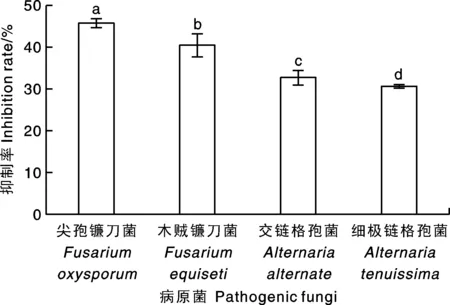
柱上无相同小写字母表示差异显著(P<0.05)。下同。The bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.
2.4 培养滤液稳定性
2.4.1 自然光稳定性
如图5-A所示,强光处理2 h后,菌株HJ-18培养滤液对F.tricinctum的相对抑制率为93.82%,而强光处理4、6、8、10、12 h后,其抑制率逐渐降低,但仍在80%以上,差异不显著,表明菌株HJ-18的抑菌活性物质对自然光不敏感。
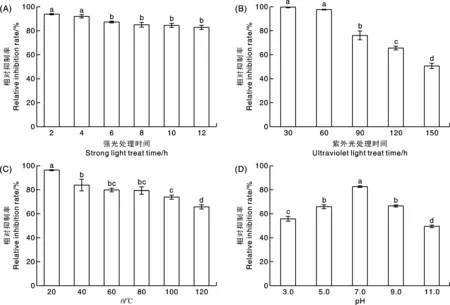
图5 不同条件下菌株HJ-18培养滤液的稳定性Fig.5 Stability of the culture filtrate of strain HJ-18 under different conditions
2.4.2 紫外光稳定性
由图5-B可知,菌株HJ-18培养滤液经紫外灯照射不同时间后,相对抑制率显著(P<0.05)下降。照射30 min后,其对F.tricinctum的相对抑制率为99.86%,而在照射150 min后,相对抑制率仅为50.57%,表明该活性物质不耐紫外光照射。
2.4.3 热稳定性
由图5-C可知,不同温度处理后,菌株HJ-18培养滤液对F.tricinctum的相对抑制率存在显著差异(P<0.05)。20 ℃处理下,其相对抑制率为96.35%,120 ℃处理下的相对抑制率为65.65%,但仍保持较高的抑制效果,说明菌株HJ-18培养滤液的活性物质对温度具有较强的耐受性。
2.4.4 酸碱稳定性
如图5-D所示,不同pH下,菌株HJ-18培养滤液对F.tricinctum的相对抑制率差异显著(P<0.05)。当pH值为7.0时,其相对抑制率达82.59%;在酸性环境(pH值3.0)和碱性环境(pH值11.0)下,菌株HJ-18培养滤液的相对抑制率均显著下降,但仍保持较高的抑制效果,相对抑制率分别为55.78%和49.43%,说明菌株HJ-18培养滤液的抑菌活性物质对酸碱具有一定的耐受性。
2.5 菌株HJ-18培养滤液对三线镰刀菌菌丝生长的影响
由图6可知,不同体积分数的菌株HJ-18培养滤液对三线镰刀菌菌丝生长的抑制率有显著差异(P<0.05),且随着菌株HJ-18培养滤液体积分数的增大,抑制率逐渐升高。当HJ-18培养滤液体积分数为50%时,其抑制率达到66.40%。
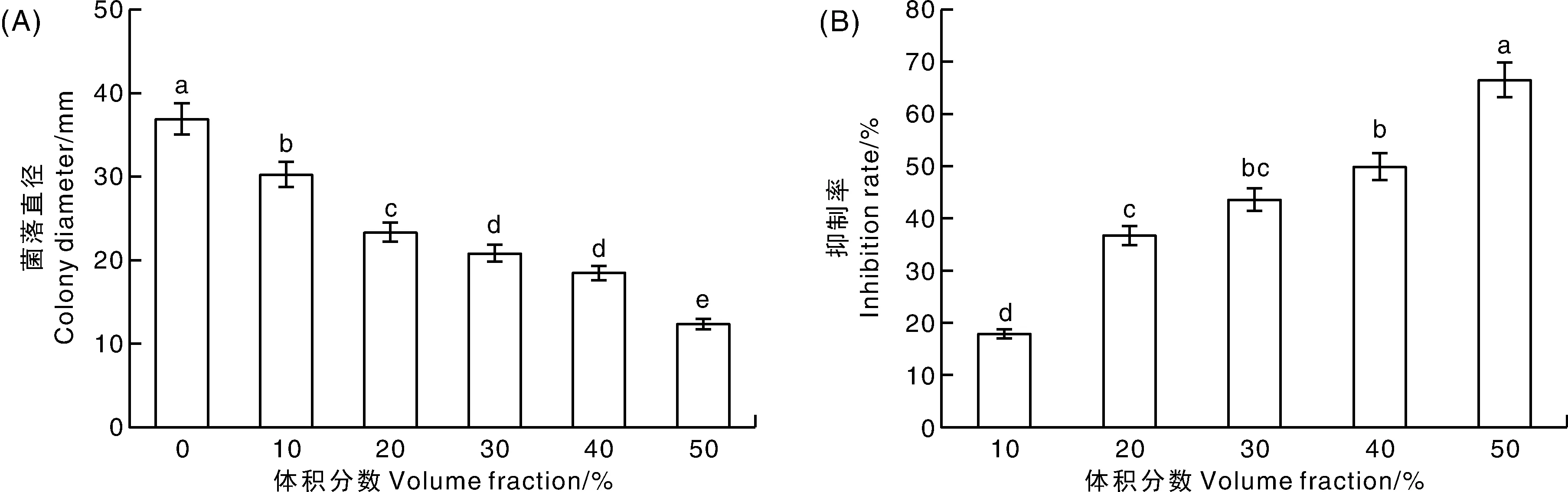
A,菌落直径;B,抑制率。A, Colony diameter; B, Inhibition ratio.
由图7可知:对照组的菌丝生长状态良好,菌丝均匀,光滑,形状完整,呈现正常的管状结构(图7-A、7-B);处理组菌丝粗细不一,出现弯曲,褶皱现象,且表面有碎屑产生(图7-C、7-D)。说明菌株HJ-18培养滤液对三线镰刀菌菌丝产生了严重的影响,导致菌丝弯曲、褶皱。
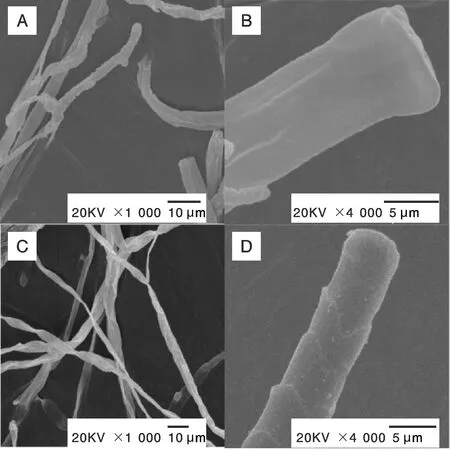
A,对照(×1 000);B,对照(×4 000);C,HJ-18培养滤液处理(×1 000);D,HJ-18培养滤液处理(×4 000)。A, Control (×1 000); B, Control (×4 000); C, Treated by HJ-18 culture filtrate (×1 000); D, Treated by HJ-18 culture filtrate (×4 000).
2.6 菌株HJ-18培养液对花椒流胶病的防治效果
不同处理均对花椒流胶病有一定的防治效果,先接种病原菌后用菌株HJ-18培养液处理的相对防效达到52.65%,略高于22.5%啶氧菌酯处理的相对防效(48.48%),显著高于无菌水处理(18.56%);先用菌株HJ-18培养液预处理,再接种病原菌的植株,仅出现小面积胶状物,大部分正常生长,其相对防效达到56.82%(图8、表1)。综上,裂褶菌HJ-18对花椒流胶病有较好的防治效果。
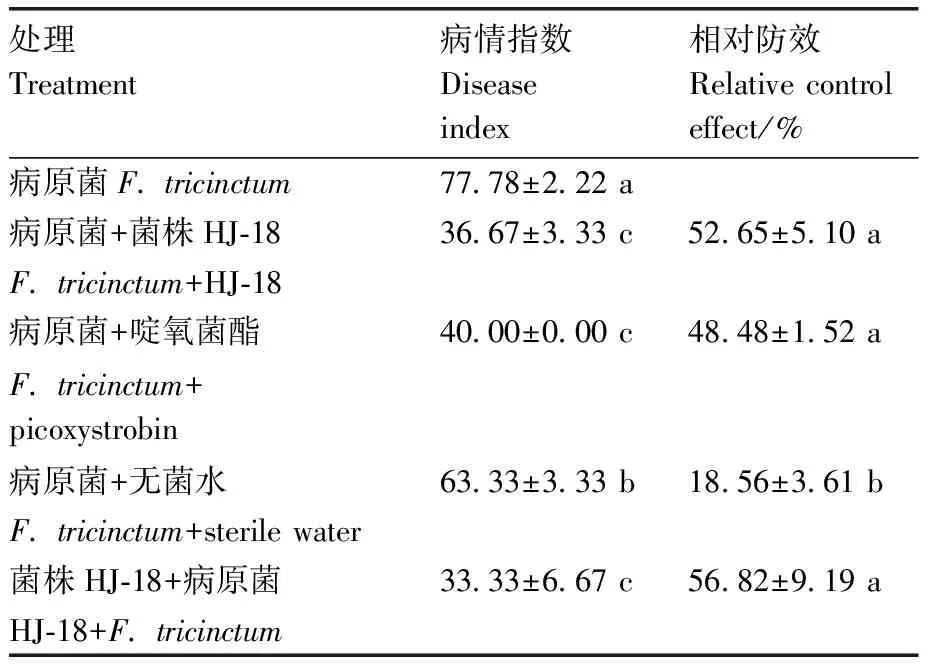
表1 菌株HJ-18对花椒流胶病的生防效果

A,接种三线镰刀菌;B,三线镰刀菌+菌株HJ-18处理;C,22.5%啶氧菌酯100倍液处理;D,无菌水处理;E,先接种菌株HJ-18再接种三线镰刀菌。A, Inoculation with Fusarium tricinctum; B, Fusarium tricinctum+HJ-18 treatment; C, 100-fold dilution of 22.5% picoxystrobin treatment; D, Sterile water treatment; E, Inoculation with strain HJ-18 before the Fusarium tricinctum.
3 结论与讨论
植物内生真菌资源丰富,在促进植物生长、抗逆、抗病等方面发挥着重要的作用[26-28]。现已发现的植物内生真菌中,约有三分之一对病原真菌具有一定的拮抗作用[29],其拮抗机制主要有竞争、重寄生、抗生作用等[30-31]。
近年来,裂褶菌逐渐作为生防菌株应用于植物病害的防治。张富美等[32]筛选出的裂褶菌G18可抑制尖镰孢菌的生长;宋晓宇[33]从杨树中筛选出的裂褶菌ROHY8225b2,其挥发性有机化合物对炭疽菌等几种植物病原菌有一定的抑制作用。本研究从花椒植株中分离的裂褶菌HJ-18对三线镰刀菌的抑制率为58.85%,且对其他4种供试植物病原真菌均具有一定的抑制效果,表明其具有生防菌株的潜力。扫描电镜结果显示,经过培养滤液处理的菌丝粗细不一,表面出现碎屑等现象,推测菌株HJ-18可能产生某种活性物质[34],其破坏病原菌菌丝体结构,导致细胞内物质发生泄露,从而起到抑制效果。
菌株在培养过程中会产生一些活性物质,如多糖、苹果酸、β-蒎烯等,这些活性物质受外界影响较大[35-37]。王恒煦等[38]研究发现,芽孢杆菌WD培养滤液经过不同温度处理后,抑制率基本保持不变,表明该培养液对温度有一定的耐受力,本研究结果与此一致。芽孢杆菌WD培养液经不同时间紫外灯处理后,活性基本保持不变;本研究中裂褶菌培养滤液经紫外灯照射之后,抑菌物质的活性下降,但抑制率仍达50%以上,这可能是因为不同菌株培养滤液对于外界环境具有不同的耐受力。裂褶菌培养滤液对酸碱有一定抗性,说明该培养滤液稳定性较好,具备一定的生产潜力,可作为一种良好的生物资源应用于生产实践。盆栽试验结果表明,菌株HJ-18对花椒流胶病的防治效果为52.65%,与22.5%啶氧菌酯100倍液的48.48%相比无显著差异,说明其有一定的应用前景。本研究还发现,先接种菌株HJ-18再接种三线镰刀菌处理组花椒的病情指数较小,相对防效略高于先接种三线镰刀菌再接种菌株HJ-18处理组,表明菌株HJ-18对花椒流胶病的预防作用优于治疗作用。陈思杰等[39]也发现,深色有隔内生真菌预处理对枸杞根腐病害的防治效果优于同时接菌。综上表明,裂褶菌HJ-18对三线镰刀菌引起的花椒流胶病具有良好的生物防治效果,可作为生防菌剂进一步开发与利用。

