POR基因敲除、回补及过表达LO2细胞株的构建及作为AFB1染毒模型的初步应用
王 琳,袁建林,缪 昌,马玉晗,曹三杰,赵 勤,*
(1.四川农业大学 动物医学院 猪病研究中心,四川 成都 611130; 2.农业农村部兽用药物与兽医诊断技术四川科学观测站,四川 成都 611130)
细胞色素P450氧化还原酶(cytochrome P450 oxidoreductase),简称POR,或CPR、CYPOR、OR、NCPR、P450R等。POR最先是作为单个烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)特异性细胞色素C还原酶被发现的,是所有肝微粒体中细胞色素P450微粒体氧化酶系(cytochrome P450 monooxygenases, CYP450s)的唯一电子供体[1]。肝脏作为机体异生素代谢的主要器官,POR在其中发挥了不可替代的代谢作用。POR对多种代谢过程至关重要,参与由CYP450s催化的类固醇激素、药物和异生素等代谢反应[2-3]。POR不仅可作为电子供体参与由CYP450s介导的异生素代谢,也是构成几种加氧酶复合物的基本成分,包括血红素氧化酶、鲨烯单加氧酶、7-脱氢胆固醇还原酶[4],在机体中发挥代谢作用。如Reczek等[5]进行了基于CRISPR(clustered regularly interspaced short palindromic repeats)的阳性选择筛选,确定POR基因是百草枯诱导活性氧(ROS)产生的来源,是百草枯诱导细胞死亡所必需的代谢基因。POR还能直接介导一些致癌毒性物质的代谢和转化,故已作为抗癌治疗的目标。Pedersen等[6]也研究发现,POR是三阴性乳腺癌(triple-negative breast cancer, TNBC)的独立预后生物标志物,评估POR的表达变化能够更有效地对TNBC患者进行监测和治疗。
黄曲霉毒素B1(aflatoxin B1,AFB1)对肝毒性的损伤巨大,肝脏作为AFB1的靶器官,机体摄入AFB1后,经过CYP450s作用将AFB1代谢为AFB1-8,9-环氧化物(AFB1-8,9-epoxide,AFBO),继而在体内与DNA、RNA和蛋白质等生物大分子结合形成DNA加合物,攻击机体内的DNA等生物大分子,引发DNA损伤、细胞凋亡等毒效应,进而引起细胞恶变,引发机体肿瘤[7]。其中POR对CYP450s有重要的调控作用,在AFB1的代谢及毒性过程中发挥了至关重要的作用,但具体的毒性作用机制还需要作深入研究。人肝细胞LO2是目前研究AFB1导致肝毒性损伤的一种常用体外细胞模型[8],但POR基因在LO2细胞中的敲除、回补或过表达细胞系的研究还未见报道。为深入研究POR在AFB1所致肝毒性中的功能和作用,急需构建LO2 PORKO、LO2 PORCO、LO2 POROE等细胞系作为相关毒理研究的细胞模型。
目前CRISPR/Cas9技术在基因编辑领域已得到广泛应用。在此之前,利用锌指核酸酶 (ZFN)和转录激活因子样效应核酸酶(TALEN)进行基因编辑是常见的手段[9]。相较于ZFN与TALEN的蛋白质引导DNA切割方法,CRISPR/Cas9基因编辑技术的两个基本组件:靶向目标基因引导RNA和切割双链DNA的Cas9内切酶,使得CRISPR/Cas9介导的基因编辑具有简单、高效、低成本、高特异性等优点。
在采用 CRISPR/Cas9技术定点敲除LO2细胞中POR基因构建LO2 PORKO细胞株,以及采用同源重组技术构建重组质粒后经细胞转染与筛选分别构建稳定的LO2 PORCO和LO2 POROE细胞株的基础上,再用AFB1染毒处理各细胞株后观察细胞形态变化及测定细胞存活率,以验证LO2 PORKO、LO2 PORCO和LO2 POROE细胞株的增殖功能,为后续将其作为相关毒理研究细胞模型并深入开展POR基因功能的研究提供材料。
1 材料与方法
1.1 材料
293T及人肝细胞LO2株(均为ATCC来源)、lentiCRISPR v2质粒和pcDNA3.1(+)/myc-His B质粒等均由四川农业大学动物医学院猪病研究中心保藏并提供;黄曲霉素B1(纯度≥ 98%)购自上海麦克林生化科技股份有限公司;人源POR抗体和HRP标记山羊抗兔IgG (H+L)均购自武汉爱博泰克生物科技有限公司;GAPDH抗体购自Proteintech公司;无缝克隆试剂盒与增强型CCK-8试剂盒购于上海碧云天生物科技有限公司。
1.2 方法
1.2.1 细胞分组处理办法
LO2细胞分为正常细胞对照组(细胞+DMEM培养液)和不同浓度的AFB1染毒组。AFB1需用二甲基亚砜(DMSO)溶解后配制成5 mmol·L-1的母液后,再用DMEM高糖培养液稀释成不同浓度,并对细胞进行规定时间的染毒处理。
1.2.2POR基因编辑靶位点的选择设计和sgRNA引物的合成
通过NCBI数据库搜索人源POR基因序列(ID:5447),再通过CRISPR设计工具网站(http://chopchop.cbu.uib.no/)设计POR的sgRNA,在待选的sgRNA中选择综合排名靠前且预测无脱靶效应的2条sgRNA,它们均靶向同一外显子exon5。故分别设计了靶向POR-exon5的2个sgRNA,sgRNA及相应引物序列如表1。预期在exon5靶位点之后的基因序列发生突变,使POR基因自sgRNA靶位点后氨基酸翻译错码从而导致POR蛋白不能正常表达。
1.2.3 lentiCRISPR v2-sgRNA重组质粒的构建
取靶向POR基因的两个sgRNA的引物,通过降落PCR退火,形成双链DNA。取经BsmB I限制性内切酶线性化后的lentiCRISPR v2质粒,使用T4 DNA连接酶连接,16 ℃过夜,第2天进行转化及克隆。使用lentiCRISPR v2通用引物对转化后平板上菌落挑单,进行菌落PCR鉴定。扩大培养阳性菌落,交由生工生物工程(上海)股份有限公司进行测序鉴定。将测序正确菌落扩大,抽提质粒保存于-20 ℃备用。
1.2.4 慢病毒包装和病毒感染
293T细胞密度达到80%~90%时将质粒lentiCRISPR v2-sgRNA、psPAX2和pMD2.G按比例(质量比10∶6∶3)混合,根据转染试剂说明,将质粒与脂质体混合物进行转染,36 h后收集细胞上清液,4 ℃保存。继续培养24 h后收集全部细胞液,两次收集的上清液离心并过滤后置于-80 ℃备用。使用冻存的慢病毒液(病毒液∶培养液体积比1∶1)感染LO2细胞,加入总浓度为8 μg·mL-1的Polybrene增加病毒感染效率。感染36 h后换液,使用嘌呤霉素(1.5 μg·mL-1)筛选14 d后获得阳性细胞株。其间产生的废弃物均无害化处理,统一回收。
1.2.5 LO2 PORKO单克隆细胞系的筛选
使用有限稀释法均匀接种约50个阳性细胞至96孔细胞培养板中,培养约一周后,挑取单克隆细胞团至24孔板中,逐渐扩大培养。收集细胞,提取基因组DNA,利用表2中的引物进行扩增,PCR产物经过回收纯化进行测序鉴定。
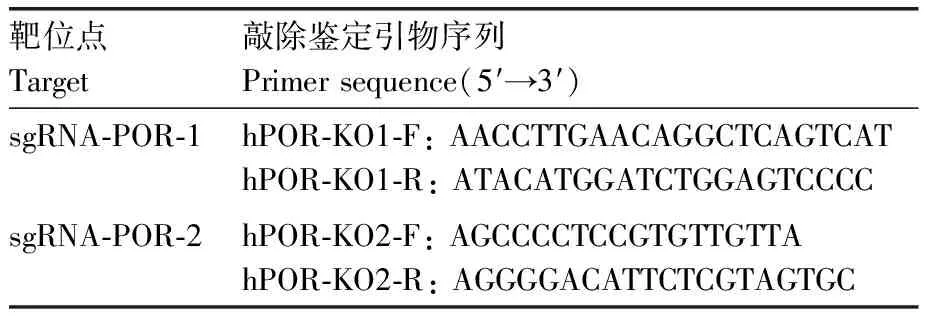
表2 POR基因敲除鉴定引物序列
1.2.6POR基因真核表达质粒的构建
POR目的片段的获取:根据RNA抽提试剂盒的说明提取LO2细胞总RNA,随后反转录获取cDNA进行POR基因扩增。POR同源扩增引物序列见表3。扩增产物大小约为2 088 bp。取PCR扩增产物进行电泳分析。线性化载体的制备:提取载体pcDNA3.1(+)/myc-His B质粒,使用限制性内切酶XhoⅠ、HindⅢ对其进行双酶切,切胶纯化获得线性化载体,保存备用。
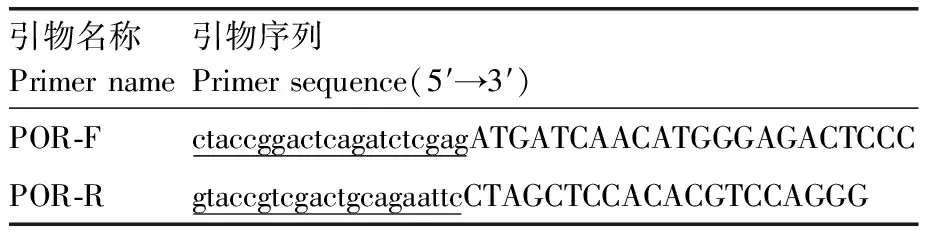
表3 POR同源扩增引物序列
无缝克隆构建重组质粒:将扩增正确的POR基因PCR产物和线性化pcDNA3.1(+)/myc-His B载体,按片段∶载体摩尔比=5∶1的比例混合,加入2×Seamless Cloning Mix,终体积为10 μL,50 ℃连接30 min,随后将重组连接产物进行转化。使用pcDNA3.1(+)/myc-His B载体通用引物T7和BGH rev,对转化后平板上菌落挑单,进行菌落PCR鉴定。扩大培养阳性菌落,抽提质粒交由生工生物工程(上海)股份有限公司进行测序鉴定。将测序正确的菌落扩大培养,抽提质粒备用。
1.2.7POR重组质粒转染及筛选
依照Lipofectamine 3000试剂盒说明向LO2细胞及LO2 PORKO细胞中转染重组质粒pcDNA3.1(+)/myc-His B-POR。转染48 h后,采用500 μg·mL-1遗传霉素(G-418)对转染后细胞进行抗性筛选,14 d为一个筛选周期,获取稳定转染的LO2 POROE、LO2 PORCO细胞系。
1.2.8 LO2 PORKO、LO2 PORCO、LO2 POROE细胞系的蛋白质印迹鉴定
收集野生型LO2、LO2 PORKO、LO2 PORCO及LO2 POROE细胞,分别提取总蛋白。通过聚丙烯酰胺凝胶电泳分离蛋白,然后转印至聚偏二氟乙烯(PVDF)膜,室温封闭1 h后,使用POR(1∶1 000稀释)和GAPDH(1∶5 000稀释)抗体孵育过夜,再用辣根过氧化物酶标记的二抗(1∶5 000稀释)室温孵育1 h后,用ECL发光法进行显色并拍照。
1.2.9 AFB1染毒LO2细胞及IC50值测定
野生型LO2细胞按密度为每孔每100 μL 3×104个细胞接种。根据CCK-8试剂盒的检测方法,设置6个试验组,分别为4 μmol·L-1、8 μmol·L-1、16 μmol·L-1及32 μmol·L-1的AFB1染毒组,试剂孔组和对照孔组。每个组设定6个复孔,重复3次。处理24 h或48 h后测定D450,根据式(1)计算存活率,绘制剂量-效应曲线,并使用SPSS 27.0软件计算IC值,为后续研究中确定合适的AFB1染毒浓度和时间提供依据。
细胞存活率(%)=
(1)
1.2.10 光镜下细胞形态观察
将野生型LO2、LO2 PORKO、LO2 PORCO及LO2 POROE细胞分别以每孔每2 mL含1×106个细胞的密度接种于6孔细胞培养板,融合度为90%时进行AFB1染毒,然后于光学显微镜下观察各组细胞形态变化并拍照记录。
1.2.11 AFB1染毒后细胞存活率测定
将野生型LO2、LO2 PORKO、LO2 PORCO、LO2 POROE细胞以每孔每100 μL含3×104个细胞的密度接种。参照1.2.9节中的分组办法及确定的染毒条件进行染毒处理与细胞存活率检测。
1.2.12 数据处理与统计分析方法
(1)评价主体多元化。参与课程考核评价活动的主体除了教师外,还应该包括学生、企业行业专家、课程研究学者、专职评价机构等人员。
采用GraphPad Prism 9.0与Microsoft Office 2016中Excel软件进行数据统计分析及绘图。所有统计数据均以平均值±标准差的形式呈现,根据需要采用t检验或双因素方差分析(Two-way ANOVA)进行差异显著性分析,P<0.05被认为差异有显著性。*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1,ns表示P>0.05。
2 结果与分析
2.1 lentiCRISPR v2-sgRNA重组质粒的构建结果
lentiCRISPR v2质粒信息部分示意图及sgRNA插入位置见图1-A;两条sgRNA序列,分别为sgRNA-1和sgRNA-2,其序列信息见图1-B,序列末端“TGG”为PAM识别位点;lentiCRISPR v2-sgRNA重组质粒测序结果见图1-C,其中v2-sgRNA-2结果为反义链序列(5′→3′)。
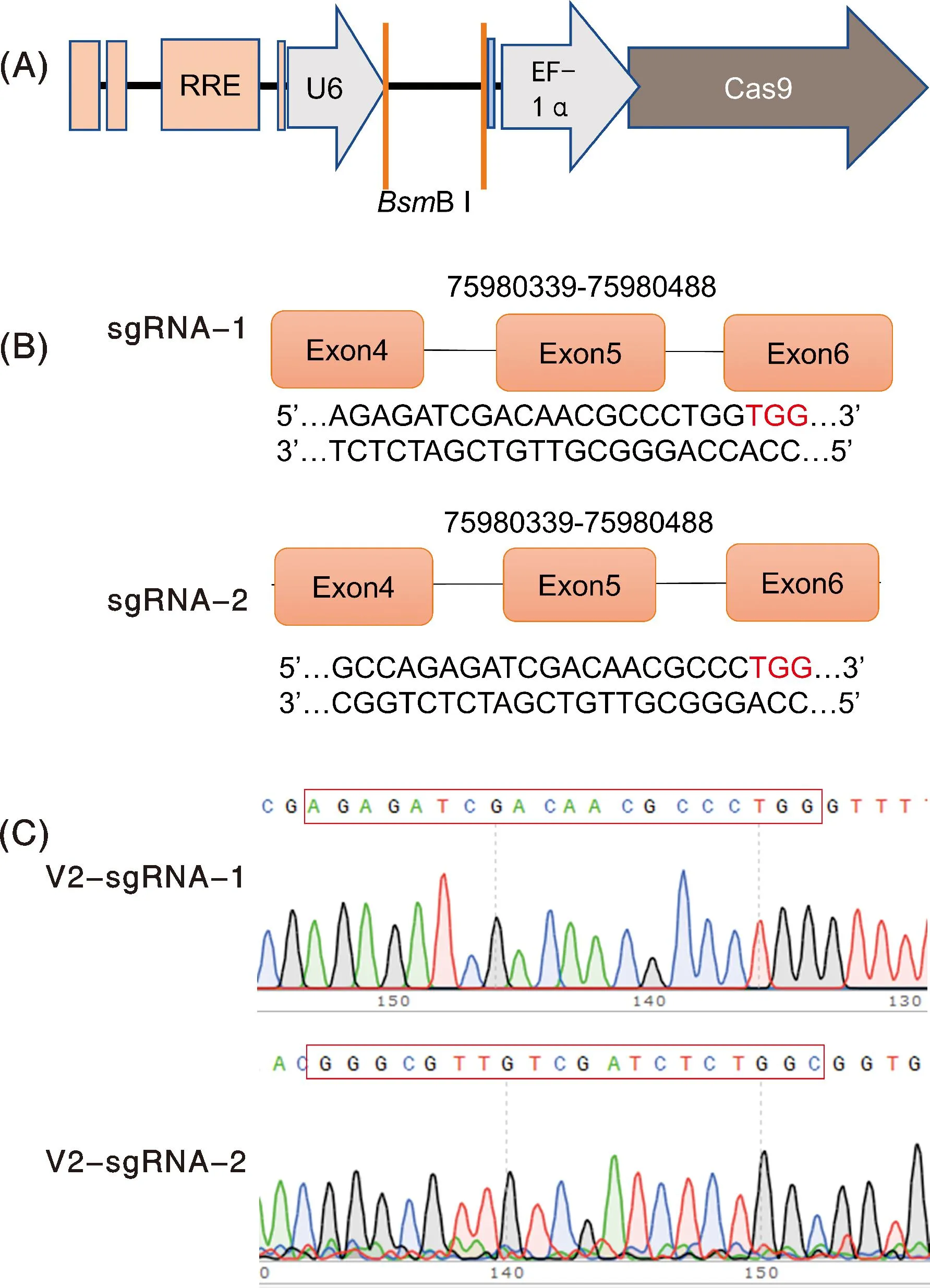
A,lentiCRISPR v2质粒信息部分示意图及sgRNA插入位置;B,sgRNA序列及靶位点示意图;C,lentiCRISPR v2-sgRNA重组质粒测序结果。A, lentiCRISPR v2 plasmid information partial schematic diagram and sgRNA insertion location; B, sgRNA sequence and target site diagram; C, lentiCRISPR v2-sgRNA recombinant plasmid sequencing results.
2.2 LO2 PORKO单克隆细胞株的鉴定
对分别采用sgRNA-1与sgRNA-2靶位点得到的LO2 PORKO单克隆细胞株进行测序鉴定,并与POR基因序列和靶序列进行比对。测序峰图如图2-A所示;图2-B为序列比对结果。结果显示:与LO2细胞相比,细胞株sgRNA-1-POR基因靶位点序列中第18位单碱基“T”敲除;而细胞株sgRNA-2-POR的基因靶位点序列的最后3个碱基发生突变(由“C”突变为“T”),而后导致靶位点后连续10个碱基(TGGTGGTTTT)敲除,编辑效率较靶位点sgRNA-1高。此后选取靶位点sgRNA-2的POR敲除细胞进一步检测POR蛋白表达水平(图4)。
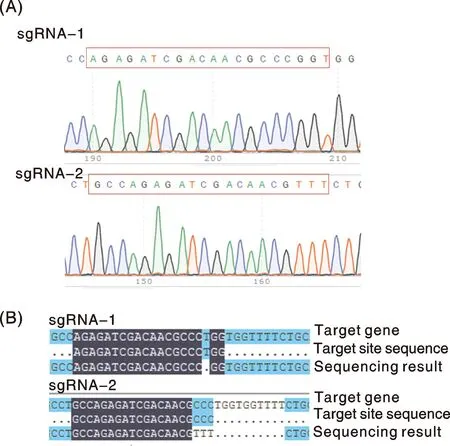
A,LO2 PORKO细胞测序峰图;B,LO2 PORKO细胞序列比对图。A, LO2 PORKO cell sequencing peak map; B, LO2 PORKO cell sequence comparison map.
2.3 pcDNA3.1(+)/myc-His B-POR重组质粒的构建
图3-A为pcDNA3.1(+)/myc-His B质粒部分信息及POR目的片段插入位点示意图;图3-B为以LO2细胞cDNA为模板扩增的POR同源片段电泳结果,片段大小约为2 088 bp;图3-C为重组质粒转化后菌落PCR鉴定的电泳结果;图3-D为阳性菌落测序峰图及测序后与POR序列比对的结果。
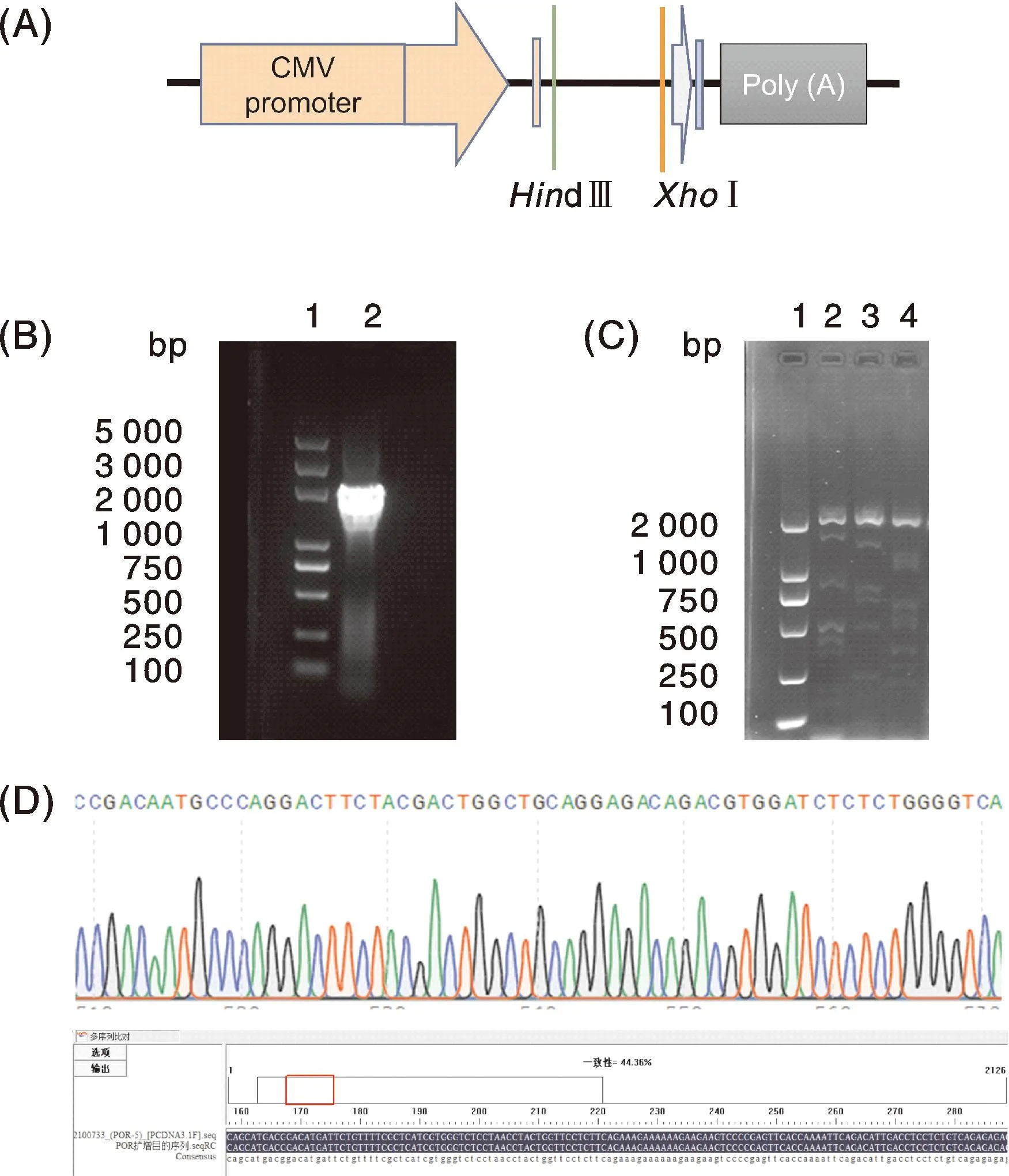
A,pcDNA3.1(+)/myc-His B质粒部分信息示意图及POR片段插入位点;B,以LO2细胞cDNA为模板扩增的POR同源片段,1为DNA marker,2为目的片段;C,菌落PCR鉴定电泳图,1为DNA marker,2~4为阳性菌落;D,阳性菌落测序比对结果。A, pcDNA3.1(+)/myc-His B plasmid partial information schematica and insertion site of POR target fragment; B, POR homologous fragment amplified in LO2 cell cDNA as template,1 is DNA marker,2 is the target fragment; C, PCR electrophoretic map of colony identification, 1 is DNA marker, 2-4 is positive colony; D, Sequencing results of positive colonies.
2.4 LO2 PORKO、LO2 PORCO、LO2 POROE细胞系的蛋白质印迹鉴定
以野生型LO2细胞为对照,用蛋白质印迹(Western blot, WB)技术鉴定各细胞系中POR蛋白表达情况。GAPDH蛋白大小为36 ku。对于LO2 PORKO细胞,根据2.2节中所得测序结果,整理获得野生型LO2细胞的POR序列及编辑后的序列,使用在线网站(http://www.bio-soft.net/sms/)对序列进行翻译,得到氨基酸序列并比对(图4)。POR靶位点处发生3个碱基的突变(C→T)及后续产生了10个碱基的缺失,导致了POR基因无法正常翻译,自sgRNA靶位点后氨基酸翻译错码,同源性极低,因此LO2 PORKO细胞泳道中未见蛋白条带。pcDNA3.1(+)/myc-His B-POR重组质粒由于其所带myc与6×His标签,经细胞转染后表达的POR蛋白大小为80.4 ku,而内源性POR蛋白大小为77 ku。因此,LO2 PORCO细胞中POR蛋白条带位置略高于野生型LO2细胞,LO2 POROE细胞泳道中则为80.4 ku与77 ku大小的POR蛋白同时存在。
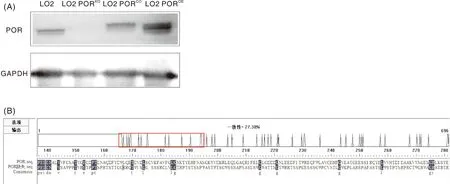
以LO2细胞为对照,WB检测LO2 PORKO、LO2 PORCO及LO2 POROE细胞中POR蛋白表达情况,并对LO2 PORKO细胞中氨基酸序列进行比对分析。With LO2 cells as the control, WB detected the expression of POR protein in LO2 PORKO, LO2 PORCO and LO2 POROE cells, and the amino acid sequences in LO2 PORKO cells were analyzed.
2.5 AFB1染毒LO2细胞后的IC50值
用4 μmol·L-1、8 μmol·L-1、16 μmol·L-1及32 μmol·L-1AFB1分别处理LO2细胞24 h及48 h后,与对照组相比,随着AFB1浓度与作用时间的增加,LO2细胞存活率降低(图5);表明AFB1染毒后会引起LO2细胞死亡,且LO2细胞存活率与AFB1呈染毒浓度及时间依赖关系。
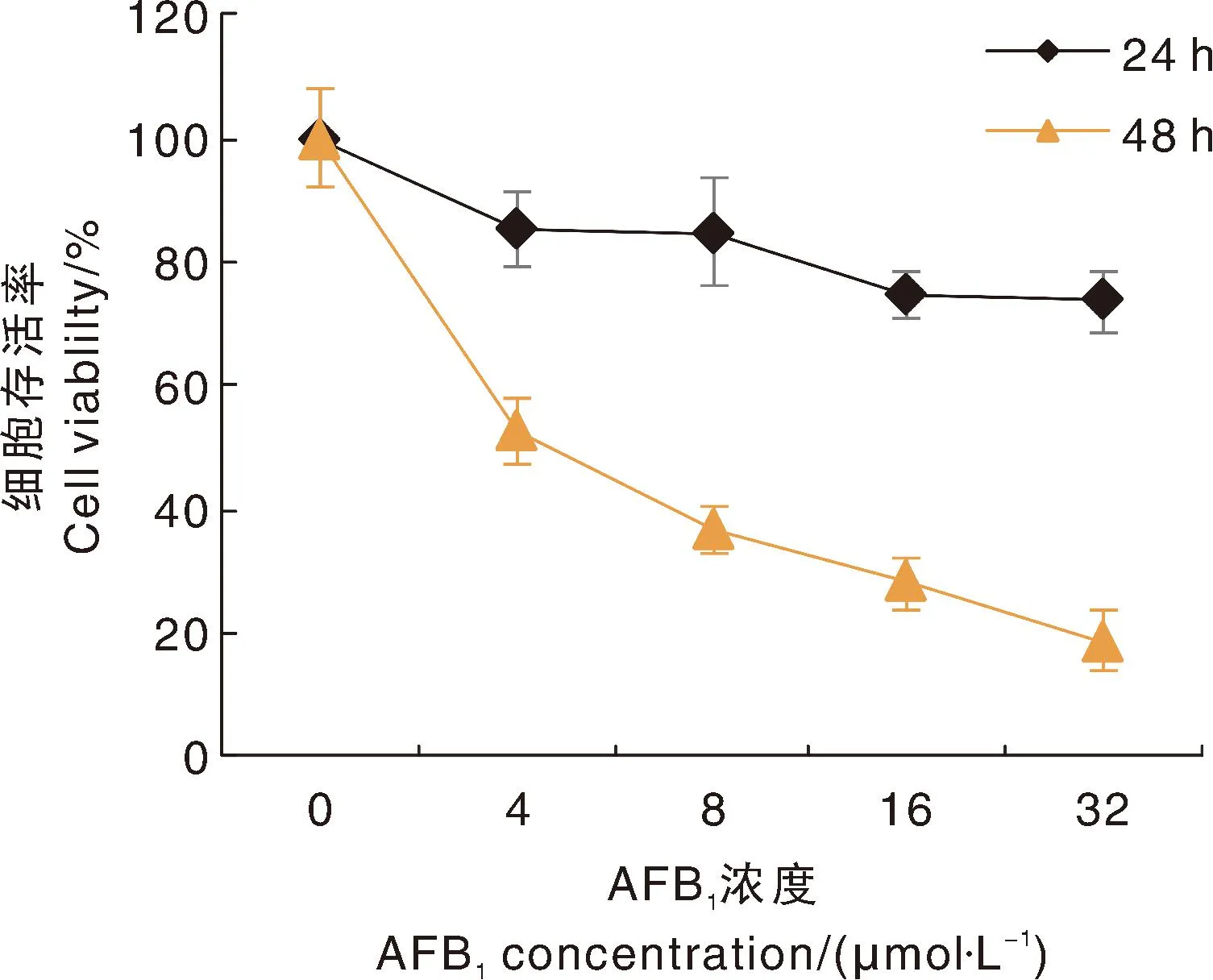
图5 AFB1对野生型LO2细胞剂量效应曲线Fig.5 The toxic dose-effect curve of AFB1on the relative cell viability of wild-type LO2 cell lines
AFB1处理LO2细胞后分析所得IC值见表4。24 h时IC50值为339.97 μmol·L-1;48 h时IC50值为4.28 μmol·L-1。根据试验结果,在综合考虑AFB1对LO2细胞有明显的毒性效应,又保证细胞有一定的存活率且不采用过高的染毒浓度的情况下,后续实验采用48 h时的近似IC50值(4 μmol·L-1)及2倍IC50值(8 μmol·L-1)的AFB1处理细胞48 h。
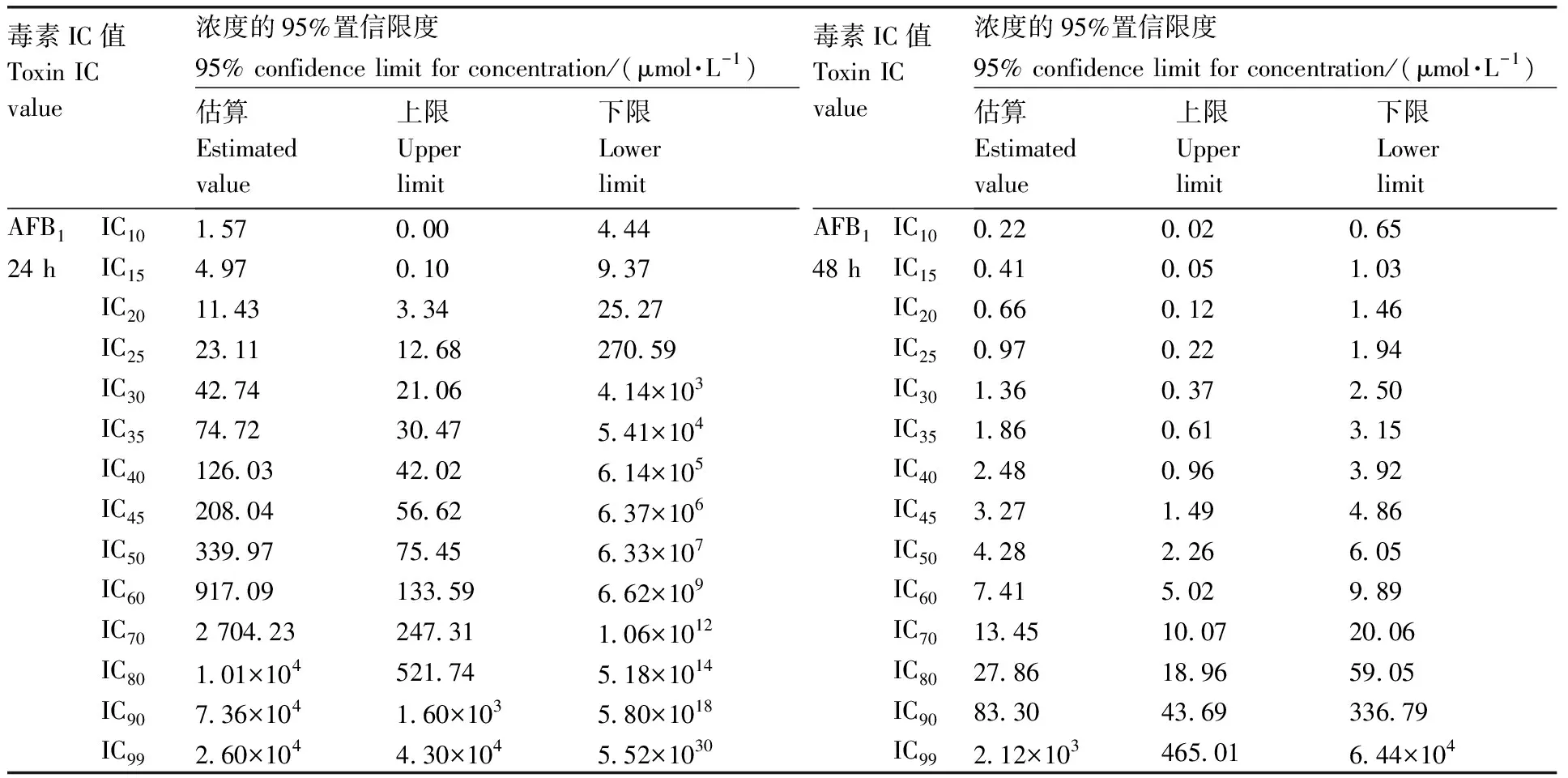
表4 IC值的统计结果
2.6 AFB1处理后的细胞形态
根据2.5节所确定的AFB1染毒浓度与时间,以0 μmol·L-1、4 μmol·L-1及8 μmol·L-1AFB1处理48 h后观察细胞形态。如图6所示,0 μmol·L-1AFB1处理后的野生型LO2细胞形态规则,大小均一,生长正常,只有少量细胞在无血清培养液中死亡后漂浮。而随着AFB1浓度的升高,细胞形态改变,间隙扩大,数量与密度减少,贴壁性减弱;胞间连接逐渐消失变圆、空泡化、脱落等,有大量死亡细胞漂浮,与对照组相比变化明显。LO2 POROE对照组细胞生长状态良好,经AFB1处理后同样出现形态改变、死亡及漂浮现象,贴壁细胞相较于同浓度下的野生型LO2细胞更少。而LO2 PORKO细胞在AFB1处理前后并无明显差别,4 μmol·L-1与8 μmol·L-1AFB1处理组之间也无明显变化。相较于LO2 PORKO细胞,LO2 PORCO在AFB1处理后死亡,呈浓度依赖性;但相比于野生型LO2细胞,同浓度下AFB1处理后的LO2 PORCO细胞死亡数量较少,贴壁细胞更多。结果表明POR基因能够对AFB1在LO2细胞上的毒性产生影响,并再次证明LO2 PORKO、LO2 PORCO、LO2 POROE细胞构建成功。
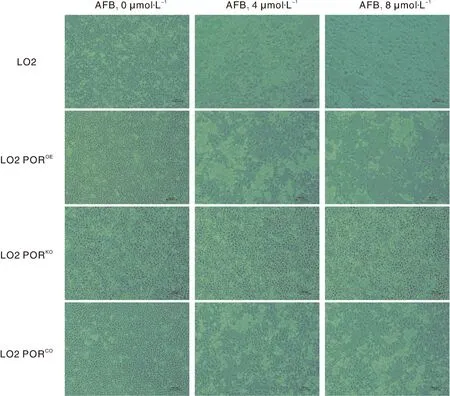
图6 AFB1作用48 h对细胞形态特征的影响(100×)Fig.6 Effect of morphological characteristics on cells after 48 h treated with AFB1under optical microsope (100×)
2.7 细胞存活率
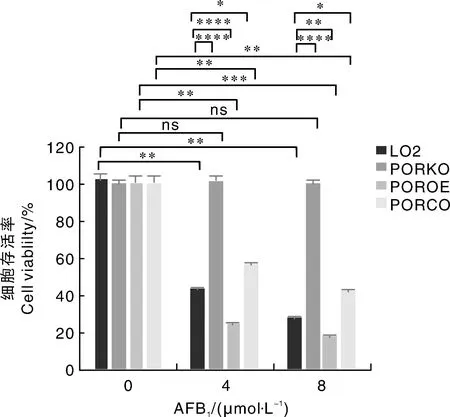
AFB1处理48 h后野生型LO2、LO2 PORKO、LO2 PORCO及LO2 POROE细胞存活率。各浓度下不同细胞株组与各自阴性对照组比较,**,P<0.01;***,P<0.001;ns, P>0.05;各浓度下不同细胞株组与同等浓度AFB1作用下的LO2细胞组相比,*,P<0.05;**,P<0.01;****,P<0.000 1。The cell viability of LO2, LO2 PORKO, LO2 PORCO and POROE cells treated with AFB1for 48 hours. Different cell lines at different concentrations were compared with negative control groups, **, P<0.01; ***, P<0.001; ns, P>0.05. Compared with LO2 cell group under the same concentration of AFB1, *, P<0.05; **, P<0.01; ****, P<0.000 1.
各浓度下不同细胞株组与同等浓度AFB1作用下的LO2细胞组相比:相比于同等浓度AFB1作用下的野生型LO2细胞,LO2 PORKO细胞各浓度组细胞存活率均显著高于野生型LO2细胞染毒组(P<0.000 1)。表明POR基因敲除后,AFB1对LO2细胞毒性作用减弱。而LO2 PORCO细胞存活率变化趋势与野生型LO2细胞相同,但仍显著高于野生型LO2细胞(P<0.05),表明POR基因回补后,LO2细胞经AFB1处理后致死的效应部分恢复。与同等浓度AFB1作用下的野生型LO2细胞相比,LO2 POROE细胞各浓度组细胞存活率均显著降低。表明在LO2细胞中,POR基因确实参与了AFB1的肝细胞毒性效应,且POR的表达量与AFB1对LO2细胞的毒性作用呈正相关关系。
3 讨论
为深入研究POR蛋白功能,近年来已有一些POR基因敲除的动物及细胞模型报道。动物模型中,可能是由于小鼠体内参与生物合成和代谢胆固醇的P450酶缺少电子转移体,POR基因敲除的小鼠在胚胎期即致死,限制了在动物整体水平上对POR功能进行进一步的深入研究[10]。在细胞模型方面,目前已有报道的肝POR基因敲除细胞系包括人肝癌HepG2细胞[11-12]、小鼠肝癌细胞Hepa1c1c7[13]等,为肝脏异生素代谢的研究提供了材料。但常用于研究肝细胞癌代谢与治疗的肝癌细胞系HepG2不仅在基因与蛋白表达方面不同于正常肝细胞系[14-15],在药物及异生素代谢方面也存在相当大的差异[3,16-17]。在肝功能体外细胞研究中,选用正常肝细胞,如人肝细胞LO2比癌细胞株更能模拟体内环境,符合生理特点,能够得到更为准确的数据,但POR基因在LO2细胞上的敲除模型尚未见报道。因此,选择CRISPR/Cas9技术构建POR基因敲除LO2细胞株,对于研究POR在肝细胞中的功能具有重要意义。
目前CRISPR/Cas9技术已在碱基编辑、转录调控和表观遗传编辑、基因组规模筛选等方面得到广泛应用[18-19]。同时,利用CRISPR/Cas9技术能够实现许多应用,包括快速生成细胞和动物模型、功能基因组筛选和细胞基因组的实时成像[20]。如在体内动物模型和体外在体细胞和生殖系统细胞中成功调节致病等位基因,为临床治疗性基因组编辑作出贡献[21]。目前已有许多应用CRISPR/Cas9技术对肝细胞进行基因编辑的研究报道:如耿梦雅等[22]利用CRISPR/Cas9技术敲除人肝脏细胞HL7702的Sidt2基因;Hendriks等[23]描述了在人类胎儿肝细胞中使用CRISPR/Cas9生成基因敲除细胞的方法;Lv等[24]在研究中使用了Nrf2基因敲除的HepG2肝癌细胞株;Lee等[25]利用CRISPR/Cas9下调了Huh7和Hep3B细胞株中的HGF基因。
本实验利用CRISPR/Cas9技术构建敲除POR基因的LO2细胞,参考基因组信息,利用在线工具网站,对POR的15个外显子序列进行sgRNA引物设计打分,选择两个综合排名靠前的序列设计引物并构建慢病毒质粒,并预测无脱靶效应。在嘌呤霉素筛选阳性细胞后直接进行单克隆细胞筛选,后续再进行测序鉴定及蛋白质印迹法验证敲除结果,极大地缩短了实验周期和节省试剂耗材,并且蛋白水平上的变化更能反映POR的敲除效果。lentiCRISPR v2-sgRNA-2质粒经克隆测序及蛋白质印迹法鉴定显示敲除效果较好,该组细胞的DNA与野生型LO2细胞对比,发生了3 bp碱基突变及靶位点后10 bp碱基敲除,导致POR基因无法正常转录,自sgRNA靶位点后氨基酸翻译错码,POR蛋白不能正常表达,POR抗体难以识别。说明sgRNA-2精准靶向了POR基因,在基因及蛋白水平上均实现了POR的成功敲除,成功构建了POR敲除LO2细胞模型。此外,相较于条件敲除小鼠模型,利用CRISPR/Cas9技术构建POR敲除的LO2细胞体外模型,更符合“3R”(减少Reduction、替代Replacement、优化Refinement)原则,且排除了其他哺乳动物与人体的反应差异问题,得到的结果更为科学客观[26]。
在基因敲除的基础上,基因回补在理论上能够恢复由基因敲除带来的表型变化,基因过表达则能正向验证基因的功能,进行某种基因的回补及过表达细胞株的构建,对深入研究该基因的功能至关重要。在成功构建LO2 PORKO细胞株的基础上,通过同源重组法构建pcDNA3.1(+)/myc-His B-POR重组质粒,转染至LO2及LO2 PORKO细胞株中,经G-418筛选及蛋白质印迹法检测POR蛋白表达水平,得到稳定表达POR重组蛋白的LO2 PORCO及LO2 POROE细胞株。pcDNA3.1(+)/myc-His B-POR重组蛋白因pcDNA3.1(+)/myc-His B载体所带myc及6×His等标签,其蛋白大小(80.4 ku)比LO2野生型细胞中POR蛋白(77 ku)大3.4 ku。蛋白质印迹法结果表明,POR蛋白成功回补进LO2 PORKO细胞中,蛋白大小与预期相符合;POR蛋白在LO2细胞中成功过表达,说明LO2 PORCO及LO2 POROE细胞系均构建成功。
AFB1作为被国际癌症研究机构(IARC)列入的Ⅰ类致癌物,与癌细胞的增殖和侵袭密切相关[27]。已有的证据表明,肝脏是AFB1毒性和生物转化的主要场所,AFB1对机体的损伤主要集中在肝脏,可导致肝脏急性或慢性肝细胞损伤[28]。AFB1的毒性作用和致癌作用与其经代谢活化形成活性中间代谢产物AFBO有关,而其在体内代谢活化过程中最主要的代谢酶CYP450s活性的发挥需要POR、NADPH等辅酶为其提供电子,显示出POR对AFB1的细胞毒性作用有十分重要的影响。因此,以AFB1为例,测定AFB1处理后的POR基因敲除、回补及过表达的LO2细胞存活率变化以验证各细胞株的增殖功能,能够为更多致肝毒性相关的毒理研究提供细胞模型。
选取4 μmol·L-1、8 μmol·L-1、16 μmol·L-1及32 μmol·L-1AFB1分别处理LO2细胞24 h及48 h,测定AFB1对LO2细胞的剂量效应关系。结果表明,AFB1对LO2细胞具有明显的毒性效应,且LO2细胞存活率随着AFB1作用浓度与作用时间的增加而降低。这符合Liu等[29]及Zhu等[30]对AFB1在LO2细胞上的毒性研究结果。但不同浓度AFB1作用48 h时细胞存活率变化比24 h时更明显,计算发现24 h时AFB1的IC50值(339.97 μmol·L-1)也远高于AFB1处理48 h时(4.28 μmol·L-1),这与Pauletto等[31]在牛胎肝细胞衍生细胞系 (BFH12)中对AFB1的IC50值测定结果一致,即暴露于浓度不断增加的AFB124 h的细胞表现出较低的死亡率,而处理48 h后BFH12细胞的IC50值为6.34 μmol·L-1。因此,根据IC值测定的结果,选取了AFB1浓度4 μmol·L-1及8 μmol·L-1,作用时间48 h进行后续试验。
细胞形态观察结果发现,LO2细胞经AFB1处理后变形、脱落、死亡并漂浮。LO2 PORKO细胞形态在AFB1染毒前后并未观察到明显变化,初步判定POR基因参与AFB1对LO2细胞的毒性作用,且POR基因与AFB1毒性效应存在正相关关系,随后对LO2 PORCO及LO2 POROE细胞的形态观察结果也表明了这一点。各细胞株AFB1处理后存活率变化与形态观察的结果相符合:野生型LO2细胞存活率随AFB1浓度增加而降低;LO2 PORKO细胞在4 μmol·L-1及8 μmol·L-1AFB1处理后存活率与对照组相比无显著差异(P>0.05);LO2 POROE细胞存活率变化趋势与野生型LO2细胞一致,随AFB1浓度的增加而降低,但其细胞存活率比同浓度下野生型LO2细胞更低,这可能是由于POR蛋白过表达后进一步促进了AFB1对LO2细胞的毒性作用;LO2 PORCO细胞存活率变化趋势也与野生型LO2细胞一致,表明POR基因回补后恢复了基因敲除带来的AFB1对LO2细胞毒性的表型变化,但其存活率仍显著高于野生型LO2细胞(4 μmol·L-1时P<0.000 1,8 μmol·L-1时P<0.01),这可能是因为LO2 PORCO细胞中POR蛋白的回补表达量未达到野生型LO2细胞水平所致,这也显示了POR基因对AFB1所致细胞毒性的影响巨大。
总之,鉴于POR在参与由细胞色素P450蛋白催化的类固醇激素、药物和异生素代谢反应方面的重要作用,LO2 PORKO、LO2 PORCO、LO2 POROE细胞株的成功构建及AFB1对各细胞株的增殖功能验证,有望为POR基因功能及更多致肝毒性风险因素相关研究的开展提供必备的细胞模型。
4 结论
本实验采用CRISPR/Cas9基因编辑技术成功敲除LO2细胞中的POR基因,构建LO2 PORKO细胞株;并通过同源重组方法构建了真核表达质粒pcDNA3.1(+)/myc-His B-POR,经转染筛选后分别建立了LO2 PORCO及LO2 POROE细胞株;最后以AFB1处理各细胞株,通过检测细胞存活率和细胞形态的变化初步验证POR基因在AFB1所致LO2细胞毒性中的影响,为后续LO2 PORKO、LO2 PORCO、LO2 POROE细胞株作为相关毒理研究细胞模型并深入开展POR基因功能的研究提供了相应的生物材料。

