日本沼虾桩蛋白基因的克隆与镉胁迫对其表达的影响
彭佳诚,吴 越,徐洁皓,夏美文,齐天鹏,徐海圣,3,*
(1.浙江大学 动物科学学院,浙江 杭州 310058; 2.浙江万里学院 生物与环境科学学院,浙江 宁波 315100; 3.浙江大学湖州市南太湖现代农业科技推广中心,浙江 湖州 313000)
桩蛋白(paxillin, PXN)是近年来发现的一种信号蛋白,主要位于细胞与胞外基质的黏着斑内,是黏着斑蛋白的结合蛋白[1],广泛参与黏着斑信号和激酶信号的传导,在细胞外信号向细胞内转导过程中起“脚手架”作用[2],调控细胞的存活、增殖、分化和迁移,在器官的发育、损伤和感染后修复过程中有重要作用[3-4]。目前关于镉胁迫下PXN基因的相关研究较少,多聚焦于PXN基因在临床肿瘤与癌症中的作用[5]。
日本沼虾(Macrobrachiumnipponense)又称为青虾、河虾,广泛分布于我国东部和亚洲其他国家的淡水水域中[6],具有个体小、繁殖快、易饲养等特点,是研究水体重金属生物毒理的较优选择。镉(cadmium, Cd)是一种广泛存在于水环境中的生物非必需重金属元素,可在生物体内积累[7],并可通过食物链进行富集[8],引起水生生物的急性或慢性中毒[9],造成畸变甚至死亡,是水环境中的主要污染物之一,已引起全球的关注[10]。研究表明,镉可导致生物体的形态破坏、生化改变和生理功能障碍等,还可引起机体活性氧积累,从而导致生物功能和细胞结构受损[11]。
本文采用分子生物学方法从日本沼虾肝胰腺组织中克隆了桩蛋白基因,并研究了镉胁迫对其表达的影响,研究结果将有助于更好地了解镉污染对日本沼虾的分子毒性作用,为水环境镉污染的生态风险预警和评估提供生物标志物选择的基线信息。
1 材料与方法
1.1 实验动物
日本沼虾购自浙江省杭州市某水产养殖公司,平均体重(1.97±0.72)g,平均体长(5.59±0.57)cm。实验前暂养于配备循环水过滤系统的12 L塑料水桶中,用增氧泵充氧,水温(20.9±0.7)℃,每隔24 h换水。暂养3 d后,随机挑选健康且规格一致的个体备用。
1.2 RNA提取与cDNA合成
解剖后取肝胰腺组织,使用RNAiso Plus试剂盒(TaKaRa Bio, JPN)提取总RNA,使用Nanodrop 2000分光光度计和1.5%的琼脂糖凝胶电泳检测总RNA的纯度和完整性,按照PrimeScriptTMRT-PCR Kit (TaKaRa Bio, JPN) 试剂盒说明书将RNA反转录成cDNA,置于-80 ℃冰箱保存备用。
1.3 MnPXN基因克隆与序列分析
在本实验室创建的日本沼虾肝胰腺转录组中找到相应基因片段,利用Primer 5.0软件分别设计MnPXN基因5′RACE和3′RACE特异性引物(表1),进行5′和3′末端巢式PCR扩增。PCR程序为94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,30个循环。RACE实验所用的试剂盒为RACE试剂盒SMARTer® RACE 5′/3′ Kit(TaKaRa,Cat. No. 634858),以F1/R1的扩增产物作为F2/R2的模板依次进行扩增;使用RACE试剂盒附带的NuceloSpin Gel and PCR Clean-Up Kit试剂盒进行胶纯化。PCR产物利用pMDTM19T Vector Cloning Kit试剂盒连接至pMD19-T载体,转化大肠埃希菌后筛选阳性克隆,送杭州尚亚生物技术有限公司测序。利用生物信息学在线工具分析MnPXN基因,在NCBI上查找开放阅读框,分析蛋白质结构,推导氨基酸序列,利用Clustal-Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)进行氨基酸序列比对,用Mega 5.0软件构建系统进化树。

表1 基因克隆所用引物
1.4 MnPXN的组织表达分析
用加入50%抗凝剂(柠檬酸24.98 mmol·L-1,柠檬酸钠51.15 mmol·L-1,葡萄糖81.59 mmol·L-1,NaCl 20.53 mmol·L-1)的注射器从日本沼虾游泳足基部的血腔处共抽取血淋巴500 μL,4 ℃、4 000 r·min-1离心5 min,弃上清,即为血细胞;再分别取其心脏、肌肉、神经、肠、肝胰腺、胃、鳃等组织,放入液氮中速冻并保存在-80 ℃冰箱中备用。
按照1.2节方法从组织中提取总RNA并反转录成cDNA。根据克隆的MnPXN序列,使用Primer Premier 5.0软件设计qRT-PCR特异性引物(表1)。以β-actin基因为内参基因,使用LightCycler480Ⅱ(Roche,480Ⅱ)进行qRT-PCR,程序设置:95℃ 30 s,95℃ 15 s,60℃ 30 s,共40个循环。每个样品重复检测3次。
1.5 镉胁迫对MnPXN mRNA表达的影响
通过预实验获得氯化镉(99%,URChem,上海)处理日本沼虾24 h和96 h的半致死浓度(LC50)分别为0.242 7 mg·L-1和0.027 7 mg·L-1。随机选取450只健康日本沼虾,平均分为6组,氯化镉质量浓度分别为0.242 7 mg·L-1(24 h-LC50组)、0.121 4 mg·L-1(1/2 24 h-LC50组)、0.061 0 mg·L-1(1/4 24 h-LC50组)、0.030 0 mg·L-1(1/8 24 h-LC50组)、0.015 0 mg·L-1(1/16 24 h-LC50组)和0 mg·L-1(对照组),每组设置3个重复。日本沼虾养殖于配备增氧泵和循环水过滤系统的120 L塑料水箱中,水温(20.9±0.7)℃,暂养3 d,每隔24 h换水。于胁迫24 h后,解剖取肝胰腺。另随机选取150只健康日本沼虾,平均分为2组,实验组加入CdCl2至终浓度为0.020 0 mg·L-1,对照组加入等量清水,每组设置3个重复。分别于0、3、6、12、24、48、72、96 h取样,解剖取肝胰腺。按照1.2节方法从肝胰腺中提取总RNA,并反转录成cDNA。按照1.4节方法进行qRT-PCR实验。
1.6 体内siRNA干扰
根据克隆的MnPXN基因序列,采用Promega公司的RNA干扰试剂盒T7 RiboMAXTMExpress RNAi System合成dsRNA,以绿色荧光蛋白(GFP)基因作为阴性对照。随机选取100只健康日本沼虾,平均分为2组,设置dsRNA-MnPXN注射组为实验组,dsRNA-GPF为对照组,利用100 μL微量注射器将上述基因的dsRNA分别从日本沼虾第四、五腹节肌肉注射至体内,每只注射50 μL。注射48、72 h后,每组分别随机取5尾日本沼虾,取其肝胰腺组织,以β-actin作为内参基因,利用qRT-PCR检测的RNA干扰效率。RNA干扰48 h后,将dsRNA-MnPXN实验组与dsRNA-GFP对照组分别置于含0.020 0 mg·L-1氯化镉的水体中,每隔6 h分别统计对照组与实验组日本沼虾的死亡个体数,计算死亡率。
1.7 数据统计分析
用2-ΔΔCT法计算mRNA的相对表达量,利用Origin8.0软件的one-way analysis of variance(ANOVA)和t-test对所有实验数据进行方差分析,结果表示为平均值±标准误。当P<0.05时认为差异显著(*),P<0.01时认为差异极显著(**),P<0.001时认为差异极显著(***)。
2 结果与分析
2.1 MnPXN基因序列分析
使用RACE技术克隆得到日本沼虾MnPXN的cDNA,其序列全长为3 655 bp(NCBI GenBank, MN728558),包括1 491 bp的编码区,235 bp的5′非编码区,1 885 bp的3′非编码区和44 bp的poly(A)尾。MnPXN基因编码496个氨基酸,蛋白质分子量为54.02 ku,等电点为5.07,N末端无信号肽,具有6个低复杂区域(low complexity)和3个保守的LIM结构域,LIM结构域分别位于第311~362个氨基酸、第370~421个氨基酸和第429~480个氨基酸(图1)。Phyre 2在线软件分析发现,蛋白质的三级结构存在12%的α螺旋结构和15%的β折叠结构。
Clustal-Omega在线比对分析发现,MnPXN与凡纳滨对虾(Litopenaeusvannamei)、家蚕(Bombyxmori)、智人(Homosapiens)、小鼠(Musmusculus)、斑马鱼(Daniorerio)的PXN序列高度保守,其中智人、小鼠、斑马鱼、凡纳滨对虾有4个LIM结构域,而日本沼虾、家蚕只有3个LIM结构域。用neighbor-joining(NJ)法构建了系统进化树,结果显示,MnPXN与甲壳动物(凡纳滨对虾)聚成一支,与昆虫(家蚕、赤拟谷盗)的亲缘关系较近,其次是鱼类(斑马鱼)、鸟类(原鸡)、两栖类(高山倭蛙、非洲爪蟾)、哺乳类(小鼠、智人),与线虫(秀丽隐杆线虫)亲缘关系最远(图2)。
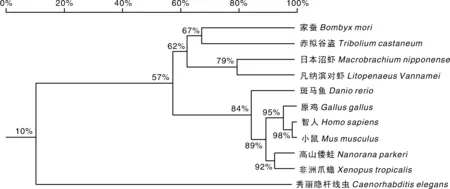
图2 MnPXN与其他物种PXN蛋白的系统进化树Fig.2 Phylogenetic analysis of MnPXN with PXN protein from other species
2.2 MnPXN基因的组织表达特征
qRT-PCR结果显示,MnPXN基因在日本沼虾的心脏、肌肉、神经、肠、血细胞、肝胰腺、胃和鳃8种组织中均有分布,其中在肝胰腺、胃、鳃中表达水平较高,在心脏和肌肉中表达水平较低(图3)。
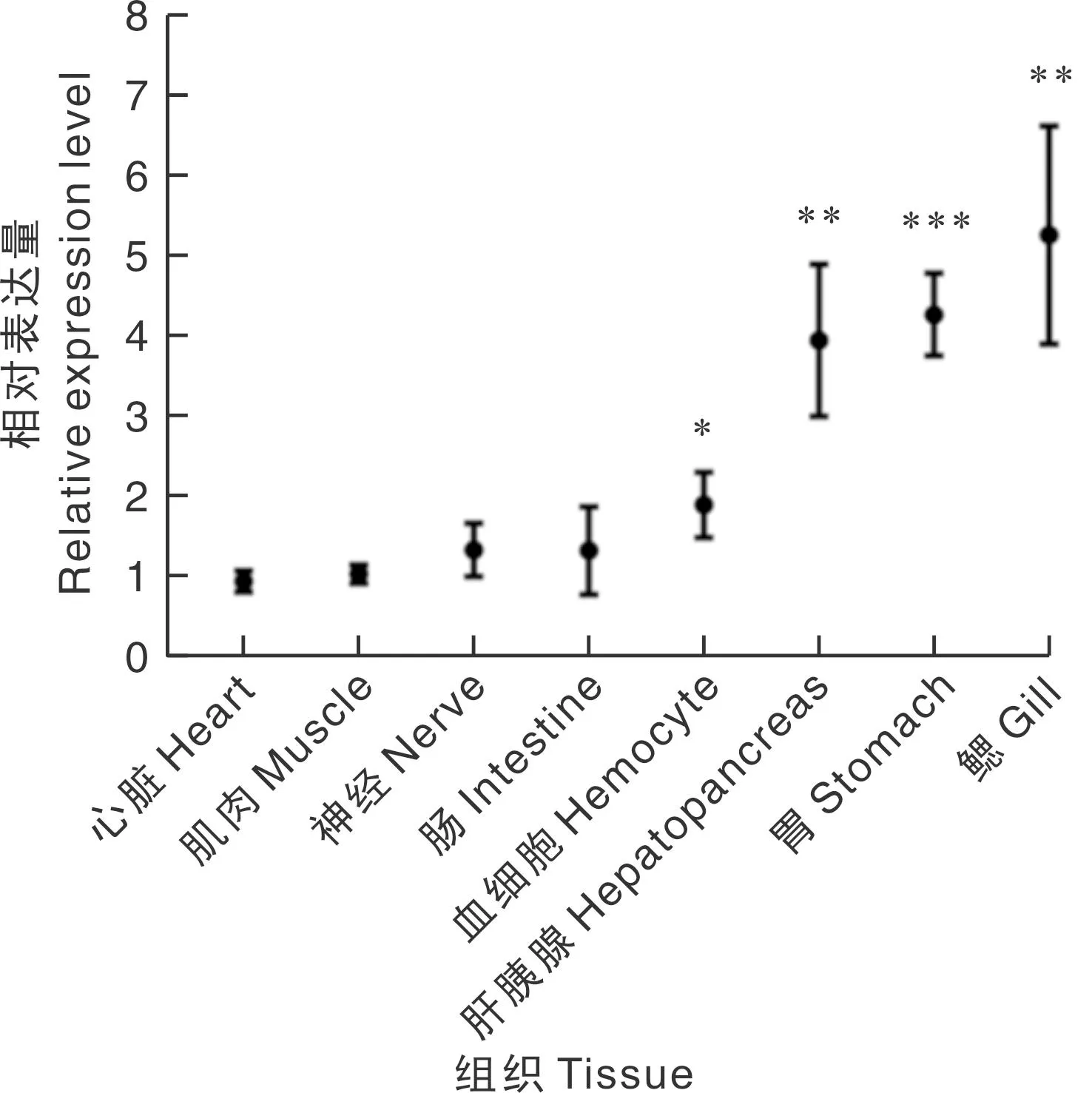
“*”表示表达水平与心脏组相比差异显著(P<0.05);“**”表示差异极显著(P<0.01);“***”表示差异极显著(P<0.001).“*” indicates that the expression level of this group is significantly different from that of the heart group (P<0.05); “**” indicates significant difference at 0.01 level; “***” indicates significant difference at 0.001 level.
2.3 镉胁迫对MnPXN基因表达的影响
分别用0.242 7、0.121 4、0.061 0、0.030 0、0.015 0 mg·L-1CdCl2胁迫日本沼虾24 h后,其肝胰腺中MnPXN基因表达水平较对照组均显著升高,其中0.061 0 mg·L-1CdCl2和0.030 0 mg·L-1CdCl2处理的MnPXN基因表达水平最高,极显著(P<0.001)高于对照组;0.121 4、0.015 0 mg·L-1CdCl2处理的MnPXN基因表达水平次之,也极显著(P<0.01)高于对照组;0.242 7 mg·L-1CdCl2处理的MnPXN基因表达水平显著(P<0.05)高于对照组(图4-A)。
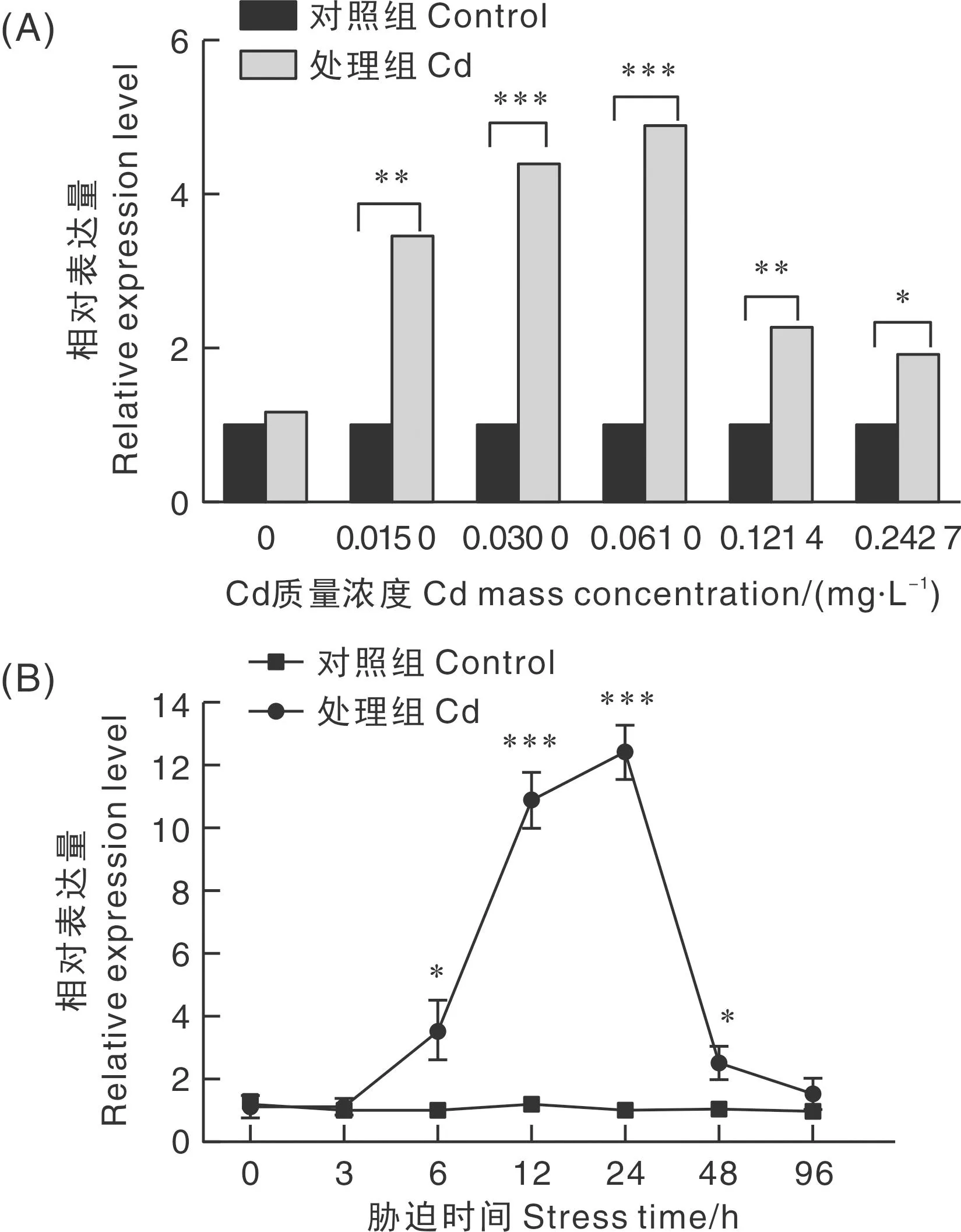
“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);“***”表示差异极显著(P<0.001)。下同。“*” indicates significant difference at 0.05 level; “**” indicates significant difference at 0.01 level; “***” indicates significant difference at 0.001 level. The same as below.
用0.020 0 mg·L-1CdCl2(亚致死浓度)胁迫日本沼虾,胁迫6 h后MnPXN基因表达水平显著升高,24 h表达水平达到最高,极显著(P<0.001)高于对照组,随后逐渐下降,胁迫96 h时,MnPXN基因表达水平与对照组差异不显著(P>0.05)(图4-B)。
2.4 体内RNA干扰
RNAi持续48 h和72 h后,MnPXN基因mRNA表达水平均较GFP显著下降(P<0.05),(图5-A),表明dsRNA对MnPXN基因的干扰是有效的。注射dsRNA-MnPXN实验组日本沼虾的死亡率显著(P<0.001)高于注射dsRNA-GFP组,且于干扰后72 h全部死亡(图5-B)。
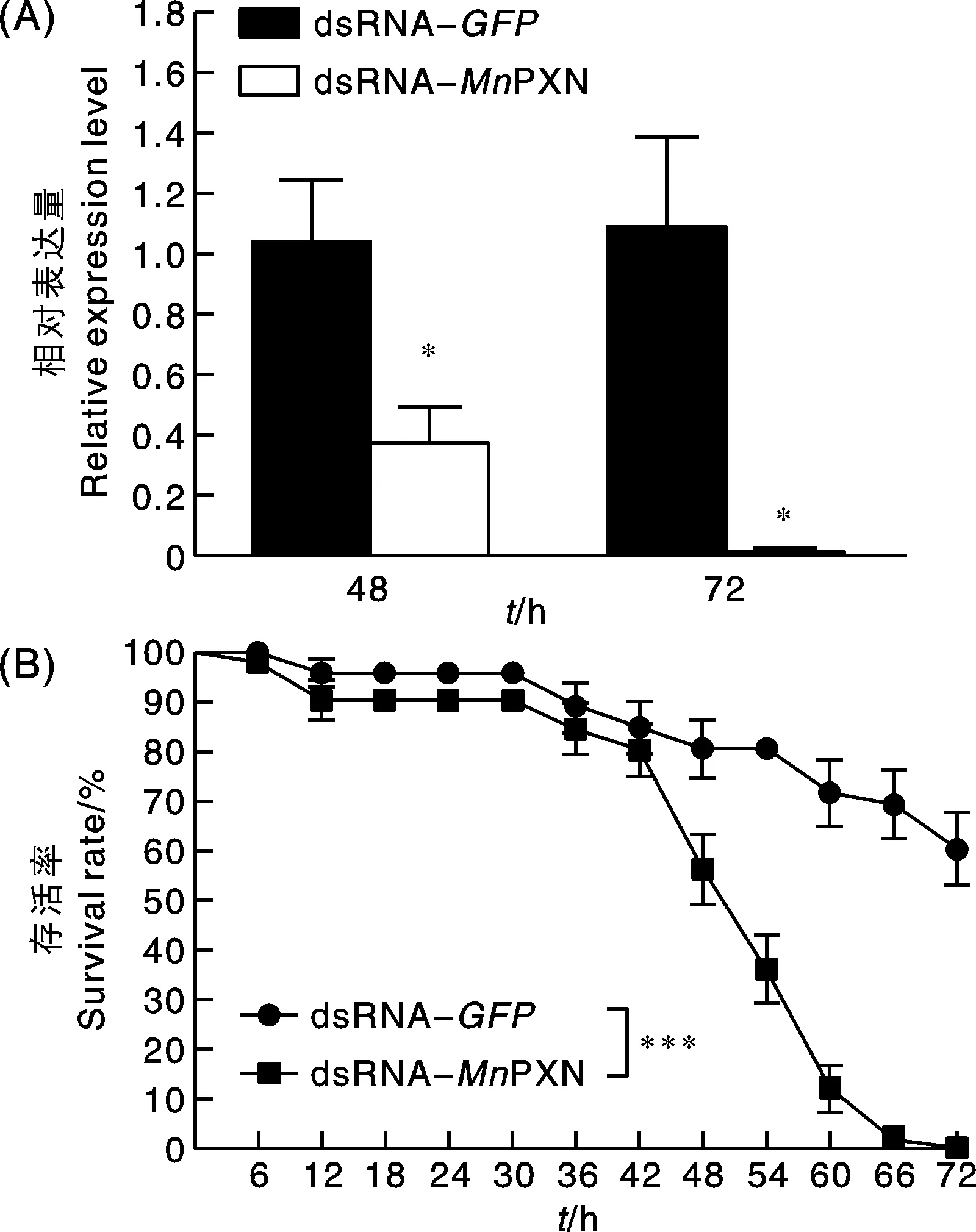
图5 RNA干扰对MnPXN基因表达和日本沼虾存活率的影响Fig.5 Effect of RNA interference on MnPXN gene expression and survival rate of Macrobrachium nipponense
3 讨论
PXN是一种信号转导衔接蛋白,主要位于黏着斑处,参与细胞附着、扩散和迁移所需的黏着斑的组装和拆卸,在整合素与细胞外基质结合后触发的细胞外信号转导到细胞内的反应中起重要作用[1,2]。目前,PXN的同源基因在智人(H.sapiens)、小鼠(M.musculus)、斑马鱼(D.rerio)等物种中被克隆出来[12-14],在一些模式动物如黑腹果蝇(Drosophilamelanogaster)的高通量测序中被报告[15],但在水生甲壳动物中尚未见报道。
本研究中,我们克隆得到了日本沼虾PXN基因(MnPXN)的cDNA序列,其全长为3 655 bp,编码496个氨基酸,蛋白质序列中含有6个低复杂区域和3个保守的LIM结构域。不同物种PXN的LIM结构域数目不同,日本沼虾、家蚕有3个LIM结构域,而智人、小鼠、斑马鱼和凡纳滨对虾含有4个LIM结构域。LIM结构域是高度保守的锌指结合、半胱氨酸富集的基序,含有2个串联的重复锌指,不仅介导桩蛋白定位于黏着斑,而且介导多种蛋白质之间的相互作用[16]。同源性比对及系统进化树结果显示,MnPXN与凡纳滨对虾相似度达到79%,与同为节肢动物门的昆虫如家蚕、赤拟谷盗的同源性为62%,与脊椎动物中的哺乳类、鸟类、两栖类、鱼类的同源性也达到了57%以上,表明PXN蛋白在进化上高度保守,物种之间具有高度同源性。
肝胰腺作为甲壳类体内重要器官,参与体内消化、贮存、分泌促生长物质、解毒与免疫等多种生理功能[17]。0.015 0 mg·L-1CdCl2处理24 h,日本沼虾肝胰腺MnPXN基因转录水平较对照组显著升高,0.061 0~0.242 7 mg·L-1CdCl2处理24 h后MnPXN转录水平呈下降趋势,但均显著高于对照组,表明日本沼虾肝胰腺MnPXN基因能够感知水体低浓度镉离子刺激,而且其响应模式与胁迫时间相关。在亚致死浓度镉胁迫96 h后,肝胰腺中MnPXN的mRNA水平出现先上调后下调的趋势,于6 h开始显著高于对照组,并于24 h达到最高值,96 h恢复至起始水平,与对照组差异不明显,表明在此浓度下胁迫24 hMnPXN响应最强烈,后续的胁迫过程使该组织逐渐适应了一定浓度的镉离子环境。
为更好地理解镉胁迫对MnPXN基因的影响,以GFP基因作为阴性对照,进行了MnPXN基因的RNA干扰实验,结果表明,肌肉注射MnPXN特异双链RNA后,日本沼虾肝胰腺中MnPXN基因表达水平显著降低。MnPXN基因沉默后,用0.020 0 mg·L-1CdCl2胁迫72 h,日本沼虾死亡率达到100%,而GFP对照组死亡率为36%,差异极显著。已有研究表明,镉胁迫可诱导细胞产生活性氧(ROS),过量的ROS导致脂质过氧化等氧化损伤[18]。胁迫下MnPXN基因表达水平呈在低浓度时升高、在高浓度时下降的特点,引起这种现象的原因可能是轻度应激引发刺激或有益的反应[19],而重度应激抑制了基因表达并对组织造成损伤或致使细胞坏死[20]。本实验中,0.015 0 mg·L-1CdCl2胁迫就能引起MnPXN基因表达水平上调,表明MnPXN基因可作为日本沼虾受水体中镉胁迫的敏感生物标志物。

