基于谱效关系的茴香根皮抗肝纤维化有效成分筛选及其机制探讨
王百才,赵 耀,耿若愚,马 冲,刘天华,胡君萍*,杨建华,2*
1新疆医科大学药学院,乌鲁木齐 830017;2新疆医科大学第一附属医院,乌鲁木齐 830011
肝纤维化是诱发肝硬化甚至肝癌的主要原因,约90%的肝癌是在肝纤维化或肝硬化的基础上发展而来,因此肝纤维化的治疗尤为重要[1]。肝纤维化在临床发病率逐年增加,严重危害了人们的生命安全。肝纤维化的主要原因包括慢性肝炎病毒感染、酗酒和非酒精性脂肪性肝炎[2]。肝纤维化的特征是细胞外基质的过度积聚,这是由细胞外基质的合成和沉积增加以及细胞外基质降解减少或不平衡引起的[3]。肝星状细胞激活被认为是肝纤维化的关键环节,它是肝脏中细胞外基质蛋白过量累积的主要原因[4,5]。
茴香根皮是伞形科植物茴香FoeniculumvulgareMill.的干燥根皮,收录在部颁标准维吾尔药分册中,用于治疗湿寒性或黏液质性疾病,如湿寒性各种炎肿,两胁寒痛,腰背酸痛,闭经、闭尿、陈旧性肠梗阻等[6]。护肝布祖热颗粒是民族医药保肝经典方,由芹菜子、芹菜根、菊苣子、菟丝子、菊苣根、茴香根皮、小茴香组成,具有补肝利胆等功效。课题组前期研究发现护肝布祖热颗粒可以保护CCl4诱导的大鼠肝纤维化[7]。麦迪乃·赛福丁等发现民族药茴香根皮具有一定程度的促进肝组织修复并保护肝细胞膜的作用[8]。因此,茴香根皮可能具有抗肝纤维化作用。
药物谱效关系研究是将化学成分与药效研究相结合对有效化学成分进行分析的方法,是在图谱研究的基础上,最大限度地获取有用的化学信息,将谱图与药效结果联系起来,通过线性或非线性数学处理,建立“谱-效”数学模型,从而确定出与药效相关的化合物群[9]。通过对已知成分和未知成分的分析,能最大程度地反映中药复杂混合体系中所含化学成分的种类和含量,进而对中药质量进行整体描述和评价[10]。故本研究采用超高效液相色谱-质谱联用对维药茴香根皮化学成分进行了研究,结合茴香根皮乙醇提取部位、石油醚部位、乙酸乙酯部位、正丁醇部位和水萃余部位对HSC-T6细胞增殖的影响联合UPLC-Orbitrap-MS/MS借助偏最小二乘法及灰色关联分析对茴香根皮化学成分进行筛选,并经体外实验验证茴香根皮有效成分抗肝纤维化的作用及其机制,为民族医药的研究和开发利用提供科学依据。
1 材料与方法
1.1 材料
茴香根皮药材(批号:HXGP-YP-210115)购自安萨尔维吾尔药业有限公司,经新疆医科大学胡君萍教授鉴定为伞形科植物茴香FoeniculumvulgareMill.的干燥根皮。
DMEM高糖培养基(批号2116111,以色列BI公司);PBS缓冲盐溶液(批号2141302,以色列BI公司);胎牛血清(批号2120140,以色列BI公司);FITC偶联Annexin-Ⅴ凋亡检测盒(批号1026022,美国BD公司);0.25%胰酶细胞消化液(批号21089531,北京Labgic Technology公司);MTT试剂(批号EZ7890B104,德国Biofroxx公司);DMSO(批号EZ6789C150,德国Biofroxx公司);Hochest33258染色液(批号20210709,武汉Proteintech公司);大鼠Ⅳ型胶原(Ⅳ-C,批号:202305)、大鼠透明质酸(HA,批号:202305)、大鼠层粘连蛋白(LN,批号:202305)、大鼠Ⅲ型前胶原(PCⅢ,批号:202305)ELISA试剂盒(上海优选生物科技有限公司)。对照品去氢骆驼蓬碱(纯度≥98%,批号H2303001)、二氢辣椒碱(纯度≥98%,批号D2211001)、乙酰香兰素(纯度≥98%,批号V2211001)、芹菜素(纯度≥98%,批号Z30142203)、7-羟基香豆素(纯度≥98%,批号H2211001)、对香豆酸(纯度≥98%,批号H2107001)、异莨菪亭(纯度≥98%,批号E2209001)(四川普西标物科技有限公司);香草醛(纯度≥98%,批号20170520,天津市北联精细化学品开发有限公司)。
1.2 仪器
BDLSRⅡ流式细胞仪(美国BD公司);TS2倒置显微镜(日本Nikon公司);MultiskanGO全波长酶标仪(美国Thermo公司)。
1.3 实验细胞
大鼠肝星状细胞HSC-T6,细胞株(批号CLL-0116)购自武汉普诺赛生命科技有限公司。
1.4 茴香根皮浸膏的制备
称取茴香根皮1 kg,分别用95%乙醇回流提取3次(3、3、2 h),料液比为1∶10,过滤合并滤液,浓缩乙醇提取物(ET),乙醇提取物浸膏得率为11.43%。乙醇提取物用水混悬,依次使用石油醚,乙酸乙酯,正丁醇萃取,合并萃取液蒸干溶剂,分别得到石油醚部位(PP)、乙酸乙酯部位(PE)、正丁醇部位(PB)、水萃余部位(PW),各部位浸膏得率分别为12.02%、3.37%、4.33%、80.28%。
1.5 茴香根皮UPLC-Orbitrap-MS/MS图谱的检测
1.5.1 对照品溶液的制备
精密称取去氢骆驼蓬碱、二氢辣椒碱、乙酰香兰素、芹菜素、7-羟基香豆素、对香豆酸、异莨菪亭、香草醛对照品适量,置于10 mL容量瓶中,用甲醇稀释并定容得到质量浓度为500 ng/mL的对照品溶液。
1.5.2 UPLC-Orbitrap-MS/MS供试品溶液制备
分别取茴香根皮醇提物和萃取物浸膏100 mg加入500 μL甲醇,涡旋30 s,45 Hz匀浆4 min,冰水浴超声1 h,后将样本在4 ℃,12 000 r/min(离心力13 800×g,半径8.6 cm)条件下离心15 min,小心地取上清液用0.22 μm微孔滤膜过滤,即得。
1.5.3 色谱条件
色谱柱为Waters ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×100 mm),流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱0~11 min,15%A→75%A;11~12 min,75%A→98%A;12~14 min,98%A;14~14.1 min,98%A→15%A;14.1~16 min,15%A。柱温30 ℃,流速为0.5 mL/min,进样量:5 μL。
1.5.4 质谱条件
采用电喷雾离子源(ESI),正离子和负离子扫描模式。正离子模式下电喷雾电压为4 000 V,负离子模式下电喷雾电压为-3 800 V,采用Orbitrap Exploris 120 质谱仪与Xcalibur软件结合,基于IDA采集模式获取MS和MS/MS数据。扫描范围为m/z100~1 500,筛选每个采集周期的前四个,进一步获得相应的MS/MS数据,护套气体流速35 arb,辅助气体流速15 arb,离子传输管温度350 ℃,全MS分辨率为60 000,MS/MS分辨率为15 000,NCE模式碰撞能量:16/32/48。
1.6 体外抗肝纤维化活性的测定
1.6.1 细胞培养
将冻存的HSC-T6细胞株复苏,用含10%胎牛血清的完全培养基重悬细胞,接种于培养瓶中,培养条件为37 ℃,细胞培养箱内CO2浓度为5%;观察细胞形态、生长状态,视情况进行换液或传代。
1.6.2 MTT法测定茴香根皮各部位抗肝纤维化活性
将浓度为2×104个/mL的细胞接种至96孔板中,过夜贴壁成长后,加入1 μg/mL的脂多糖100 μL干预24 h,之后加入含茴香根皮醇提物或不同萃取物的完全培养基,使其终浓度为200、400、600、800、1000 mg/mL,每孔200 μL。干预48 h后,每孔加入100 μL MTT溶液,放入培养箱孵育4 h,孵育完毕加入150 μL DMSO溶液,490 nm下检测OD值,并计算细胞存活率。
1.7 茴香根皮抗肝纤维化谱效关系研究
1.7.1 偏最小二乘法筛选活性成分
利用偏最小二乘法分别分析正负离子模式成分峰面积与HSC-T6细胞抑制率之间的关系,细胞抑制率越高,表明体外抗肝纤维化活性越好。将MTT法抑制率数据和正负离子模式检测到的成分峰面积数据输入到软件SIMCA 14.1中进行偏最小二乘法分析得到VIP值和相关系数。VIP值越大,说明该成分对药效的贡献越大,相关系数大于零,表明化学成分与抑制率正相关,反之负相关[11,12]。
1.7.2 灰色关联分析筛选活性成分
分别将正负离子模式茴香根皮化学成分峰面积和MTT抑制率数据导入在线网站SPSSPRO(https://www.spsspro.com/)进行灰色关联分析得到成分关联度和排名,将成分关联度大于0.7的成分纳入筛选范围,关联度越大评价结果越好[13]。
1.8 茴香根皮成分体外抗肝纤维化验证
1.8.1 MTT法测定单体化合物的抗肝纤维化活性
实验分组为正常组(control,Con)、模型组(model,Mod)、阳性药水飞蓟宾组(silybin,Sil)、去氢骆驼蓬碱组(harmine,Har)、二氢辣椒碱组(dihydrocapsaicin,Dih)、异莨菪亭组(isoscopoletin,Iso)等。给药组分别加入浓度为25、50、100、200、400、800 μmol/L的化合物干预48 h,MTT法检测OD值。
1.8.2 划痕实验
先用马克笔在6孔板背面均匀的划出横线。待细胞生长至70%~80%时,使用200 μL的灭菌枪头,按照横线垂直划痕。使用PBS清洗3次,洗去划下的细胞,倒置显微镜下观察并拍照记录。之后分别加入浓度为200 μmol/L的去氢骆驼蓬碱、二氢辣椒碱、异莨菪亭,24 h后在倒置显微镜下观察并拍照记录,实验重复3次。
1.8.3 免疫荧光法检测α-SMA的表达
取HSC-T6细胞6×103个/mL接种于24孔板中,培养过夜,加入1 μg/mL脂多糖500 μL干预24 h。之后分别加入浓度为200 μmol/L的去氢骆驼蓬碱、二氢辣椒碱、异莨菪亭,干预48 h后,无菌PBS清洗,固定液固定,使用TritonX-100室温通透,使用5%羊血清室温封闭,最后加入一抗工作液(1∶100),4 ℃孵育,次日用无菌PBS清洗,滴加二抗工作液,避光孵育,清洗,封片,拍照。
1.8.4 Hochest33258染色检测细胞凋亡形态
给药方法同“1.8.3”,弃去孔板内含药培养基后,无菌PBS清洗,固定液固定15 min,无菌PBS清洗,Hochest33258染色液染色,避光孵育20 min,无菌PBS清洗,拍照。
1.8.5 JC-1检测线粒体膜电位
给药方法同“1.8.3”,干预48 h后,弃去旧培养基,无菌PBS清洗,接着用JC-1染色工作液避光孵育20 min,JC-1染色缓冲液清洗,弃去洗液加入完全培养基,拍照。
1.8.6 Annexin V-FITC/PI法检测细胞凋亡
将浓度为7×104个/mL的肝星状细胞接种于6孔板中,培养过夜,加入1 μg/mL脂多糖1 000 μL干预24 h,分别加入浓度为200 μmol/L的去氢骆驼蓬碱、二氢辣椒碱、异莨菪亭干预48 h后,收集孔内培养基,无菌PBS清洗,收集PBS洗涤液,胰酶消化,无菌PBS清洗,100 μL 1×Binding Buffer重悬细胞。空白组和各给药组分别加入Annexin V-FITC和PI染料,最后加400 μL 1×Binding Buffer,尼龙网过滤,上机检测。
1.8.7 ELISA法检测上清Ⅳ-C、HA、LN和PCⅢ的含量
给药方法同“1.8.3”,收集给药干预过后的细胞上清液3 000 r/min离心10 min,用细胞上清按照试剂盒说明书进行后续步骤。
1.8.8 Western blot检测Bax、Bcl-2、Caspase3蛋白的表达
采用Western blot法研究Bax、Bcl-2、Caspase3的蛋白表达水平。按试剂盒说明书提取细胞蛋白,BCA蛋白定量,金属浴15 min使蛋白变性。取变性蛋白适量,选用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入奶粉孵育2 h洗涤后,加入一抗,4 ℃孵育过夜;TBST洗涤后,加入对应二抗,室温孵育1 h,显影。用ImageJ图像分析软件进行灰度值分析。
1.8.9 统计学方法
使用SPSS 25.0软件对实验数据进行统计,绘图使用Graphpad prism 8软件。组间比较采用One-way ANOVA。P<0.05为差异有统计学意义。
2 结果
2.1 MTT法测定各样品的抗肝纤维化活性
不同浓度(200、400、600、800、1000 mg/L)ET、PP、PE、PB、PW作用于HSC-T6细胞48 h的MTT结果显示:细胞存活率随药物浓度的升高显著降低(见图1)。选用给药浓度为0.8 mg/L时的抑制率进行谱效关系研究,0.8 mg/L时ET、PP、PE、PB、PW抑制率分别为48.47%、11.38%、89.80%、51.13%和7.61%。

图1 茴香根皮不同部位对HSC-T6增殖的影响Fig.1 Effects of different parts of F.vulgare cortex on the proliferation of
2.2 UPLC-Orbitrap-MS/MS图谱的建立
通过UPLC-Orbitrap-MS/MS获得的茴香根皮不同部位总离子色谱图(total ion chromatogram,TIC)(见图2)。根据总离子流图中保留时间、一级质谱提供的准分子离子峰及二级质谱提供的碎片离子信息与对照品比对,并与文献数据进行比较,共识别58个共有峰化合物[14,15],结果见表1。

表1 茴香根皮化合物不同部位峰面积

图2 茴香根皮不同部位总离子流图Fig.2 Total ion chromatograms of different parts of F.vulgare cortex
2.3 偏最小二乘法和灰色关联分析结果
根据偏最小二乘回归分析原理,自变量投影重要性值(VIP)越大表示其对抑制率的解释能力越强。由分析结果(见图3)可知,共有11个成分VIP值大于1,且回归系数均大于0(见表2),说明11个成分与细胞抑制率呈正相关关系。这11个成分在灰色关联度分析中关联度系数均>0.7,分别为二氢辣椒碱、去氢骆驼蓬碱、异莨菪亭、乙酰香兰素、3,4-二甲氧鄰苯二甲酸、对甲氧基肉桂酸乙酯、7-羟基香豆素、1′-乙酰氧丁香酚醋酸酯、4-羟基苯甲酸酯、2-羟基苯乙酮、1,3-二咖啡酰奎宁酸。

表2 茴香根皮化合物VIP值、回归系数和关联度
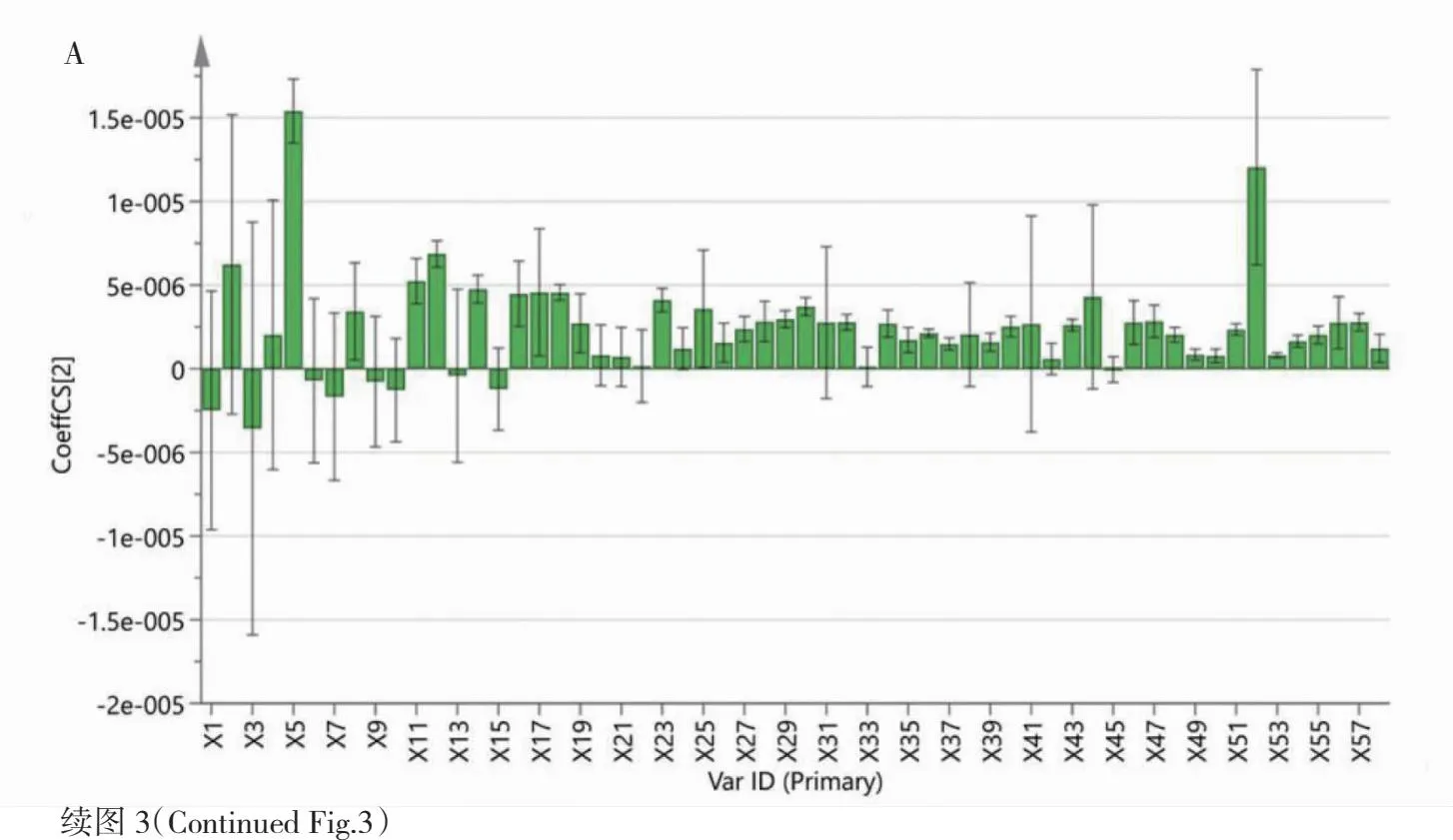
图3 标准化回归系数图、VIP值图Fig.3 Standardized regression coefficient diagram and VIP value diagram.
2.4 MTT法筛选单体化合物体外抗肝纤维化活性验证结果
基于谱效关系及文献报道,本研究对具有潜在活性的化合物包括二氢辣椒碱、乙酰香兰素、异莨菪亭、7-羟基香豆素、1,3-二咖啡酰奎宁酸、去氢骆驼蓬碱等进行了体外抗肝纤维化活性验证,与对照组比较,这些化合物对活化的HSC-T6细胞增殖均具有不同程度的抑制作用(P<0.05、P<0.01、P<0.001),其中二氢辣椒碱、去氢骆驼蓬碱、异莨菪抗肝纤维化活性最强(见图4),故选用这三个化合物进行后续验证实验。

图4 化合物对HSC-T6增殖抑制的影响Fig.4 Effect of compounds on the inhibition of HSC-T6
2.5 单体化合物对HSC-T6细胞迁移的影响
与模型相比,二氢辣椒碱组细胞愈合率没有明显差异,异莨菪亭组和去氢骆驼蓬碱组的细胞划痕愈合率显著降低(P<0.001)(见图5),说明异莨菪亭和去氢骆驼蓬碱显著抑制HSC-T6细胞运动能力。
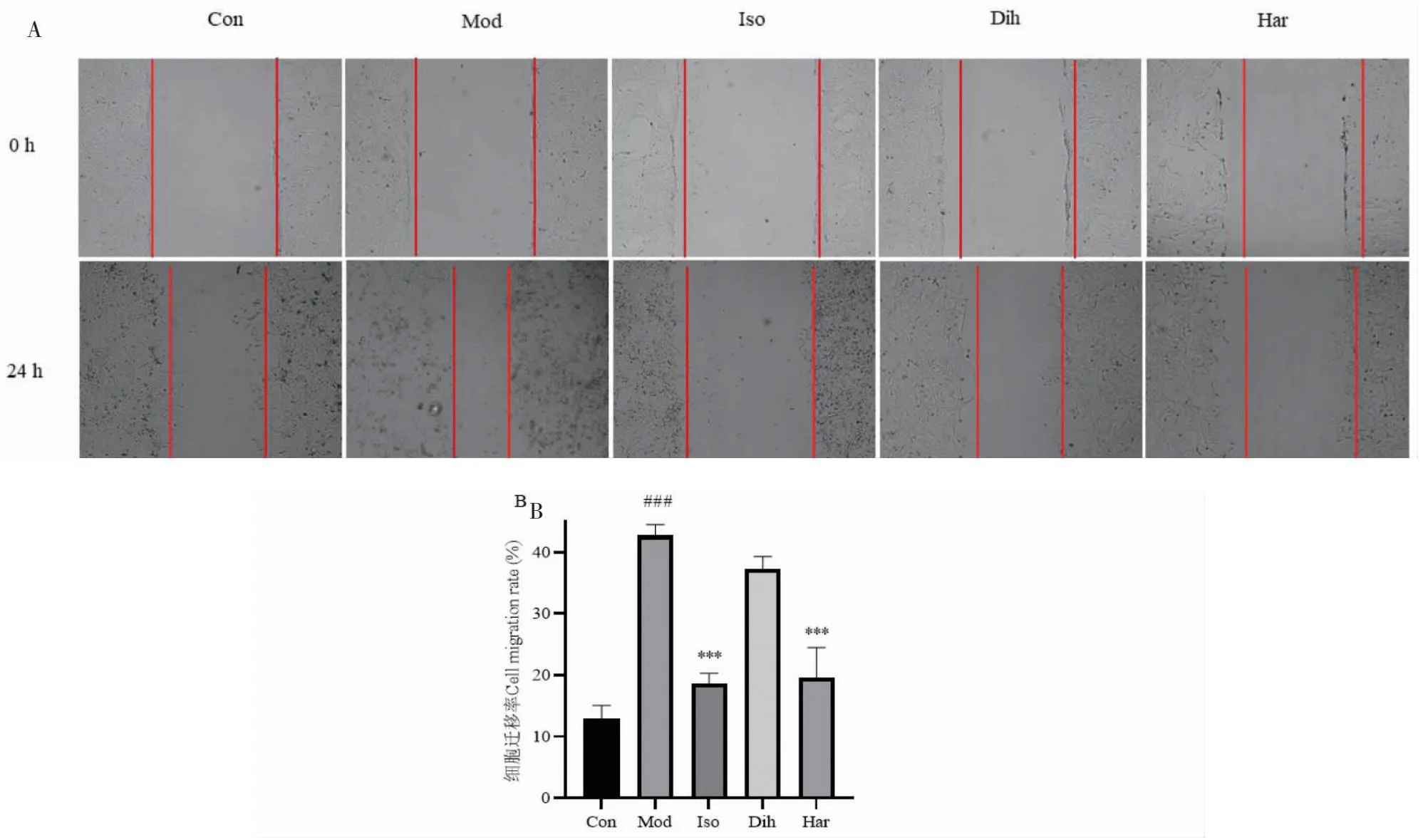
图5 化合物对HSC-T6细胞运动能力的影响Fig.5 Effects of compounds on the motility of HSC-T6
2.6 单体化合物对HSC-T6细胞α-SMA的影响
免疫荧光染色显示,与正常组比较,模型组α-SMA荧光强度明显升高(P<0.001);与模型组比较,二氢辣椒碱组、去氢骆驼蓬碱组、异莨菪亭组α-SMA荧光强度明显降低(P<0.01、P<0.001),差异有统计学意义(见图6)。
2.7 单体化合物对HSC-T6凋亡的影响
细胞凋亡发生时细胞核会发生一系列形态变化,例如核皱缩,染色质凝聚,产生凋亡小体等。利用染料对细胞核染色,如果细胞是存活状态,经过染色后是均匀的蓝色荧光,如果细胞处于凋亡状态,染色后是致密浓染的亮蓝色荧光。本研究采用Hochest33258染色观察HSC-T6细胞核的形态变化(见图7A)。结果发现,与正常组相比,给药组均出现核破裂、皱缩、致密浓染细胞等。

图7 各化合物对HSC-T6细胞凋亡的影响Fig.7 Effects of compounds on the apoptosis of HSC-T6
当细胞处于凋亡状态,细胞内的线粒体膜电位会下降,而且这种改变是比细胞核形态学变化要早,之后会不可逆地进入凋亡过程,因此线粒体膜电位的降低用于判断细胞是否进入凋亡早期阶段。正常线粒体内,JC-1聚集在线粒体基质中形成聚合物,聚合物发出强烈的红色荧光;在化合物诱导线粒体膜电位崩溃时,由于膜电位的下降或丧失,JC-1只能以单体的形式存在于胞浆中,发出绿色荧光。本研究结果发现(见图7B),正常组细胞的红色荧光强度高,绿色荧光几乎不可见,表明正常组细胞线粒体膜电位较高。说明异莨菪亭、二氢辣椒碱和去氢骆驼蓬碱可以导致HSC-T6的线粒体膜电位下降,发生凋亡。
流式细胞术检测结果显示二氢辣椒碱组、去氢骆驼蓬碱组、异莨菪亭组的凋亡率分别为(59.00±3.90)%、(86.87±8.80)%、(37.17±4.71)%。异莨菪亭组与正常组相比,细胞凋亡率升高(P<0.05),二氢辣椒碱组、去氢骆驼蓬碱组与正常组相比细胞凋亡率显著升高(P<0.05、P<0.001),表明二氢辣椒碱、去氢骆驼蓬碱、异莨菪亭可以促进肝星状细胞的凋亡(见图7C)。
2.8 单体化合物对Ⅳ-C、HA、LN和PCⅢ的影响
与正常组相比,模型组HSC-T6细胞上清Ⅳ-C、HA、LN和PCⅢ的含量显著增加(P<0.05);与模型组相比,去氢骆驼蓬碱组Ⅳ-C、HA、LN和PCⅢ的含量均显著降低(P<0.05),二氢辣椒碱组的HA和PCⅢ含量显著降低(P<0.05),异莨菪亭组和水飞蓟宾组HA的含量显著降低(P<0.05)(见图8)。

图8 化合物对HSC-T6细胞上清Ⅳ-C、HA、LN和PCⅢ的影响Fig.8 Effects of compounds on IV-C,HA,LN and PCIII in the supernatant of HSC-T6
2.9 Western blot结果
二氢辣椒碱组和去氢骆驼蓬碱组Bax/Bcl-2相对表达量与模型组相比差异有显著性(P<0.05)。模型组HSC-T6中Caspase3相对表达量高于正常组。二氢辣椒碱组和去氢骆驼蓬碱组Caspase3相对表达量显著高于模型组(P<0.01、P<0.001),异莨菪亭组和水飞蓟宾组Caspase3相对表达水平与模型组相比没有显著性(见图9)。
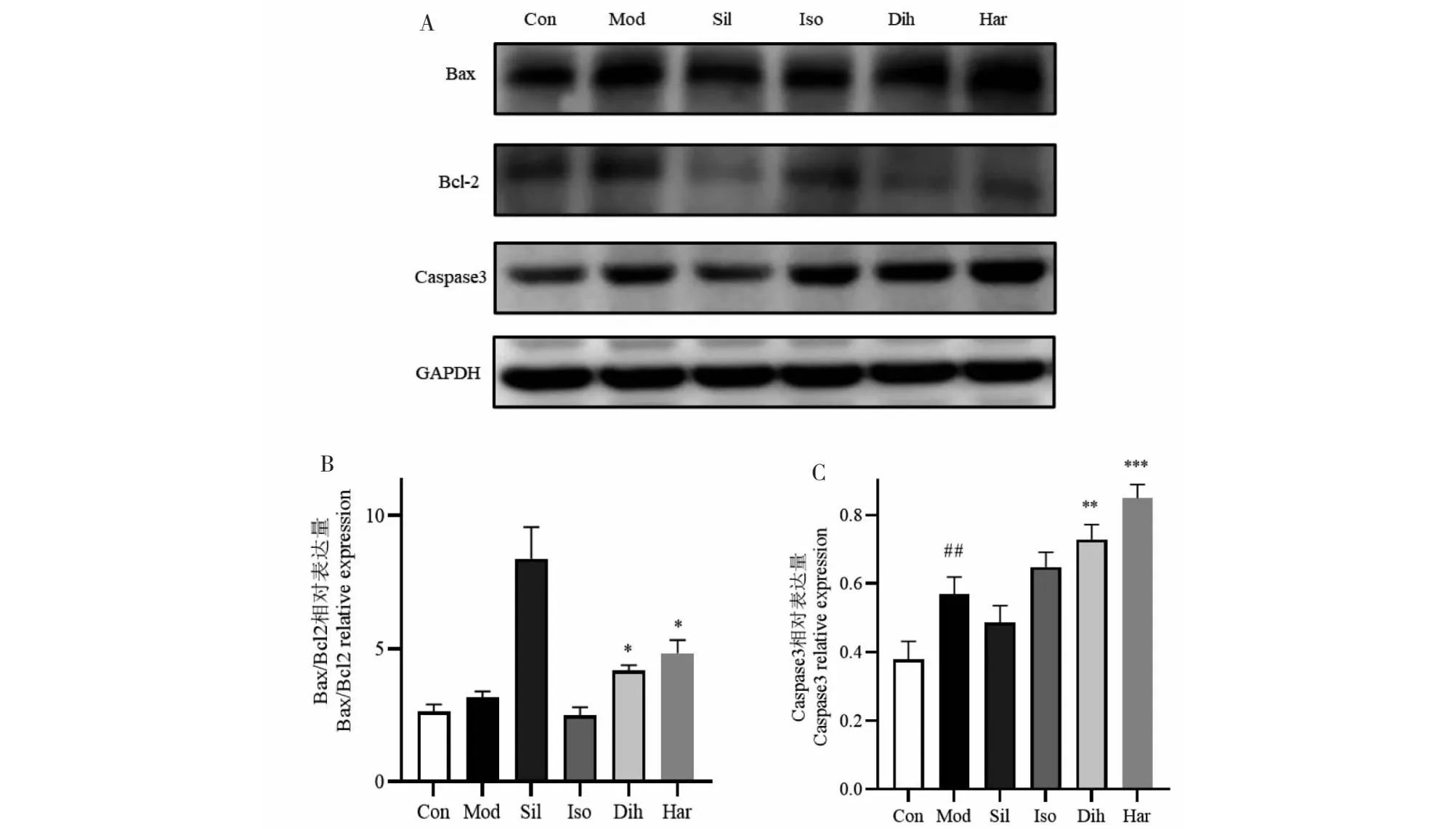
图9 化合物对HSC-T6细胞Bax、Bcl-2、Caspase3的影响Fig.9 Effects of compounds on Bax,Bcl-2 and Caspase3 in HSC-T6
3 讨论与结论
中药多靶点多成分的协同作用已成为中药研究的热点。药效成分研究是药物研究的基础,其活性成分及作用方式均存在复杂性的特点。2002年,李戎提出谱效关系理论,为中药药效研究指明新的研究方向[16]。本研究在茴香根皮醇提取物和不同萃取物UPLC-Orbitrap-MS/MS图谱共有峰与其抗肝纤维化作用数据量化的基础上,采用偏最小二乘法和灰色关联分析对茴香根皮总离子流图谱共有峰与抗肝纤维化作用的大小进行相关性研究,可较大程度反映成分对药效的贡献作用。
本研究以茴香根皮醇提物、石油醚、乙酸乙酯、正丁醇和水部位为研究对象,开展高效液相色谱联用质谱分析,构建茴香根皮液质图谱,正负离子模式共标定了58个共有峰,分析图谱,可见各样品的共有峰面积有差别,可用于谱效关系研究。谱效关系分析有11种成分对抗肝纤维化作用的贡献较大(VIP>1和回归系数>0)。其中,已有文献报道具有抗肝纤维化作用的化合物有没食子酸、芹菜素、山柰酚、秦皮乙素、东莨菪内酯和大黄酸等[17-22],体现了茴香根皮多成分多靶点发挥抗肝纤维化作用的特点。去氢骆驼蓬碱、二氢辣椒碱和异莨菪亭是首次在茴香根皮中发现含量相对较高且具有较好抗肝纤维化活性的化合物,可能为潜在质量标志物。其中去氢骆驼蓬碱可能通过降低肺组织中TGF-β1、Smad3和NF-кB p65的表达改善细粒棘球蚴继发感染引起的小鼠肺组织纤维化[23]。二氢辣椒碱和异莨菪亭抗肝纤维化的研究尚未见报道。
Bcl-2属于抗凋亡基因,是协调细胞生命和死亡的关键因子[24],Bax属于促凋亡基因,是Bcl-2家族的促凋亡蛋白[25]。caspase3作为细胞凋亡的重要效应因子,是细胞凋亡蛋白酶级联反应的必由之路,其被激活预示着凋亡步入不可逆阶段[26]。在凋亡中,Bax/Bcl-2的比值是衡量细胞经线粒体途径凋亡的重要指标,Bax/Bcl-2比值升高时,凋亡增加;反之,凋亡减少。当细胞感受到凋亡信号后,可以通过调控Bcl-2、Bax等凋亡因子的表达而活化半胱氨酸天冬氨酸蛋白酶-9(Caspase9),进而激活Caspase3,引发Caspase家族级联反应,从而诱导细胞凋亡。本研究通过实验证实,去氢骆驼蓬碱、二氢辣椒碱可以降低活化肝星状细胞内线粒体功能并打破线粒体膜电位平衡,使促凋亡因子(Bax)被大量释放,最终导致细胞凋亡,减少肝星状细胞的增殖,抑制细胞外基质和α-平滑肌激动蛋白的表达,从而减轻肝纤维化[27,28]。在后续的实验中,需要对筛选出的单体化合物进行体内实验验证,在mRNA和蛋白水平上进一步研究茴香根皮单体化合物抗肝纤维化的作用机制。
综上所述,本研究通过采用UPLC-Orbitrap-MS/MS技术联合偏最小二乘法和灰色关联分析阐明了茴香根皮的抗肝纤维化的可能成分,体现了茴香根皮多成分多靶点抗肝纤维化的作用特点,对于明确中药药效物质基础研究和中药质量标准的提升具有重要意义,为进一步了解其作用机制和临床应用提供参考依据。