基于炮制前后质量一致性的清半夏炮制新工艺评价
颜雨豪,殷莉丽,黎 智,蒋孟莲,杨转珍,万子玉,赖月月,李 敏
成都中医药大学 药学院/现代中药产业学院 省部共建西南特色中药资源国家重点实验室,成都611137
半夏(Pinellia Rhizoma,PR)为天南星科植物半夏Pinelliaternata(Thunb.) Breit.的干燥块茎,具有燥湿化痰,降逆止呕,消痞散结的功效[1],为临床常用中药之一。清半夏(Pinelliae Rhizoma Praeparatum cum Alumine,PRPA)是半夏经白矾浸泡或煮制所得的炮制饮片,相较生半夏增强了祛寒痰的功效[2]。二者的质量传递关系可概括为:生半夏炮制后,游离有机酸含量增加,总糖、总生物碱及部分核苷、蛋白含量降低[3,4]。而有机酸、核苷中单一成分的变化却少有报道,对半夏、清半夏主要成分的变化规律也缺乏系统性分析。
清半夏的制法较为固定,2015年版《中华人民共和国药典》(以下简称《中国药典》)中的清半夏采用8%白矾溶液浸泡制得,2020年版《中国药典》则在此基础上增加了煮制清半夏。但目前除了白矾浸泡、白矾煮制方法可制作清半夏饮片外,还有公司尝试使用白矾蒸法以改进清半夏饮片的制作流程。
高温蒸制法以工艺可控、省时省工且对毒性药材有较好的减毒效果等优点,作为新兴的炮制工艺而受到青睐[5,6]。据考证,半夏历代炮制方法中尚未见到蒸法的记载[7],目前已有部分学者对半夏蒸法炮制进行了研究。Mo[8]、Li[9]等建立了一种稳定的高压蒸制半夏的炮制工艺;Xiao[10]使用蒸法炮制得到清半夏,相较于浸制清半夏,其总有机酸含量有所增加,草酸钙针晶的含量显著降低,且白矾限量均符合药典标准。但蒸法仍有较多问题还需解答,如蒸法所得清半夏的质量稳定性,蒸法所得清半夏的药效,蒸法所得清半夏与浸、煮清半夏的质量一致性等。
本研究将不同产地的半夏药材分别按浸法、煮法及蒸法炮制为清半夏饮片,使用团队前期建立的含量测定方法,从浸出物、有机酸、多糖、核苷和蛋白等方面分析生半夏与清半夏的质量传递关系,并探究蒸法与浸法、煮法所得清半夏在质量上的一致性,为清半夏的药效机制及解毒机制的进一步研究奠定基础。
1 材料与方法
1.1 仪器与材料
A580型紫外可见分光光度计(翱艺仪器有限公司),1200型高效液相色谱仪(美国安捷伦公司),SpectraMax iD3型酶标仪(美谷分子仪器有限公司),植物总蛋白提取试剂盒(北京酷来搏科技有限公司,批号1401005),总蛋白定量测试盒(南京建成生物工程研究所,批号X12011)。
十二水合硫酸铝钾(白矾,成都金山化学试剂有限公司);草酸、L-苹果酸、枸橼酸、富马酸、次黄嘌呤、腺嘌呤、尿苷、腺苷、肌苷、鸟苷、尿嘧啶(中国食品药品检定研究院,批号分别为101097-201101、190014-201302、111679-200401、111541-201102、140661-201704、110886-201102、110887-201803、110879-201703、140669-201606、111977-201501、100469-201302,纯度均≥98%);胞苷、D-无水葡萄糖、琥珀酸、顺式乌头酸、反式乌头酸(四川维克奇生物科技有限公司,批号分别为wkq19011101、wkq16082202、wkq16081104、wkq-05072、wkq-03269,纯度均≥98%);胸苷(西格玛奥德里奇(上海)贸易有限公司,批号BCBSZ979V,纯度≥99%)。水为超纯水,甲醇、乙腈、磷酸为色谱纯,其余试剂均为分析纯。
半夏药材12批,产自山西、甘肃、贵州等7个省份,经成都中医药大学中药鉴定教研室李敏教授鉴定为天南星科植物半夏Pinelliaternata(Thunb.) Breit.的干燥块茎。药材来源信息见表1。

表1 半夏药材来源信息
1.2 药材加工
半夏、清半夏实验编号见表2。清半夏F01~F12均按2020年版《中国药典》中白矾浸法进行炮制[11]:取净半夏,大小分开,用8%白矾溶液浸泡至内无干心,口尝微有麻舌感,取出,洗净,切厚片,干燥。每100 kg净半夏,用白矾20 kg。清半夏C01~C06按北京市中药饮片炮制规范中的白矾煮法进行炮制:取生半夏,大小分开,浸漂,每日换水2~3次,至起白沫时(约7 d),换水后加白矾(每100 kg净半夏,加白矾8 kg)溶化,再泡7 d,用水洗净,取出置不锈钢锅内,加入剩余的白矾,先用武火,后用文火煮约3 h,至内无白心为度,加入少量水,取出,晾至7成干,再闷约3 d,切薄片,阴干。每100 kg净半夏,用白矾12.5 kg。清半夏E07~E12按饮片公司提供的清半夏炮制试验方法进行炮制:取净半夏,大小分开,以8%白矾溶液浸泡半夏,每天翻动半夏1~2次,浸泡至内无干心后取出,蒸制2~3 h,以内无白心为度,取出,略收水后切片,低温干燥。每100 kg净半夏,用白矾20 kg。计算各法所得清半夏饮片得率,采用SPSS 22.0软件对结果进行单因素方差分析。

表2 半夏及对应清半夏样品信息
1.3 浸出物测定
按照2020年版《中国药典》四部通则2201项下水溶性浸出物测定法冷浸法进行测定。采用SPSS 22.0软件对结果进行单因素方差分析。
1.4 有机酸含量测定
参考课题组前期建立的方法,采用高效液相色谱法(HPLC)同时测定半夏中草酸、L-苹果酸、枸橼酸、琥珀酸、富马酸、顺式乌头酸、反式乌头酸等7种有机酸的含量[12]。采用SPSS 22.0软件对结果进行单因素方差分析。
1.5 多糖含量测定
以D-无水葡萄糖作为标准对照品,参考蒽酮-硫酸法测定生半夏和炮制品总多糖的含量[13]。采用SPSS 22.0软件对结果进行单因素方差分析。
1.6 核苷类成分含量测定
参考课题组前期建立的HPLC方法,同时测定半夏中胞苷、腺嘌呤、尿嘧啶、次黄嘌呤、尿苷、腺苷、鸟苷、肌苷、胸苷9种核苷的含量[14]。采用SPSS 22.0软件对结果进行单因素方差分析。
1.7 蛋白质的测定
参考植物总蛋白提取试剂盒说明书提取半夏总蛋白,使用BCA微板法蛋白质定量测定试剂盒测定半夏蛋白含量。采用SPSS 22.0软件对结果进行单因素方差分析。
1.8 半夏炮制前后质量指标综合比较
综合上述质量相关检测指标,取各制法的均值,使用Origin 2022软件对结果进行统计。使用SPSS 22.0软件对测得数据进行Z-score标准化,再使用SIMCA 14.1软件进行正交偏最小二乘判别分析(OPLS-DA),建立各指标与样品类别之间的关系模型。此外,使用了Origin 2022软件对生半夏的质量指标进行Pearson相关性分析。
1.9 三种炮制品的主成分分析
使用SPSS 22.0软件进行主成分分析,因指标原数值的量级差异大,故对数据进行Z-score标准化处理后,以浸出物(ZX1)、6种有机酸(ZX2~ZX7)、多糖(ZX8)、9种核苷(ZX9~ZX17)以及蛋白(ZX18)的含量标准值为变量,对炮制后的半夏进行主成分分析,其中琥珀酸因无法检出,故舍去该指标。巴特利特球形度检验得到显著性为P<0.001,证明数据适用于主成分分析。
1.10 三种炮制品安全性指标检测
按照2020年版《中国药典》一部清半夏项下白矾限量检测方法进行测定。采用SPSS 22.0软件对结果进行单因素方差分析。
2 结果与分析
2.1 不同方法清半夏饮片得率
统计结果见表3,三种炮制方法均较稳定,其内部差异较小。浸法、蒸法、煮法的饮片得率依次为74.01%、70.76%、63.28%,浸法得率显著高于其他方法,但与蒸法得率差距较小,煮法得率最低。

表3 清半夏饮片得率
究其原因,根据清半夏外观(见图1)可将其分为浸制清半夏和蒸、煮制清半夏两类,这两类炮制品的质地分别为粉性、角质。粉性清半夏在切片时更易保持完整,而角质清半夏更易破碎,这与各方法的得率相对应。半夏中含有大量淀粉,据药典描述,浸、煮制清半夏的主要差异为煮制中含有糊化淀粉粒,故推测蒸制中同样含有糊化淀粉粒[15],而角质化可能与淀粉粒的糊化相关。本研究所用煮法的高温制备时间较蒸法长,可能导致其炮制品的角质化现象更为明显,致使其得率最低。

图1 半夏及三种炮制品饮片图Fig.1 Decoction pieces of PR and three processed products graphs
2.2 炮制前后浸出物的变化
半夏经浸、煮法炮制为清半夏后,浸出物呈下降趋势,其中煮法浸出物损失略高于浸法,但蒸法却不减反增。统计结果显示,半夏药材和浸制、煮制、蒸制清半夏的浸出物平均值分别为12.28%、10.35%、9.89%、40.02%。浸出物变化率见表4,同一组生半夏,经浸法或煮法炮制为清半夏后,其浸出物较生品分别降低了24.10%和28.28%,但生品、浸法、煮法浸出物无显著差异。另一组半夏分别采用浸法和蒸法炮制,浸法浸出物较生品降低了10.68%,而蒸法却增加了264.76%,与其他制法均呈显著差异(P<0.01)。同时,由变异系数可知,蒸法较浸法、煮法相对更为稳定。
表4 浸出物变化率
因半夏、清半夏均为检测水溶性浸出物,故其含量变化可能与炮制过程有直接联系。本研究所用煮法与浸法比较,浸泡时间更长,浸出物损失量也更多。而蒸法与浸法的差异在于浸泡结束后的蒸制步骤,水蒸气的高温可破坏药材细胞结构,有助于内含物的提取,从而使浸出物含量增加。
2.3 炮制前后有机酸含量的变化
有机酸测定结果见表5、表6,HPLC图谱见图2。半夏炮制后草酸含量均显著提高(P<0.05),其余有机酸含量大幅降低,且检出率也随之降低,其中琥珀酸均未检出。浸制、煮制、蒸制炮制品的草酸含量均值增加了0.501 7%、0.537 8%、0.807 3%,其总酸含量均值分别增加了0.267 0%、0.237 0%、0.573 6%,草酸占总酸的比例也从8.53%提高至88.36%左右。由此可知,经三种方法炮制过后,草酸以外的有机酸含量减少,而草酸含量大幅上升,使总酸含量随之增加。
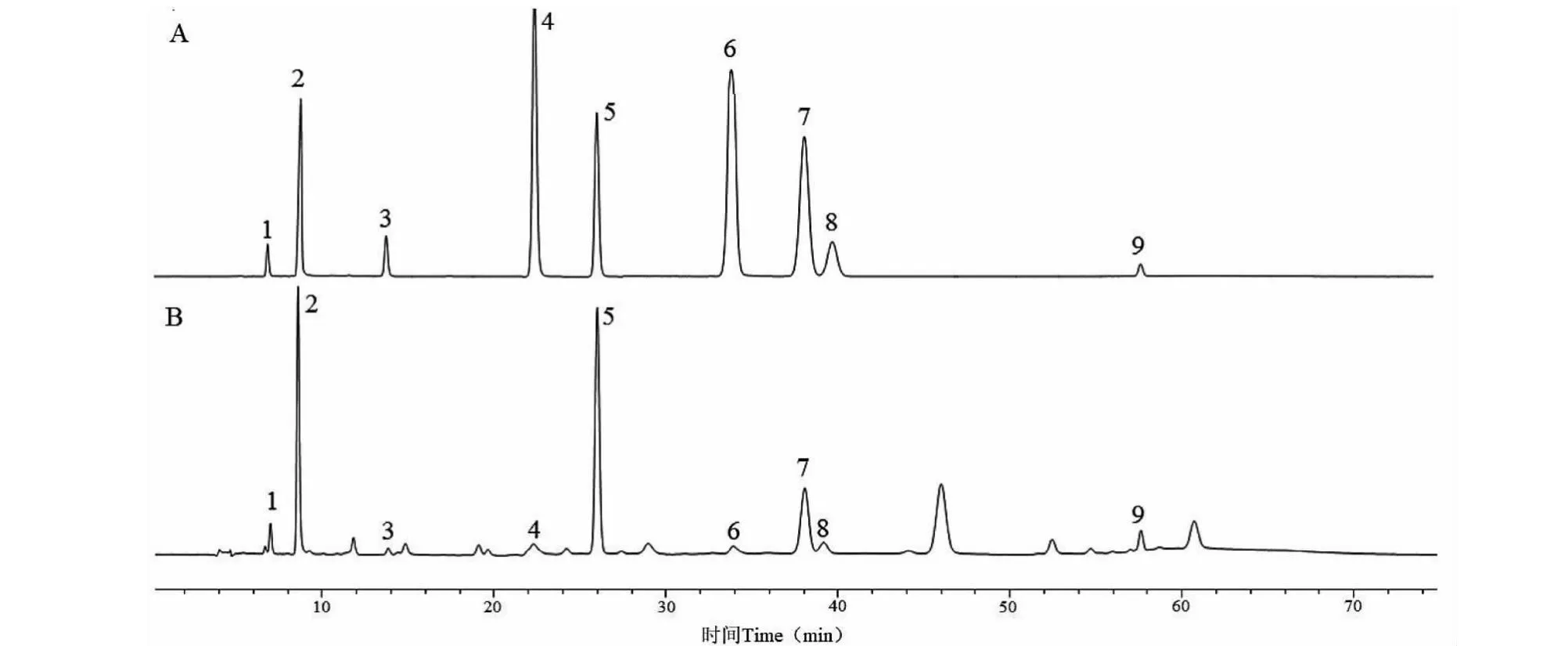
图2 混合对照品与样品的有机酸HPLC图谱Fig.2 HPLC chromatogram of organic acids in mixed control and sample
表5 七种有机酸平均含量

表6 不同炮制品的有机酸含量变化率
比较不同炮制方法可知,蒸法炮制后草酸和总有机酸含量均显著高于浸法及煮法(P<0.01),其含量变化率也更为稳定。尽管浸、煮法的总酸含量差异无统计学意义,但煮法对草酸以外的有机酸损失更大,其含量变化率也更不稳定。
2.4 炮制前后多糖含量的变化
统计结果显示,半夏药材和浸制、煮制、蒸制炮制品的多糖平均含量分别为16.93%、33.54%、33.48%、56.79%。多糖含量变化率见表7,同一组生半夏,经浸制、煮制法炮制为清半夏后,其多糖含量均显著提高(P<0.05);另一组半夏经浸制、蒸制法炮制后,多糖含量较生品分别提高了128.83%和327.52%。可见不论何种炮制方法,均会导致多糖含量增加。

表7 多糖含量变化率
有学者认为多糖因在炮制过程中引入物料而增加[3],但并未深入探究,明矾如何使多糖含量增加尚无定论。据文献报道,多糖类成分在高温或酸性条件下可由高聚物降解为低分子量多糖[18],如海参硫酸多糖[19]、地锦草多糖[20]等均有相关研究,这提示了炮制过后多糖含量上升的原因:白矾溶液常温下呈酸性,pH值在3.0~3.5左右,且炮制过程中有高温处理步骤,以上因素均可促使半夏中高分子量多糖水解为更多的低分子多糖。如半夏中存在着大量的淀粉粒,在酸性条件下可发生水解,生成较小的糖类分子[21],淀粉分子结构遭到破坏,使部分直链淀粉溶出[15]。基于硫酸-蒽酮法的原理,与蒽酮反应的分子越多,该法测定得出的多糖含量也就越多。Zhang[22]等研究结果发现,半夏炮制为清半夏后,其还原糖含量大幅增加,这也提示增加的总多糖可能与半夏淀粉等多糖类成分降解相关,并且溶出多糖的增多亦可能是浸出物增加的一个原因。
比较不同炮制方法可知,浸法与煮法的多糖含量差异无统计学意义,而蒸法明显高于二者(P<0.05)。统计各批次炮制后的含量变化率,由其变异系数可知,蒸法较浸法、煮法相对更为稳定。
2.5 炮制前后核苷类成分含量的变化
核苷测定结果见表8、表9,HPLC图谱见图3。半夏经炮制后,除蒸制炮制品的次黄嘌呤、鸟苷外,其余核苷含量均明显降低(P<0.05)。核苷类成分为具有广泛生理活性的一类水溶性成分,在炮制过程中易流失,还可能因炮制过程中加入白矾等辅料使糖苷键断裂而分解[3],该结论与本研究结果也较为一致。然而次黄嘌呤、鸟苷的含量较低,对蒸法所得炮制品的核苷总量影响小,故三种炮制品的核苷总量差异仍无统计学意义,但蒸法的含量变化率相较之下更为稳定。
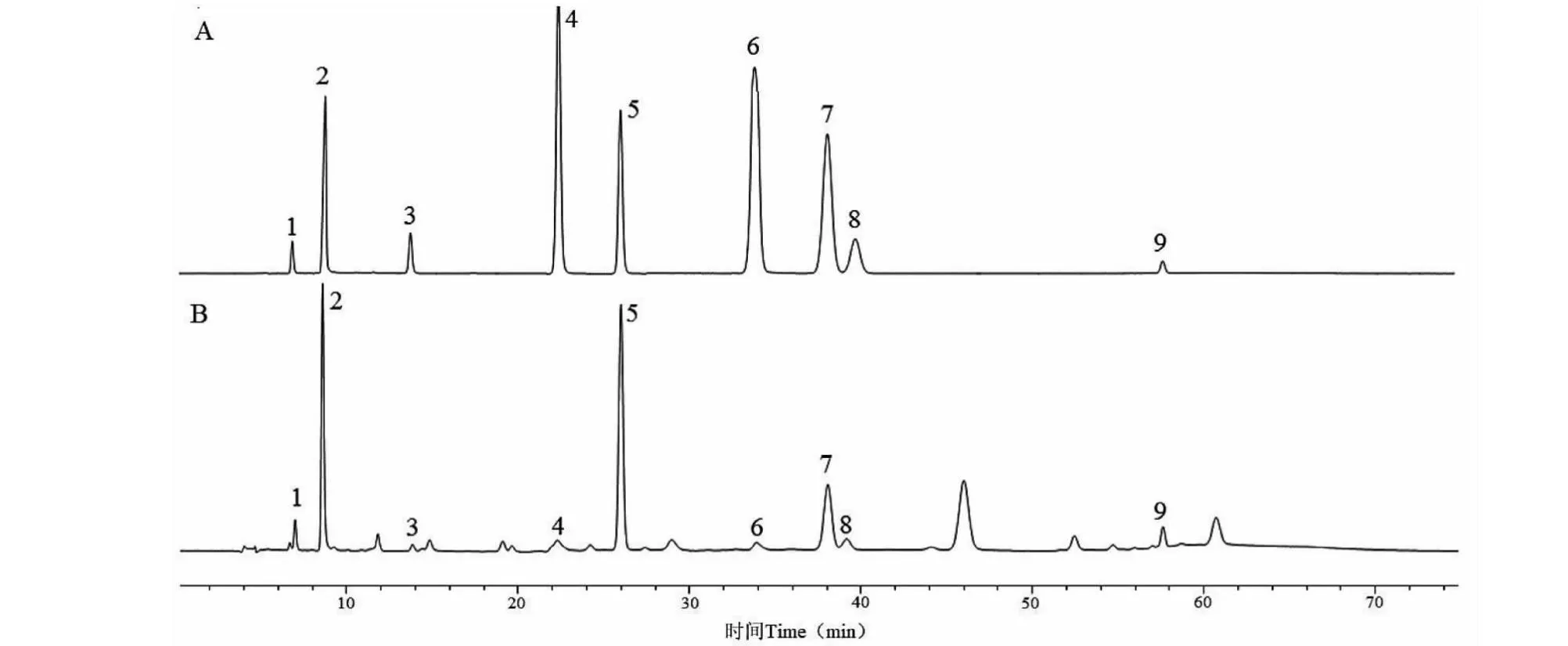
图3 混合对照品与样品的核苷HPLC图谱Fig.3 HPLC chromatograms of nucleosides in mixed control and sample
表8 九种核苷平均含量

表9 不同炮制品的核苷含量变化率
2.6 炮制前后蛋白含量的变化
统计结果显示,半夏药材和浸制、煮制、蒸制炮制品的蛋白质平均含量分别为69.68%、23.87%、8.72%、18.89%。蛋白含量变化率见表10,由表可知半夏炮制后蛋白质发生降解,总蛋白含量显著降低(P<0.01)。炮制过程中的高温及白矾溶液因素,为蛋白发生变性与水解的主要原因[23]。

表10 蛋白质含量变化率
比较同组不同制法的蛋白含量,可知煮法相较于浸法,蛋白的损失更大,而蒸法介于二者之间,与浸制、煮制法的含量差异无统计学意义。由变化率可知,浸、蒸法的含量变化率更为稳定,煮法的变化率波动更大。
2.7 炮制前后质量指标综合比较
由图4可知,半夏炮制过后内在质量成分的含量呈增加趋势,其中蒸制清半夏在浸出物和多糖含量上增长最为显著,而核苷含量尽管下降,因其自身含量过低,相较之下变化幅度可忽略。
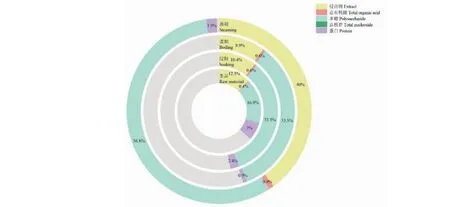
图4 半夏炮制前后各成分含量均值比较Fig.4 Comparison of the mean component contents before and after PR processing
OPLS-DA分析结果见图5,该模型将样品分成生半夏、蒸制清半夏、浸制和煮制清半夏三类。生半夏来自多个产地,其内部差异较大,且与炮制品有着明显的差异。浸制清半夏与煮制清半夏的质量一致性较好,但其组内差异相对较大。而半夏在蒸制过后与其余炮制品存在较大差异,其内部差异较浸制法更小,但在浸出物、多糖等含量较高的成分方面,其变化量的绝对数值仍远高于其他炮制方法。
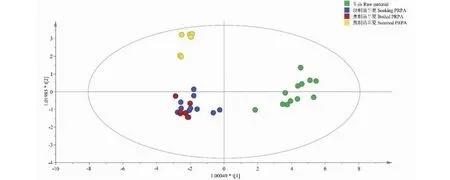
图5 半夏炮制前后OPLS-DA分析结果Fig.5 OPLS-DA analysis results before and after processing of PR
相关性结果如图6所示,颜色越深,相关性越大。可知浸出物与有机酸中占比最高的枸橼酸、L-苹果酸以及蛋白呈显著正相关,但与2015版《中国药典》中半夏的含量指标琥珀酸呈显著负相关;有机酸类成分中,草酸、反式乌头酸与其他有机酸多呈正相关;含量最高的多糖与大部分成分均呈负相关,但并不显著;核苷类成分与有机酸相关性较高,其中尿苷、肌苷与枸橼酸、草酸均有较高的相关性,核苷类成分之间的相关性也较强,其中腺嘌呤与多数核苷呈负相关。

图6 生半夏成分相关性Fig.6 Correlation of raw PR components
2.8 三种炮制品的主成分分析
主成分分析结果显示,可从18个变量中提取5个主成分,成分矩阵及方差百分比见表11。得到的5个主成分的累计方差百分比为83.003%,涵盖了原数据绝大部分的内容。第一主成分中胞苷、枸橼酸、尿苷的正向影响最大,第二主成分中次黄嘌呤、浸出物的正面影响最大,第三主成分中尿嘧啶、顺式乌头酸的正面影响最大,第四、第五主成分中正向影响最大的分别为尿嘧啶以及富马酸,随后根据表11中各载荷值计算主成分得分。首先计算主成分系数,主成分系数=主成分载荷值/各主成分对应特征值开平方根,代入表中数值,再将主成分系数与指标标准值相乘,得到如下公式:

表11 清半夏质量指标主成分分析
Y1=0.175*ZX1+0.171*ZX2+0.175*ZX3+0.358*ZX4+0.08*ZX5+0.229*ZX6+0.288*ZX7+0.067*ZX8+0.361*ZX9+0.328*ZX10-0.11*ZX11-0.01*ZX12+0.357*ZX13+0.007*ZX14+0.177*ZX15+0.085*ZX16+0.347*ZX17+0.314*ZX18
Y2=0.395*ZX1+0.312*ZX2-0.099*ZX3-0.043*ZX4-0.152*ZX5-0.238*ZX6-0.18*ZX7-0.345*ZX8+0.119*ZX9-0.094*ZX10-0.1*ZX11+0.422*ZX12-0.027*ZX13+0.047*ZX14+0.367*ZX15-0.349*ZX16+0.093*ZX17-0.157*ZX18
Y3=-0.027*ZX1-0.046*ZX2-0.286*ZX3+0.02*ZX4+0.213*ZX5+0.323*ZX6+0.343*ZX7-0.104*ZX8+0.002*ZX9-0.243*ZX10+0.406*ZX11+0.243*ZX12+0.097*ZX13-0.519*ZX14-0.085*ZX15-0.260*ZX16-0.031*ZX17-0.02*ZX18
Y4=0.01*ZX1-0.373*ZX2-0.344*ZX3-0.094*ZX4-0.212*ZX5-0.098*ZX6-0.164*ZX7+0.086*ZX8+0.229*ZX9-0.096*ZX10+0.397*ZX11+0.181*ZX12+0.307*ZX13+0.278*ZX14-0.086*ZX15+0.338*ZX16+0.022*ZX17+0.314*ZX18
Y5=0.055*ZX1-0.1*ZX2-0.421*ZX3+0.21*ZX4+0.687*ZX5-0.059*ZX6-0.067*ZX7+0.396*ZX8-0.066*ZX9+0.014*ZX10-0.142*ZX11-0.09*ZX12-0.041*ZX13+0.243*ZX14+0.044*ZX15+0.063*ZX16-0.159*ZX17-0.078*ZX18
以5个主成分的方差百分比为权重,计算主成分综合得分:Y=0.330 94*Y1+0.225 95*Y2+0.119 63*Y3+0.085 21*Y4+0.068 45*Y5。依据主成分综合得分对炮制品进行排名,见表12。由表可知,3种炮制品基于炮制过后各成分含量高低的总体排名为蒸制>浸制>煮制。

表12 清半夏综合得分与排名
2.9 三种炮制品安全性指标检测
统计结果见表13,浸制、煮制、蒸制清半夏的白矾限量均值分别7.04、9.54、7.82%,浸法白矾限量显著低于煮、蒸法,而煮法的白矾限量则显著高于蒸法,偶有超过药典规定的10%限量。
表13 清半夏白矾限量
浸法与蒸法的差异在于蒸法增加了蒸制步骤,即蒸制步骤会导致白矾残留少量提升,推测蒸制可促进半夏吸收其表面残留的白矾,但通过蒸制前清洗应可减少其影响。煮法的白矾残留相对较高,推测与长时间接触白矾溶液有关。故蒸制炮制品在安全性方面并无较大隐患。
3 讨论与结论
本研究从质量成分的传递出发,比较了3种清半夏炮制方法的差异,并评价了蒸法这一炮制新工艺。基于上述质量传递的影响因素探究,使蒸法有别于浸法、煮法的关键步骤应为蒸制,蒸制步骤的高温以及不直接接触水体,直接导致了浸出物、草酸、多糖的保留、增加。综合所有检测指标及多种分析方法,可见蒸制法对内在质量的影响使炮制品与传统清半夏产生显著差异,其炮制品能否被称为“清半夏”有待商榷。
但是,半夏、清半夏的质量指标成分至今没有确定,2020版《中国药典》仅以浸出物作为质量检测指标。与浸出物含量呈正相关的枸橼酸、L-苹果酸、腺嘌呤等成分,在主成分分析中也基本为第一、第二主成分的重要正向成分。这一结果提示了枸橼酸、L-苹果酸、腺嘌呤等成分应用于评价生半夏质量的可能,同时,按当前建立的质量评价方法,蒸法较浸、煮法炮制品所展现的质量更优。而且,通过饮片得率、白矾限量,分别从生产效率、安全性进行比较,蒸法较煮法均有较大优势。
浸法与煮法炮制的饮片质量传递一致性较好,与蒸法炮制的饮片质量存在较大差异,但当前尚未见三种炮制方法所得炮制品在临床效果上的比较。煮法在地方中药饮片炮制规范(如北京市、内蒙古、吉林、河南等地)及1963年版中国药典中均有收载[7],但蒸法报道较少,且并未被收入药典或地方标准中。根据本研究结果,蒸法在其成分含量和稳定性上具有可取之处,其能否作为一种正规炮制方式进行收载还有待进一步深入研究。
蒸法因高温可用于缩短炮制的时间,且在本研究中表现出含量变化率更为稳定的趋势,在节省用时用工方面有巨大潜力。下一步可进一步优化蒸法工艺:能否缩短浸泡时间,利用高温蒸汽同步达成透心的效果。此外,蒸法炮制品的内在含量与传统工艺有差异,可基于其差异成分,与传统清半夏炮制品比较药理作用、临床疗效,由此探究清半夏的药效机制,为阐明炮制的科学性提供依据。