基于HPLC指纹图谱结合化学模式识别以及多指标成分定量评价前胡药材质量
谢 景,秦 优,唐雪阳,沈冰冰,王勇庆,陈 林,张水寒*
1湖南省中医药研究院中药资源研究所,长沙 410013;2湖南中医药大学药学院,长沙 410208
前胡药材来源于伞形科植物白花前胡PeucedanumpraeruptorumDunn的干燥根,始载于《名医别录》,具有疏散风热、降气化痰的功效,常用于痰热咳喘、咯痰黄稠、风热咳嗽痰多等症[1]。在现代化学成分和临床应用上,前胡活性成分主要为角型吡喃香豆素,包括白花前胡甲素、白花前胡乙素、白花前胡丁素等,具有祛痰平喘、抗心衰、降血压、抗炎等药理作用[2,3]。自古以来,前胡药材以野生资源为主,分布于安徽、湖南、江西、浙江、江苏等地。近年来,因资源需求激增,人工种植逐渐代替野生,其栽培主产区主要为安徽宁国、湖南华容、贵州遵义、重庆奉节等地[4]。白花前胡实现人工种植后,各产地纷纷引种种植,种植区域东至浙江,西至云南、四川,但因产地环境千差万别,前胡药材质量存在较大差异,品质良莠不齐[3]。此外,加上人工种植白花前胡容易发生早薹等[5,6]问题,迫使前胡药材提前采收,生长年限不足致使药材不合格率大幅上升。2020版《中国药典》规定“白花前胡甲素不得少于0.90%,白花前胡乙素不得少于0.24%”,但市场上前胡药材质量达标率仅26%,不合格前胡药材充斥市场[7]。前胡药材质量保障除了培育高品质新品种、形成适宜种植技术、规范产地初加工外,客观、科学、合理的质量评价方法及标准也是其重要内容。目前,前胡药材质量评价关键在于白花前胡甲素、乙素含量高低,但这往往不能从整体评价前胡药材的内在品质,直接影响了中医临床应用。
HPLC指纹图谱能较全面反映药材内在质量,是共识度较高的质控手段,结合多指标含量测定,现已成为中药材质量控制的主流[8,9]。聚类分析(hierarchical clustering analysis,HCA)、主成分分析(principal component analysis,PCA)等非监督方法和偏最小二乘法(partial least squares method,PLS)、人工神经网络等有监督的化学模式方法能够较好反映药材内在质量,是近年来运用较多的新方法[10]。本研究基于前期基础[11,12],新建HPLC指纹图谱,并结合聚类分析、主成分分析、偏最小二乘回归分析法等化学模式方法对不同产地前胡药材进行综合评价;同时,定量测定佛手柑内酯、白花前胡甲素、白花前胡乙素、白花前胡素E四个香豆素类成分含量,明确不同产地前胡药材的成分差异特征,为前胡药材质量标准制定提供参考。
1 仪器与试药
1.1 仪器
1200型HPLC高效液相色谱仪(美国Agilent公司);AL204型万分之一电子天平(梅特勒-托利多仪器(上海)有限公司);XPE105 型百万分之一电子分析天平(梅特勒-托利多仪器(上海)有限公司);Agilent SB-C18色谱柱(4.6 mm × 250 mm,5 μm)。
1.2 试剂
佛手苷内酯(bergapten)(批号:CHB201127)、白花前胡香豆精Ⅱ(peucedanocoumarin Ⅱ)(批号:CHB210205)、白花前胡甲素(praeruptorin A)(批号:CHB210115)、白花前胡乙素(praeruptorin B)(批号:CHB201101)、白花前胡素E(praeruptorin E)(批号:CHB201211)对照品(质量分数均大于98.0%,成都克洛玛生物科技有限公司);甲醇(色谱纯,安徽天地高纯溶剂有限公司,批号:MS1922-801);纯净水(华润怡宝市售纯净水,批号:20221208);其余试剂均为分析纯。
1.3 药材
前胡药材总共有16批次,主要来自于湖南、贵州、重庆、安徽、湖北、云南等地,除市售样品外,其余均为产地采集。所有样品经湖南省中医药研究院刘浩副研究员鉴定为伞形科前胡属白花前胡PeucedanumpraeruptorumDunn的干燥根,具体信息见表1。

表1 前胡药材信息表
2 方法与结果
2.1 溶液的制备
2.1.1 供试品溶液
取样品粉末(过四号筛)约1.0 g,精密称定,置于50 mL锥形瓶中,加入纯甲醇25 mL,称定质量,超声提取1 h,取出,放冷,称定质量,加甲醇补足减失的质量,摇匀,滤过,取续滤液,过微孔滤膜(0.22 μm),即得。
2.1.2 混合对照品溶液
精密称定佛手柑内酯、白花前胡甲素、白花前胡乙素、白花前胡素E对照品适量,加入纯甲醇,溶解,配制成含白花前胡甲素1.838 mg/mL、白花前胡乙素0.432 mg/mL、佛手柑内酯0.012 mg/mL、白花前胡素E 0.616 mg/mL的混合对照品溶液。
2.1.3 空白对照溶液
取提取溶剂甲醇溶液,制备成空白对照溶液。
2.2 色谱条件
采用Agilent SB-C18(4.6 mm × 250 mm,5 μm)色谱柱,以甲醇(A)-0.5%甲酸水(B)为流动相,梯度洗脱(0~35 min,30%→75%A;35~55 min,75%→78%A;55~70 min,78%→83%A;70 ~85 min,83%→100%A),流速0.5 mL/min,检测波长321 nm,柱温30 ℃,进样体积10 μL。
2.3 指纹图谱方法学考察
2.3.1 精密度试验
取样品粉末(过四号筛)1 g,精密称定,按照供试品溶液的制备方法,在“2.2”项色谱条件下连续进样6次,记录色谱图。以15号峰(白花前胡甲素)为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间和相对峰面积的RSD分别为0.011%~0.033%、0.050%~1.8%,均小于3.0%,表明仪器精密度良好。
2.3.2 重复性试验
取样品粉末(过四号筛)1 g,精密称定,按照供试品溶液的制备方法平行制备六份,在2.2项色谱条件下分别进样,记录色谱图。以15号峰(白花前胡甲素)为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间和相对峰面积的RSD分别为0.036%~0.16%、0.56%~2.6%,均小于3.0%,表明本方法的重复性良好。
2.3.3 稳定性试验
取样品粉末(过四号筛)1 g,精密称定,在2.2项色谱条件下分别在0、4、8、12、16、24 h进样6次,记录色谱图。以15号峰(白花前胡甲素)为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间和相对峰面积的RSD分别为0.040%~0.28%、0.070%~1.4%,均小于3.0%,表明供试品溶液在24 h内稳定性良好。
2.4 指纹图谱建立及相似度评价
将16批前胡药材按“2.1.1”项方法制备供试品溶液,在“2.2”项色谱条件下依次进行测定,得到HPLC色谱图。采用国家药典委员会《中药色谱指纹图谱相似度评价系统(2012版)》进行分析,以S5的色谱图为参照图谱,采用中位数法,经多点校正、自动匹配后进行色谱峰匹配,生成样品叠加指纹图谱(S1~S16)(见图1)和对照图谱(见图2)。以对照指纹图谱为参照,进行各样品图谱的相似度评价,并采用对照品、二级质谱碎片信息以及数据库比对等进行色谱峰指认,结果见表2。结果表明,16批前胡样品共标定21个共有峰,共指认9个成分,分别为7号峰(佛手苷内酯)、13号峰(hyuganin D)、14号峰(白花前胡香豆精Ⅱ)、15号峰(白花前胡甲素)、16号峰(白花前胡香豆精 I)、17号峰(前胡香豆素J)、19号峰(白花前胡乙素)、20号峰(白花前胡素E)、21号峰(cis-3′,4′-diisovalerylkhellactone)。16批样品相似度在0.966~0.999,各样品图谱与对照指纹图谱的相似度为0.989~0.999,相似度评价结果见图3,这表明不同产地间前胡药材具有较高的相似性。然而,21个共有峰的峰面积RSD为23.9%~120.1%,说明各产地间成分含量相差较大。

图1 16批前胡HPLC指纹图谱Fig.1 HPLC fingerprint of 16 batches of Peucedani Radix

图2 前胡对照指纹图谱Fig.2 Reference fingerprint of Peucedani Radix
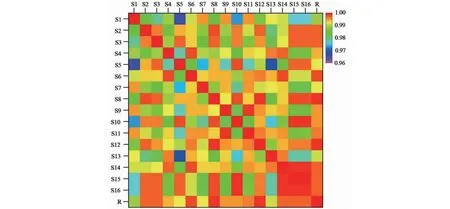
图3 16批前胡指纹图谱相似度热图Fig.3 Heat map of fingerprint similarity from 16 batches of Peucedani Radix

表2 白花前胡指纹图谱共有峰指认
2.5 化学模式识别
2.5.1 HCA分析
采用多元统计分析软件SIMCA 14.1对将16批次前胡样品的21个共有峰的相对峰面积进行HCA分析,聚类树状图见图4。16批样品聚为三类:S1~S3、S5~S6、S8、S10、S12聚为一类,产地为湖南华容、永州,湖北恩施,重庆奉节,贵州遵义、大方(产地一类);S4、S7、S9、S11、S13~S14聚为一类,产地为安徽亳州、宁国、宣城(产地二类);S15、S16聚为一类,产地为云南(产地三类)。

图4 16批前胡HCA聚类分析图Fig.4 HCA analysis of 16 batches of Peucedani Radix
2.5.2 PCA分析
采用SPSS 25.0软件对16批样品21个共有峰进行PCA分析,将共有峰标准化处理后,计算方差贡献率。以特征值>1.0为标准,提取出6个主成分,方差贡献率依次为26.674%、18.599%、14.772%、11.785%、9.161%、5.222%,累计贡献率为86.213%,可代表21个共有峰的主要信息(见表3)。主成分因子载荷矩阵见表4可知,第一主成分主要代表了峰19、18、20、11、21,第二主成分主要代表了峰15、13,第三主成分主要代表了峰17、6,第四主成分主要代表了4、5,第五主成分主要代表了峰3、10,第六主成分主要代表了峰16。

表3 主成分特征值及方差贡献率

表4 主成分因子载荷矩阵
2.5.3 PLS-DA分析
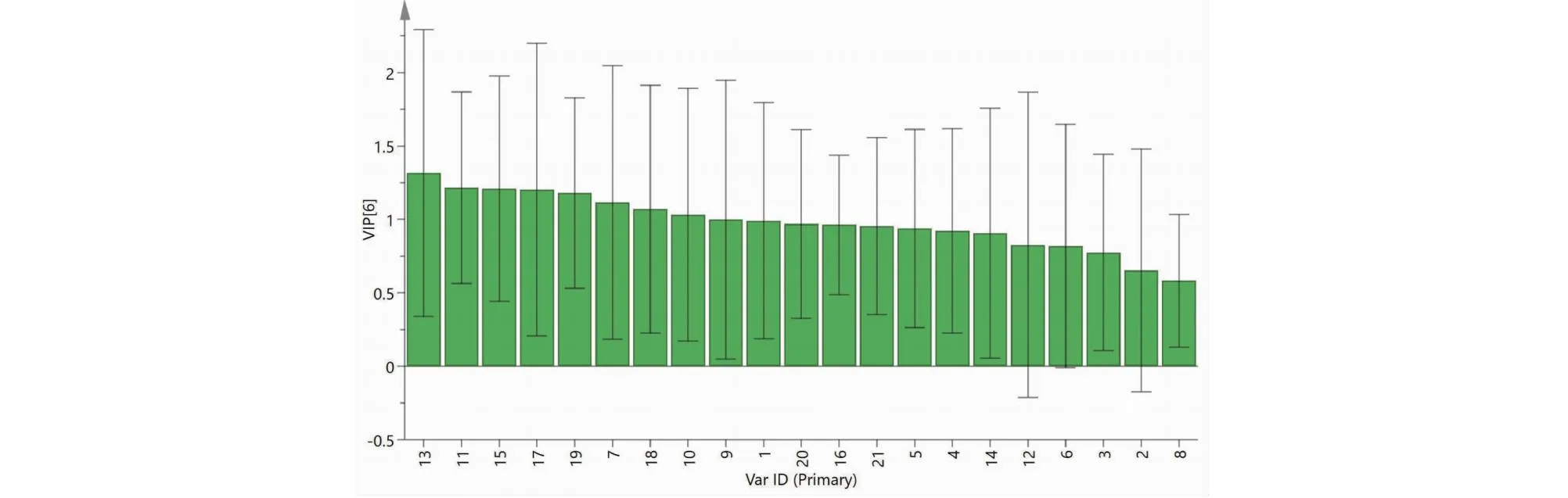
图5 16批前胡样品PLS-DA得分图Fig.5 PLS-DA score plot of 16 batches of Peucedani Radix

图6 16批前胡样品21个共有峰的VIP值Fig.6 VIP value of 21 common peaks of 16 batches of Peucedani Radix
2.6 多指标含量测定
2.6.1 专属性试验
取供试品溶液、混合对照品溶液和空白对照溶液,在“2.2”项的条件下进行分析,色谱图见图7。结果表明,佛手柑内酯、白花前胡甲素、白花前胡乙素、白花前胡素E的分离度均大于1.5,理论塔板数均大于6 000,空白对照溶液无干扰。此方法专属性较好。

图7 前胡样品(A)、混合对照品(B)以及空白对照(C)的HPLC图Fig.7 HPLC chromatograms of Peucedani Radix samples (A),mixed substance solution (B) and blank control (C)
2.6.2 线性关系考察
精密量取混合对照品溶液2.5 mL,定容至5 mL,反复精密量取并稀释,得到梯度浓度混合对照品。佛手柑内酯梯度浓度分别为0.19、0.38、0.76、1.52、3.04、6.08、12.16 μg/mL;白花前胡甲素梯度浓度分别为28.72、57.44、114.88、229.75、459.50、919.00、1838.00 μg/mL;白花前胡乙素梯度浓度分别为6.75、13.50、27.00、54.00、108.00、216.00、432.00 μg/mL;白花前胡素E梯度浓度分别为9.63、19.25、38.50、77.00、154.00、308.00、616.00 μg/mL。精密吸取系列梯度浓度混合对照品溶液10 μL,按“2.2”项的条件注入液相色谱仪,以质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,进行线性回归,结果见表5。可见,在一定范围内,各成分质量浓度与峰面积呈良好的线性关系。

表5 前胡4种香豆素类成分线性回归方程
2.6.3 加样回收率试验
称取已知待测成分含量的前胡样品(S11)六份各0.50 g,精密称定,加入与样品含量相近的佛手柑内酯、白花前胡甲素、白花前胡乙素、白花前胡素E对照品适量,按照“2.1.1”方法制备供试品溶液,在“2.2”色谱条件下,记录峰面积,计算佛手柑内酯、白花前胡甲素、白花前胡乙素、白花前胡素E加样回收率,分别为99.28%、100.3%、101.2%、100.7%,RSD均小于3.0%。
2.6.4 样品含量测定
按照“2.1.1”方法制备供试品溶液,按照“2.2”色谱条件进行含量测定,计算佛手柑内酯、白花前胡甲素、白花前胡乙素、白花前胡素E,结果见表6。佛手柑内酯含量0.016 7~0.131 9 mg/g,均值为0.041 2 mg/g,最高为云南昆明产地。白花前胡甲素6.069 6~16.225 5 mg/g,均值为10.028 8 mg/g,最高为重庆奉节。白花前胡乙素0.426 5~2.010 0 mg/g,均值为1.275 8 mg/g,最高为贵州遵义。白花前胡素E 1.340 7~3.115 5 mg/g,均值为2.271 0 mg/g,最高为湖南华容。按产地分类进行统计分析,结果见图8,产地三类(云南昆明、重庆奉节)的佛手柑内酯、白花前胡甲素含量分别为0.095 4 mg/g和15.936 2 mg/g,远高于产地一类和产地二类,可作为区分产地三类的差异性成分。产地一类和二类的四个香豆素类成分含量总体差异不大。

图8 产地类别中前胡药材香豆素类成分含量Fig.8 Content of coumarins of Peucedani Radix in different producing areas

表6 前胡中四个香豆素类成分含量
3 讨论与结论
为了优化前胡HPLC指纹图谱的色谱条件,本研究基于前期研究,对检测波长、流动相、流速进行优化。采用全波长扫描方法进行分析,结果表明在波长190~245 nm和290~340 nm有吸收,选择321 nm检测波长,其信息量大,响应值较好,杂质干扰少,确定以321 nm作为检测波长。对流动相“乙腈-水”“甲醇-水”进行考察,结果表明“甲醇-水”分离效果更好,0.5%甲酸水能得到更好峰形,因此确定“甲醇-0.5%甲酸水”为流动相。此外,对流速1、0.8、0.5 mL/min进行考察,发现0.5 mL/min有更好的分离度,确定以0.5 mL/min作为此方法的流速。
本研究采用HPLC指纹图谱对湖南、安徽、重庆、湖北、贵州、云南等产地样品进行分析,16批前胡药材指纹图谱具有较高相似度,共确定21个共有峰,共指认了7个成分。在化学模式分析中,将16批样品共分为三类,结合参考文献[14]报道,可分为:以安徽宁国、亳州等为主的道地产区前胡,以湖南、贵州、重庆等为主的前胡,以及高海拔云南产区的前胡。通过主成分和PLS-DA分析,6个主成分累计方差贡献率86.213%,进一步分析筛选出区分产地的8个共有峰,可作为产地的主要标志性成分。高海拔云南产区前胡样品的白花前胡甲素和佛手柑内酯含量显著高于其他产区,白花前胡乙素略高于其他产地,我们推测,高海拔利于前胡药材佛手柑内酯、白花前胡甲素、白花前胡乙素的积累。Yang等[15]认为高海拔有利于白花前胡甲素和白花前乙素的生成与积累,Luo等[16]认为海拔对白花前胡乙素含量的影响大于白花前胡甲素。虽然本研究与前人研究不尽相同,但可明确一点,在高海拔环境下,更加有利于前胡药材品质的形成。
在多指标成分含量测定分析中,共有9批前胡样品白花前胡甲素符合《中国药典》要求,占比56.25%,但没有批次符合白花前胡乙素限量要求,最高者仅2.01 mg/g。Xu等[11]、Liu等[17]也均发现,前胡药材中白花前胡甲素更易达标,而白花前胡乙素不达标现象较为常见。白花前胡为多年生一次开花植株,规模化种植致使改变为一年生品种,年限不足是前胡药材品质下降的重要原因。此外,白花前胡极易发生早薹现象[5],“火药籽”(一年生种子)充斥市场,长期迭代选择,前胡药材品质人为选择性逐年下降。前胡药材品质的普遍性下降是否影响临床疗效,有待进一步研究。
文献报道[7],白花前胡甲素含量与白花前胡乙素存在某种程度的负相关关系,本研究也发现存在这种趋势,但具体原因有待进一步证实。市场上前胡药材品质低劣的原因除了生态环境、遗传基因及人工干预外,还可能与现行质量评价存在较大关系。现行标准中,市售前胡药材合格率极低,特别是白花前胡乙素含量的达标率,这种现状已经不符合前胡药材临床用药及其产业发展。在此背景下,Qiu等[18]探索采用白花前胡甲素与白花前胡乙素比值或和来综合评价前胡药材质量,Liu等[19]、Xiao等[12]、Shi等[20]均对前胡药材指纹图谱进行评价研究,从不同角度对前胡药材进行了质量评价,并取得了较好预期。
本研究采用指纹图谱、多指标成分和化学模式分析三者相结合的方法对药材品质进行分析和评价,对前胡药材质量评价标准的制订具有重要的借鉴意义。然而,不足的是,本研究样品的采集主要从市场、种植基地等途径获得,没有详细记录种质、生态环境、种植技术等信息,样品一致性的局限可能对本研究存在一定影响。在后续研究中,应加强生态环境对前胡药材品质形成影响的研究,解决白花前胡早薹的核心问题,加大药材质量标准研究的样本量,制定符合市场预期、促进产业可持续发展的质量评价标准。