超声心外膜脂肪厚度联合心肌分层应变参数预测冠心病患者冠脉狭窄程度*
安景景 靳通通 闫静 王小娟 邓爱云
(1.兰州大学第一临床医学院,甘肃 兰州 730000; 2.兰州大学第一医院超声科,甘肃 兰州 730000;3.兰州大学第一医院心内科超声室,甘肃 兰州 730000)
心血管疾病是全世界范围内引起死亡的主要原因,而冠心病(Coronary artery disease,CAD)是心血管疾病最常见的死亡原因,每年有720万人死亡,占全球总死亡人数的12%[1]。心外膜脂肪组织(Epicardial adipose tissue,EAT)为位于心肌表面及脏层心包之间的内脏脂肪组织,其分布是局部不对称的,通过产生和分泌脂肪因子及细胞因子,在局部和全身水平调节炎症和致动脉粥样硬化间的平衡[2]。随着冠脉狭窄程度的加重,CAD患者心肌缺血由心内膜下层向心外膜下层心肌进展[3]。研究指出,EAT及心肌纵向分层应变参数检测心肌缺血的敏感性较高[4-5]。本研究拟应用斑点追踪分层应变技术获取CAD患者左室心内膜下心肌(GLSendo)、中层心肌(GLSmyo)及心外膜下心肌(GLSepi)整体纵向应变,探索EAT联合心肌分层应变参数预测CAD患者冠脉病变严重程度,以期为临床早期预防及诊断冠脉狭窄提供参考依据。
1 资料与方法
1.1 一般资料 选取2020年9月—2022年9月于兰州大学第一医院心脏中心行冠脉造影确诊为CAD的患者185例,其中男141例,女44例,平均年龄(60.25±9.07)岁。依据Gensini积分系统[6]对其冠脉病变评分,量化冠状动脉狭窄的严重程度,以Gensini积分45分为界[7]分为轻中度病变组(Gensini积分≤45分)89例和重度病变组(Gensini积分>45分)96例。纳入标准:左室射血分数(LVEF)≥50%且无明显室壁运动异常者。排除标准:①先天性心脏病、心脏瓣膜病、心包积液、心肌炎、心肌病及严重心律失常者。②急慢性肝、肾功能不全者。③出血性或缺血性脑卒中、合并严重恶性肿瘤、血液系统疾病或自身免疫性疾病者。④伴严重CAD并发症或心力衰竭者。⑤对超声检查存在相关禁忌症或图像质量欠佳者。本研究获兰州大学第一医院伦理委员会审批(审批号:LDYYLL2023-245)。
1.2 仪器与方法
1.2.1 生化指标检测 入院时采集血样测定血清肌酐、空腹血糖、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)水平。
1.2.2 超声检查 采用SIEMENS Acuson SC2000的彩色超声诊断仪,4Vlc探头(频率1.25~4.5 MHz),帧频50~70帧/s。参与者均于冠脉造影前进行超声心动图检查。测量方法:被检者在平静呼吸状态下左侧卧位,同步记录心电图,连续采集3个心动周期的胸骨旁左心室长轴、胸骨旁短轴、心尖左室长轴、心尖四腔心及心尖两腔心切面的动态图像。图像分析:①EAT:胸骨旁左心室长轴切面于右室游离壁垂直主动脉环测量收缩末期(EATs)及舒张末期(EATd)EAT厚度;胸骨旁短轴切面于右室游离壁在乳头肌中段垂直于室间隔测量EATs及EATd。②心肌纵向分层应变参数:将心尖左室长轴、心尖四腔心及心尖两腔心切面的动态图像导入Echo PAC工作站,在分层应变模式下,软件自动将心肌分为3层,计算心肌斑点位置变化,得出GLSendo、GLSmyo及GLSepi。③常规超声参数:根据ASE超声心动图测量指南[8],测量舒张末期室间隔厚度(IVSTd)、舒张末期左室后壁厚度(LVPWTd)、左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、二尖瓣口舒张期血流速度(E峰、A峰),计算E/A;用Simpson双平面法测量LVEF。由不知冠脉造影结论的高年资超声医师完成以上参数的测量及分析,于不同心动周期测量3次,取平均值。

2 结果
2.1 两组一般资料比较 两组年龄、性别、高血压、糖尿病、高脂血症、吸烟史、血清肌酐、空腹血糖、TC、TG、LDL-C、IVSTd、LVPWTd、LVESD、LVEDD、LVEF及E/A比较,差异无统计学意义(P>0.05);病变血管数量、HDL-C、BMI及腰围比较,差异具有统计学意义(P<0.05),见表1。

表1 两组一般资料及常规超声指标比较
2.2 两组EAT及心肌分层纵向应变参数比较 两组EATs及GLSendo、GLSmyo及GLSepi比较,差异具有统计学意义(P<0.05),EATd比较差异无统计学意义(P>0.05)。见表2、图1~3。
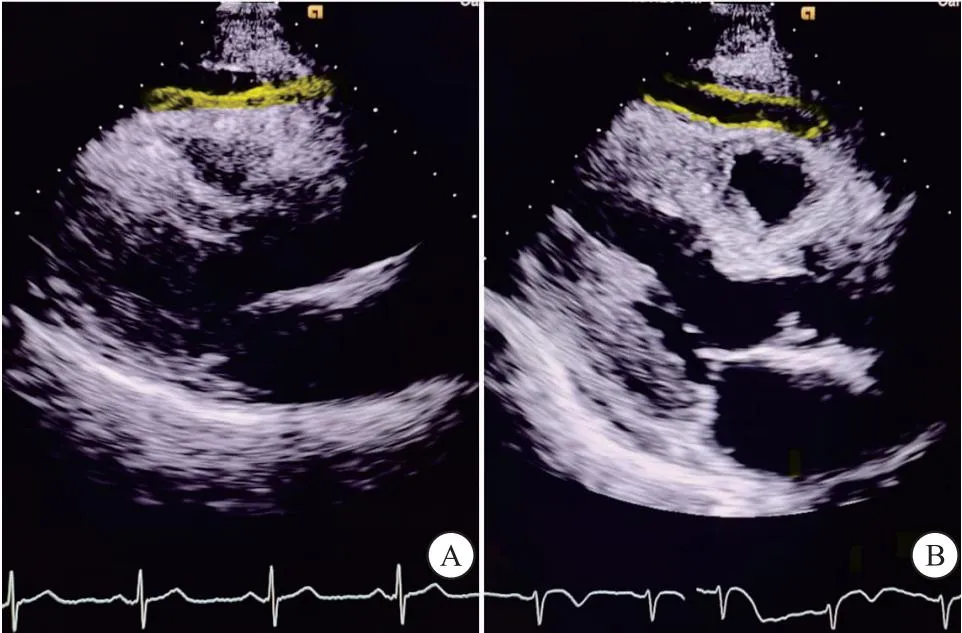
图1 CAD患者的EATs
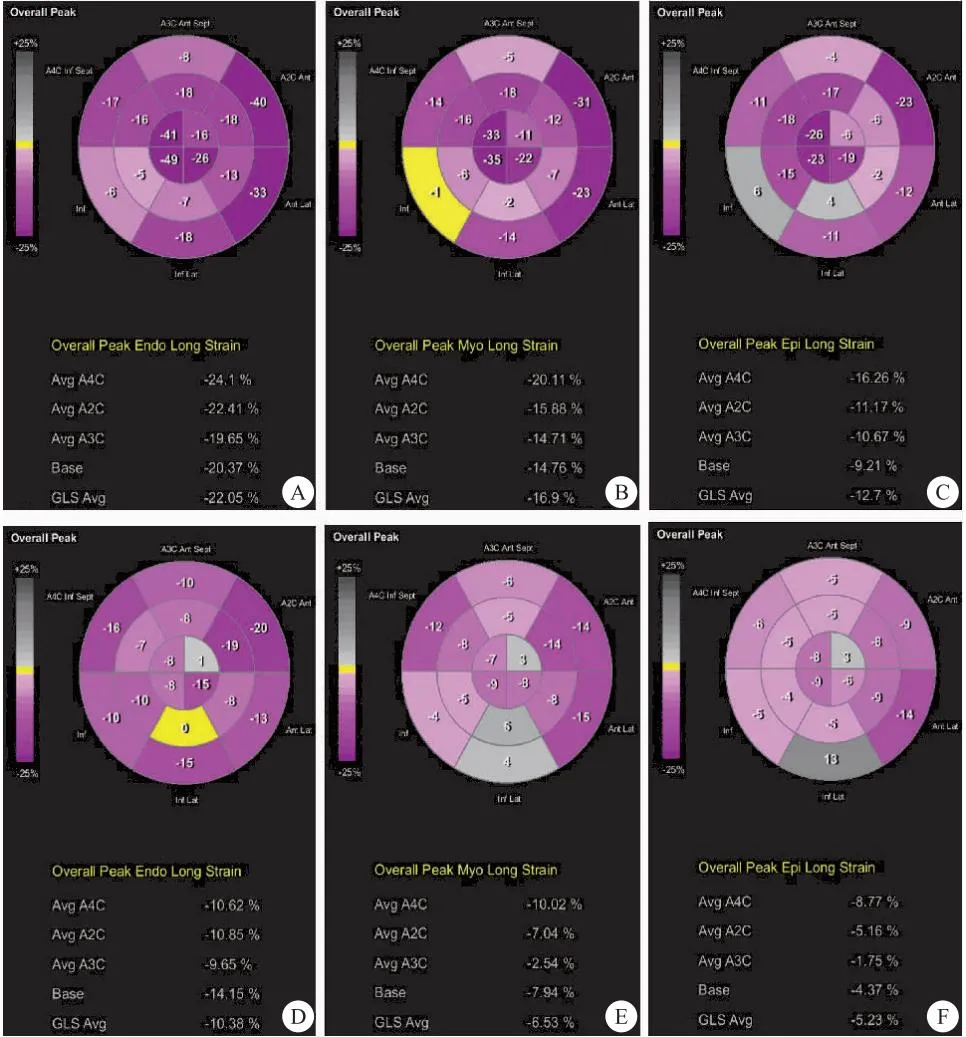
图2 CAD患者的GLSendo、GLSmyo及GLSepi Figure 2 GLSendo, GLSmyo, GLSepi in CAD patients
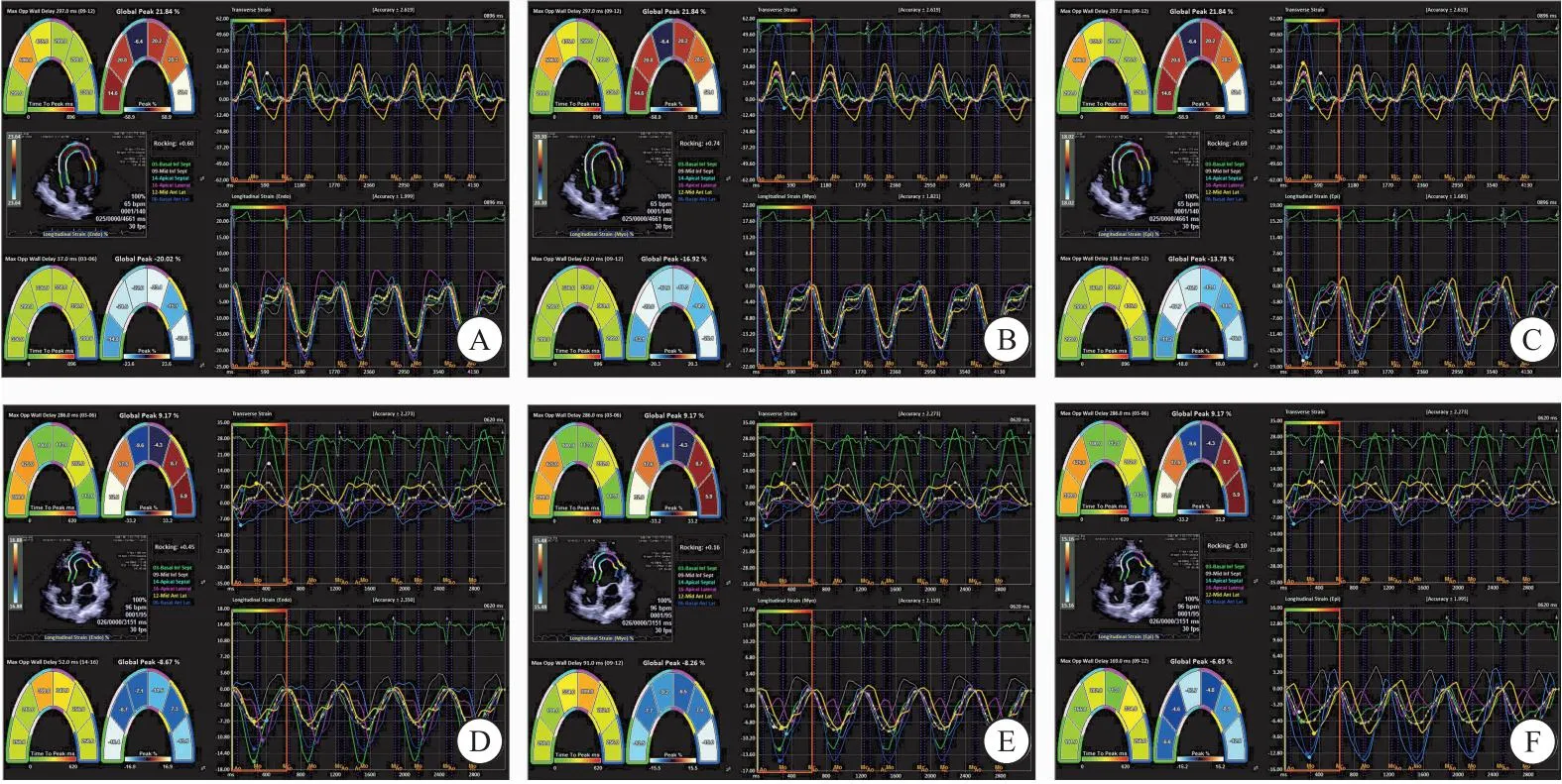
图3 CAD患者节段性应变曲线

表2 两组EAT及心肌纵向分层应变参数比较
2.3 影响CAD患者冠脉狭窄程度的多因素Logistic回归分析 本研究纳入的自变量较多,故在进行多因素Logistic回归分析前,不同变量间进行相关性检验,相关性热图显示变量间没有显著相关性,表示各变量间相互独立,不存在共线性(图4)。多因素Logistic 回归分析结果显示,EATs、GLSendo、GLSmyo、GLSepi、BMI、腰围及病变血管数量为CAD患者冠脉重度狭窄的危险因素,HDL-C为保护性因素(P<0.05),见表3。

图4 变量间相关性热图
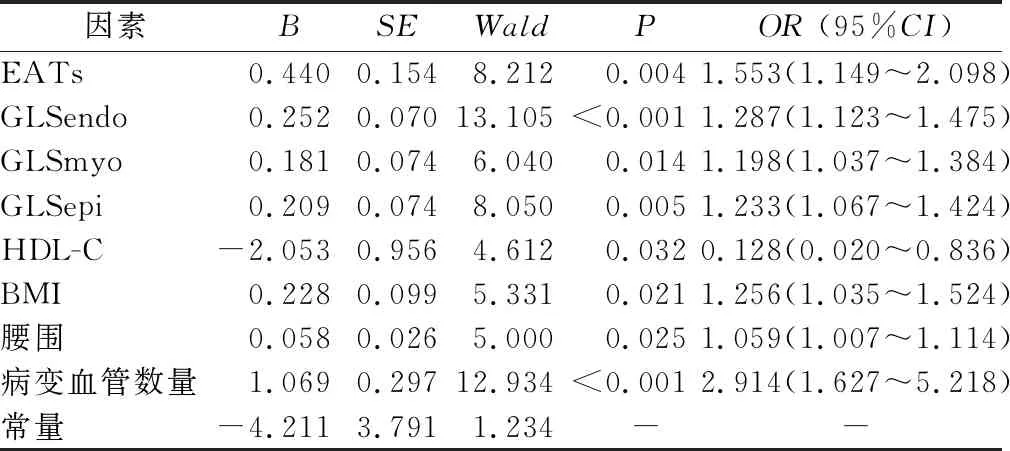
表3 影响CAD患者冠脉狭窄程度的多因素Logistic回归分析
2.4 EATs、心肌纵向分层应变参数及二者联合预测CAD患者冠脉狭窄程度的ROC曲线 EATs、GLSendo、GLSmyo、GLSepi及EATs联合分层应变参数预测冠脉狭窄程度的AUC值分别为0.729(0.654~0.803)、0.709(0.634~0.785)、0.675(0.594~0.755)、0.673(0.594~0.752)、0.820(0.760~0.880);最佳截断值分别为7.18 mm、-17.21%、-16.96%、-13.64%及0.495。见表4、图5。

图5 EATs、分层应变参数及二者联合预测冠脉狭窄程度的ROC曲线

表4 EATs、分层应变参数及二者联合预测CAD患者冠脉狭窄程度的ROC曲线分析结果
3 讨论
心外膜是脂肪刺激后发生反应的重要场所,它可将EAT从心脏的营养来源转变为局部炎症病灶中心[9]。炎症激活的免疫细胞会分泌促炎细胞因子,影响心外膜脂肪细胞功能及旁分泌;反过来,EAT 作为高浓度炎性细胞因子的储存库,大量分泌脂联素、瘦素等的炎性细胞因子及脂肪细胞因子[10-11],促进免疫细胞浸润和激活。这种恶性循环为全身低度炎症创造了一个最佳微环境[12],增强脂肪分解、游离脂肪酸释放、缺氧、氧化应激,从而推动CAD进程。研究指出,EAT与CAD患者高危斑块、冠脉病变血管数目及更为严重的CAD密切相关[13]。这与心外膜脂肪细胞的大小和肥厚程度有关,并且EAT驱动胰岛素抵抗可能是介导冠脉狭窄的重要因素之一[14-15]。常规超声评估心肌功能时以整个心肌壁厚度为基础,而不考虑各层心肌间的差异,但左心室3层心肌的变形能力和功能各不相同。每个心肌层的变形不是独立的,存活心肌收缩可能牵引相邻的非存活心肌导致变形,非存活心肌也会对邻近存活心肌的收缩产生负面影响,每层心肌的变形是该层内心肌主动收缩和相邻心肌被动牵引的总和[16]。因此,准确、有效地评估这些层面可能会提高诊断的准确性和对CAD严重程度的理解。
Gensini积分方便快捷,研究指出,其评估致命和非致命的心血管事件至关重要,在长期随访中具有预测心血管事件的价值[17]。因此,本研究选用Gensini积分评价冠状动脉病变严重程度。本研究结果显示,随着CAD患者冠状动脉狭窄程度增大,EATs逐步增厚,GLSendo、GLSmyo及GLSepi逐渐降低(P<0.05)。Naryzhnaya等[18]研究指出,EAT是预测重度冠状动脉粥样硬化较优指标,葡萄糖/胰岛素代谢的全身损伤及血清脂联素的减少是严重冠状动脉粥样硬化患者EAT脂肪细胞氧化应激作用强度的独立决定因素。Zhang等[19]研究发现,随着冠脉狭窄程度增加,心内膜下层心肌、中层心肌及心外膜下心肌功能依次降低,且GLSendo识别复杂CAD 并预测急性冠脉综合征患者冠状动脉病变的严重程度诊断效能高于GLSmyo及GLSepi。本研究结果与其基本一致。左心室壁由心内膜、心肌中层和心外膜层组成,各层的形变不均匀,与其他两层相比,心内膜层最容易受到缺血性损伤的影响[20]。一方面,心内膜层心肌直接承受来自心室面血液流动带来的压力冲击,并暴露于冠状动脉血液循环中,最易受到缺血影响[21]。此外,缺血再灌注损伤期间心脏平衡是由心肌细胞和常驻细胞直接和间接的相互作用网络维持,在冠状动脉发生闭塞后心内膜层心肌从血流再灌注中恢复至正常状态较为困难[22]。Li等[23]的研究发现,左心室心肌应变随着冠状动脉狭窄的加重而在不同水平上降低,当预测冠状动脉狭窄率>50%时,纵向应变的诊断效能高于径向及圆周应变(AUC=0.899、0.873、0.723)。在心血管系统疾病中,纵向应变通常先于圆周及径向应变受损,这可能是由于中层心肌的曲率半径比纵向肌纤维的曲率半径要小,从而带来的应力相对较低,因此推迟了心肌功能异常出现的时间[24]。
理论上,EAT及心肌纵向分层应变参数均为预测冠状动脉病变严重程度的独立危险因素,推测二者联合应用对CAD患者冠脉狭窄无创诊断价值更大。本研究发现,EATs预测冠脉重度狭窄的效能高于GLSendo、GLSmyo、GLSepi(OR=1.553vs1.287vs1.198vs1.233), 但各指标单独预测时敏感度及特异度均相对较低,联合使用时AUC值高达0.820,敏感度高达0.813,特异度高达0.708。因此,EATs联合分层应变参数对CAD患者冠脉狭窄程度的无创诊断价值较大。此外,仅EATs为冠脉狭窄严重程度的预测因素,而EATd则无预测能力。在某些情况下,最大的EAT厚度可能与真实心动周期中收缩末期或舒张末期并不对应,故超声心动图应在何时测量EAT是一个有争议的话题,目前还没有明确的共识。但Iacobellis等[25]强烈建议于收缩末期测量最大EAT厚度,这可能与舒张期EAT被挤压有关。因此,在临床实践中不仅要注重节段性室壁运动异常这一常规征象,更应重视患者EAT及心肌纵向分层应变参数的变化趋势,当常规超声缺乏节段性室壁运动异常的证据,但患者分层应变参数明显减低,且EAT显著增厚时,不能排除缺血性心肌病的诊断。
本研究的局限性:①对超声应变参数选择较为片面,只纳入了左室纵向分层应变值,径向应变及圆周应变等并未纳入。②仅在胸骨旁左室长轴及短轴两个标准切面测量EAT厚度,并未观察其余切面的EAT情况。③样本量较小,仅为单中心数据,未来仍需多中心、大样本、高质量的研究进一步验证。
4 结论
随CAD患者冠脉狭窄程度增加,EATs逐步增厚,心肌纵向分层应变参数逐步降低,二者均可预测冠脉狭窄,联合时诊断效能更优。

