美托洛尔联合氯吡格雷对心肌缺血再灌注损伤小鼠的作用机制*
门汝梅 王艳林 张琳娜 门丽丽 兰文达 孟庆兰 于建才
(1.沧州市人民医院心内三科,河北 沧州 061099;2.沧州市中西医结合医院手显微外二科,河北 沧州 061013;3.沧州市中心医院心内二科,河北 沧州 061017)
急性心肌梗死(Acute myocardial infarction,AMI)是冠心病中最严重、危害最大的病症之一,具有发病急骤、进展迅速、复杂多变、并发症多、死亡率高等特点[1]。AMI治疗方法通常为溶栓疗法、经皮冠状动脉介入治疗、冠状动脉旁路移植术(冠脉搭桥术)[2]。多数情况下,缺血后再灌注可使组织器官功能得到恢复,损伤的结构得到修复,患者病情好转康复;但有时缺血后再灌注,不仅不能使组织、器官功能恢复,反而加重组织、器官的功能障碍和结构损伤[3]。这种在缺血基础上恢复血流后组织损伤反而加重,甚至使心肌发生不可逆性损伤的现象称为心肌缺血再灌注(Myocardial ischemia reperfusion,MI/R)损伤。MI/R损伤是一个重要的临床问题,尚缺乏有效的治疗方案。研究表明β受体阻滞药降低AMI病死率与减慢心率有关,β受体阻滞药美托洛尔能够选择作用于心脏,不增加周围血管阻力和影响后负荷,且不增加支气管阻力,故临床上较常选用[4]。研究发现美托洛尔治疗具有降低MI/R损伤引发的心肌梗死[5]。此外,AMI患者再灌注期间要常给予抗血小板药物治疗,避免血栓形成[6]。研究表明在MI/R损伤过程,血小板激活通过分泌血清素等促进循环系统中性粒细胞激活,激活的中性粒细胞会浸润至缺血再灌注区域心肌组织中,然后发生脱颗粒,引发心肌组织损伤[7]。因此,抗血小板药物在抗凝的同时可能具有改善MI/R损伤的功能。本研究探讨美托洛尔联合抗血小板药物氯吡格雷对MI/R损伤小鼠的作用,为临床MI/R损伤药物治疗提供理论基础。
1 材料与方法
1.1 实验动物 75只10周龄SPF级雄性C57BL/6小鼠购于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2022-0009]。饲养条件:饲养盒内饲养,温度20~26 ℃,湿度40%~60%。本研究获沧州市人民医院伦理委员会批准[审批号:K2022-批件-065(11.1)]。
1.2 动物分组及MI/R损伤模型复制 小鼠随机化分为假手术组、模型组、美托洛尔组、氯吡格雷组及联合组,每组15只。术前分别给予假手术组和模型组生理盐水灌胃、美托洛尔组美托洛尔(阿斯利康制药有限公司,10 mg/kg/d)灌胃、氯吡格雷组氯吡格雷(赛诺菲安万特杭州制药有限公司,20 mg/kg/d)灌胃、联合组美托洛尔(10 mg/kg/d)和氯吡格雷(20 mg/kg/d)灌胃。各组小鼠吸入3%异氟烷麻醉诱导,1.5%~2%异氟烷麻醉维持。方法:将小鼠以仰卧位放置,剪开左胸皮肤,钝性分离胸肌,然后经第4肋间隙开胸迅速暴露心腔,心包打开后,小鼠心脏暴露,用左手手指调整心脏位置使心尖朝向胸廓开口处,在心脏跳动的带动下轻轻将心脏挤出至胸外,假手术组小鼠使用7-0丝线在距心底3 mm处左前降支冠状动脉下穿线,不结扎。其余组小鼠使用7-0丝线在距心底3 mm处左前降支冠状动脉下穿线结扎,形成活结,然后将心脏迅速放回胸腔,手动排空气,胸腔皮肤用4-0丝线缝合。缺血30 min时,将心脏上7-0结扎丝线解开并移除。
1.3 心脏超声检查 采用VeVo 2100小动物超声仪(VisualSonics公司)检测再灌注24 h后小鼠心功能。将小鼠用3%异氟烷诱导麻醉,然后用1.5%~2%异氟烷维持麻醉状态。将小鼠以仰卧位放置,在其胸部涂上超声耦合剂,通过超声仪检测心脏功能和心室结构,评估左心室射血分数(Ejection fraction,EF)和左心室缩短分数(Fraction shortening,FS)。
1.4 心脏伊文思蓝及2,3,5-氯化三苯基四氮唑(TTC)染色 MI/R 24 h后,用1%戊巴比妥钠(80 mg/kg)麻醉小鼠,按缺血时的位置、宽度和深度结扎左前降支冠状动脉,通过升主动脉将2%的伊文思蓝染料200 μL注入心脏。取下其心脏并用PBS漂洗,吸水纸吸干心脏表面的水分。将心脏在-80 ℃冷冻30 min以上,然后将结扎线以下的心脏组织横向平均切成五片。切片置于1% 2,3,5-氯化三苯基四氮唑(索莱宝生物科技有限公司)中,37 ℃避光孵育10 min,然后用10%福尔马林固定2~4 h。对染色后的心脏组织进行拍照记录。
1.5 流式细胞仪检测 MI/R 24 h后,取50 μL各组小鼠外周血,分别加入0.5 μL FITC标记的抗小鼠CD41a抗体、PE标记的抗小鼠CD62p抗体,冰上孵育30 min,然后4 ℃ 400 g离心5 min,将沉淀细胞用FACS缓冲液重悬,流式上机检测。所有抗体均购于Biolegend公司。
1.6 免疫荧光及TUNEL染色 MI/R 24 h后,取小鼠心脏,采用10%福尔马林溶液固定组织24 h,然后将固定的组织脱水,石蜡包埋,制备石蜡切片。免疫荧光染色:取石蜡切片,脱蜡、固定,山羊血清(中杉金桥)进行封闭,然后分别使用兔抗小鼠Ly6G抗体(Abcam公司)、大鼠抗小鼠CD41抗体对组织中性粒细胞和血小板进行染色,4 ℃孵育16 h,洗片后再使用Alex Flour488标记的抗兔IgG抗体(中杉金桥)及Alex Flour594标记的抗大鼠IgG抗体(中杉金桥)室温孵育1 h,洗片后用DAPI封片,荧光显微镜下观察拍照。TUNEL染色:石蜡切片经二甲苯透明和梯度乙醇脱蜡水化处理后,使用TUNEL细胞凋亡检测试剂盒(绿色FITC标记荧光检测法,凯基生物)对小鼠心肌细胞凋亡情况进行分析,具体方法参照试剂盒说明书,通过光学显微镜观察细胞凋亡状况。
1.7 Western blot检测 MI/R 24 h后,取小鼠心脏,然后加入1 mL RIPA裂解液,使用组织匀浆机对组织进行匀浆,匀浆后的组织放于冰上裂解10 min,之后4 ℃,12 000 g离心5 min,取上清液;然后往上清液中加入上样缓冲液;SDS-PAGE跑胶、转膜,转印蛋白的膜用5%脱脂奶粉37 ℃封闭2 h,之后抗小鼠Caspase 3抗体(1∶1 000)、PARP-1抗体(1∶1 000)、GAPDH(1∶1 000)抗体4 ℃孵育12 h(GAPDH、Caspase 3和PARP-1抗体均购于Abcam公司),然后使用HRP标记的二抗37 ℃孵育1 h,最后加入ECL发光液曝光检测。

2 结果
2.1 各组小鼠心功能变化 MI/R损伤手术前各组小鼠左心室EF值和FS值无显著性差异(P>0.05)。手术后(再灌注24 h后),模型组、美托洛尔组、氯吡格雷组及联合组小鼠左心室EF值、FS值相比于手术前显著降低(P<0.05);美托洛尔组、氯吡格雷组及联合组小鼠左心室EF值、FS值显著高于模型组(P<0.05);联合组小鼠左心室EF值、FS值分别显著高于美托洛尔组、氯吡格雷组(P<0.05),见表1。
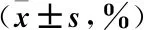
表1 各组小鼠左心室EF和FS比较
2.2 各组小鼠缺血再灌注区心肌梗死面积比较 伊文思蓝-TTC染色结果显示,再灌注24 h后,假手术组、模型组、美托洛尔组、氯吡格雷组及联合组小鼠缺血危险区面积/心脏总面积无显著性差异(P>0.05);模型组、美托洛尔组、氯吡格雷组及联合组小鼠缺血区心肌梗死面积显著高于假手术组(P<0.05);美托洛尔组、氯吡格雷组及联合组小鼠缺血区心肌梗死面积显著低于模型组(P<0.05);联合组小鼠缺血区心肌梗死面积分别显著低于美托里尔组和氯吡格雷组(P<0.05),见图1。
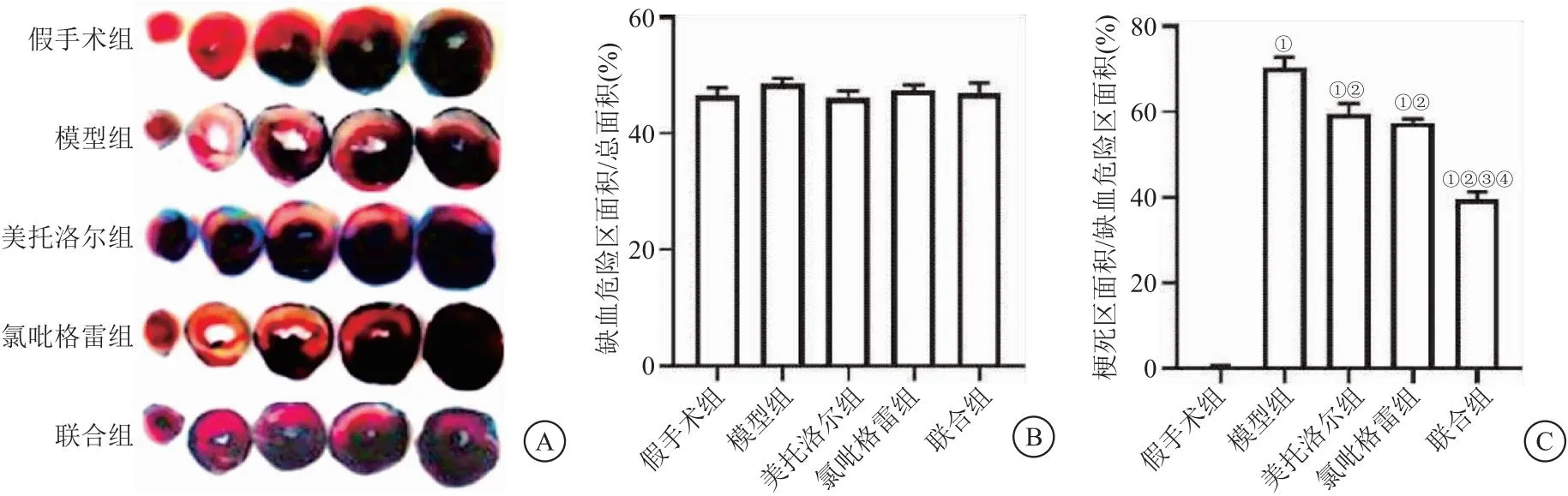
图1 各组小鼠缺血再灌注区心肌梗死面积比较
2.3 各组小鼠外周血血小板活化水平比较 流式细胞术检测分析结果显示,再灌注24 h后,模型组、美托洛尔组、氯吡格雷组外周血血小板活化水平显著高于假手术组(P<0.05),氯吡格雷组和联合组外周血血小板活化水平显著低于模型组(P<0.05),联合组外周血血小板活化水平分别显著低于美托洛尔组和氯吡格雷组(P<0.05),与假手术组水平接近(P>0.05),见图2。
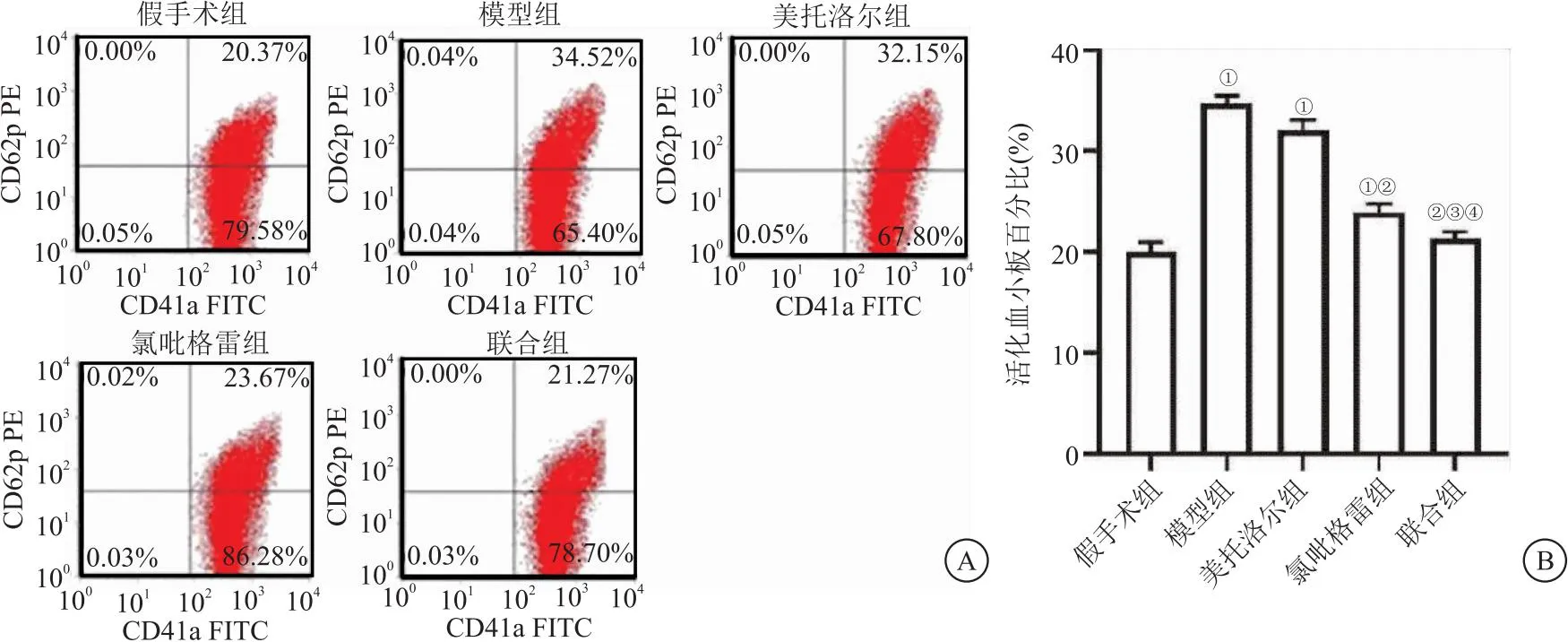
图2 各组小鼠外周血血小板活化水平比较
2.4 各组小鼠缺血再灌注区血小板、中性粒细胞沉积水平比较 免疫荧光染色结果显示,再灌注24 h后,模型组、美托洛尔组、氯吡格雷组及联合组缺血再灌注区心肌组织血小板、中性粒细胞沉积显著高于假手术组(P<0.05),美托洛尔组、氯吡格雷组、联合组缺血再灌注区心肌组织血小板、中性粒细胞沉积显著低于模型组(P<0.05),氯吡格雷组比美托洛尔组下降更明显,联合组缺血再灌注区心肌组织血小板、中性粒细胞沉积分别显著低于美托洛尔组和氯吡格雷组(P<0.05),见图3。
图3 各组小鼠缺血再灌注区血小板、中性粒细胞沉积水平比较
2.5 各组小鼠缺血再灌注区心肌细胞凋亡水平比较 TUNEL染色结果显示,再灌注24 h后,模型组、美托洛尔组、氯吡格雷组及联合组缺血再灌注区心肌组织凋亡心肌细胞显著高于假手术组(P<0.05),美托洛尔组、氯吡格雷组及联合组缺血再灌注区心肌组织凋亡心肌细胞显著少于模型组(P<0.05),美托洛尔组比氯吡格雷组下降更明显;联合组缺血再灌注区心肌组织凋亡心肌细胞分别显著低于美托洛尔组、氯吡格雷组(P<0.05),见图4。
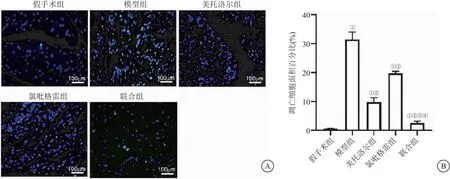
图4 各组小鼠缺血再灌注区心肌组织TUNEL染色比较
2.6 各组小鼠缺血再灌注区凋亡调控蛋白水平比较 Western blot检测结果显示,再灌注24 h后,模型组、美托洛尔组、氯吡格雷组及联合组缺血再灌注区心肌组织剪切的Caspase 3和PARP1水平显著高于假手术组(P<0.05),美托洛尔组、氯吡格雷组及联合组缺血再灌注区心肌组织剪切的Caspase 3和PARP1水平显著少于模型组(P<0.05),美托洛尔组比氯吡格雷组减少更明显;联合组缺血再灌注区心肌组织剪切的Caspase 3和PARP1水平分别显著低于美托洛尔组、氯吡格雷组(P<0.05),见图5。
3 讨论
冠心病是临床常见的缺血性心脏病,是指冠状动脉发生粥样硬化引起管腔狭窄或闭塞,导致心肌缺血缺氧或坏死而引起的心脏病。各种血运重建手段通过及时有效地恢复心肌血液灌注,可以减轻缺血导致的心肌损伤及坏死,然而心肌缺血后恢复血液再灌注本身也可进一步导致MI/R损伤。病理性缺血与心肌梗死治疗后再损伤的耦合性疾病,尤其难以治疗。尽管心脏保护作用在动物实验中取得了成功,但事实证明将其转化为临床实践很困难[8]。目前为解决临床MI/R损伤药物治疗问题,对现有心血管疾病药物用于MI/R损伤治疗的研究显得尤为重要。
美托洛尔是一种高选择性β受体阻滞药,它广泛使用于心力衰竭和AMI的临床治疗,且有研究显示美托洛尔治疗能够显著减少AMI患者治疗后的死亡率,且动物实验研究表明美托洛尔能够减少MI/R损伤后心肌梗死面积,其机制与抑制心肌细胞凋亡有关[9-10]。本研究同时发现美托洛尔干预能够显著改善小鼠MI/R损伤后心功能,减少心肌梗死面积。另外,AMI患者经治疗后心肌恢复血流后都会给予抗凝药治疗,避免术后血栓形成,引发二次堵塞,其中抗血小板抗凝剂氯吡格雷是常用的抗凝剂。氯吡格雷是通过抑制血小板表面的ADP受体(P2Y12),起到抑制血小板的作用以预防血栓形成。与其他抗血小板抗凝剂如阿司匹林相比,氯吡格雷具有抗血小板作用强、起效快等特点,且长期使用氯吡格雷的安全性比阿司匹林更高[11]。研究表明血小板通过其受体P2Y12激活后,能够调控机体中性粒细胞、单核巨噬细胞激活[12]。此外,在MI/R损伤过程中血小板介导的炎症反应扮演至关重要角色。研究表明,当缺血心脏恢复血流发生再灌注时,小鼠循环系统中血小板被激活,激活的血小板释放血清素,继而激活循环系统中性粒细胞,使中性粒细胞浸入至缺血再灌注损伤区域,导致心肌梗死加重[13-14]。此外,在MI/R损伤过程激活的血小板会沉积在心脏微血管上,导致微血管堵塞,引发心脏微循环障碍,导致心肌梗死加重[15-16]。因此,抗血小板P2Y12受体的氯吡格雷可能具有改善MI/R损伤的作用。本研究发现单独给予氯吡格雷治疗改善小鼠MI/R损伤后心功能,减少缺血再灌注区心肌梗死面积,其效果与单独使用美托洛尔效果相当。进一步发现美托洛尔联合氯吡格雷改善MI/R损伤后心功能及减少心肌更面积的能力显著优于单独使用美托洛尔或氯吡格雷。
MI/R损伤机制涉及炎症反应、心肌细胞凋亡等[17-18]。本研究发现,MI/R损伤小鼠外周血血小板激活水平及缺血再灌注区小鼠心肌血小板沉积显著高于假手术组,美托洛尔或氯吡格雷单独治疗及氯吡格雷联合美托洛尔治疗小鼠外周血血小板活化水平、缺血再灌注区小鼠心肌血小板沉积显著下降,但氯吡格雷单独治疗血小板活化程度弱于美托洛尔,提示氯吡格雷主要通过抑制血小板激活改善MI/R损伤。对缺血再灌注区心肌组织凋亡分析发现,MI/R损伤小鼠缺血再灌注区心肌细胞凋亡数量及心肌组织剪切的Caspase 3、PARP1蛋白水平显著高于假手术组,美托洛尔或氯吡格雷单独及联合治疗小鼠缺血再灌注区小鼠心肌细胞凋亡数量及心肌组织剪切的Caspase 3、PARP1蛋白水平显著下降,但美托洛尔单独治疗小鼠心肌细胞凋亡数量及心肌组织剪切的Caspase 3、PARP1蛋白水平少于氯吡格雷,提示美托洛尔主要是通过抑制心肌细胞凋亡改善MI/R损伤。有研究发现[19-20],MI/R损伤与Toll样受体4/核转录因子κB(TLR4/NF-κB)、磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K/Akt)、Janus蛋白酪氨酸激酶/信号转导子与转录激活因子3(JAK/STAT-3)等信号通路有关,其中心肌缺血后PARP蛋白上调,并通过增强NF-κB活性和增加基质金属蛋白酶9的mRNA和蛋白表达造成再灌注损伤;MI/R后大鼠心肌组织NF-κB和Caspase-3活性明显升高,而抑制JAK/STAT信号通路后心肌组织NF-κB和Caspase-3表达下调,但目前有关美托洛尔联合氯吡格雷通过调控上述信号通路来影响Caspase 3、PARP1蛋白表达的详细机制仍有待完善。由于MI/R损伤具有复杂的分子机制,美托洛尔及氯吡格雷均展现了抑制心肌细胞凋亡及血小板活化,但是二者也都基于其药物特点,展现出相应侧重的分子机制。
4 结论
美托洛尔联合氯吡格雷治疗心肌缺血再灌注损伤效果优于美托洛尔或氯吡格雷单独治疗,其机制与抑制心肌细胞凋亡及血小板激活有关。

