红花清肝十三味丸通过抑制炎性细胞浸润改善小鼠肝损伤的研究
包 旭,卞康坤,肖海军,王 利,包玉龙
(内蒙古医科大学基础医学院,内蒙古 呼和浩特 010000)
红花清肝十三味丸(以下简称HHQG)是经典的蒙药保肝良方, 以凉血益肝良药红花为主药[1],佐以栀子、丁香、川楝子、木香、麦冬、莲子、诃子、紫檀香、人工麝香、水牛角浓缩粉、人工牛黄、银朱[2],被收录于《中华人民共和国卫生部药品标准·蒙药分册》(1998 版)。HHQG 在临床上已经被广泛用于治疗各类肝炎、肝损伤以及肝衰竭[3],但其作用途径与机理尚不完全明确。
笔者所在课题组前期运用超高效液相色谱-串联质谱 (ultra-high performance liquid chromatography tandem mass spectrometry,UHPLC-MS/MS)技术对HHQG 醇提取物进行了鉴定, 并利用网络药理学分析方法对HHQG 在治疗肝损伤中发挥的作用及潜在的靶点进行了预测与探究; 结果显示,从HHQG 醇提取物中分析鉴定出747 种化学成分,目前认为可对肝损伤起作用的靶点有38 个, 这些在肝损伤治疗中发挥潜在作用的化学成分,主要集中在抗炎、抗氧化、肝功能代谢等方面,提示HHQG可以通过抗炎作用达到保肝效果[4]。 本研究通过建立四氯化碳(CCl4)诱导的小鼠肝损伤模型,比较肝损伤模型组与HHQG 保肝组的肝脏功能及病理损伤情况,利用免疫组织化学技术、反转录实时荧光定量PCR (RT-qPCR) 技术、 转录组测序分析(RNA-Seq) 方法对炎性细胞浸润情况以及炎性因子和相关黏附分子表达情况进行分析,进一步研究HHQG 对肝损伤后中性粒细胞与单核/巨噬细胞等炎性细胞浸润的影响, 以期为明晰HHQG 的抗炎保肝作用机理提供参考。
1 材料与方法
1.1 试验材料
1.1.1 实验动物
6~8 周龄雄性C57BL/6 小鼠54 只,体重20~22 g,购自北京维通利华实验动物技术有限公司。饲养环境条件为温度(20±2)℃、相对湿度60%~70%、12 h光照/12 h 黑暗循环。
1.1.2 主要试剂
HHQG 购自内蒙古自治区国际蒙医医院;CCl4购自上海阿拉丁生化科技股份有限公司; 无水乙醇、二甲苯、异丙醇、橄榄油、氯仿、盐酸购自天津市化学试剂研究所有限公司;谷草转氨酶(AST)和谷丙转氨酶(ALT)活力测定试剂盒购自南京建成科技有限公司;HE 染色试剂盒、Masson 染色试剂盒及Mayer 苏木素染色液购自北京索莱宝科技有限公司;FastKing 一步法除基因组cDNA 第一链合成预混试剂购自天根生化科技(北京)有限公司;PerfectStartRGreen qPCR SuperMix 购自北京全式金生物技术股份有限公司; 粉剂型PBS 磷酸盐缓冲液、DAB 底物显色试剂盒、 粉剂型柠檬酸修复液、即用型免疫组化超敏UltraSensitiveTMSP 试剂盒、中性树胶购自福州迈新生物技术开发有限公司;CD11b 抗 体、F4/80 抗 体、TNF-α 抗 体 购 自 美 国Abcam 公司。
1.1.3 主要仪器设备
全自动轮转式切片机、石蜡包埋机、烤片机、展片机、正置显微镜购自德国Leica 公司;水平摇床购自上海一恒科学仪器有限公司; 全自动数字切片扫描系统购自杭州科洛码光电科技有限公司;高温高压灭菌锅、制冰机、-80 ℃超低温冰箱、-20 ℃/-30 ℃医用低温冰箱购自日本Panasonic 公司; 实时荧光定量PCR 仪购自美国ABI 公司;普通PCR 仪购自德国Analytikjena 公司; 微量移液器、 高速冷冻离心机购自德国Eppendorf 公司;多功能酶标仪购自美国Biotek 公司。
1.2 试验方法
1.2.1 试验设计
将54 只C57BL/6 小鼠随机分为对照组、 模型组和HHQG 保肝组,每组18 只。经过7 d 的饲养适应期后,HHQG 保肝组小鼠连续7 d 每天灌胃1 次HHQG, 剂量为0.616 5 g/(kg·BW)(笔者所在课题组前期试验确定的最适剂量)[5], 对照组和模型组小鼠每天灌胃1 次等体积的生理盐水。在第7 天灌胃4 h 后,对照组腹腔注射橄榄油,剂量为0.1 mL/(10g·BW),模型组和HHQG 保肝组均腹腔注射等剂量的CCl4橄榄油混合物(CCl4∶橄榄油=1∶4,V/V)[6]。分别在注射后第2、5、7 天每组选取3 只小鼠,处死后采血并取肝脏用于后续试验。
1.2.2 血清AST 和ALT 活力测定
采集小鼠血液,室温静置后离心,分离血清。按照AST 和ALT 活力测定试剂盒说明书进行操作并计算测定结果。
1.2.3 肝脏组织病理学HE 染色和胶原沉积Masson 染色
取小鼠相同部位的肝脏组织于4%多聚甲醛中固定24 h,再将冲洗好的组织脱水、浸蜡、包埋并制成厚度为4 μm 的切片。 按照HE 染色试剂盒及Masson 染色试剂盒说明书对制备好的肝脏组织切片进行HE 染色和Masson 染色。
1.2.4 肝脏组织炎性细胞及TNF-α 免疫组织化学染色
取脱水浸蜡肝脏切片,脱蜡复水,柠檬酸微波热激修复;将切片置于3%的H2O2溶液中室温避光处理; 室温下用3%山羊血清封闭; 加入一抗(CD11b 抗 体 按1∶200 比 例 稀 释,F4/80 抗 体 按1∶200 比例稀释,TNF-α 抗体按1∶200 比例稀释),在4 ℃湿盒中过夜孵育; 二抗孵育;DAB 显色剂显色;Mayer 苏木素染色液复染, 盐酸乙醇分化液处理,脱水透明,中性树胶封片,室温保存。
1.2.5 RT-qPCR 检测TNF-α基因及黏附分子基因mRNA 相对表达水平
提取小鼠肝脏组织总RNA, 按照反转录试剂盒说明书进行反转录PCR 获取cDNA。 根据PerfectStartRGreen qPCR SuperMix 试剂盒说明书推荐的反应体系和反应条件进行实时荧光定量PCR(qPCR)。 以β-actin 为内参基因, 通过比较阈值(2-ΔΔCT) 的方法计算TNF-α、VCAM-1、ICAM-1 基因的mRNA 相对表达量。qPCR 所用引物信息如表1 所示。

表1 qPCR 所用引物信息
1.2.6 RNA-seq 分析
采集造模后第5 天小鼠的肝脏组织,分别提取各组小鼠相同部位肝叶组织(每组独立3 次重复样本) 的总RNA 用于创建RNA 文库并进行RNA 测序。 基于至少2 次具有相同趋势的成对比较,运用统计学分析方法,筛选出表达变化高于1.5 倍的基因(P<0.01),即差异表达基因,用于后续研究分析。RNA-seq 分析委托北京诺禾致源科技股份有限公司完成。
1.2.7 统计分析
所有试验数据以“平均值±标准差” 的形式表示, 使用GraphPad Prism 软件进行t 检验,P<0.05表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 血清中AST 和ALT 活力检测结果
由图1 和图2 可知,在CCl4诱导肝损伤后第2天,与对照组相比,模型组小鼠血清中AST 和ALT活力极显著(P<0.01)升高;与模型组相比,HHQG保肝组小鼠血清中AST 和ALT 活力极显著 (P<0.01)降低。在CCl4诱导肝损伤后第5 天和第7 天,模型组与对照组、HHQG 保肝组与模型组小鼠血清中AST 和ALT 活力均无显著(P>0.05)差异。

图1 小鼠血清AST 活力测定结果
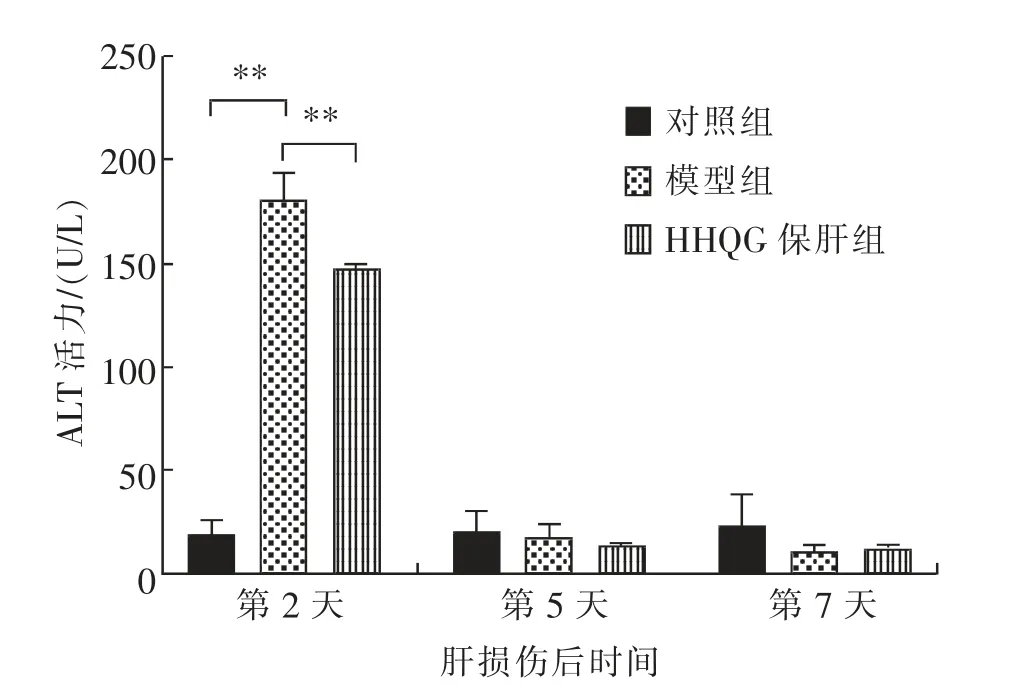
图2 小鼠血清ALT 活力测定结果
2.2 肝脏组织病理学HE 染色及胶原沉积Masson 染色观察结果
2.2.1 肝脏组织病理学HE 染色观察结果
HE 染色结果显示(见图3),对照组小鼠的肝小叶结构完整,肝实质细胞轮廓清晰,核质分布均匀,肝细胞排列整齐。肝损伤后第2 天,模型组小鼠的肝门静脉周围形成大面积弥漫性变性坏死,边缘的肝细胞排列混乱,多数呈水肿状态,可见部分炎性细胞浸润; 此时,HHQG 保肝组小鼠的肝脏损伤及坏死面积明显减小。 肝损伤后第5 天,与模型组相比,HHQG 保肝组小鼠肝损伤区门静脉炎性细胞浸润明显减少。 肝损伤后第7 天,模型组小鼠的肝损伤区域通过肝细胞增殖进行组织修复,炎性细胞浸润减少,炎症开始消退;此时,HHQG 保肝组小鼠的肝损伤修复基本完成,无炎症反应。
2.2.2 肝脏组织胶原沉积Masson 染色观察结果
Masson 染色结果显示(见图4),肝损伤后第2天,与对照组相比,模型组小鼠肝脏组织大面积弥漫性坏死的区域有大量胶原纤维合成;肝损伤后第5 天,损伤区域周围出现大量炎性细胞浸润,发生炎性细胞浸润的门静脉与中央静脉轴系存在大量胶原沉积;肝损伤后第7 天,胶原纤维物质逐渐降解,大部分坏死区域已被修复,但门管区与中央静脉周围仍存在部分胶原纤维沉积和炎性细胞浸润,相比之下,HHQG 保肝组小鼠肝脏组织的炎性细胞浸润被抑制,胶原沉积改善,肝脏组织的损伤状况明显减轻。
2.3 肝脏组织炎性细胞免疫组织化学染色观察结果
2.3.1 中性粒细胞免疫组织化学染色观察
免疫组织化学染色结果显示(见图5),与对照组相比,模型组小鼠自肝损伤后第2 天开始,损伤区域的门静脉壁周围出现大量中性粒细胞浸润;此时,HHQG 保肝组小鼠的门静脉周围损伤区域中性粒细胞浸润明显减少。 肝损伤后第5 天,模型组小鼠肝脏组织的受损区域可见部分中性粒细胞浸润;此时,HHQG 保肝组小鼠的肝脏组织基本无中性粒细胞浸润。 肝损伤后第7 天,模型组和HHQG 保肝组均无中性粒细胞浸润。
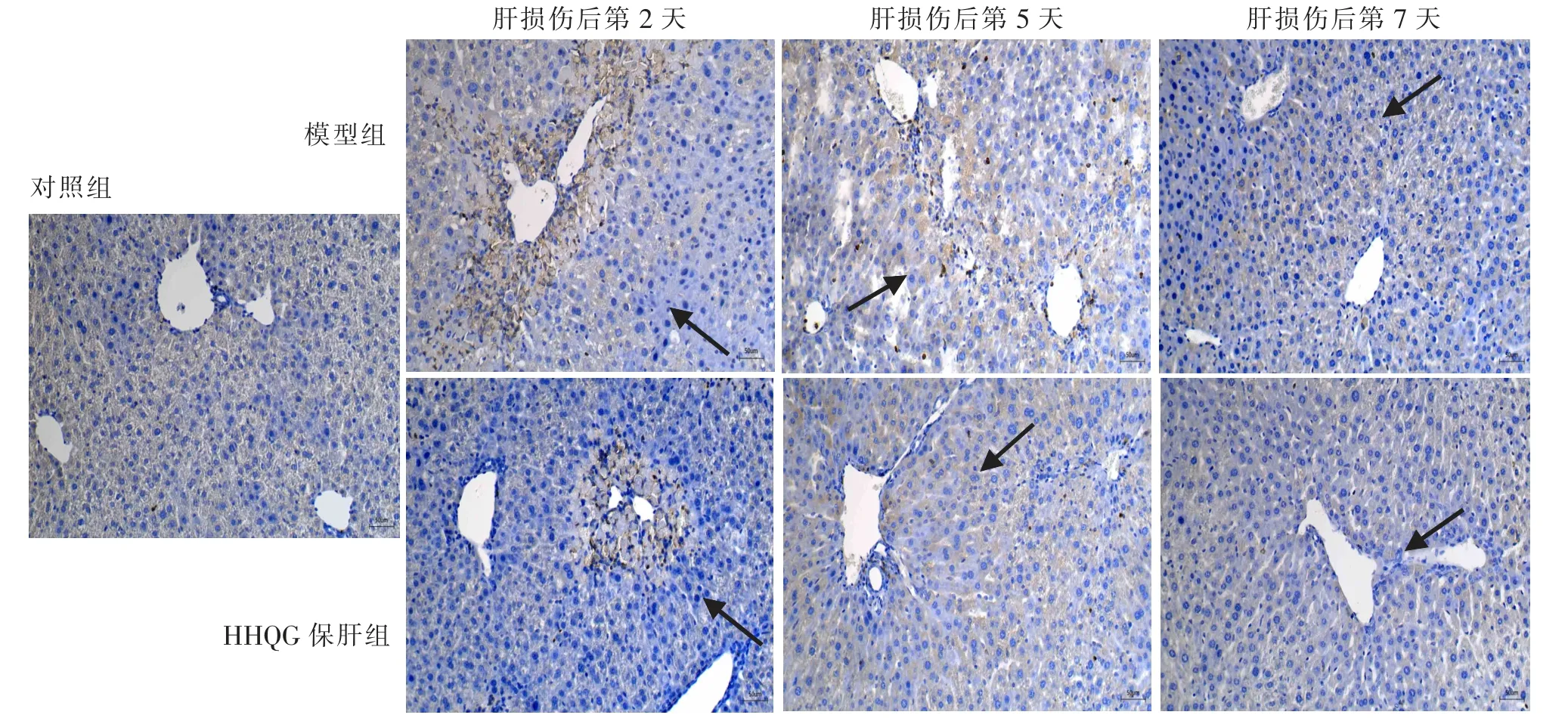
图5 肝脏组织中性粒细胞免疫组织化学染色观察(200×)
2.3.2 单核/巨噬细胞免疫组织化学染色观察
免疫组织化学染色结果显示(见图6),对照组小鼠肝脏中库普弗细胞均匀地分布在血窦中。模型组小鼠自肝损伤后第2 天开始,损伤区域的门静脉壁周围逐渐出现单核/巨噬细胞浸润; 此时,HHQG保肝组小鼠肝损伤区域门静脉周围几乎没有单核/巨噬细胞浸润。 肝损伤后第5 天,模型组小鼠肝脏的受损区域可见大量的单核/巨噬细胞浸润;此时,HHQG 保肝组小鼠的单核/巨噬细胞浸润明显减少,仅在门静脉周围损伤区域可见少量浸润。 肝损伤后第7 天, 模型组小鼠肝脏组织单核/巨噬细胞浸润逐渐消退,但门静脉和中央静脉周围仍可见部分单核/巨噬细胞浸润;此时,HHQG 保肝组小鼠的单核/巨噬细胞浸润基本完全消退, 肝血窦中巨噬细胞分布均匀。

图6 肝脏组织单核/巨噬细胞免疫组织化学染色观察(400×)
2.4 TNF-α 免疫组织化学染色观察及TNF-α 基因mRNA 相对表达量检测结果
2.4.1 TNF-α 免疫组织化学染色观察结果
免疫组织化学染色结果显示(见图7),对照组小鼠肝脏组织中TNF-α 几乎不表达; 与对照组相比,肝损伤后第2 天,模型组小鼠门静脉壁周围的损伤区域TNF-α 表达量迅速增加,而HHQG 保肝组小鼠相关区域TNF-α 的表达量明显下降。 肝损伤后第5 天,模型组小鼠肝脏组织的受损区域仍有比较明显的TNF-α 过表达;此时,HHQG 保肝组小鼠肝脏组织受损区域TNF-α 基本不表达。 肝损伤后第7 天, 模型组小鼠肝脏组织的受损区域TNFα 仍有少部分过表达, 而HHQG 保肝组小鼠肝脏组织的受损区域TNF-α 几乎不表达。
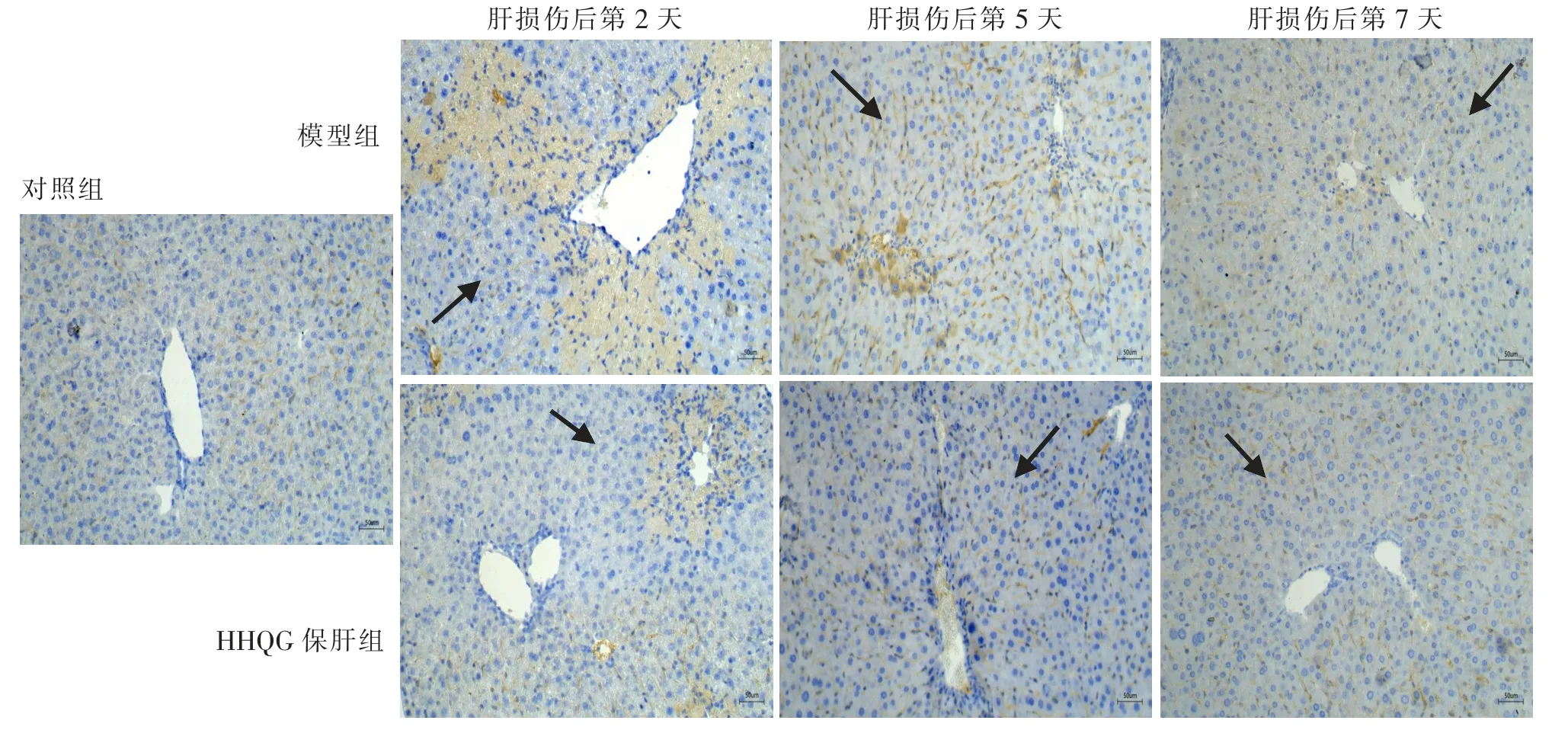
图7 肝脏组织TNF-α 免疫组织化学染色观察(200×)
2.4.2 TNF-α基因mRNA 相对表达量检测结果
由图8 可知,在CCl4诱导肝损伤后的第2、5、7天,与对照组相比,模型组小鼠肝脏组织中TNF-α基因的mRNA 相对表达量极显著(P<0.01)升高;与模型组相比, 肝损伤后第2、7 天以及第5 天,HHQG 保肝组的肝脏组织中TNF-α基因的mRNA相对表达量分别极显著(P<0.01)和显著(P<0.05)降低。
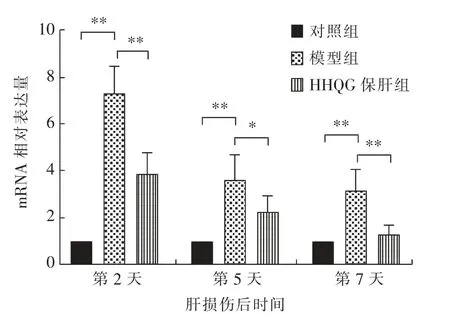
图8 肝脏组织中TNF-α 基因的mRNA 相对表达量测定结果
2.5 RNA-seq 分析HHQG 与黏附分子相关基因的表达
利用RNA-seq 技术分析了肝损伤后第5 天模型组和HHQG 保肝组与黏附分子相关的基因群。由图9A 可知, 相较于模型组,HHQG 保肝组与黏附分子相关的基因群显著下调, 相关基因包括Siglec1、H2-T24、H2-Q6、H2-DMb1、H2-Aa、Itgal、Sdc3、H2 -Ab1、Cd22、H2 -Eb1、Itga4、Selplg、H2 -DMa、Ptprc、Itgb7、Sell、Icam1、H2-T-ps、Vsir、Cd86、H2-T22、H2-D1、Cd40、Itga6、H2-Q2、Ptprm、Cdh4、H2-T23、Vcam1、Spn、Pecam1、H2-Q7、Jam2、Vcan、Vtcn1、Icam2、Cd2、Cdh5、Itga9。 如图9B 所示,网络中连线越多的节点发挥的作用越重要, 如细胞间黏附分子-1(ICAM-1)和血管细胞黏附分子-1(VCAM-1),因此,通过RT-qPCR 技术验证ICAM-1 和VCAM-1 基因的mRNA 相对表达量变化。
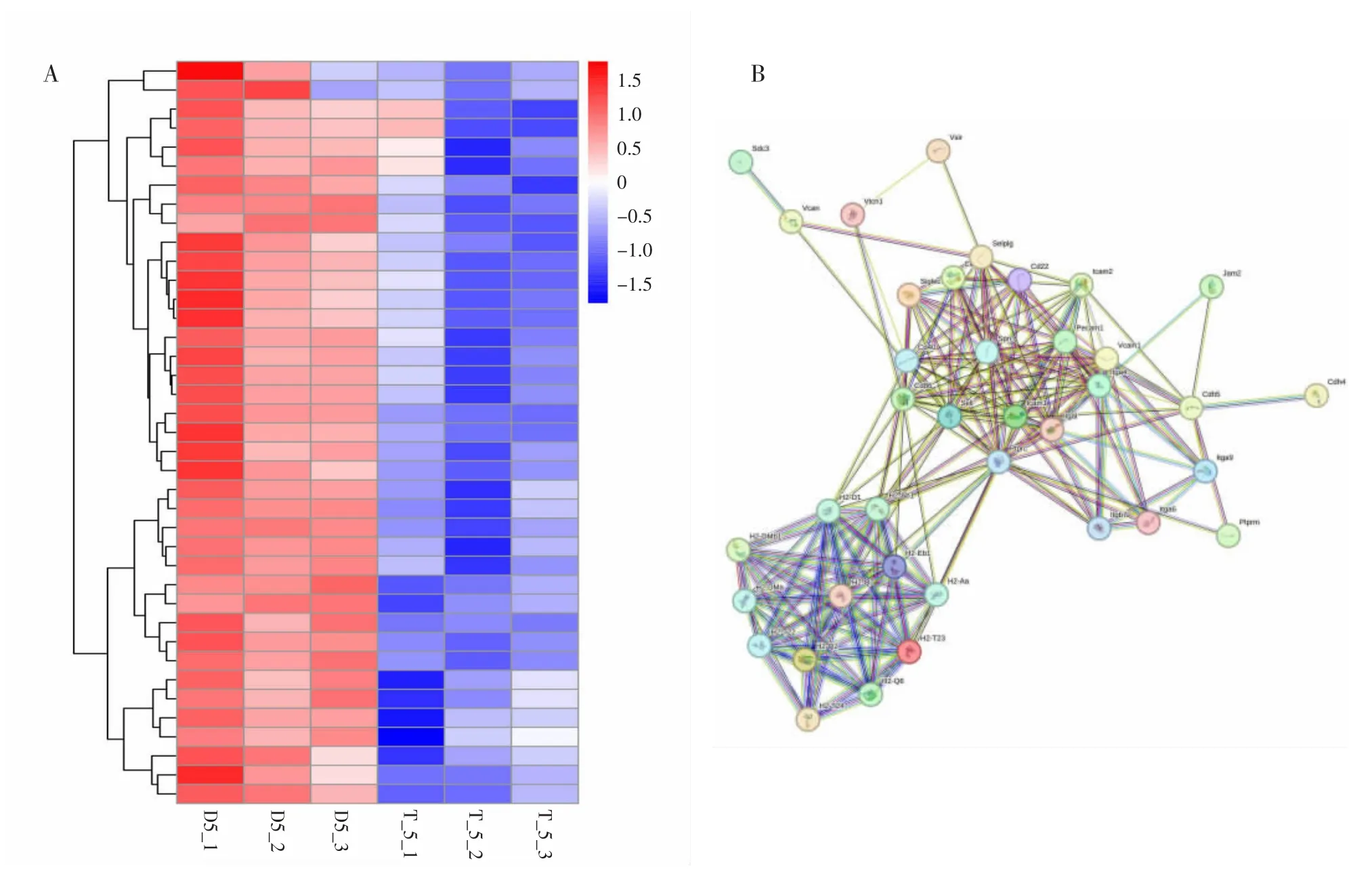
图9 HHQG 抑制黏附分子相关基因群分析
2.6 VCAM-1 和ICAM-1 基因的mRNA 相对表达量检测结果
由图10 和图11 可知, 在CCl4诱导肝损伤后的第2、5、7 天,与对照组相比,模型组小鼠肝脏组织中VCAM-1 和ICAM-1 基因的mRNA 相对表达量均显著(P<0.05)或极显著(P<0.01)升高;与模型组相比, 肝损伤后第2 天,HHQG 保肝组的肝脏组织中VCAM-1 基因的mRNA 相对表达量无显著(P>0.05) 差异, 但肝损伤后第5、7 天极显著(P<0.01)降低;与模型组相比,肝损伤后第2 天以及第5、7 天,HHQG 保肝组的肝脏组织中ICAM-1 基因的mRNA 相对表达量分别显著(P<0.05)和极显著(P<0.01)降低。
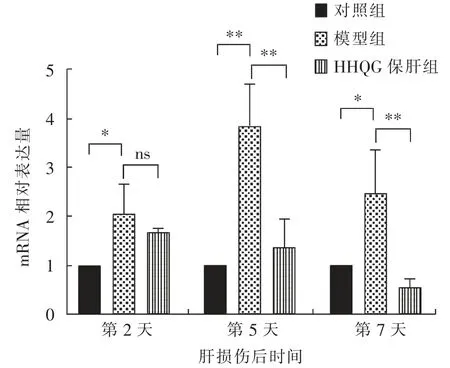
图10 肝脏组织中VCAM-1 基因的mRNA 相对表达量检测结果
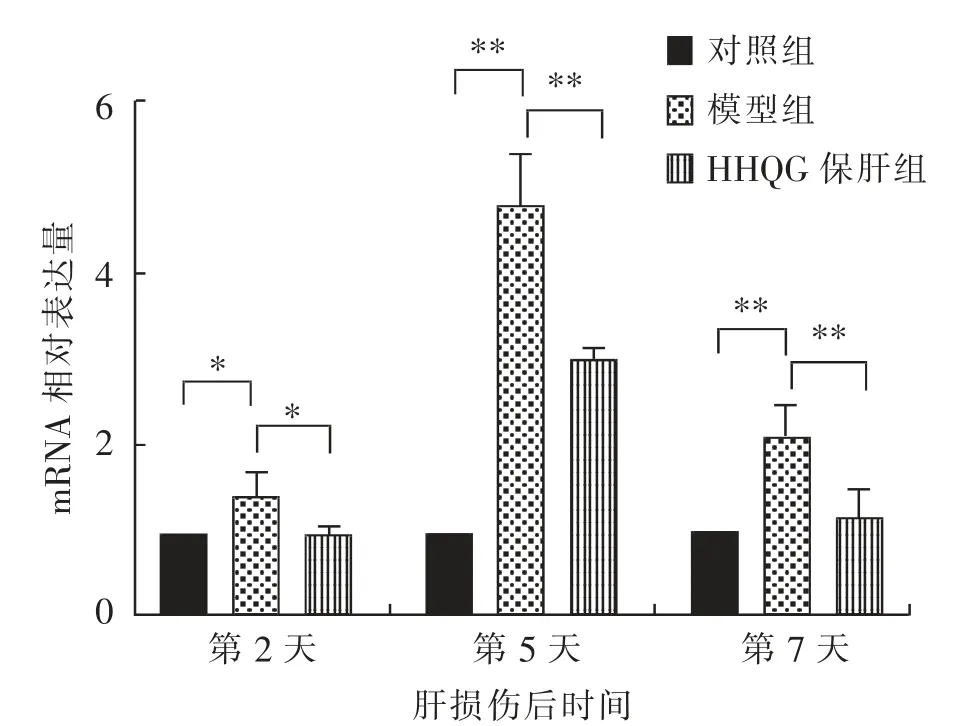
图11 肝脏组织中ICAM-1 基因的mRNA 相对表达量检测结果
3 讨论
肝损伤是肝脏在受到肝炎病毒感染、有毒药物或毒素侵害、酒精滥用等不良外源性因素作用引起的,以肝细胞凋亡或坏死、脂肪变性以及肝功能损害为主要特征的肝脏疾病[7]。 严重的急性肝损伤以及肝功能衰竭会诱发肝性脑病以及全身多器官衰竭等并发症,从而危害人体健康[8]。 肝损伤的防治是肝病临床治疗工作的重要环节,控制肝损伤的发生和发展对肝病的治疗具有重要的临床意义。蒙药HHQG 是目前临床上广泛应用的经典保肝方剂,但HHQG 发挥保肝作用的机理十分复杂,目前仍处于研究阶段。 CCl4诱导的肝损伤、肝纤维化和肝硬化模型是评估保肝药物效果的经典模型[9-10],因此,本研究使用CCl4诱导的小鼠急性肝损伤模型评估HHQG 的保肝作用。CCl4对肝脏的毒性作用初期表现为血清转氨酶活力显著升高,肝功能下降[11]。 本研究首先对各组小鼠血清中的ALT 和AST 活力进行检测, 结果显示, 模型组小鼠血清中的ALT 和AST 活力在肝损伤早期迅速显著升高,提示肝脏严重受损;此时,相较于模型组小鼠,HHQG 保肝组小鼠血清中的ALT 和AST 活力显著降低, 这一结果与文献报道的结果相似[12-14]。 有文献报道,高剂量HHQG 可以减轻肝脏病理损伤程度[12-13,15],因此,本研究分别对各组小鼠进行肝脏组织病理学检查,HE 染色和Masson 染色结果显示,CCl4可以造成肝脏组织大面积弥漫性坏死,并伴有大量胶原纤维物质沉积以及炎性细胞浸润, 而接受HHQG 干预的小鼠肝脏组织的损伤坏死面积明显缩小,胶原纤维物质沉积与炎性细胞浸润均明显减少。在肝损伤过程中,除了毒物本身及其代谢产物对肝细胞的直接损伤外,损伤后引起的免疫炎症反应也对肝损伤的发展至关重要[14]。 本研究组织病理学检查结果表明,HHQG 可以明显改善CCl4诱导的肝损伤,这可能与HHQG 减轻炎症细胞浸润密切相关。
笔者所在课题组前期开展的相关研究表明,HHQG 可能通过抗炎作用改善肝损伤[4]。 在此基础上,本研究对HHQG 改善肝损伤、发挥抗炎保肝的作用机制进行了进一步探索。很多中药通过抑制炎性因子表达发挥减轻炎症的作用。 例如,追风透骨胶囊通过抑制IL-1β、IL-6、TNF-α 和IFN-γ 等炎性因子表达缓解骨关节炎症[16],并通过减少单核/巨噬细胞浸润达到减轻炎症反应的效果;中草药产品PhytodolorR(STW 1)通过降低脂多糖(LPS)激活的单核/巨噬细胞TNF-α 和PTGS2 分泌水平发挥抗炎作用[17];槲皮素通过抑制中性粒细胞的过度炎症活动缓解类风湿性关节炎[18]。
中性粒细胞[19-21]和单核/巨噬细胞[22-24]是炎症反应中最重要的固有免疫细胞,因此,抑制肝损伤后与中性粒细胞和单核/巨噬细胞浸润有关的炎症反应是临床治疗肝损伤需要解决的关键问题[25]。本研究发现HHQG 可以抑制CCl4诱导的肝损伤组织中性粒细胞和单核/巨噬细胞浸润,从而发挥抗炎、促进受损肝组织修复的作用。 为了进一步探究HHQG 的抗炎机制,本研究对小鼠肝脏组织样本进行转录组测序分析, 结果表明,HHQG 可以显著下调大量黏附分子相关基因的表达水平。 ICAM-1 和VCAM-1 等黏附分子参与炎性细胞的运输[26]。VCAM-1 有助于调节炎症相关的血管黏附和巨噬细胞的跨内皮转移[27]。 本研究通过RT-qPCR 试验验证,HHQG 可抑制黏附分子ICAM-1 和VCAM-1的基因表达,但具体作用机制尚不明确。 TNF-α 作为肝损伤中重要的炎性因子[28],具有促炎的作用。在肝脏中,TNF-α 主要由库普弗细胞产生[29],其不仅可以直接诱导肝细胞凋亡造成肝损伤[30],促进血液中的单核细胞向肝脏大量浸润,而且可以诱导黏附分子ICAM-1 和VCAM-1 的 表达[31],介 导进一步的炎症反应,加重肝损伤。 本研究通过免疫组织化学技术和RT-qPCR 技术分析了小鼠肝脏组织中TNF-α 的表达情况,结果表明,HHQG 可在蛋白水平和基因水平上显著降低TNF-α 的表达, 进一步验证了HHQG 通过抑制炎性因子表达从而减轻肝脏炎症反应的作用机理。
4 结论
HHQG 通过减少以中性粒细胞和单核/巨噬细胞为主的炎性细胞浸润,下调肝损伤区域炎性因子TNF-α 的表达,以及抑制黏附分子的表达,减轻肝损伤后发生的炎症,从而发挥抗炎保肝作用。 本研究为今后进一步探索HHQG 改善肝损伤的多靶标治疗效应提供了参考。

