某院抗肿瘤药物说明书信息标注情况调查与分析
张裴,李欢欢,沈静
近年来,国家高度重视抗肿瘤药物管理,持续推进肿瘤诊疗体系建设,制定完善相关诊疗规范,加强肿瘤用药管理。自2018年起每年12月发布《新型抗肿瘤药物临床应用指导原则》[1-4],于2020年12月发布《抗肿瘤药物临床应用管理办法(试行)》[5]指出,抗肿瘤药物临床应用应当遵循安全、有效、经济的原则。医疗机构和医务人员应当以循证医学证据为基础,以诊疗规范、临床诊疗指南、临床路径和药品说明书等为依据,充分考虑药物临床治疗价值和可及性,合理应用抗肿瘤药物,加强医院抗肿瘤药物规范管理,提高抗肿瘤药物合理用药水平,以达到治疗肿瘤、提高患者生存率、改善患者生存质量的目的。
药品说明书是各个药品生产企业提供,由国家药监局批准,作为用药治疗过程中的法律依据,直接指导医务工作者与患者安全合理的使用药品。国内已有文献报道药品说明书存在标注信息内容缺失、不规范的现象。本文收集医院抗肿瘤药物说明书进行统计分析,为不断促进其临床规范、合理用药提供参考。
1 资料与方法
收集2021年新疆医科大学第五附属医院使用的抗肿瘤药物的说明书52份,选择最新版的说明书(截止到2022年3月31日前),根据《化学药品和治疗用生物制品说明书规范细则》《药品说明书和标签管理规定》等相关规定,对每份药品说明书中的所有项目,包括药品名称、剂型、成分、适应证、用法用量、药品不良反应、禁忌证、注意事项、特殊人群用药信息、药品相互作用、药品过量、药理作用、药代动力学、临床试验及贮藏等进行统计分析[6]。
2 结 果
2.1 基本情况 共收集说明书52份,根据药物作用机制分类包括:作用于DNA 8份、影响核酸合成10份、影响核酸转录6份、抑制蛋白质合成5份、激素类药物3份、靶向抗肿瘤药物15份,以及其他类药物5份。
2.2 标注内容统计 52种抗肿瘤药物,适应证、用法用量的标注率为100.00%,辅料标注率为55.77%。不良反应、注意事项、禁忌证、特殊人群、药物相互作用、临床试验、毒理研究及药代动力等标注率,见表1。药物不良反应的临床症状的标注率虽为100.00%,但并不是所有的药物都标注不同不良反应的发生占比,对其发生不良反应的处理措施的标注率仅为11种,占比21.15%。
2.3 辅料标注情况 辅料标注率为55.77%,其中静脉给药标注率为53.85%,非静脉给药标注率仅有1.92%,见表2。

表2 医院抗肿瘤药物辅料标注情况
2.4 特殊人群用药信息标注情况分析 特殊人群与一般患者的生理特点不同,较为独特,主要表现为对药物的耐受程度、反应性。抗肿瘤药物的不良反应较大,因此当特殊人群使用抗肿瘤药物时,更应严格参考用药说明书。根据统计,儿童的标注率为100.00%,妊娠期或哺乳期女性的标注率为76.92%,低于肝肾功能不全者和老年人,见表1。
2.5 贮藏条件标注情况分析 医院所使用的抗肿瘤药物的贮藏条件标注率为100.00%,关于温度、湿度、光线的标注情况见表3。
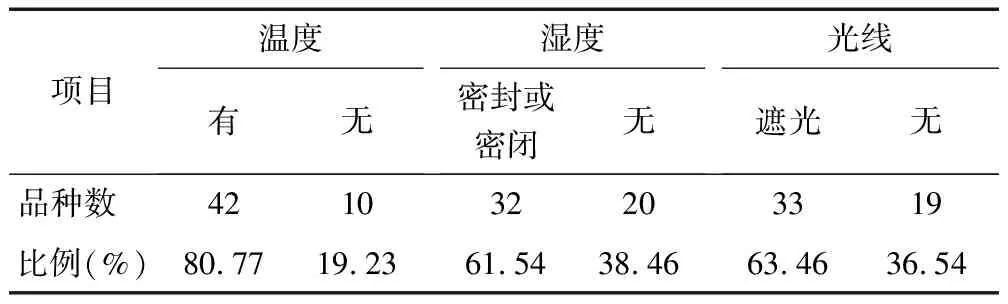
表3 医院抗肿瘤药物贮藏条件标注情况
3 讨 论
近年来,全球恶性肿瘤患者的发病率与病死率逐年升高。而我国庞大的人口基数,发病率、病死率也较高(发病率为23.7%、病死率为30.7%)[7]。药物治疗是抗肿瘤治疗中的重要手段之一,随着抗肿瘤新药的不断上市,2021年国家药品监督管理局批准了70余种创新药物上市,明显多于2019年、2020年单年上市新药数量。其中肿瘤领域共有35种药物的44项新适应证获批上市。恶性肿瘤的规范诊疗及合理用药日益受到临床的广泛关注。
药品说明书是传达药物关键信息的主要媒介及临床合理用药的重要指导依据,同时也是由药品生产企业提供的经国家市场监督管理总局审核批准的具有法律效力的法定文件[8]。医护工作者和患者用药前详细阅读药物说明书,可很大程度上避免不规范,减少药物对患者造成的损害。抗肿瘤药物说明书相关信息缺失会影响用药安全,且抗肿瘤药物毒性较大,一旦有细节问题未注意,可能会造成难以逆转的后果。药品说明书标注的不完善,使其失去了应有的参考价值。
本研究对医院使用抗肿瘤药物说明书进行统计分析,结果显示项目标注情况不完善。辅料是药物制剂的重要组成部分,尤其是注射剂,在其制备过程中,常加入pH调节剂、增溶剂、抑菌剂、抗氧剂、填充剂等辅料使药物更加稳定,增加主药的浓度,抑制细菌生长繁衍,降低注射时的疼痛感,最终确保药物的安全、有效及稳定[9-10]。医院静脉给药和非静脉给药途径的抗肿瘤药物对比显示,静脉给药途径的抗肿瘤药物的辅料标注率高于非静脉给药。医院所使用的抗肿瘤药物35种(67.31%)给药方式为静脉给药,是通过静脉把含药物的液体输入到体内的一种治疗方法,起效快,而部分不良反应与辅料密切相关。如医院的注射用紫杉醇,其辅料为聚氧乙基代蓖麻油、无水乙醇。聚氧乙烯蓖麻油(CrEL)是非离子型表面活性剂,常用于增加注射液中难溶性药物的溶解度等。近年来有研究发现,CrEL不仅是辅料,还具有一定的药理作用,并导致了一些不良反应。如CrEL可使紫杉醇的溶解度增加,但也可产生严重过敏反应、外周神经病变等[11-12]。对于CrEL引起的急性过敏反应,若要降低其发生率,可提前使用高剂量糖皮质激素、组胺受体拮抗剂,或是改用玻璃或其他输液装置。乙醇肌内注射或皮下注射刺激性大,乙醇的浓度与不良反应也有相关性,当其浓度≥10%时,会导致机体发生急剧溶血[13]。故静脉注射时,可在浓度<10%的乙醇中添加0.9%或0.6%的氯化钠注射液防止发生溶血。
药物不良反应的临床症状标注率虽为100.00%,但并不是所有的药物都标注不同不良反应的发生占比。尤其应对其发生不良反应的处理措施的标注率仅为21.15%,表明52种药物中只有少数药物如靶向抗肿瘤药物中的甲苯磺酸索拉非尼片和盐酸安罗替尼胶囊等标注了如何应对不良反应,剩下的41种药物都未标注如何应对不良反应。药物使用注意事项中关于影响疗效的标注并不明确,仅15%左右的少量药物如基于HER2基因扩增和蛋白质过度表达检测结果会影响注射用曲妥珠单抗的疗效等[14]。抗肿瘤药物的不良反应有很多,大部分的化疗药物都要经过肝、肾代谢,因此会影响患者的肝肾功能,关于此药物是否会影响肝肾功能的标注率为67.31%,仍有32.69%的药物并未标注使用此药物是否会影响患者的肝肾功能。患者在用药过程中需要注意的具体内容标注情况很全面,只有少数的药物如注射用硼替佐米未标注用药过程中应注意事项。其他药物如注射用曲妥珠单抗等在说明书中标注使用过程中需要注意心脏风险高的患者慎用[15]。
特殊人群与一般患者的生理特点不同,主要表现为对药物的耐受程度、反应性。抗肿瘤药物不良反应较大,当特殊人群使用抗肿瘤药物时,更应严格参考用药说明书,药品说明书在标注此项信息时,应全面详细。目前许多儿童、肝肾功能不全者及妊娠期或哺乳期女性也需要使用抗肿瘤药物,如儿童肿瘤类发病率居于首位的是白血病,其治疗的常见药物有长春新碱、甲氨蝶呤和门冬酰胺酶等,以医院培门冬酶注射液为例,其说明书标注的儿童用法用量为14 d 82.5 IU/kg。儿童肿瘤发病在儿童死因顺位排序中占第二[16]。根据我国第3次死因调查显示,不同年龄段的儿童恶性肿瘤的死因排名不同,在0岁、1~4岁、5~14岁的儿童中,恶性肿瘤的死因排名分别为第9位、第5位、第2位,仅次于损伤中毒。对于医院使用的抗肿瘤药物说明书信息中,儿童用药信息标注率虽为100.00%,但存在许多药品儿童并不能使用,部分药品说明书中仅标示“儿童禁用的、慎用的”“尚未明确”“尚无充足的安全性研究资料”等内容,许多可用于治疗其他类型肿瘤的药物,如可用于治疗霍奇金淋巴瘤、肝癌的卡瑞利珠单抗在儿童用药项下标注的内容为“尚未确立安全性和疗效”,而无明确的儿童用法用量信息给临床用药提供指导。妊娠期或哺乳期女性也有同样的情况,一般是通过FDA妊娠分级对孕妇是否用药达到指导作用,未标注具体的用法用量。老年患者的用药信息标注也存在有模糊的词汇,如医院所用的注射用盐酸表柔比星的老年患者用药仅模糊标注“老年患者心功能减退者宜慎用或减量”,未标注具体应该减少的剂量。
温度对药品质量影响不容忽视,不适宜的温度会导致药品变性、变质,降低疗效。一般温度越高,会加快挥发性成分的挥发,催化药品的各类反应,使部分药物灭活失效。温度过低,使药物的溶解度降低,发生混浊或析出结晶,使水针冻裂,生物制品冻结后可能会失去活性等[17]。每种药品在上市前均已进行稳定性相关试验,其贮藏温度数据是经过科学验证的[18]。
综上所述,药品说明书是临床用药的第一法定依据,为临床正确使用药品、减少不良反应提供了重要参考依据。针对目前抗肿瘤药物说明书内容尚不规范、项目缺失等问题,建议相关监督管理部门应高度重视药物说明书相关内容的规范及完善,为患者提供更安全、有效的用药保障。
利益冲突所有作者声明无利益冲突

