依达拉奉右莰醇治疗进展性脑梗死的临床效果及对脑细胞的保护作用
谢丽萍
脑梗死是因脑组织缺血缺氧性损伤坏死造成的一种不可逆性功能损伤,为神经内科常见、高发性疾病,具有高致残率、高复发率等特点。研究发现,部分脑梗死患者在发病数小时内神经功能迅速进展,出现不同程度的损伤。临床认为脑梗死有多种发病机制,涉及能量代谢障碍、大量释放兴奋性递质、大量生成自由基、钙超载及发生炎性反应等,相互作用交联,造成恶性循环[1]。单一药物无法调控以上复杂的级联反应,需联合应用多种药物。依达拉奉右莰醇是我国新上市的第一代创新药物,是一种复方依达拉奉注射液[2]。该药物对缺血损害中炎性反应相关蛋白的表达具有良好抑制作用,可起到协同增效效果,对脑梗死患者预后具有积极意义[3]。本研究观察依达拉奉右莰醇治疗进展性脑梗死的临床效果及对脑细胞的保护作用,报道如下。
1 资料与方法
1.1 临床资料 选取2020年6月—2022年6月当阳市人民医院收治的进展性脑梗死患者60例,根据随机数字表法分为观察组和对照组,各30例。观察组男17例,女13例;年龄50~83(66.83±4.79)岁;梗死部位:基底节区13例,脑叶皮质5例,放射冠区或半卵圆中心7例,脑干梗死5例。对照组男18例,女12例;年龄48~82(66.14±4.51)岁;梗死部位:基底节区12例,脑叶皮质6例,放射冠区或半卵圆中心6例,脑干梗死6例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会审核批准,患者及家属已知晓研究内容并签署知情同意书。
1.2 选择标准 纳入标准:符合《中国急性缺血性脑卒中诊治指南(2018年)》中急性脑梗死诊断标准;发病到入院时间≤48 h;美国国立卫生研究院卒中量表(NIHSS)评分4~24分。排除标准:对本研究用药有禁忌证者;既往接受过静脉溶栓治疗及血管内介入者;既往脑梗死遗留神经功能障碍者;并发心房颤动者;存在心脏瓣膜病变者;活动性出血者;合并脑动脉瘤者。
1.3 治疗方法 2组均接受常规治疗方案,予阿司匹林肠溶片(拜耳医药保健有限公司生产)100 mg口服,每天1次;硫酸氢氯吡格雷片(深圳信立泰药业股份有限公司生产)75 mg口服,每天1次;阿托伐他汀钙片(北京嘉林药业股份有限公司生产)20 mg睡前口服,每天1次;注射用血栓通(冻干)[广西梧州制药(集团)股份有限公司生产]500 mg混合0.9%氯化钠注射液250 ml静脉滴注,每天1次;银杏内酯注射液(成都百裕制药股份有限公司生产)10 ml混合0.9%氯化钠注射液250 ml缓慢静脉滴注,每天1次;丁苯酞氯化钠注射液(石药集团恩必普药业有限公司生产)100 ml静脉滴注,每天2次。治疗过程中维持正常进食,如经口进食困难者实施肠外营养;合并高血压、糖尿病者,积极控制血压、调节血糖;伴明显脑水肿占位者,应用甘露醇、甘油果糖等。
在上述基础上,对照组予依达拉奉注射液(南京先声东元制药有限公司生产,规格:20 ml ∶30 mg)30 mg混合0.9%氯化钠注射液100 ml静脉滴注,每天2次。观察组予依达拉奉右莰醇注射用浓溶液[先声药业有限公司生产,规格:5 ml(10 mg ∶2.5 mg)]15 ml混合0.9%氯化钠注射液100 ml静脉滴注,每天2次。2组均持续用药2周。
1.4 观察指标与方法 (1)改良Rankin量表(mRS)评分、NIHSS评分:于治疗前后进行评估,其中mRS总分0~6分,0分为无临床症状,6分为死亡,0~2分表示患者预后良好;NIHSS评分范围0~42分,分值越高表明神经受损越严重。(2)神经功能指标:治疗前后采集患者空腹血液样本,离心处理后取血清,采用酶联免疫吸附试验测定神经元特异性烯醇化酶(NSE)、脑源性神经营养因子(BDNF)、胰岛素样生长因子-1(IGF-1)水平。(3)炎性因子:治疗前后采用酶联免疫吸附法测定白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、超敏C反应蛋白(hs-CRP)水平。(4)氧化应激指标:治疗前后应用分光光度计检测超氧化物歧化酶(SOD)水平,应用硫代巴比妥酸比色法测定丙二醛(MDA)水平。(5)不良反应:包括肝功能异常、消化道反应、颅内出血及皮疹等。
1.5 疗效评定标准 依据《中国急性缺血性脑卒中诊治指南(2018年)》评定,显效:治疗后患者NIHSS评分下降幅度>80%;有效:治疗后患者NIHSS评分下降幅度30%~80%;无效:治疗后患者NIHSS评分下降幅度<30%。总有效率=(显效+有效)/总例数×100%。
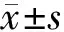
2 结 果
2.1 临床疗效比较 观察组治疗总有效率为93.33%,高于对照组的73.33%(χ2=4.320,P=0.037),见表1。

表1 对照组与观察组临床疗效比较 [例(%)]
2.2 mRS评分、NIHSS评分比较 治疗前,2组mRS评分、NIHSS评分比较差异无统计学意义(P>0.05);治疗2周后,2组mRS评分、NIHSS评分低于治疗前,且观察组低于对照组(P<0.05或P<0.01),见表2。

表2 对照组与观察组治疗前后mRS评分、NIHSS评分比较分)
2.3 神经功能指标比较 治疗前,2组NSE、BDNF、IGF-1水平比较差异无统计学意义(P>0.05);治疗2周后,2组NSE水平较治疗前降低,BDNF、IGF-1水平较治疗前升高,且观察组降低/升高幅度大于对照组(P<0.05或P<0.01),见表3。
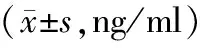
表3 对照组与观察组治疗前后神经功能指标比较
2.4 炎性因子水平比较 治疗前,2组IL-1β、TNF-α、hs-CRP水平比较差异无统计学意义(P>0.05);治疗2周后,2组IL-1β、TNF-α、hs-CRP水平低于治疗前,且观察组低于对照组(P均<0.01),见表4。

表4 对照组与观察组治疗前后炎性因子水平比较
2.5 氧化应激指标比较 治疗前,2组SOD、MDA水平比较差异无统计学意义(P>0.05);治疗2周后,2组SOD水平高于治疗前,MDA水平低于治疗前,且观察组高/低于对照组(P<0.05或P<0.01),见表5。

表5 对照组与观察组治疗前后氧化应激指标比较
2.6 不良反应比较 观察组与对照组不良反应总发生率比较差异无统计学意义(10.00% vs. 20.00%,χ2=0.523,P=0.470),见表6。

表6 对照组与观察组不良反应比较 [例(%)]
3 讨 论
脑梗死是因血液供应障碍所造成的一种脑部疾病,具有较高的发病率和病死率。脑梗死存在多种病因及发生机制,治疗关键在于清除自由基、抑制炎性反应,促进神经功能恢复。溶栓治疗具有严格时间窗,通常发病时间>6 h者,主要采取内科治疗手段。
依达拉奉属于抗氧化剂自由基清除剂,可通过血脑屏障,发挥细胞膜抗氧化作用,同时清除自由基,降低脑细胞膜损伤,以保护脑细胞,改善脑梗死患者预后[4]。依达拉奉右莰醇注射用浓溶液是在依达拉奉基础上添加右莰醇结构,组成最佳配比为4∶1,血脑屏障通透率为60%,含有互变异构体3种,可转化为阴离子形式,与中性形式依达拉奉相比,阴离子形式的依达拉奉能更快清除羟基自由基。该药物可降低黄嘌呤氧化酶活性,促进前列环素合成,清除羟基自由基,减轻细胞毒性,避免大量氧自由基造成继发性脑损伤,调节脑血流动力学,缓解脑水肿,减小梗死面积[5]。
IGF-1由中枢神经系统中神经元和胶质细胞分泌,具有促进增殖作用,从而修复神经损伤;BDNF具有神经营养和神经生长作用,可在缺血缺氧状态下保护神经元,使神经细胞增殖并促进神经功能恢复[6]。NSE、BDNF为大脑神经生化标志物,是中枢神经损伤程度评估的重要指标[7]。本研究结果显示,观察组治疗后mRS评分、NIHSS评分与NSE水平低于治疗前与对照组,BDNF、IGF-1水平高于治疗前与对照组。依达拉奉右莰醇具有良好抗炎、清除氧自由基作用,可协同增效,发挥显著脑细胞保护作用,促进神经功能恢复,改善患者预后[8]。
脑梗死发生后缺血灶大量释放炎性因子,引起“级联反应”,其中较为典型的炎性因子是IL-1β、TNF-α及hs-CRP。TNF-α可激活巨噬细胞产生及炎性反应的多条通路,通过细胞毒性损害及凝血机制障碍,造成神经功能损害,是脑梗死患者神经功能损害的始动调节因子。IL-1β通过诱导神经元细胞凋亡参与脑卒中神经损伤的炎性反应[9-10]。hs-CRP水平与脑梗死患者病情严重程度呈正比。SOD、MDA为抗氧化酶,其水平低说明氧自由基清除效果好。本研究结果显示,观察组治疗后IL-1β、TNF-α、hs-CRP、MDA水平低于对照组,SOD水平高于对照组。右莰醇具有良好的抗炎作用,为双环单萜类炎性因子抑制剂,不仅可抑制炎性因子表达,还可与依达拉奉发挥协同作用,阻断炎性反应、氧化应激的循环作用,以减轻脑梗死患者神经功能损伤[11];且还能改善脑血管通透性,提高SOD活性,以增强抗氧化能力,减少细胞凋亡,降低缺血再灌注损伤,减小梗死面积[12]。
本研究结果显示,2组不良反应总发生率比较差异无统计学意义;说明使用依达拉奉右莰醇治疗安全性高,分析原因为右莰醇对GABAAR亚型高度亲和且具有高选择性,效果温和,不良反应低。
综上所述,依达拉奉右莰醇治疗进展性脑梗死的疗效显著,可明显改善神经功能并抑制炎性反应,清除机体内自由基,降低氧化应激反应,发挥显著脑细胞保护作用,且安全性较高。
利益冲突所有作者声明无利益冲突

