木犀草素通过TLR4/PI3K/AKT通路对子痫前期大鼠胎盘血管生成及细胞凋亡的影响
曾克非 夏婷婷 吴小兰 雷祥华
(1.井冈山大学附属医院妇产科, 吉安 343000;2.井冈山大学附属医院生殖医学科,吉安 343000)
子痫前期(preeclampsia,PE)是一种妊娠期特有的疾病,以蛋白尿和高血压为主要表现,可导致胎盘持续性缺氧缺血,进而引发炎症,造成胎盘滋养层细胞凋亡及血管生成受损,影响胎儿器官发育,并损害母体健康,是孕产妇死亡的主要原因之一[1-2]。在PE发病过程中,炎症反应是导致胎盘功能受损的主要病理基础,抗炎治疗是改善PE患者临床症状的有效策略[3-4]。动物实验研究表明,Toll样受体4(Toll-like receptor 4,TLR4)是调控炎症反应的重要信号分子,下调TLR4表达可抑制磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase/protein kinase B,PI3K)/蛋白激酶B(protein kinase B,AKT)通路蛋白磷酸化,抑制小鼠促炎细胞因子产生,保护关节及肝组织免于炎症损伤[5-6]。研究发现,下调TLR4还可通过抑制PE大鼠炎症因子表达而恢复其螺旋动脉重塑,促使胎儿生长[7],而侯敬等[8]研究显示PI3K/AKT信号在PE发病过程中具有重要作用,其通路蛋白在早发型PE患者体内表达明显升高,由此可知,下调TLR4/PI3K/AKT信号激活可能是防治PE的分子作用机制之一。木犀草素最初提取自木犀草茎、枝、叶中,是一种具有明显抗炎功效的天然化合物,可通过下调TLR4/NF-κB通路表达改善变应性鼻炎大鼠Th1/Th2失衡,减轻鼻黏膜炎症损伤[9]。有研究显示,木犀草素是银杏叶的主要活性成分,可治疗高血压[10]。但木犀草素是否能够通过TLR4/PI3K/AKT通路降低血压,改善PE引发的胎盘血管生成受损及细胞凋亡还不清楚,本研究通过建立PE大鼠模型对此进行探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠购自上海昇敞生物科技有限公司,生产许可证号:SCXK(沪)2021-0002,雌性(76只)体质量180~210 g,雄性(38只)体质量270~310 g,SPF级,在井冈山大学附属医院屏障环境动物中心适应饲养1周,4~6只/笼,明暗各12 h交替照明,动物房温度、湿度分别为22~25 ℃、50%~60%,通风换气10~20次/h。本实验经井冈山大学附属医院生物医学研究伦理委员会审批[伦批2023第(81)号]。
1.1.2 主要试剂与仪器 N-硝基-L-精氨酸甲酯(L-NAME,FT011014)购于上海梵态生物科技有限公司;腺病毒包装的TLR4过表达载体(含有空载对照)购于苏州吉玛基因股份有限公司;大鼠IL-6 ELISA试剂盒、木犀草素(HPLC纯度≥98%)、大鼠IL-17 ELISA试剂盒购于北京索莱宝科技有限公司(货号SEKR-0005、SL8300、SEKR-0007);TUNEL细胞凋亡原位检测试剂盒、BCA法总蛋白定量测定试剂盒、肿瘤坏死因子-α(TNF-α)测试盒、高强度RIPA裂解液购于南京建成生物工程研究所(货号:G001-1-1、A045-3-2、H052、W062-1-1);大鼠二步法免疫组化试剂盒购于北京中杉金桥公司(货号ZLI-9017);羊抗兔二抗、兔源Anti-BCL2相关X蛋白(BCL2-associated X protein,Bax)一抗、兔源Anti-天冬氨酸特异性半胱氨酸蛋白酶3(caspase-3)一抗、兔源Anti-B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)一抗、兔源Anti-CD31一抗、兔源Anti-GAPDH一抗、兔源Anti-TLR4一抗、兔源Anti-PI3K一抗、兔源Antip-PI3K一抗、兔源Anti-p-AKT一抗、兔源Anti-AKT一抗购于美国Abcam公司(货号ab150077、ab32503、ab184787、ab196495、ab281583、ab181602、ab13867、ab133595、ab182651、ab38449、ab179463等)。
血压测量仪购于中国成都泰盟科技有限公司(型号:BL-410);全自动生化分析仪购于美国Beckman Coulter公司(型号:AU2700);酶标仪购于美国Bio Tek公司(型号:Synergy H4);石蜡包埋机、切片机购于德国MEDITE公司(型号TES99、BM2135);倒置显微镜购于德国Leica公司(型号:DMIL/DFC295);蛋白电泳仪购于美国Hoefer公司(型号:SE300);转印电泳仪购于中国北京六一生物科技有限公司(型号:DYCZ-40D);化学发光凝胶成像仪购于美国Bio-Rad公司(型号:Transilluminator)。
1.2 方法
1.2.1 建立PE大鼠模型及分组给药 将大鼠以2∶1的雌雄比例合笼,交配后获得孕鼠72只(观察到阴栓),随机平分为6组:对照组、模型组、木犀草素组、TLR4过表达载体组、TLR4空载组、木犀草素+TLR4过表达载体组,以阴栓脱落作为孕1 d,除对照组外,其余各组大鼠于孕10 d向其臀部皮下注射L-NAME,剂量为100 mg/kg[11],对照组大鼠同时皮下注射等剂量0.9%NaCl溶液,所有大鼠均每天注射1次,持续至孕18 d,大鼠妊娠晚期平均动脉压与24 h尿蛋白含量显著升高,表明PE模型制备成功。
将木犀草素溶于0.9%NaCl溶液中,制成4 mg/ml的药液[12],木犀草素组、木犀草素+TLR4过表达载体组大鼠以10 ml/kg的剂量灌胃给药,每日1次;TLR4过表达载体组、TLR4空载组、木犀草素+TLR4过表达载体组大鼠静脉注射0.5 ml腺病毒包装的载体(TLR4过表达载体、空载对照浓度按照说明书设置)[13],每周1次,对照组和模型组大鼠以10 ml/kg剂量每日灌胃给药木犀草素1次,同时每周静脉注射0.5 ml 0.9%NaCl溶液1次,各组大鼠均于孕13 d给药,共给药1周。
1.2.2 测定大鼠妊娠晚期24 h尿蛋白含量及平均动脉压 使用代谢笼收集孕20 d大鼠24 h内的尿液,以生化分析仪测出其中尿蛋白含量;采用血压测量仪测定孕20 d大鼠尾根部的收缩压和舒张压,计算平均动脉压=(收缩压+舒张压×2)/3。
1.2.3 检测大鼠妊娠结局状况及收集标本 以乙醚麻醉孕21 d大鼠,采集尾静脉血1.3 ml静置离心,于-80 ℃冰箱中保存上清备用;然后打开子宫,取出胎鼠和胎盘,测量胎鼠体质量并计数,获得平均子代体质量和平均子代数目;以手术剪取0.4 g胎盘组织,加入裂解液剪碎、匀浆、离心,以BCA法测出上清中总蛋白浓度后将其调至各组相等,最后分组标记,于-80 ℃冰箱中保存备用;剩余胎盘组织清洗、固定、脱水后,以仪器进行包埋、切片备用。
1.2.4 测定大鼠血清炎症因子IL-6、TNF-α、IL-17水平 提前取出1.2.3中的血清,以冰水浴慢慢解冻,采用试剂盒测定其中炎症因子IL-6、TNF-α、IL-17水平,具体步骤参照各自试剂盒说明书进行。
1.2.5 检测大鼠胎盘组织血管生成及细胞凋亡状况 取出1.2.3中的胎盘组织切片,每只大鼠选3张于37.5 ℃下脱蜡(二甲苯孵育15 min)、水化(100%~70%乙醇依次孵育10 min)、封闭(5%牛血清白蛋白孵育3 h)后,4 ℃孵育CD31一抗(稀释比例1∶250)过夜,洗涤,37.5 ℃孵育二抗(稀释比例1∶500) 3 h,使用试剂盒进行免疫组化染色,再次洗涤、脱水后透明、封片,任选镜下5个视野拍照,以显微镜所带有的病理分析软件分析计算出CD31阳性细胞比例;每只大鼠再次选出3张切片,以上述相同方法脱蜡、水化后,TUNEL染色、洗涤、脱水、透明、封片,显微镜下观察并拍照,同样以病理分析软件分析计算凋亡细胞比例。
1.2.6 大鼠胎盘组织TLR4/PI3K/AKT通路蛋白水平检测 取出1.2.3中的胎盘组织蛋白样品液,以冰水浴慢慢解冻,各组均取20 μg蛋白100 ℃煮沸5 min变性,上样电泳后湿转,均于120 V电压下进行80 min,然后将分离转移到膜上的蛋白于37.5 ℃封闭(3%牛血清白蛋白孵育2 h),然后4 ℃分别孵育一抗(Anti-GAPDH、Anti-TLR4、Anti-PI3K、Anti-p-PI3K、Anti-p-AKT、Anti-AKT、Anti-Bax、Anti-caspase-3、Anti-Bcl-2)过夜稀释比例分别为1∶2 000、1∶3 000、1∶2 500、1∶1 000、1∶1 500、1∶2 000、1∶2 500、1∶1 500、1∶1 000,以TBST洗膜(3次,6 min/次)后37.5 ℃孵育二抗(稀释比例1∶1 000) 2 h,再次以TBST洗膜(3次,6 min/次)后,以化学发光法使蛋白条带显色,拍照,以Image J软件定量条带灰度值,对其进行统计分析后得到各蛋白相对表达水平。
1.3 统计学分析 实验数据以±s表示,采用SPSS24.0软件进行统计学分析,两组间差异比较采用t检验;组间差异比较采用单因素方差分析,两两之间进一步比较行SNK-q检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量测定结果 与对照组相比,模型组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量显著升高(P<0.05)。与模型组、木犀草素+TLR4过表达载体组分别相比,木犀草素组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量均显著降低(P<0.05);TLR4过表达载体组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量均显著升高(P<0.05)。与模型组相比,TLR4空载组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量(±s,n=12)Tab.1 Average arterial pressure in third trimester of pregnancy and 24-hour urinary protein content of rats in each group (±s,n=12)
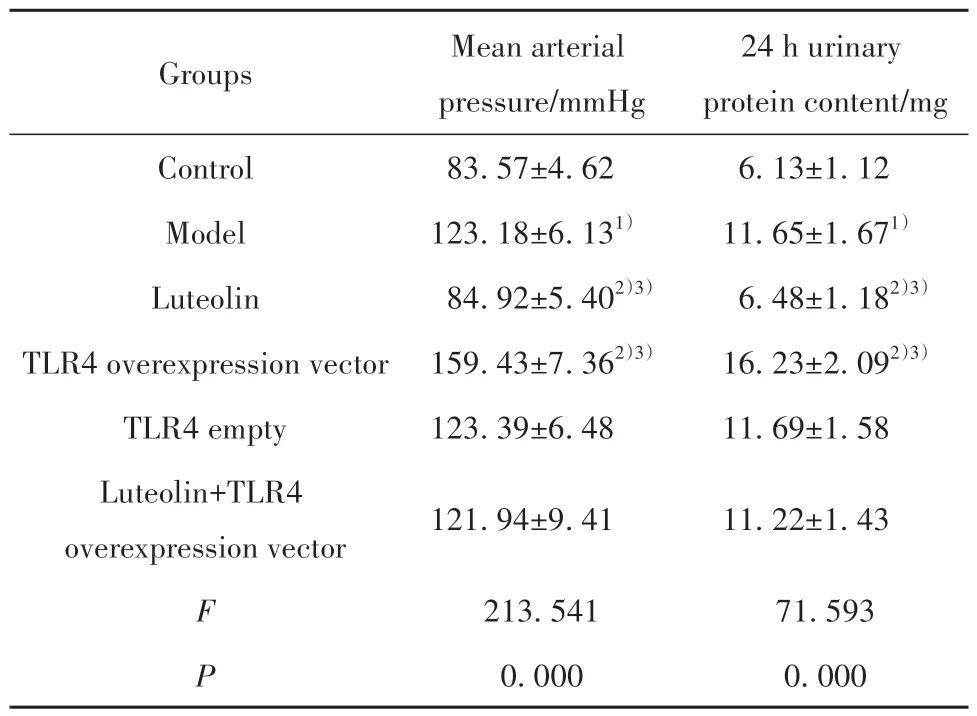
表1 各组大鼠妊娠晚期平均动脉压与24 h尿蛋白含量(±s,n=12)Tab.1 Average arterial pressure in third trimester of pregnancy and 24-hour urinary protein content of rats in each group (±s,n=12)
Note:1)P<0.05 vs control group; 2)P<0.05 vs model group; 3)P<0.05 vs luteolin+TLR4 overexpression vector group.
Groups Control Model Luteolin TLR4 overexpression vector TLR4 empty Luteolin+TLR4 overexpression vector Mean arterial pressure/mmHg 83.57±4.62 123.18±6.131)84.92±5.402)3)159.43±7.362)3)123.39±6.48 24 h urinary protein content/mg 6.13±1.12 11.65±1.671)6.48±1.182)3)16.23±2.092)3)11.69±1.58 121.94±9.41 11.22±1.43 71.593 0.000 F P 213.541 0.000
2.2 各组大鼠妊娠结局情况检测结果 与对照组相比,模型组大鼠平均子代数目及平均子代体质量显著降低(P<0.05)。与模型组、木犀草素+TLR4过表达载体组分别相比,木犀草素组大鼠平均子代数目及平均子代体质量均显著升高(P<0.05);TLR4过表达载体组大鼠平均子代数目及平均子代体质量均显著降低(P<0.05)。与模型组相比,TLR4空载组大鼠平均子代数目及平均子代体质量差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠平均子代数目及平均子代体质量(±s,n=12)Tab.2 Average offspring number and average offspring weight of rats in each group (±s, n=12)
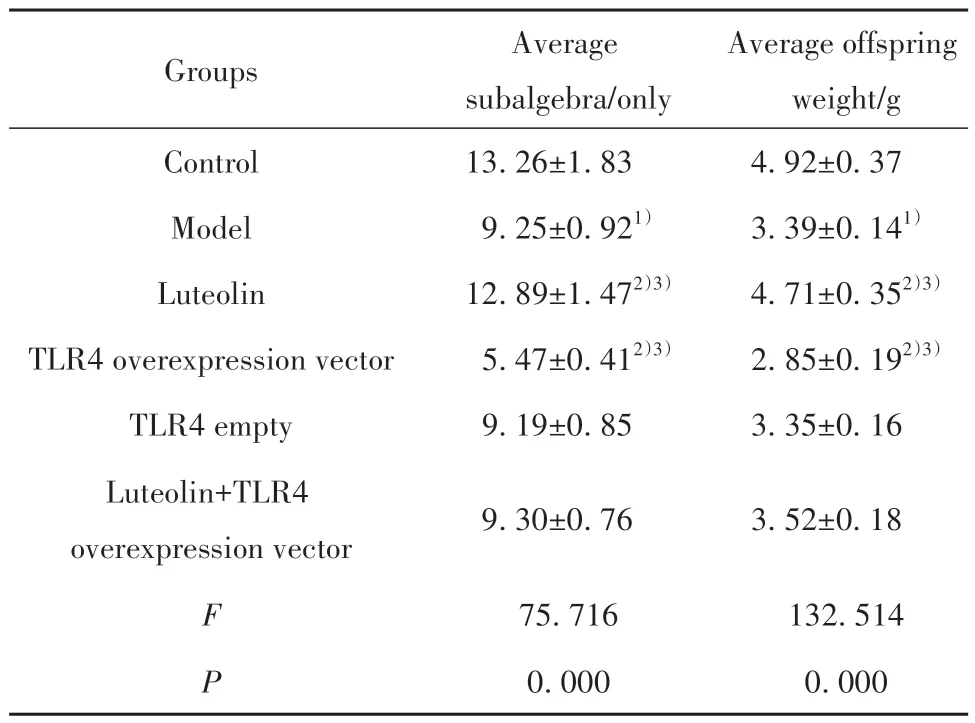
表2 各组大鼠平均子代数目及平均子代体质量(±s,n=12)Tab.2 Average offspring number and average offspring weight of rats in each group (±s, n=12)
Note:1)P<0.05 vs control group; 2)P<0.05 vs model group; 3)P<0.05 vs luteolin+TLR4 overexpression vector group.
Groups Control Model Luteolin TLR4 overexpression vector TLR4 empty Luteolin+TLR4 overexpression vector Average subalgebra/only 13.26±1.83 9.25±0.921)12.89±1.472)3)5.47±0.412)3)9.19±0.85 Average offspring weight/g 4.92±0.37 3.39±0.141)4.71±0.352)3)2.85±0.192)3)3.35±0.16 9.30±0.76 3.52±0.18 132.514 0.000 F P 75.716 0.000
2.3 各组大鼠胎盘微血管密度测定结果 与对照组相比,模型组大鼠胎盘组织CD31阳性细胞比例显著降低(P<0.05)。与模型组、木犀草素+TLR4过表达载体组分别相比,木犀草素组大鼠胎盘组织CD31阳性细胞比例均显著升高(P<0.05);TLR4过表达载体组大鼠胎盘组织CD31阳性细胞比例均显著降低(P<0.05)。与模型组相比,TLR4空载组大鼠胎盘组织CD31阳性细胞比例差异无统计学意义(P>0.05)。见图1、表3。
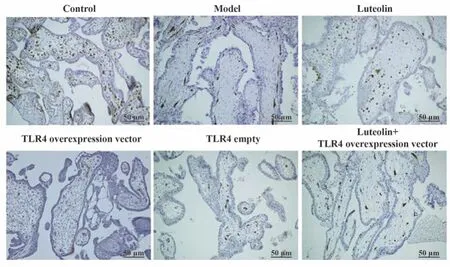
图1 免疫组化学染色检测胎盘组织CD31表达(微血管密度)(×100)Fig.1 Expression of CD31 (microvessel density) in placental tissue detected by immunohistochemical staining (×100)
表3 各组大鼠胎盘组织CD31阳性细胞比例(±s,n=12)Tab.3 Proportion of CD31 positive cells in placental tissue of rats in each group (±s,n=12)
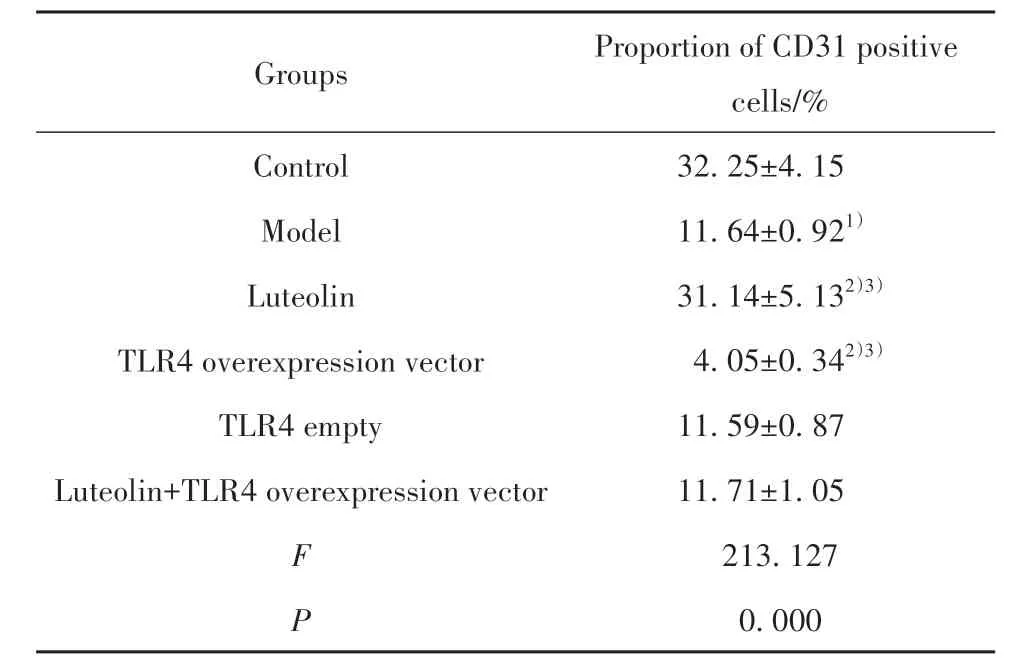
表3 各组大鼠胎盘组织CD31阳性细胞比例(±s,n=12)Tab.3 Proportion of CD31 positive cells in placental tissue of rats in each group (±s,n=12)
Note:1)P<0.05 vs control group; 2)P<0.05 vs model group; 3)P<0.05 vs luteolin+TLR4 overexpression vector group.
Proportion of CD31 positive cells/%Groups 32.25±4.15 11.64±0.921)31.14±5.132)3)4.05±0.342)3)11.59±0.87 11.71±1.05 213.127 0.000 Control Model Luteolin TLR4 overexpression vector TLR4 empty Luteolin+TLR4 overexpression vector F P
2.4 各组大鼠胎盘细胞凋亡测定结果 与对照组相比,模型组大鼠胎盘细胞凋亡比例显著升高(P<0.05)。与模型组、木犀草素+TLR4过表达载体组分别相比,木犀草素组大鼠胎盘细胞凋亡比例均显著降低(P<0.05);TLR4过表达载体组大鼠胎盘细胞凋亡比例均显著升高(P<0.05)。与模型组相比,TLR4空载组大鼠胎盘细胞凋亡比例差异无统计学意义(P>0.05)。见图2、表4。
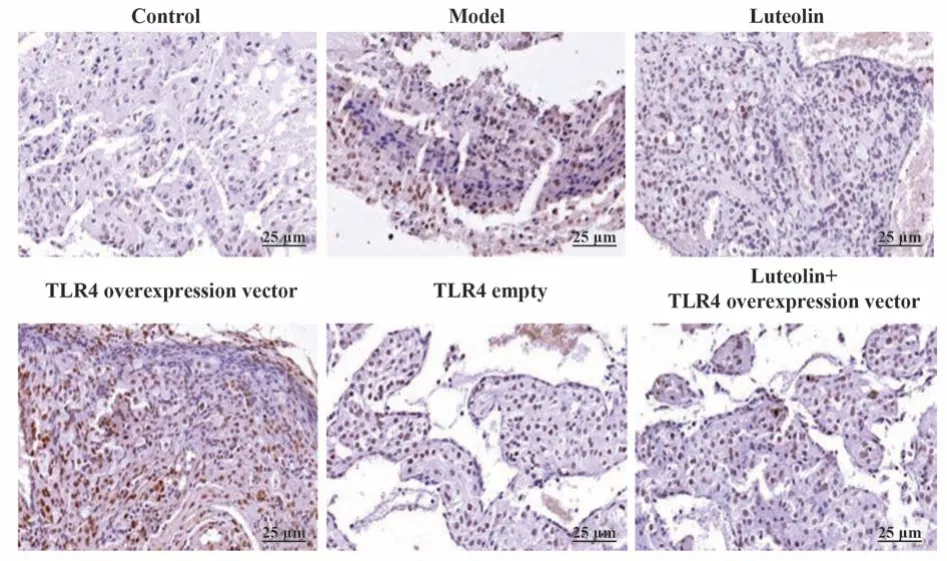
图2 TUNEL染色检测大鼠胎盘细胞凋亡情况(×200)Fig.2 Apoptosis of rat placental cells detected by TUNEL staining (×200)
表4 各组大鼠胎盘细胞凋亡比例(±s,n=12)Tab.4 Proportion of placental cell apoptosis of rats in each group (±s,n=12)
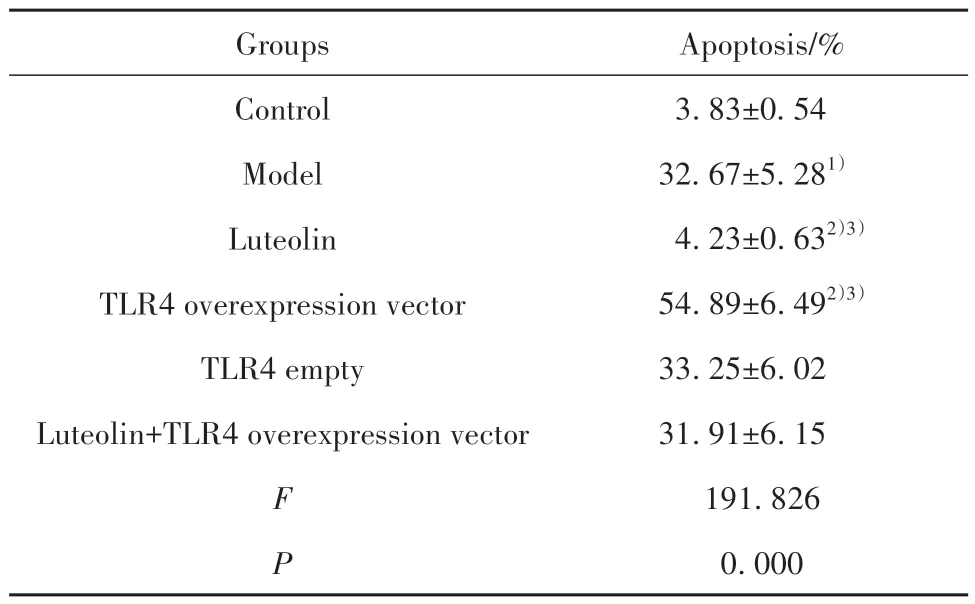
表4 各组大鼠胎盘细胞凋亡比例(±s,n=12)Tab.4 Proportion of placental cell apoptosis of rats in each group (±s,n=12)
Note:1)P<0.05 vs control group; 2)P<0.05 vs model group; 3)P<0.05 vs luteolin+TLR4 overexpression vector group.
Apoptosis/%3.83±0.54 32.67±5.281)4.23±0.632)3)54.89±6.492)3)33.25±6.02 31.91±6.15 191.826 0.000 Groups Control Model Luteolin TLR4 overexpression vector TLR4 empty Luteolin+TLR4 overexpression vector F P
2.5 各组大鼠血清炎症因子IL-6、TNF-α、IL-17水平检测结果 与对照组相比,模型组大鼠血清炎症因子IL-6、TNF-α、IL-17水平显著升高(P<0.05)。与模型组、木犀草素+TLR4过表达载体组分别相比,木犀草素组大鼠血清炎症因子IL-6、TNF-α、IL-17水平均显著降低(P<0.05);TLR4过表达载体组大鼠血清炎症因子IL-6、TNF-α、IL-17水平均显著升高(P<0.05)。与模型组相比,TLR4空载组大鼠血
清炎症因子IL-6、TNF-α、IL-17水平差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠血清炎症因子IL-6、TNF-α、IL-17水平(±s,n=12)Tab.5 Serum inflammatory factors IL-6, TNF-α and IL-17 levels of rats in each group (±s,n=12)
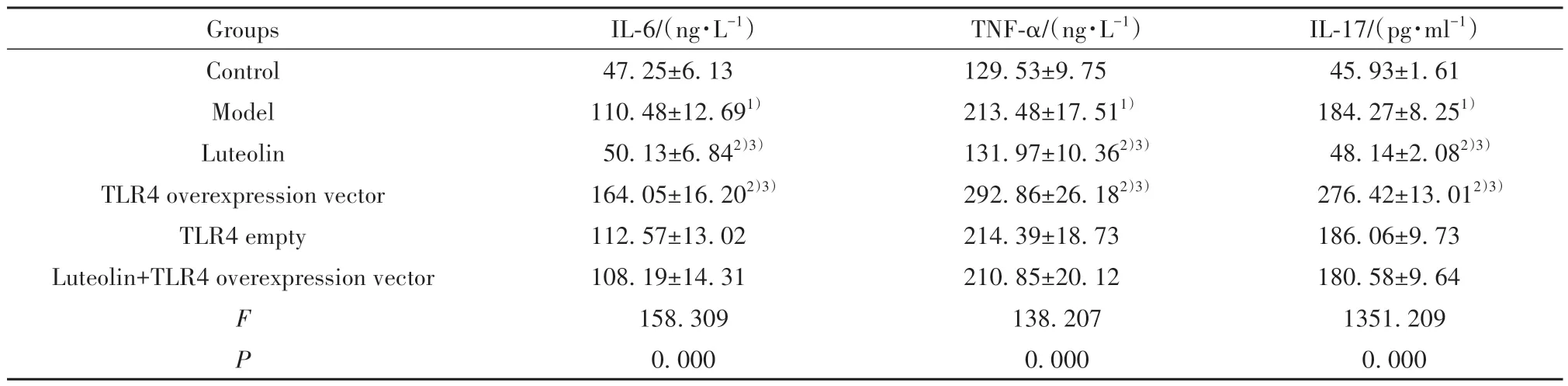
表5 各组大鼠血清炎症因子IL-6、TNF-α、IL-17水平(±s,n=12)Tab.5 Serum inflammatory factors IL-6, TNF-α and IL-17 levels of rats in each group (±s,n=12)
Note:1)P<0.05 vs control group; 2)P<0.05 vs model group; 3)P<0.05 vs luteolin+TLR4 overexpression vector group.
Groups Control Model Luteolin TLR4 overexpression vector TLR4 empty Luteolin+TLR4 overexpression vector IL-17/(pg·ml-1)45.93±1.61 184.27±8.251)48.14±2.082)3)276.42±13.012)3)186.06±9.73 180.58±9.64 1351.209 0.000 F P IL-6/(ng·L-1)47.25±6.13 110.48±12.691)50.13±6.842)3)164.05±16.202)3)112.57±13.02 108.19±14.31 158.309 0.000 TNF-α/(ng·L-1)129.53±9.75 213.48±17.511)131.97±10.362)3)292.86±26.182)3)214.39±18.73 210.85±20.12 138.207 0.000
2.6 各组大鼠胎盘组织凋亡相关蛋白及TLR4/PI3K/AKT通路蛋白表达的检测结果 与对照组相比,模型组大鼠胎盘组织凋亡蛋白Bax、caspase-3及TLR4/PI3K/AKT通路蛋白TLR4、p-PI3K/PI3K、p-AKT/AKT表达水平显著升高(P<0.05),抗凋亡蛋白Bcl-2表达水平显著降低(P<0.05)。与模型组、木犀草素+TLR4过表达载体组分别相比,木犀草素组大鼠胎盘组织凋亡蛋白Bax、caspase-3及TLR4/PI3K/AKT通路蛋白TLR4、p-PI3K/PI3K、p-AKT/AKT表达水平均显著降低(P<0.05),抗凋亡蛋白Bcl-2表达水平均升高(P<0.05);TLR4过表达载体组大鼠胎盘组织凋亡蛋白Bax、caspase-3及TLR4/PI3K/AKT通路蛋白TLR4、p-PI3K/PI3K、p-AKT/AKT表达水平均升高(P<0.05),抗凋亡蛋白Bcl-2表达水平均降低(P<0.05)。与模型组相比,TLR4空载组大鼠胎盘组织上述各蛋白表达水平差异无统计学意义(P>0.05)。见表6、图3。
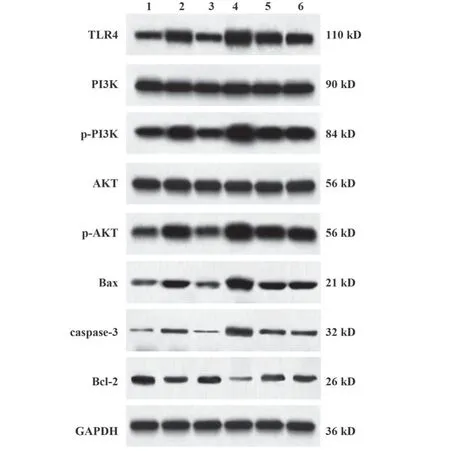
图3 Western blot检测各组大鼠胎盘组织TLR4/PI3K/AKT通路蛋白表达Fig.3 Expression of TLR4/PI3K/AKT pathway protein in placental tissue of rats in each group was detected by Western blot
表6 各组大鼠胎盘组织TLR4/PI3K/AKT通路蛋白相对表达水平(±s,n=12)Tab.6 Relative expression level of TLR4/PI3K/Akt pathway protein in placenta of rats in each group (±s,n=12)
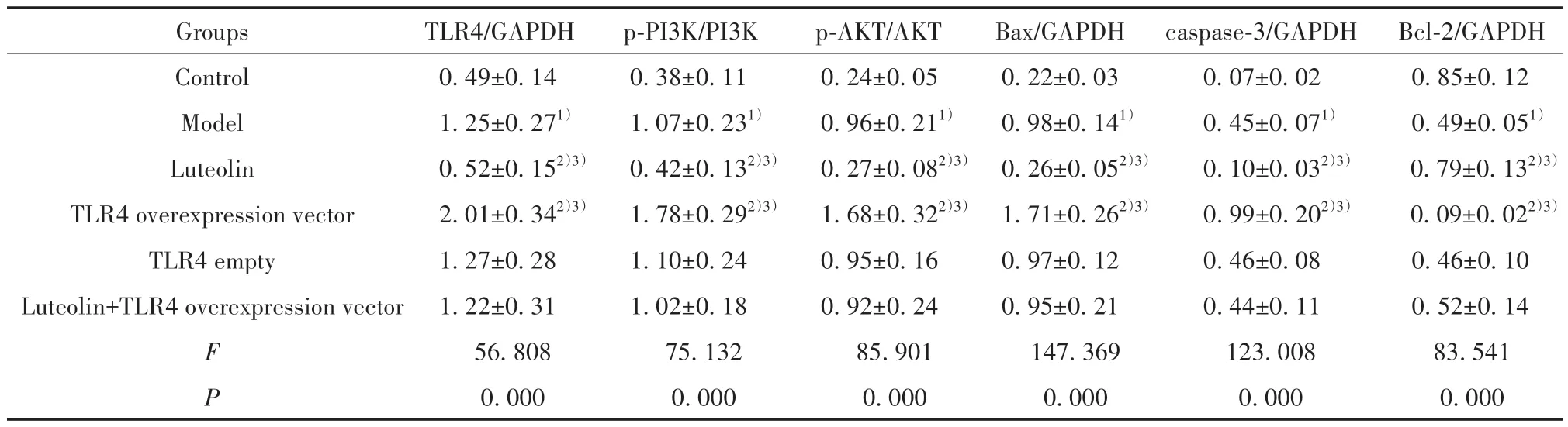
表6 各组大鼠胎盘组织TLR4/PI3K/AKT通路蛋白相对表达水平(±s,n=12)Tab.6 Relative expression level of TLR4/PI3K/Akt pathway protein in placenta of rats in each group (±s,n=12)
Note:1)P<0.05 vs control group; 2)P<0.05 vs model group; 3)P<0.05 vs luteolin+TLR4 overexpression vector group.
Groups Control Model Luteolin TLR4 overexpression vector TLR4 empty Luteolin+TLR4 overexpression vector caspase-3/GAPDH Bcl-2/GAPDH 0.85±0.12 0.49±0.051)0.79±0.132)3)0.09±0.022)3)0.46±0.10 0.52±0.14 83.541 0.000 F P TLR4/GAPDH 0.49±0.14 1.25±0.271)0.52±0.152)3)2.01±0.342)3)1.27±0.28 1.22±0.31 56.808 0.000 p-PI3K/PI3K 0.38±0.11 1.07±0.231)0.42±0.132)3)1.78±0.292)3)1.10±0.24 1.02±0.18 75.132 0.000 p-AKT/AKT 0.24±0.05 0.96±0.211)0.27±0.082)3)1.68±0.322)3)0.95±0.16 0.92±0.24 85.901 0.000 Bax/GAPDH 0.22±0.03 0.98±0.141)0.26±0.052)3)1.71±0.262)3)0.97±0.12 0.95±0.21 147.369 0.000 0.07±0.02 0.45±0.071)0.10±0.032)3)0.99±0.202)3)0.46±0.08 0.44±0.11 123.008 0.000
3 讨论
PE作为一种常见的产科疾病,严重威胁孕产妇生命安全和胎儿发育,还是造成流产、早产、新生儿死亡的重要原因,目前尚无特效治疗手段,对于人口质量的提升产生较大的负面影响[14-15]。本文以皮下注射L-NAME的方法诱导建立PE大鼠模型,观察到大鼠血清中炎症因子IL-6、TNF-α、IL-17水平明显升高,显示L-NAME可引发妊娠大鼠体内炎症,导致大鼠尿蛋白含量和平均动脉压明显升高,胎盘组织血管生成受损,凋亡蛋白Bax、caspase-3表达水平显著升高,抗凋亡蛋白Bcl-2表达显著降低,细胞大量凋亡,最终造成胎鼠发育迟缓,体质量降低,存活率减少,揭示PE模型建立成功。
胎盘滋养层细胞是维持胎盘正常功能和胎儿营养支持的重要结构,在PE病理过程中会发生严重凋亡,影响胎儿正常生长发育[1-2],而炎症反应是导致包括胎盘滋养层细胞凋亡在内的PE病理过程的主要因素,减轻母体全身炎症有利于PE的治疗[3-4]。木犀草素是一种有显著抗菌消炎活性的天然黄酮类物质,可通过抑制IL-17炎症信号通路,降低氧化应激水平,促进血管平滑肌细胞增殖及再生,减轻脑缺血损伤,发挥脑保护作用[16-17],刘翠翠等[10]研究发现木犀草素还可治疗高血压。本研究以木犀草素干预处理PE大鼠,可显著降低其血清IL-6、TNF-α及IL-17水平、平均动脉压、24 h尿蛋白含量,降低胎盘细胞凋亡比例及凋亡蛋白Bax、caspase-3表达,提升抗凋亡蛋白Bcl-2表达,增加平均子代数目、平均子代体质量和胎盘组织CD31阳性细胞比例,表明木犀草素能够抑制炎症细胞因子表达,减轻PE大鼠体内炎症,降低滋养层细胞凋亡率,促进胎盘血管生成及胎鼠生长发育,改善大鼠妊娠后期高血压及蛋白尿症状,揭示木犀草素对PE具有较强的治疗作用。
在动物实验中发现,TLR4作为与炎症密切相关的重要蛋白分子,可通过调控NF-κB、PI3K/AKT信号参与介导小鼠肝损伤、过敏性鼻炎等炎症疾病的致病过程,下调TLR4表达可通过抑制PI3K/AKT信号激活减轻小鼠肝组织炎症[5,18-19]。研究发现,PI3K/AKT信号通路蛋白在早发型子痫前期患者体内表达明显升高,可介导PE的发病过程[8];另外下调TLR4表达还可通过抑制NF-κB信号激活减少PE大鼠炎症因子合成释放,进而抑制胎盘滋养层细胞凋亡,修复胎盘功能,促使子代存活,改善大鼠PE症状[7,20]。另外有研究显示木犀草素可通过下调变应性鼻炎大鼠TLR4/NF-κB通路表达,从而改善其鼻黏膜炎症损伤,因而推测下调TLR4/PI3K/AKT通路可能是木犀草素治疗PE的作用机制[9]。本文以腺病毒包装的TLR4过表达载体上调PE大鼠TLR4表达,对此推测进行验证,结果显示,木犀草素可以降低PE大鼠胎盘组织TLR4、p-PI3K/PI3K、p-AKT/AKT蛋白表达水平,而以腺病毒包装的TLR4过表达载体可以促进PE大鼠炎症进展,加重其高血压及蛋白尿症状,进一步降低子代存活率,并可减弱木犀草素对上述症状的改善作用,逆转木犀草素对PE的治疗作用,表明木犀草素可通过下调TLR4/PI3K/AKT通路抑制炎症反应,改善PE临床症状,维持胎盘正常功能,促使胎儿存活。
综上所述,木犀草素可通过下调TLR4表达,减弱PI3K、AKT蛋白的磷酸化,进而降低炎症因子表达合成,阻碍炎症反应进展,减少PE大鼠胎盘细胞凋亡,促进胎盘血管生成,改善大鼠妊娠后期高血压与蛋白尿症状,提高子代存活率,干扰TLR4/PI3K/AKT信号途径传导是其药理机制之一。本文为木犀草素治疗PE提供了支持性证据,对其临床的推广应用可能有一定的参考价值。

