低氧条件下食管癌来源外泌体调控巨噬细胞M2型分化与自噬的机制研究
尹星 邢艳丽 常欢 周阳 付民 尹先哲 (南阳市第二人民医院肿瘤科一病区,南阳 473000)
食管癌是最常见的消化道恶性肿瘤之一,其发病率和致死率逐年升高,我国食管癌发病率已跃居所有肿瘤第三位,病死率位居第四[1-2]。根据病理特征,食管癌可分为食管腺癌和食管鳞状细胞癌,食管鳞状细胞癌主要发病于中国等亚洲国家,目前食管癌治疗主要包括外科手术、放疗和化疗等传统治疗方式,虽然治疗效果逐渐提高,但总体预后较差,复发和转移严重[3-4]。因此,探究食管癌的发病机制对其治疗和药物设计至关重要。缺氧是实体肿瘤微环境的主要特征,缺氧环境可诱导肿瘤生长和转移[5]。肿瘤外泌体是一类由肿瘤分泌的纳米级囊泡,可调控肿瘤生长、血管新生、免疫逃逸等,而缺氧条件下肿瘤细胞分泌的外泌体亦可通过多种途径影响肿瘤发生发展[6],如缺氧诱导的肿瘤外泌体调控PTEN/PI3Kγ诱导M2型巨噬细胞极化进而促进胰腺癌生长和转移,而缺氧诱导的卵巢癌外泌体可通过调控STAT3/Rab促进卵巢癌化疗耐药[7-8]。已有研究表明,缺氧诱导的神经胶质瘤外泌体可通过增强自噬促进肿瘤相关巨噬细胞形成[9]。本研究探讨了低氧条件下食管癌细胞分泌的外泌体对巨噬细胞分化和自噬的影响,旨在为临床研究提供帮助。
1 材料与方法
1.1 材料 食管癌细胞Eca-109、食管上皮细胞HEEC、人外周血单核细胞THP-1均购自中国科学院上海细胞库;佛波酯(phorbol 12-myristate 13-acetate,PMA,美国Sigma公司);PKH-26染料(美国SIGMA-ALDRICH公司);IL-1β、IL-12、TNF-α、Arg1、IL-10、TGF-β ELISA检测试剂盒(天津安诺瑞康生物技术有限公司);Trizol试剂盒(美国Invitrogen公司);Fast Quant RT Kit和Real Universal Color PreMix(美国TIANGEN公司);CD9、CD63、CD81、CD14、CD206抗体(Cell Signaling Technology公司);p-PI3K、p-Akt、p-mTOR、PI3K、Akt、mTOR、GAPDH、山羊抗兔IgG、CD14、CD206抗体(武汉三鹰生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 食管癌细胞Eca-109和食管上皮细胞HEEC均培养于含10%FBS的RPMI1640培养基,人外周血单核细胞THP-1培养于含12%FBS+1%青霉素-链霉素+50 μmol/L β-巯基乙醇的RPMI-1640培养基,细胞培养于含5%CO2、37 ℃的恒温恒湿培养箱,低氧诱导的Eca-109细胞培养于含0.2%O2、5%CO2、37 ℃的培养箱,细胞密度达80%~90%时传代,隔天更换培养基。
1.2.2 外泌体提取、鉴定与摄取 将各组Eca-109和HEEC细胞培养基更换为含10%无外泌体胎牛血清的RPMI1640培养基,培养48 h后收集细胞培养液,超速离心法提取细胞培养液中的外泌体:细胞培养液2 000 g离心10 min,收集上清,1 000 g离心30 min去除死细胞和细胞碎片,100 000 g超高速离心70 min,所得沉淀用无菌PBS溶液重悬后再次100 000 g超高速离心70 min,所得沉淀即为外泌体,400 μl PBS重悬外泌体,-80 ℃保存。HEEC细胞、Eca-109细胞、低氧条件下Eca-109细胞分泌的外泌体分别记为HEEC-exo、Nom-Eca-109-exo、Hypo-Eca-109-exo。透射电镜下观察外泌体的形态结构,Western blot检测外泌体标志蛋白CD9、CD63、CD81表达。巨噬细胞摄取外泌体检测:用PKH-26染料试剂盒将外泌体标记为红色荧光,将1×104个M0型巨噬细胞接种至激光共聚焦培养皿,DAPI染料标记M0型巨噬细胞的细胞核,将带有红色荧光的外泌体10 μg/ml与M0型巨噬细胞共孵育2 h,取出培养皿中的培养基,无水甲醛固定30 min,清洗后于激光共聚焦显微镜下观察并拍照。
1.2.3 巨噬细胞诱导分化与共孵育 50 ng/ml PMA诱导1×106个THP-1细胞48 h分化为M0型巨噬细胞。THP-1细胞为悬浮细胞,M0型巨噬细胞为贴壁细胞,细胞贴壁即为诱导成功。共孵育:将诱导分化的M0型巨噬细胞分别加入Nom-Eca-109-exo、Hypo-Eca-109-exo、HEEC-exo及等体积PBS,各组共孵育体系中外泌体浓度均为10 μg/ml,共孵育48 h后收集细胞进行后续研究。
1.2.4 流式细胞术 收集与各组外泌体共孵育的M0型巨噬细胞,每组5×105个,每组细胞用预冷PBS洗涤1次,用100 μl含10%FBS的无菌PBS溶液重悬,各组细胞加入1 μg FITC-CD14抗体和1 μg PECD206抗体,设置单独加入FITC-CD14抗体和PECD206抗体的组别调补偿,空白管调电压,将细胞与抗体4 ℃避光孵育30 min,收集细胞用300 μl PBS重悬,流式细胞仪检测各组细胞CD14和CD206表达。
1.2.5 ELISA检测细胞因子 采用ELISA试剂盒检测细胞培养液炎症因子IL-1β、IL-12、TNF-α、Arg1、IL-10和TGF-β水平:96孔板内包被一抗,加入40 μl待测样品和10 μl生物素标记抗体,室温静置30 min后加入100 μl辣根过氧化物酶标记抗体,37 ℃孵育75 min,清洗3次,加入显色液显色,450 nm处测吸光度,根据标准曲线计算各细胞因子含量。
1.2.6 qRT-PCR 使用Trizol试剂盒提取各组细胞RNA,核酸定量仪定量,Fast Quant RT Kit试剂盒合成mRNA的cDNA,Real Universal Color PreMix试剂盒进行qRT-PCR,2-ΔΔCt计算相对表达量,引物序列见表1。

表1 各组基因引物序列Tab.1 Primer sequences of genes in each group
1.2.7 Transwell检测细胞迁移和侵袭 Transwell小室中每孔接种50 μl Matrigel胶检测细胞侵袭,小室中接种无血清RPMI1640重悬的1×104个Eca-109细胞,置于24孔板,接种用含10%FBS RPMI1640重悬的1×104个M0型巨噬细胞,分别加入Nom-exo、Hypo-exo、HEEC-exo及等体积PBS,各组外泌体浓度为10 μg/ml,共培养72 h,清洗各组小室底部,无水甲醛固定30 min,结晶紫染色10 min,清洗晾干后显微镜下观察拍照,比较各组细胞侵袭和迁移数。
1.2.8 Western blot 收集各组与外泌体共孵育的巨噬细胞,RIPA蛋白提取试剂盒提取细胞或外泌体总蛋白,BCA定量,各组蛋白取10 μg进行SDS-聚丙烯酰胺凝胶电泳,转膜后5%BSA封闭,清洗,与1∶1 000稀释的p-PI3K、p-Akt、p-mTOR、PI3K、Akt、mTOR、GAPDH、CD9、CD61、CD81、LC3-Ⅱ、p62、Beclin 1一抗孵育过夜,与山羊抗兔IgG二抗室温孵育1.5 h,TBST洗膜,ECL试剂盒曝光拍照,Image J软件对曝光结果进行定量。
1.3 统计学分析 采用SPSS22.0软件进行统计分析,GraphPad Prism软件绘制图形,所有数据以±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 外泌体鉴定结果 透射电镜观察外泌体形态结构,结果显示(图1A):HEEC-exo、Nom-Eca-109-exo、Hypo-Eca-109-exo粒径为30~100 nm,双层膜结构,形态呈“杯托”样,Western blot检测结果显示(图1B),HEEC-exo、Nom-Eca-109-exo、Hypo-Eca-109-exo均表达外泌体标志蛋白CD9、CD63、CD81,说明提取的外泌体符合其生物学特征。
2.2 外泌体摄取结果 红色PKH-26染料标记外泌体,蓝色DAPI染料标记巨噬细胞的细胞核,共孵育后检测发现,DAPI染料标记的巨噬细胞的细胞核附近出现红色荧光,说明外泌体可被巨噬细胞摄取(图2)。

图2 外泌体摄取鉴定结果(×20)Fig.2 Identified results of exosomal uptaking (×20)
2.3 低氧诱导的食管癌外泌体促进M2型巨噬细胞分化 qRT-PCR检测结果(图3A)显示,与各组外泌体共孵育后,相比于PBS组,HEEC-exo组M1和M2型巨噬细胞标志蛋白表达均无显著差异(P>0.05),而Nom-Eca-109-exo和Hypo-Eca-109-exo组M1型标志蛋白CCR7和TLR2表达显著下调(P<0.01),M2型巨噬细胞标志蛋白CD206和CD14表达显著上调(P<0.001),说明Nom-Eca-109-exo和Hypo-Eca-109-exo可显著诱导M2型巨噬细胞极化,而Hypo-Eca-109-exo组细胞CD206和CD14表达显著高于Nom-Eca-109-exo组(P<0.001),说明低氧条件下Eca-109细胞外泌体能促进M2型巨噬细胞极化。流式细胞术进一步鉴定结果显示(图3B),Nom-Eca-109-exo和Hypo-Eca-109-exo组CD206+CD14+细胞比例显著升高(P<0.001),且Hypo-Eca-109-exo组CD206+CD14+细胞比例高于Nom-Eca-109-exo组,进一步说明低氧诱导的食管癌外泌体能促进M2型巨噬细胞极化。
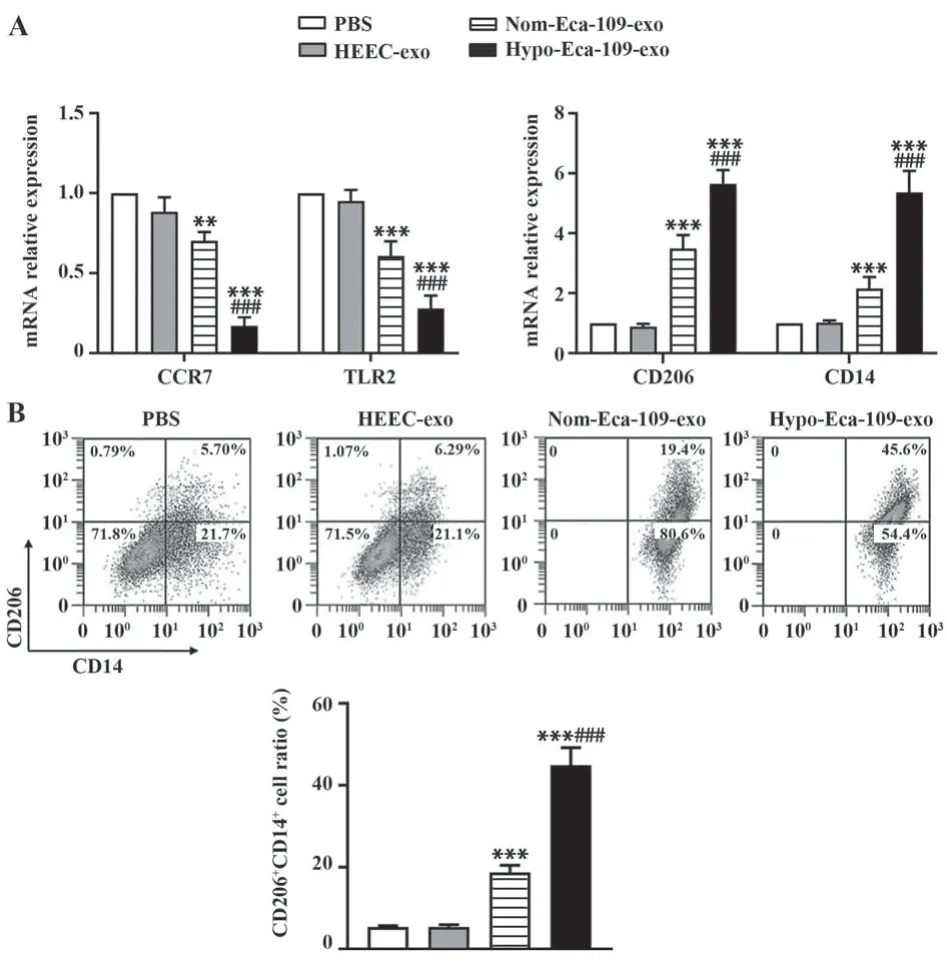
图3 Hypo-Eca-109-exo促进M2型巨噬细胞分化Fig.3 Hypo-Eca-109-exo promotes differentiation of M2 type macrophages
2.4 低氧诱导的食管癌外泌体促进M2型巨噬细胞炎症因子分泌 ELISA检测结果(图4)显示,相比于PBS组,HEEC-exo组巨噬细胞分泌的炎症因子无显著变化(P>0.05),Nom-Eca-109-exo和Hypo-Eca-109-exo组细胞分泌的IL-1β、IL-12、TNF-α显著减少(P<0.05),Arg1、IL-10和TGF-β分泌显著增加(P<0.001),Hypo-Eca-109-exo组IL-1β、IL-12、TNF-α分泌显著少于Nom-Eca-109-exo组(P<0.05),Arg1、IL-10和TGF-β分泌显著多于Nom-Eca-109-exo组(P<0.05),IL-1β、IL-12、TNF-α由M1型巨噬细胞分泌,Arg1、IL-10和TGF-β由M2型巨噬细胞分泌,说明Hypo-Eca-109-exo可促进M2型巨噬细胞分化。
2.5 低氧诱导的食管癌外泌体促进M2型巨噬细胞自噬 Western blot检测结果(图5)显示,与Nom-Eca-109-exo和Hypo-Eca-109-exo共孵育后,巨噬细胞中LC3-Ⅱ和Beclin-1表达显著高于PBS组和HEEC-exo组(P<0.001),p62表达显著低于PBS组和HEEC-exo组(P<0.001),且Hypo-Eca-109-exo组细胞LC3-Ⅱ和Beclin-1表达显著高于Nom-Eca-109-exo组(P<0.01),p62表达显著低于Nom-Eca-109-exo组(P<0.001),LC3-Ⅱ和Beclin-1表达与细胞自噬水平呈正相关,p62表达与细胞自噬呈负相关,说明Hypo-Eca-109-exo可显著促进M2型巨噬细胞自噬。
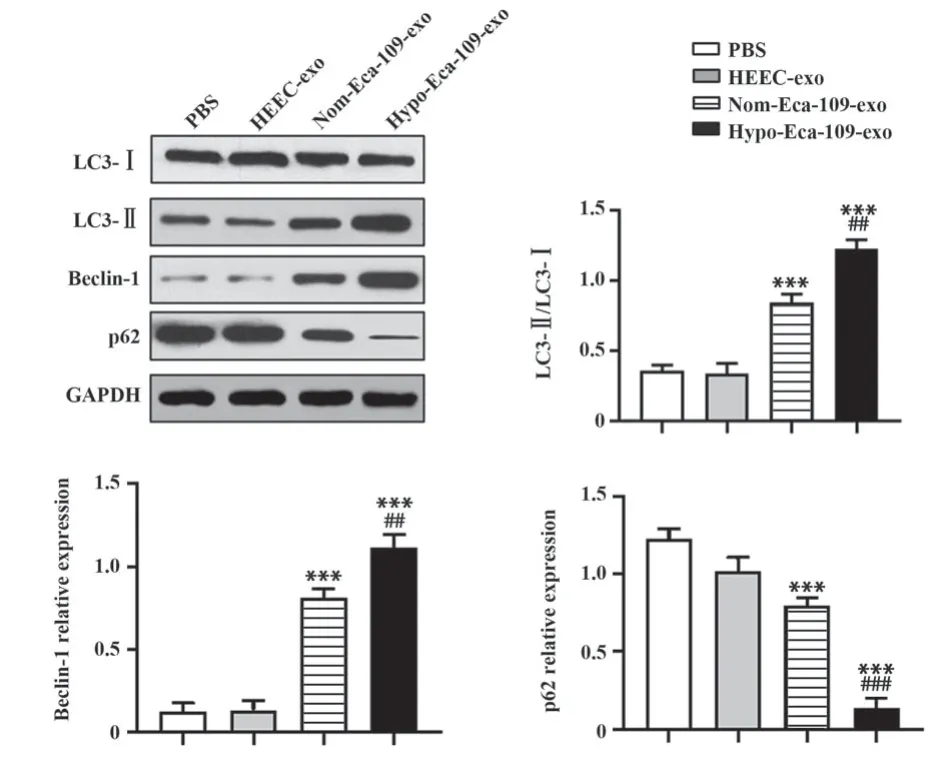
图5 Hypo-Eca-109-exo调控自噬相关基因的蛋白表达Fig.5 Hypo-Eca-109-exo regulates protein expressions of autophagy-related genes
2.6 低氧条件下食管癌外泌体诱导的巨噬细胞可促进食管癌细胞迁移和侵袭 外泌体和M0型巨噬细胞共孵育后检测发现(图6),Nom-Eca-109-exo和Hypo-Eca-109-exo组细胞迁移和侵袭数均显著高于PBS组和HEEC-exo组(P<0.05),而Hypo-Eca-109-exo组细胞迁移和侵袭数显著高于Nom-Eca-109-exo组(P<0.001),说明Hypo-Eca-109-exo可促进巨噬细胞M2型分化,从而促进食管癌迁移和侵袭。
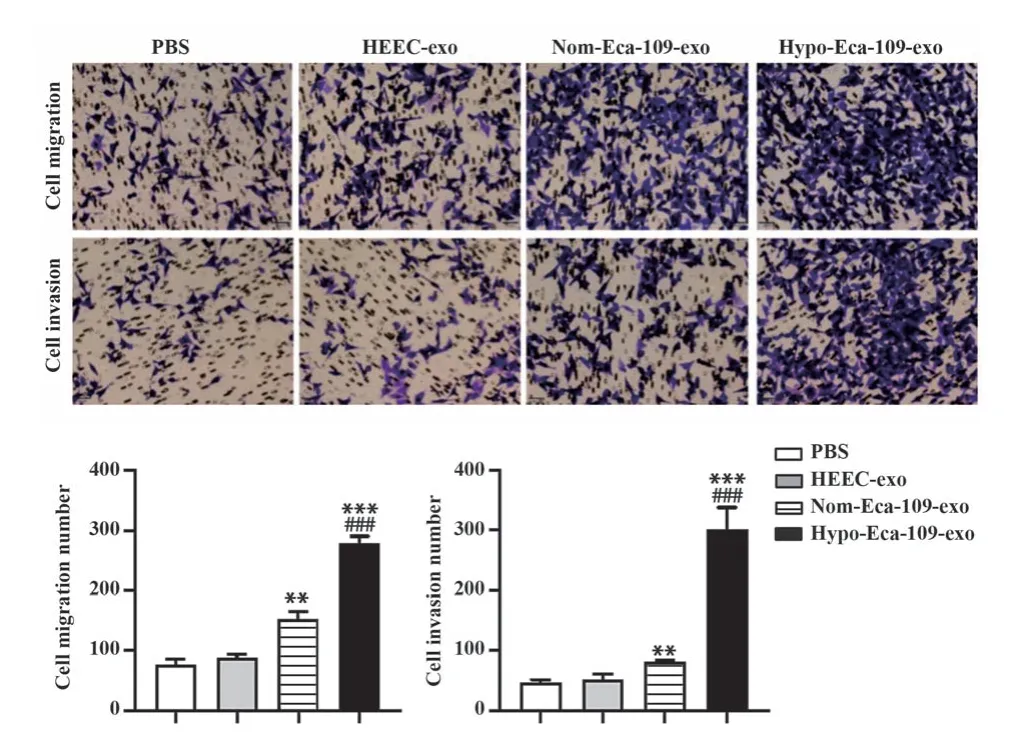
图6 Hypo-Eca-109-exo诱导的M2型巨噬细胞极化影响食管癌细胞迁移和侵袭(×10)Fig.6 Hypo-Eca-109-exo-induced polarization of M2 macrophages affects migration and invasion of esophageal cancer cells (×10)
2.7 低氧条件下食管癌外泌体激活PI3K/Akt/mTOR信号通路 Western blot检测结果(图7)显示,与Nom-Eca-109-exo和Hypo-Eca-109-exo共孵育后,巨噬细胞中PI3K、Akt、mTOR磷酸化水平均显著高于PBS组和HEEC-exo组(P<0.01),Hypo-Eca-109-exo组细胞PI3K、Akt、mTOR磷酸化水平均显著高于Nom-Eca-109-exo组(P<0.001),说明Hypo-Eca-109-exo可显著激活PI3K/Akt/mTOR信号通路。
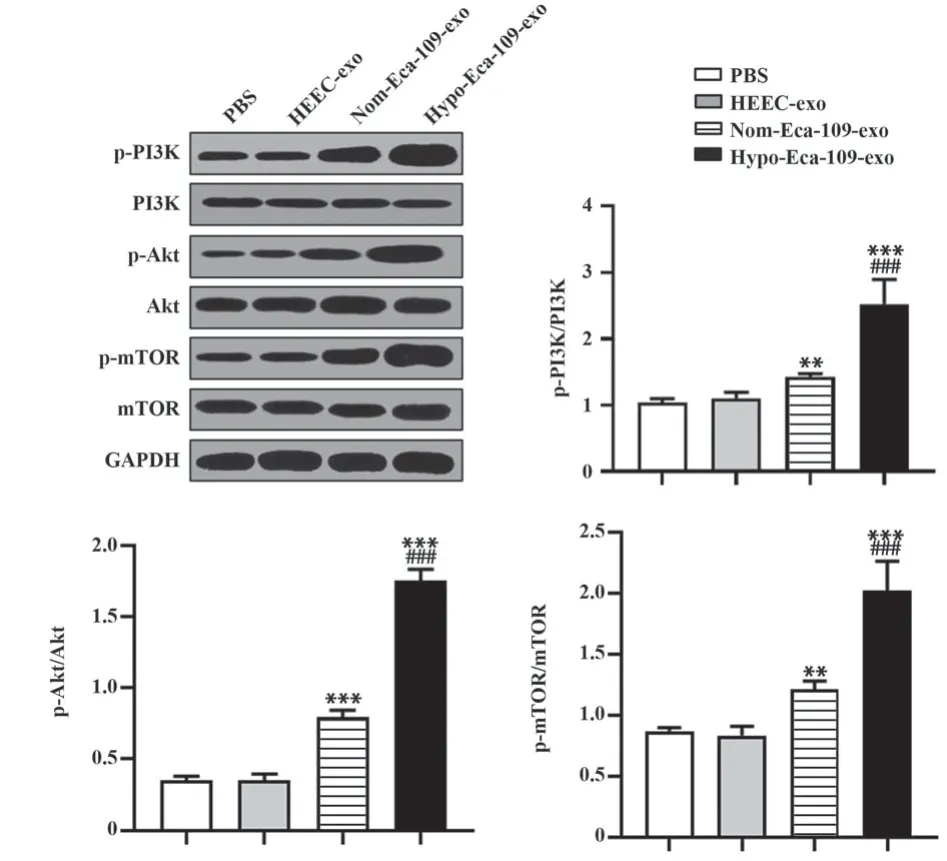
图7 Hypo-Eca-109-exo激活巨噬细胞PI3K/Akt/mTOR信号通路Fig.7 Hypo-Eca-109-exo activates macrophage PI3K/Akt/mTOR signaling pathway
3 讨论
肿瘤微环境是肿瘤赖以生存和发展的必要条件,在食管癌肿瘤微环境中,巨噬细胞、成纤维细胞、内皮细胞等对其生长、代谢和转移发挥重要调控作用[10]。其中肿瘤相关巨噬细胞能够通过PD-1信号通路调控食管癌免疫逃逸,肿瘤浸润的巨噬细胞与食管癌化疗耐药和患者预后相关[11-12]。缺氧是实体肿瘤微环境的重要特征,是诱导肿瘤生长和转移的重要因素,缺氧诱导因子激活可促进肿瘤血管新生、转移、耐药等[13]。研究表明低氧可诱导食管鳞状细胞癌生长和上皮-间质转化,低氧诱导的miR-10b-3p通过靶向TSGA10促进食管鳞状细胞癌生长和转移[14-15]。
外泌体是一类由多种活细胞分泌的纳米级囊泡,粒径为30~100 nm,内含多种母细胞遗传物质,调控远端靶组织和靶器官,肿瘤外泌体由肿瘤细胞分泌至肿瘤微环境作用于免疫细胞、基质细胞及肿瘤干细胞等[16-17]。巨噬细胞是肿瘤微环境中的重要免疫细胞,可分为M1型巨噬细胞和M2型巨噬细胞,M1型巨噬细胞具有促炎功能,有抗肿瘤活性,M2型巨噬细胞是免疫抑制细胞表型,诱导肿瘤发生和发展,肿瘤相关巨噬细胞与M2型巨噬细胞相似,可诱导肿瘤血管新生、促进免疫逃逸等[18]。研究表明肿瘤相关巨噬细胞可富集于缺氧部位[19]。亦有研究表明,缺氧环境中的肿瘤细胞外泌体对肿瘤发展有显著促进作用。本研究分别提取了食管上皮细胞HEEC、食管癌细胞Eca-109及低氧诱导的Eca-109细胞分泌的外泌体,检测发现与Hypo-Eca-109-exo共孵育后巨噬细胞CCR7和TLR2表达显著下调,CD206和CD14表达显著上调,且细胞培养液中IL-1β、IL-12、TNF-α分泌显著减少,Arg1、IL-10和TGF-β分泌显著增加,CCR7和TLR2为M1型巨噬细胞标志蛋白,CD206和CD14为M2型巨噬细胞标志蛋白,IL-1β、IL-12、TNF-α为M1型巨噬细胞分泌的细胞因子,Arg1、IL-10和TGF-β为M2型巨噬细胞分泌的炎症因子,说明低氧条件下食管癌细胞分泌的外泌体可显著促进M2型巨噬细胞分化。WANG等[7]研究表明,缺氧条件下胰腺癌外泌体miR-301a可通过激活PTEN/PI3Kγ信号通路诱导M2型巨噬细胞极化,进而诱导肿瘤生长和转移。推测低氧条件下食管癌细胞分泌的外泌体也可通过调控巨噬细胞极化影响食管癌生物学功能。
自噬是一种依赖溶酶体的自我保护机制,主要通过清除不必要或有害的物质以及不同应激反应中损坏的细胞器维持正常细胞内环境[20]。LC3-Ⅱ、Beclin-1和p62是参与自噬的重要蛋白,LC3-Ⅱ则由LC3-Ⅰ经泛素样加工修饰而成,Beclin-1和LC3-Ⅱ表达与自噬小体数量成正比,p62蛋白可使泛素化底物在自噬溶酶体内降解,p62表达与自噬呈负相关[21]。本研究发现与Hypo-Eca-109-exo共孵育后巨噬细胞LC3-Ⅱ、Beclin-1表达显著上调,p62表达显著下调,说明低氧条件下食管癌细胞分泌的外泌体可显著促进M2型巨噬细胞自噬。将Eca-109细胞与外泌体诱导的巨噬细胞共孵育后发现,与Hypo-Eca-109-exo共孵育的巨噬细胞可显著诱导Eca-109细胞迁移和侵袭,说明低氧条件下食管癌细胞分泌的外泌体促进M2型巨噬细胞分化或自噬而诱导肿瘤转移。CHEN等[22]研究表明,自噬介导的巨噬细胞分化有肿瘤治疗潜力,提示食管癌外泌体调控巨噬细胞极化和自噬或可作为肿瘤治疗靶点,其临床应用还需进一步探究。
PI3K/Akt/mTOR信号通路是调控自噬和巨噬细胞分化的重要信号通路,研究表明,结直肠癌分泌的EGF可通过调控PI3K/Akt/mTOR信号通路促进M2型巨噬细胞极化[23]。调控PI3K/Akt/mTOR信号通路亦可调控巨噬细胞自噬[24]。miR-125a可通过调控PI3K/Akt/mTOR信号通路调控巨噬细胞自噬[25]。本研究发现,与Hypo-Eca-109-exo共孵育的巨噬细胞PI3K/Akt/mTOR信号通路显著激活,说明Hypo-Eca-109-exo可通过调控PI3K/Akt/mTOR信号通路促进巨噬细胞M2型极化和自噬。
综上,低氧条件下,食管癌细胞外泌体可诱导巨噬细胞M2型分化和自噬而促进食管癌迁移和侵袭,其机制可能为激活PI3K/Akt/mTOR信号通路,为食管癌的发生发展机制提供了补充,但食管癌外泌体能否成为其临床治疗和诊断靶点还需进一步探究。

