miR-150对T细胞PD-1表达及肺肿瘤生长的影响
张婷 郭晗 郑爱华 张爱红 郑全辉 (.华北理工大学基础医学院,河北省慢性疾病基础医学重点实验室,唐山 060;.华北理工大学基础医学院,唐山 060;.唐山市工人医院,唐山 06000)
微小RNA(microRNAs,miRNAs)是长度为20~24个核苷酸的非编码小RNA,在转录后调节基因中表达,其中,miR-150主要在机体免疫系统中表达。既往研究发现,miR-150缺失不影响传统αβT细胞在胸腺中的产生和发育,但对自然杀伤性T细胞(nature killer T cells,NKT)的发育和功能发挥重要调控作用。本研究率先进一步探讨了miR-150对外周免疫器官和外周血中CD4 T、CD8 T细胞数量、活化表型分子和程序性细胞死亡分子1(programmed cell death 1,PD-1)表达的影响,进而采用小鼠肺移植肿瘤模型,探讨miR-150通过调控T细胞PD-1表达对肿瘤发展的影响。研究结果将为进一步探索以miRNAs为靶点的肿瘤免疫治疗提供新的线索。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6背景的miR-150基因敲除(miR-150 knock-out,miR-150KO)小鼠购自美国Jackson实验室(Stock No:007750),以正常野生型(wild-type,WT) C57BL/6小鼠作为对照。小鼠在华北理工大学SPF级小鼠房内饲养、繁殖,实验选取4~8周龄、性别匹配的小鼠进行研究。小鼠实验操作按照华北理工大学实验动物管理委员会规定进行,动物伦理审查编号:2013-008。提取miR-150KO和WT小鼠尾DNA,根据Jackson实验室推荐的PCR扩增程序和引物进行基因型鉴定(protocol 28985),正向引物:5'-CAAGGACAGGAACCCTTCAGCA-3';反向引物:5'-CCATGATGCCTGGAAGACATTTC-3'。miR-150KO鼠尾DNA扩增产生262 bp片段,WT鼠尾DNA扩增产生866 bp片段[1-3]。
1.1.2 细胞系 小鼠Lewis肺癌细胞系(Lewis lung cancer cell line,LLC)于2020年购自华拓生物科技有限公司,在含10%胎牛血清及双抗的高糖DMEM培养液中培养,条件为饱和湿度、37 ℃、5%CO2,2~3 d更换1次培养液。细胞总数达到95%融合时,用0.25%胰酶消化、传代培养。
1.1.3 主要试剂 胎牛血清购自Life Technologies;双抗(青霉素100 U/ml,链霉素100 μg/ml)购自Gibco公司;高糖DMEM培养液购自HyClone公司;荧光标记的抗小鼠CD4、CD8、CD69和PD-1抗体购自美国BD公司;小鼠PD-1封闭抗体anti-mouse CD279(PD-1)购自Biolegend公司。
1.2 方法
1.2.1 miR-150KO小鼠的DNA鉴定 取 2~3 mm小鼠鼠尾组织,加入75 μl 鼠尾裂解液,98 ℃裂解1 h。待温度降至室温后,加入等体积鼠尾中和液,充分吸打混匀后,1 000 r/min离心3 min。PCR反应结束后,行2%琼脂糖凝胶电泳(107 V,45 min),采用凝胶成像显影设备检测DNA条带,判断小鼠基因型。
1.2.2 流式细胞术分析 采用miR-150KO和WT小鼠,每组3~5只。分离各组小鼠脾脏、淋巴结细胞和外周血白细胞,采用荧光标记的抗小鼠CD4、CD8、CD69和PD-1抗体进行细胞表面染色(4 ℃30 min)。染色后洗涤细胞,采用Beckman流式细胞仪收集标本,Flow Jo软件进行数据分析。
1.2.3 荷瘤小鼠模型制备 消化、收集LLC细胞,离心去上清,用无菌PBS洗涤2次,将细胞悬浮于无菌PBS中,台盼蓝染色细胞活力大于95%。选取雌性miR-150KO和WT小鼠,每组3~5只,将1×106个LLC细胞悬浮于100 μl PBS中,接种到各组小鼠腋窝皮下。每隔1 d通过游标卡尺测量肿瘤尺寸,并使用以下公式估计肿瘤体积:肿瘤体积(mm3)=长轴×短轴2×1/2。第21天处死小鼠,收集并分析外周血和淋巴结T细胞中PD-1的表达变化。
1.2.4 抗PD-1抗体治疗 分组及制备miR-150KO和WT小鼠肿瘤模型同上,在注射LLC细胞系5 d后,采用抗PD-1抗体,根据文献[4]以250 μg/小鼠(19~21 g)进行腹腔注射。每隔1 d通过游标卡尺测量各组小鼠肿瘤大小变化,持续观察2周。
1.3 统计学分析 采用GraphPad Prism v9软件进行统计学分析,通过Student'st检验评估统计显著性,P<0.05表示差异有统计学意义。
2 结果
2.1 miR-150敲除对T细胞数量的影响 PCR鉴定鼠尾DNA,miR-150KO小鼠产生262 bp扩增片段,WT小鼠产生866 bp扩增片段,小鼠基因型鉴定正确(图1A)。分离miR-150KO和WT小鼠脾脏、淋巴结和外周血细胞,流式分析各组织CD4+T和CD8+T细胞数量变化。结果发现:与WT小鼠相比,miR-150KO小鼠脾脏中CD8+T细胞无明显变化,CD4+T细胞比例和数量显著升高(P<0.01或P<0.05,图1B、C);与WT小鼠相比,miR-150KO小鼠淋巴结中CD8+T细胞无显明显化,但CD4+T细胞比例和数量显著升高(P<0.01,图1D、E);与WT小鼠相比,miR-150KO小鼠外周血中CD4+T和CD8+T细胞比例显著降低(P<0.01,图1F)。
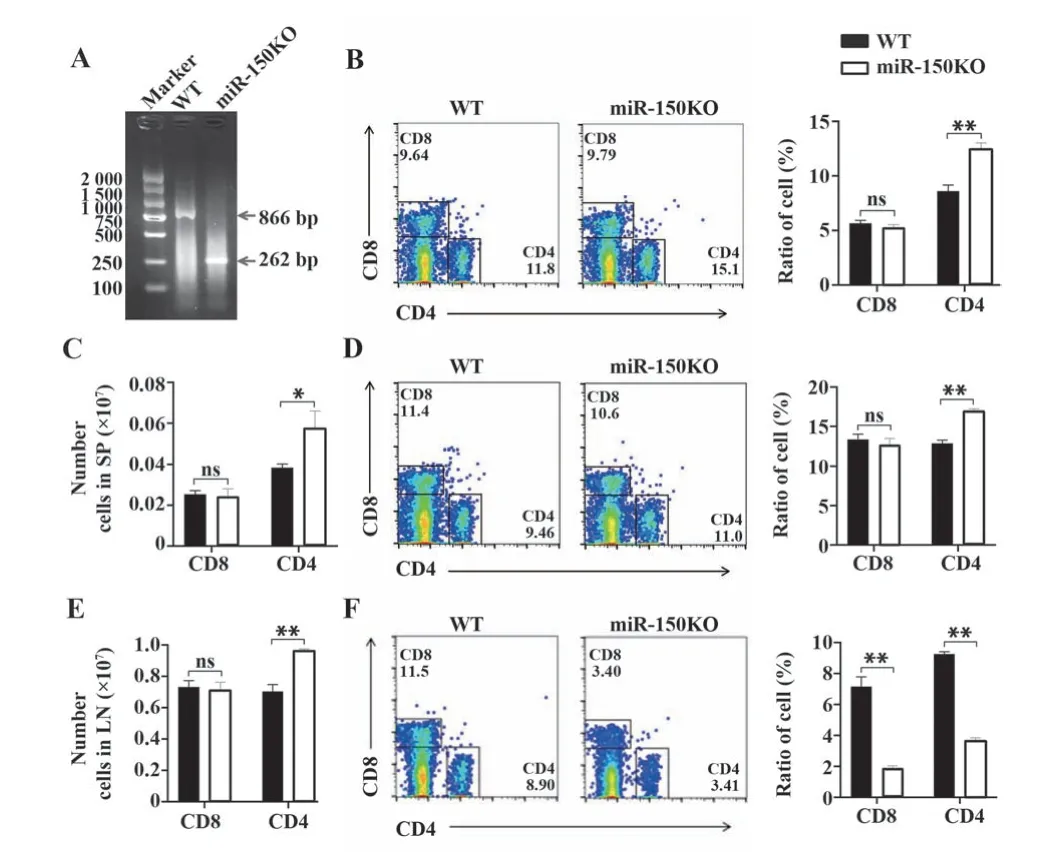
图1 miR-150KO小鼠T细胞比例和数量变化Fig.1 Changes in proportion and number of T cells in miR-150KO mice
2.2 miR-150敲除对T细胞活化的影响 流式分析miR-150KO和WT小鼠脾脏、淋巴结和外周血T细胞活化差异。结果发现:与WT小鼠相比,miR-150KO小鼠脾脏CD4 T和CD8 T细胞中CD69+细胞比例无显著变化(图2A);与WT小鼠相比,miR-150KO小鼠淋巴结CD4 T和CD8 T细胞中CD69+细胞比例显著升高(P<0.05,图2B);与WT小鼠相比,miR-150KO小鼠外周血中CD4 T和CD8 T细胞CD69+细胞比例也显著升高(P<0.01或P<0.05,图2C)。
2.3 miR-150敲除对T细胞PD-1表达的影响 流式分析miR-150KO和WT小鼠淋巴结、外周血CD4 T和CD8 T细胞中PD-1的表达变化。结果发现:与WT小鼠相比,miR-150KO小鼠淋巴结CD4 T和CD8 T细胞中PD-1+细胞比例无显著变化(图3A);与WT小鼠相比,miR-150KO小鼠外周血CD4 T和CD8 T细胞中PD-1+细胞比例显著升高(P<0.01,图3B)。
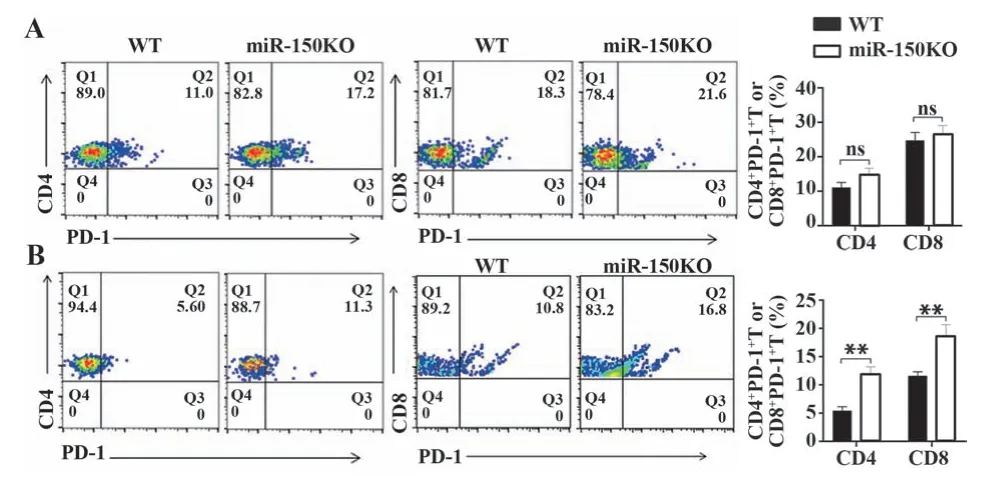
图3 miR-150KO小鼠T细胞PD-1表达变化Fig.3 Changes of PD-1 expression in T cells of miR-150 KO mice
2.4 miR-150敲除对小鼠肺肿瘤生长的影响 与WT小鼠相比,miR-150KO小鼠肿瘤生长明显加快(图4A、B);流式分析miR-150KO和WT小鼠淋巴结和外周血CD4 T和CD8 T细胞中PD-1表达变化。结果发现:与WT荷瘤小鼠相比,miR-150KO荷瘤小鼠淋巴结CD4 T和CD8 T中细胞PD-1+细胞比例显著升高(P<0.01,图4C);与WT荷瘤小鼠相比,miR-150 KO荷瘤小鼠外周血CD4 T和CD8 T细胞中PD-1+细胞比例也显著升高(P<0.01,图4D)。
2.5 抗PD-1抗体处理对miR-150KO和WT小鼠肿瘤生长的影响 采用抗PD-1封闭抗体腹腔注射miR-150KO和WT荷瘤小鼠,观察其对肿瘤生长的影响。结果发现:抗PD-1抗体处理几乎不影响WT小鼠的肿瘤生长,但对miR-150KO小鼠的肿瘤生长具有明显抑制作用(P<0.05,图5)。
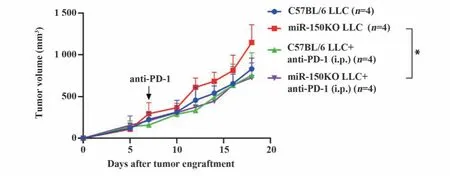
图5 抗PD-1抗体处理对miR-150KO和WT荷瘤小鼠肿瘤生长的影响Fig.5 Tumor growth in miR-150KO and WT tumor bearing mice after treatment of anti-PD-1 antibody
3 讨论
miR-150主要表达在免疫系统中。课题组的前期研究显示,miR-150敲除对胸腺传统T细胞的产生和发育无明显影响,但导致NKT细胞的发育和功能异常[5]。本研究进一步探讨了miR-150对外周免疫器官和外周血中传统T细胞数量和表型的影响。与课题组的既往研究结果一致,与WT小鼠相比,miR-150敲除小鼠外周血中CD4+T和CD8+T细胞显著降低[3]。但本研究进一步发现miR-150敲除导致小鼠淋巴结和脾脏中CD4+T细胞显著增加。其原因可能与miR-150对NKT细胞迁移的影响相似,miR-150敲除诱导趋化因子受体7(chemokine receptor 7,CCR7)和CCR9表达增加,导致CD4+T细胞从血液向脾脏和淋巴结的迁移增加[6-7]。有研究发现,miR-150敲除可促进某些自身免疫病的发生,提示miR-150敲除可能促进T细胞的异常活化[6,8-10]。本研究发现,miR-150敲除导致CD4 T和CD8 T细胞中CD69表达显著增加,表明miR-150敲除导致传统T细胞活化显著增强,可能是导致自身免疫病发生、发展的主要原因之一。
近年研究发现,免疫检查点分子PD-1在T细胞中的表达变化影响肿瘤的发生发展[11-13]。在此研究中,课题组又深入探讨了miR-150敲除对正常和荷瘤小鼠CD4 T和CD8 T细胞中PD-1的表达影响,发现在正常小鼠中,miR-150敲除导致外周血CD4 T和CD8 T细胞中PD-1表达显著增加。在荷瘤小鼠中,miR-150敲除导致淋巴结和外周血CD4 T和CD8 T细胞中PD-1表达也显著增加。另外,研究发现miR-150敲除对移植肺肿瘤具有促进作用,可见miR-150可通过抑制T细胞中PD-1表达,降低对肿瘤的免疫耐受,进而抑制其发生或发展。已有研究表明,miR-150在非小细胞肺癌细胞中具有抑癌基因作用[14]。因此,miR-150既可通过肿瘤细胞本身,也可通过免疫系统抑制肺肿瘤生长,提示其对肺肿瘤治疗的潜在临床应用价值。
为进一步研究miR-150敲除通过PD-1对肺肿瘤发展的影响,课题组对miR-150KO和WT荷瘤小鼠腹腔注射抗PD-1封闭抗体。结果发现,抗PD-1抗体处理几乎不影响WT小鼠肿瘤的生长变化,但对miR-150KO小鼠肿瘤生长具有明显抑制作用。虽然抗PD-1抗体对血液系统肿瘤具有明显的抗肿瘤活性,但对实体瘤的治疗效果并不理想[15-16]。一般情况下需与放疗或化疗药物联合应用,才能产生更显著的效果[17-19]。另一方面,miR-150敲除导致T细胞PD-1表达增加,可能增加了抗PD-1抗体在miR-150KO小鼠中的作用靶点,进而增强了其对肿瘤的免疫杀伤效果。目前miR-150在T细胞中调控PD-1表达变化的机制还不清楚,需要在后续实验中进一步阐明。

