催乳素对奶牛RANKL 基因启动子活性的研究
毛永尽,杨慧琳,马晓聪,赵锋,崔英俊
(东北农业大学乳品科学教育部重点实验室 哈尔滨 150030)
0 引 言
核因子κB 受体活化因子配体(R eceptor activator of the N F-κB ligand,RANKL),俗称TRANCE、ODF、OPGL、TN FSF11。RANKL 是国际上普遍接受的名字。T 淋巴细胞、巨噬细胞、破骨细胞、骨髓基质细胞、乳腺上皮细胞等都能够表达RANKL。RANKL与其同源性受体RANK 相互作用,能够活化下游的信号通路,从而对骨重建,促进乳腺发育,T、B 细胞的早期分化,淋巴结形成,体温调节等重要生理过程发挥调节作用[1-2]。在乳腺中,RANKL 能够以自分泌或旁分泌的方式影响乳腺上皮细胞的增殖分化及腺泡腔的形成过程[3-5]。研究表明RAN KL 缺陷会使妊娠期小鼠乳腺组织中乳腺上皮细胞增殖受到抑制、细胞凋亡增加、导管侧枝和腺泡发育受损,从而导致分娩时泌乳过程受阻[6]。已有研究表明RAN KL 是催乳素(Prolactin, PR L)信号途径重要的下游调节者,参与PR L 调节的乳腺组织发育过程。在体内及体外PR L 都能够诱导RANKL 的表达[7-8]。敲除研究表明PR LR 缺陷会导致RANKL 表达量下降,小鼠乳腺组织呈现出与RANKL/RANK 功能缺陷相同的表型[9]。而PR L 调控RANKL 表达的分子机制还未见报道。本研究以奶牛乳腺上皮细胞为实验模型,探索PR L 调节RANKL表达的分子机制,旨在进一步丰富和完善PR L 调控奶牛乳腺组织发育及泌乳的调控机理。
1 材料与方法
1.1 试剂与仪器
DM EM/F12 培养基粉末、0.25% T rypsin-EDTA,Gibco;Dual-Luciferase Reporter Assay System,Prom ega;RANKL 抗体、STAT 5a 抗体、p-STAT 5a 抗体,Cell Signaling Technology;Lipofectamine 2000,Invitrogen;Kpn Ι 和Bgl Ⅱ限制性内切酶,Takara;CK-18 抗体,FITC 标记山羊抗兔二抗,Bioss;Pro lactin,Peprotech。
激光共聚焦扫描显微镜,德国Leica;PCR 仪、CO-150 型CO2细胞培养箱,美国Eppendorf;G lo-M ax 20/20 Luminom eter,Prom ega。
1.2 方法
1.2.1 乳腺上皮细胞分离培养及鉴定
取泌乳期荷斯坦奶牛健康新鲜乳腺组织,剔除多余脂肪和结缔组织,采用酶消化法从组织中分离乳腺上皮细胞。将得到的原代乳腺上皮细胞培养在鼠尾胶原包被的培养瓶中,使用DM EM/F12 培养基(含10%胎牛血清,100 μg/m L 链霉素,100 U/m L 青霉素),37 ℃,5% CO2条件下,进行贴壁培养。使用胰蛋白酶对细胞传代及纯化处理,将纯化后得到的乳腺上皮细胞进行CK-18 鉴定。
1.2.2 奶牛RANKL 启动子双荧光素酶报告载体的构建
采用DN A 提取试剂盒以奶牛乳腺上皮细胞中提取基因组DNA。以NCBI 数据库提供的牛源RANKL基因启动子序列为模板,采用Prim er 5 软件设计引物并进行PCR 扩增,引物序列如表1 所示。将PCR 扩增得到的基因片段与PGL3-Basic 载体,分别使用KpnΙ 和BglⅡ限制性内切酶进行双酶切反应。将酶切后DN A 片段与质粒载体进行连接转化,构建重组PGL3质粒,分别命名为:P-RAN KL-1428(L-1428)、PRAN KL-883(L-883)、P-RAN KL-239(L-239)、PRANKL-90(L-90)。将构建好的重组质粒进行双酶切及San-ger 测序验证。

表1 RANKL 基因启动子引物序列
1.2.3 双荧光素酶报告基因检测
将乳腺上皮细胞接种在12 孔板中,细胞密度长至80%左右进行转染处理。采用Lipo fectamine 2000 转染试剂将PGL3-Basic(阴性对照)、PGL3-CM V(阳性对照)、L-1428、L-883、L-239、L-90 6 种质粒与pR LTK 质粒按照50∶1 的比例共转染至乳腺上皮细胞中,具体实验操作按照产品说明书进行。转染6 h,在相应组中添加PR L 处理,继续培养48 h。采用Dual-Luciferase R eporter Assay System 来检测荧光素酶活性。
1.2.4 W estern Blot
采用R IPA 裂解液从处理后的乳腺上皮细胞中提取总蛋白,并使用BCA 蛋白浓度测定试剂盒对蛋白浓度进行测定,具体操作按照产品说明书进行。每孔40 μg 总蛋白用10%SDS-PAGE 进行电泳,然后将其转移到NC 膜上。将NC 膜用5%脱脂乳封闭2 h、37 ℃,用相应一抗4 ℃孵育过夜。将NC 膜充分清洗后,HRP 标记的二抗37 ℃孵育1 h。加入ECL发光液检测蛋白条带,并使用Im ageJ 对蛋白条带进行分析。
1.2.5 数据统计与分析
采用G raphpad Prism 8.0 对3 组独立的实验数据进行分析处理并作图。所有数据均以平均数±标准误表示,“*”表示P< 0.05,有统计学差异“**”表示P<0.01,有极显著统计学差异;“ns”表示P> 0.05,无统计学差异。
2 结果与分析
2.1 乳腺上皮细胞的鉴定
采用免疫荧光染色法对乳腺上皮细胞特异性标志物角蛋白18(CK-18)进行鉴定,激光共聚焦显微镜扫描结果如图1 所示。图中蓝色物质代表DAPI 染色的细胞核;绿色物质则代表FITC 染色的CK-18。实验结果表明,分离纯化得到的细胞为奶牛乳腺上皮细胞。

图1 奶牛乳腺上皮细胞CK-18 鉴定结果
2.2 PRL 对RANKL 蛋白表达的影响
1 μg/m L PR L 处理乳腺上皮细胞48 h,采用W estern Blot 方法检测PRLR、p-STAT 5a 以及RANKL 蛋白水平变化,结果如图2 所示。与对照组相比,PRL 能够显著提高PR LR、p-STAT 5a 以及RANKL蛋白的表达(P< 0.05),而STAT 5a 蛋白表达水平无显著变化(P> 0.05)。
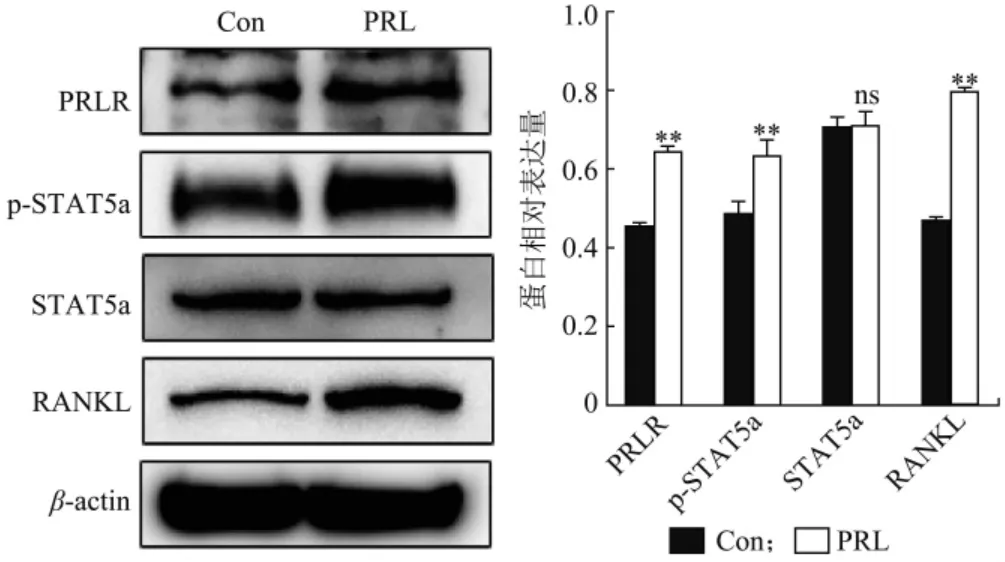
图2 PRL 对RANKL 蛋白表达的影响
2.3 RANKL 启动子双荧光素酶报告载体的构建
采用KpnΙ 和BglⅡ限制性内切酶对L-1428、L-883、L-239 及L-90 重组质粒进行双酶切验证,结果如图3 所示。电泳结果显示,在预期位置都出现相应大小的DNA 条带,结果说明L-1428、L-883、L-239及L-90 双荧光素酶载体构建成功。
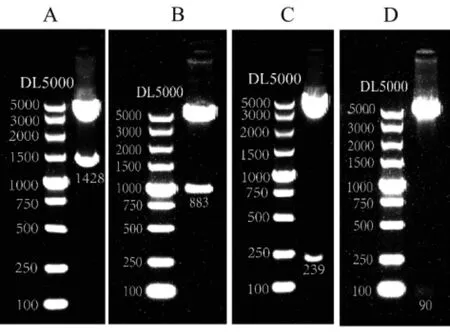
图3 RANKL 启动子双荧光素酶载体双酶切结果
2.4 PRL 对RANKL 启动子活性的影响
将PGL3-Basic、PGL3-CM V、L-1428、L-883、L-239 及L-90 载体与pR L-TK 共转染至乳腺上皮细胞中,转染6 h 后,添加PR L 刺激,继续培养48 h 后采用双荧光素酶报告基因检测RANKL 启动子不同长度区段的荧光素酶活性,结果如图4 所示。与对照组相比,PR L 处理后,L-1428 和L-883 启动子活性显著增加(P< 0.05),而L-239,L-90 启动子活性无显著变化(P> 0.05)。实验结果表明在RANKL 基因启动子在-883~ -239 bp 区段存在着PR L 响应元件。

图4 PRL 对RANKL 启动子活性的影响
采用JASPAR 数据库对RANKL基因启动子-883~-239 bp 区域进行预测,在-826~-814 bp 位置存在GAS 位点(5′-GGTTCCTATAAGC-3′)。为验证潜在的GAS 位点,采用定点突变的方法将该位点突变为5′- ATGATGATAGTCA-3′,构建突变型L-883-M ut 荧光素酶载体。分别将野生型L-883-W t 和突变型L-883-M ut 载体转染至乳腺上皮细胞中,转染6 h后,添加PR L 刺激,继续培养48 h 后采用双荧光素酶报告基因检测RANKL 启动子荧光素酶活性,结果如图5 所示。与对照组相比,PR L 能够显著增加野生型L-883-W t 启动子活性(P< 0.05),而突变型L-883-M ut 对PR L 刺激无显著变化(P> 0.05)。
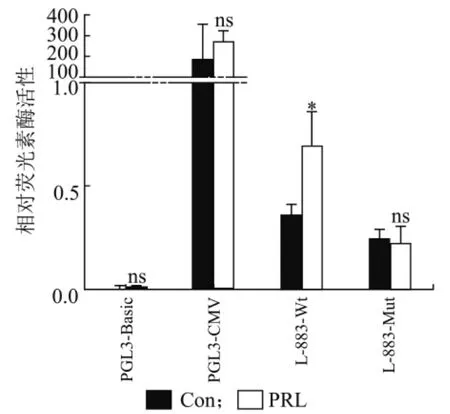
图5 PRL 对突变型RANKL 启动子活性的影响
3 讨论与结论
乳腺是一个动态发育器官,其发育过程主要发生在出生后[10]。新出生时乳腺组织中只有少量初步形态的导管,在甾体类激素、多肽类激素和一些细胞因子的控制下,乳腺组织逐渐发育完善[11-12]。PR L 是由垂体前叶催乳激素细胞分泌的多肽类激素,能够促进乳腺发育生长,启动且维持泌乳过程,并提高乳产量[13-15]。PR L 既能够通过间接调控孕酮的分泌来调控乳腺导管分支,也能够直接作用于乳腺上皮细胞,来促使腺泡结构的形成[9],因此在青春期及妊娠期,PR L 能够以旁分泌、自分泌和内分泌的形式调控转录因子、细胞与细胞、细胞与细胞基质的相互作用,从而控制着乳腺上皮细胞的增殖、乳腺导管延伸及分支和腺泡腔结构的形成[14-16]。PR L 与其受体PR LR 是乳腺上皮细胞增殖分化以及腺泡腔形成的重要驱动力[17]。RAN KL 是乳腺上皮细胞增殖和分化的关键调节因子,RANKL能够促进乳腺上皮细胞增殖、存活及小叶腺泡发育过程,特别是腺泡发育后期所必需[18-19]。已有研究发现,RANKL 是PR L 途径主要的下游信号分子,是PRL诱导乳腺发育关键调控因子[6-7]。本研究发现,在奶牛乳腺上皮细胞中,PRL 能够显著提高RANKL 蛋白的表达。
转录因子STAT 5 在泌乳期乳腺组织中被首次发现,是PRL 途径最重要的转录因子[20]。PR L 与其受体PR LR 结合引起受体二聚化,从而激活JAK 2,导致STAT 5 发生磷酸化[21-22]。一旦被激活,磷酸化的STAT 5蛋白分子会形成同源或者异源活性二聚体转导至细胞核,与靶基因启动子区域GAS 位点结合,调控靶基因的转录水平[23-25]。研究发现PR LR 和STAT 5a 是乳腺上皮细胞增殖分化所必需的[26-27],STAT 5a 缺失会引起引起乳腺上皮细胞凋亡增加[28]。在乳腺组织中,STAT 5a不仅调节上皮细胞的增殖分化和存活[29],还参与泌乳期乳蛋白的合成过程[30],例如STAT 5a 直接调节β-casein启动子活性来促进β-casein的表达。PR L 刺激引起STAT 5 被迅速招募到Cyclin D1启动子区域,增强Cyclin D1启动子活性[31-32]。本研究发现,PRL 刺激能够显著增加RANKL L-1428 和L-883 片段启动子活性,而对L-239 和L-90 片段启动子活性无影响。由此推测潜在PR L 响应元件位于RANKL 基因启动子-883~-239 bp 区域。早期研究也发现在小鼠内源性RANKL启动子中含有能够被PR L 激活的GAS 位点[33]。本研究采用定点突变的方法证明在奶牛RAN KL 基因启动子-826~-814 bp 位点存在一个GAS 位点,是转录调控的核心区段,该位点能够响应PR L 刺激。
综上所述,本实验结果表明在奶牛乳腺上皮细胞中,PRL 通过调控RANKL 启动子活性,促进RANKL 的表达。该结果为PRL 参与奶牛乳腺组织发育及泌乳过程提供了理论基础,进一步丰富和完善了PR L 在乳腺组织中的分子调控机制。

