麻风树JcHDZ28基因克隆与功能分析
唐跃辉, 赵雨凡, 蒋心言, 张英颖, 王 寒, 包欣欣, 范雨杰, 李 彤
(周口师范学院生命科学与农学学院,河南 周口 466001)
非生物胁迫如干旱、高温、低温、氧化胁迫、高盐等都会降低作物产量,给农业生产造成重大的经济损失。为了适应这些极端环境条件,植物在生理、代谢、形态和分子水平上进化出复杂的调控机制,通过激活或者抑制胁迫相关基因的表达使得植物在这些极端条件下能够更好地生存[1]。研究结果表明,一些转录因子如MYB、NAC、HD-Zip、AP2/ERF、WRKY、bZIP等家族成员参与调控植物生长发育和逆境胁迫的调控[1-6]。
HD-Zip蛋白是植物特异性转录因子,具有1个由61个氨基酸组成的高度保守的同源结构域(HD),以及1个与HD的羧基端紧密相连的亮氨酸拉链(LZ)元件。HD负责特异性DNA序列结合,调控下游基因的转录。LZ元件协助HD-Zip蛋白特异性识别目标DNA序列,起到二聚化的作用[1,7]。植物HD-Zip转录因子最先在玉米中被发现,编码1个涉及叶片发育的HD-Zip I类的转录因子[7]。之后,HD-Zip基因在不同的植物中被发现,并通过构建这类基因的功能缺失突变体或功能获得突变体对其功能进行了研究,结果表明HD-Zip蛋白在植物生长发育和逆境胁迫的调控中扮演重要的角色[6-8]。例如,TaHDZipl-2正调控小麦花期和穗的发育[9];oshox33突变体通过改变GS1和GS2的表达呈现出叶片衰老的表型[10];AtHB12是一种潜在的关键调节因子,参与植物叶片发育的调节[11]。除此之外,许多研究结果表明HD-Zip蛋白也参与调节植物对非生物胁迫的响应[12-13]。提高TaHDZipI-5基因的表达水平增强了转基因小麦对干旱胁迫和冷胁迫的抗性[12];提高OsHOX24基因的表达水平增强了转基因水稻抗旱、抗盐能力[13];玉米HD-Zip家族基因Zmhdz10通过调控干旱胁迫相关基因的表达正调控转基因拟南芥对干旱胁迫的响应[14]。尽管许多物种HD-Zip基因家族成员已被克隆并进行功能分析,然而,麻风树中参与生长发育和胁迫调控的HD-Zip基因仍然有待挖掘和进一步研究。
麻风树又名小桐子,由于其具有生长快、适应性强、耐贫瘠、耐干旱、耐盐碱、种仁含油量高等特点成为生产生物柴油的明星物种,越来越引起科学家的重视[15]。因此,本研究拟从麻风树中挖掘响应盐胁迫的HD-Zip家族基因并对其调控的分子机制进行研究,以期为麻风树耐盐品种的培育提供理论依据。
1 材料与方法
1.1 植物材料与胁迫处理
试验材料为麻风树自交系品种GZQX0401和拟南芥Columbia-0。选取6叶期麻风树的根、茎、叶、花和授粉后35 d的种子进行JcHDZ28基因组织特异性表达分析。盐胁迫试验,对6叶期麻风树直接浇灌150 mmol/L的NaCl溶液,选取胁迫处理0 h、2 h、6 h、12 h和24 h的第4片叶,-80 ℃保存备用。
1.2 JcHDZ28基因序列分析
麻风树JcHDZ28序列和该基因在别的物种中的同源基因均来自于NCBI(美国国立生物技术信息中心),JcHDZ28在拟南芥中的同源基因来自TAIR数据库。采用DNA MAN 9.0软件进行蛋白质氨基酸序列分析。
1.3 JcHDZ28基因亚细胞定位
以麻风树叶片cDNA为模版,通过RT-PCR技术克隆获得不含终止密码子的JcHDZ28编码序列,随后将其连接到pBWA(V)HS-GLosgfp载体构建pBWA(V)HS-JcHDZ28-GLosgfp融合表达载体。将构建好的pBWA(V)HS-JcHDZ28-GLosgfp载体和pBWA(V)HS-GLosgfp载体通过聚乙二醇(PEG)介导转入拟南芥原生质体细胞,在共聚焦扫描显微镜(Leica TCS SP8)上获得定位样品的荧光图像。聚乙二醇介导的转化和原生质体制备参照文献[16]的方法进行。
1.4 基因克隆与转基因植株构建
以麻风树叶片cDNA为模版,通过RT-PCR技术克隆获得JcHDZ28基因的全长编码序列,测序后,将测序正确的序列连接到p1301载体KpnI和XbaI的酶切位点之间,构建35S::JcHDZ28-p1301植物表达载体。然后通过GV3101介导的花序浸染法将35S::JcHDZ28-p1301载体转化到拟南芥中获得转基因植株[14]。通过潮霉素、β-葡萄糖苷酸酶(GUS)染色和RT-PCR确定有效JcHDZ28转基因植株用于后续试验研究,以期为麻风树耐盐品种的培育提供理论依据。
1.5 转JcHDZ28基因植株盐胁迫分析
首先用潮霉素将野生型拟南芥和转JcHDZ28基因植株种子消毒,4 ℃暗处理2 d后,将拟南芥Columbia-0(WT,野生型)和转JcHDZ28基因植株种子点播到1/2 MS和含有100 mmol/L NaCl的1/2 MS培养基中,置于22 ℃生长间中生长(16 h 光照/8 h黑暗),20 d后观察表型。
1.6 生理指标分析
选用盐胁迫处理15 d的野生型拟南芥和转JcHDZ28基因植株叶片进行相对电导率和脯氨酸含量测定。相对电导率的测定方法参照文献[14],脯氨酸含量测定方法参照文献[17]。
1.7 RNA提取和定量PCR分析
RNA采用TRIzol试剂进行提取,采用Invitrogen SuperScript III逆转录酶试剂盒合成第一链cDNA,具体操作方法参照试剂盒使用说明书进行。采用SYBR PremixExTaqTMII 试剂盒和LightCycler 480定量PCR仪进行qRT-PCR检测。基因相对表达量采用2-△△Ct方法进行计算。本研究所用引物信息见表1。

表1 本研究所用引物
2 结果与分析
2.1 JcHDZ28基因的生物信息学分析
设计特异性引物,以麻风树叶cDNA为模版,通过RT-PCR克隆获得JcHDZ28基因编码区序列,测序并通过NCBI比对,结果表明,JcHDZ28基因编码区序列(CDS)全长882 bp,编码293个氨基酸。我们进一步通过DNA MAN软件对JcHDZ28及其与在别的物种中的同源基因的相似性进行了分析,结果表明,麻风树JcHDZ28蛋白与拟南芥、玉米和水稻中的HD-Zip家族成员高度同源,且均含有高度保守的HD和LZ基序(图1)。

Oshox1表示水稻中的HD-Zip家族蛋白;Zmhdz25表示玉米中的HD-Zip家族蛋白;AtHB2表示拟南芥中的HD-Zip家族蛋白。
2.2 JcHDZ28基因的表达模式分析
为了进一步研究JcHDZ28在植物生长发育中的作用,我们使用qRT-PCR分析了JcHDZ28基因在根、茎、叶、花和种子中的表达模式,结果表明,在所有被检测的器官中都检测到JcHDZ28的表达,且JcHDZ28基因在生殖器官(花和种子)中的相对表达量较高(图2a)。我们进一步检测了JcHDZ28基因在盐胁迫下的表达模式,结果表明,JcHDZ28基因在盐胁迫2 h、6 h、12 h和24 h的相对表达量均显著低于盐胁迫0 h的相对表达量,且盐胁迫24 h的相对表达量相比盐胁迫6 h、12 h有所提高(图2b)。该结果进一步表明,JcHDZ28基因也许在植物响应盐胁迫中起重要的调控作用。

a:JcHDZ28基因组织特异性表达;b: JcHDZ28基因在盐胁迫条件下的表达模式分析。 **表示在盐胁迫2 h、6 h、12 h、24 h与0 h相比差异极显著(P<0.01)。
2.3 JcHDZ28蛋白的亚细胞定位
为了检测JcHDZ28蛋白的亚细胞定位,我们构建了35S::JcHDZ28-GLosgfp融合表达载体。随后将构建好的质粒连同35S::GFP质粒一起转化到拟南芥原生质体细胞,在共聚焦扫描显微镜上获得定位样品的荧光图像。结果(图3)表明,35S::GFP质粒在所有细胞中都可以检测到荧光信号,然而,35S::JcHDZ28-GFP质粒只在细胞核中检测到了明亮的绿色信号。这些结果表明,JcHDZ28蛋白定位于细胞核中。

图3 JcHDZ28蛋白亚细胞定位分析
2.4 转JcHDZ28基因拟南芥表型分析
为了进一步研究JcHDZ28基因的功能,我们构建了过表达转JcHDZ28基因拟南芥植株。RT-PCR结果表明,检测到JcHDZ28基因在转基因株系中高表达,在野生型中没有检测到表达(图4a)。表型分析结果表明,过表达JcHDZ28不影响拟南芥地上部分生长发育(图4b)。开花时间统计结果表明,转JcHDZ28基因植株开花时间与野生型相比没有显著差异,表明过表达JcHDZ28不影响拟南芥开花时间(图4c)。这些结果表明,JcHDZ28基因不影响转基因拟南芥地上部分的生长和发育。

a:JcHDZ28基因在野生型拟南芥和转基因拟南芥中的表达情况;b:转JcHDZ28基因植株表型分析;c:转JcHDZ28基因植株开花时间统计。 WT:野生型;OE1:转JcHDZ28基因植株1号株系;OE2:转JcHDZ28基因植株2号株系;OE3:转JcHDZ28基因植株3号株系。
2.5 转JcHDZ28基因拟南芥盐胁迫抗性分析
qRT-PCR结果表明盐胁迫抑制JcHDZ28基因的表达(图2b),因此我们推测JcHDZ28也许参与植物对盐胁迫的响应。为了证明这个假设,我们进一步检测了野生型和转基因植株对盐胁迫的抗性。我们将消毒后的野生型和转JcHDZ28基因植株直接点播到1/2 MS和含有100 mmol/L NaCl的1/2 MS培养基中生长20 d。结果表明,在盐胁迫条件下,转基因拟南芥植株大小明显小于野生型拟南芥植株大小,叶片白化更严重(图5a),存活率极显著低于野生型拟南芥(图5b)。生理指标测定结果表明,在盐胁迫条件下,转基因拟南芥植株叶片相对电导率极显著高于野生型拟南芥(图5c),脯氨酸含量极显著低于野生型拟南芥(图5d)。这些结果表明,过表达JcHDZ28降低了转JcHDZ28基因植株对盐胁迫的抗性。
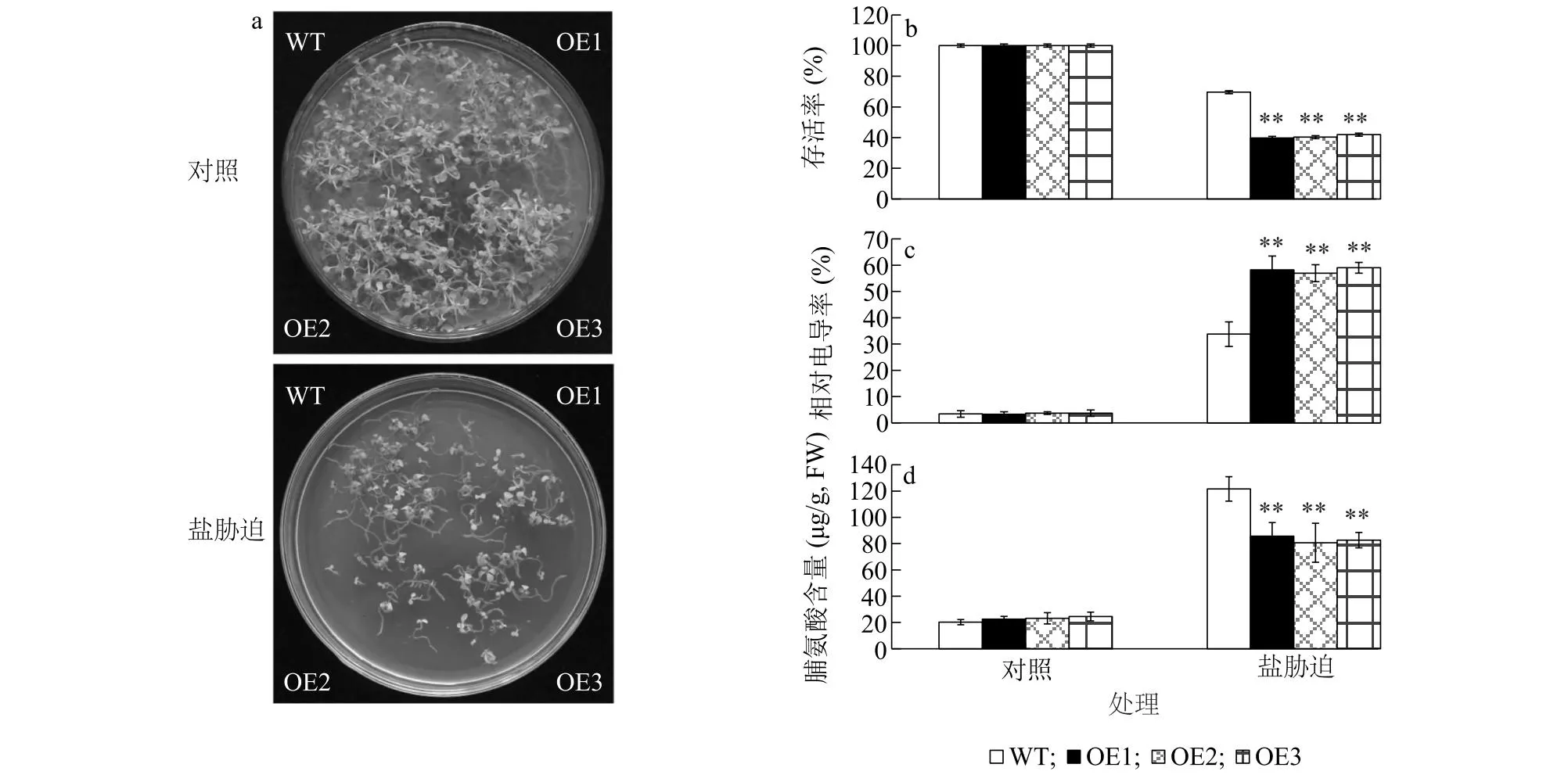
a:野生型拟南芥和转JcHDZ28基因拟南芥在正常生长和盐胁迫(100 mmol/L NaCl)条件下的生长分析;b:成活率分析;c:相对电导率分析;d:脯氨酸含量分析。 WT:野生型;OE1:转JcHDZ28基因植株1号株系;OE2:转JcHDZ28基因植株2号株系;OE3:转JcHDZ28基因植株3号株系。**表示在盐胁迫条件下转基因植株与野生型植株相比差异极显著(P<0.01)。
2.6 盐胁迫条件下非生物胁迫相关基因表达
为了进一步阐明JcHDZ28调控拟南芥响应盐胁迫的分子机理,我们通过qRT-PCR技术检测了SNAC1、AtCATA、LEA3、P5CS1等胁迫相关基因的表达。结果表明,在正常生长条件下,SNAC1、AtCATA、LEA3、P5CS1在野生型拟南芥和转JcHDZ28基因拟南芥植株中的相对表达量没有显著差异,然而,在盐胁迫条件下,这些基因在转JcHDZ28基因拟南芥植株中的相对表达量显著低于在野生型拟南芥中的相对表达量(图6)。这些结果表明,盐胁迫条件下,过表达JcHDZ28增加转基因拟南芥对盐胁迫的敏感性也许是通过改变这些非生物胁迫相关基因的表达引起的。
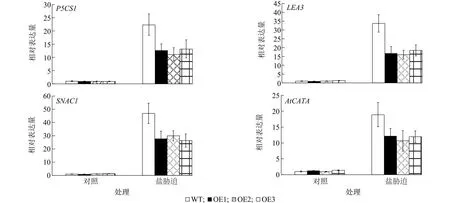
WT:野生型;OE1:转JcHDZ28基因植株1号株系;OE2:转JcHDZ28基因植株2号株系;OE3:转JcHDZ28基因植株3号株系。
3 讨 论
HD-Zip基因是植物特异性转录因子基因,这些转录因子基因在植物生长发育(如胚胎发生、分生组织调控等)和非生物胁迫(如高盐、干旱等)过程中发挥重要的作用[1]。尽管许多HD-Zip转录因子基因在拟南芥、水稻和别的物种中的功能已经被阐述,但是HD-Zip基因在大戟科尤其是麻风树中的研究较少。在本研究中,我们克隆了麻风树JcHDZ28基因(1个HD-Zip家族基因的成员)并分析了该基因的功能,在拟南芥中超表达JcHDZ28增加了转基因植物对盐胁迫的敏感性。
前人研究结果表明,超表达HD-Zip家族基因能够改变转基因植物对非生物胁迫的抗性[12-15]。在水稻中,过表达HD-Zip家族基因增加了转基因水稻对非生物胁迫的敏感性[15]。与此相似,在本研究中,转JcHDZ28基因拟南芥在盐胁迫条件下的植株大小和存活率均低于野生型拟南芥。前人研究结果表明,当植物遭遇非生物胁迫的时候,其体内的一些生理指标迅速变化使得植物能够更好地应对这些极端环境条件[12-14]。因此,生理指标可以用来衡量植物对非生物胁迫的抗性。相对电导率是植物遭受逆境胁迫时其细胞膜损伤程度的重要评价因子[15]。本研究结果表明,转JcHDZ28基因拟南芥在盐胁迫条件下的相对电导率极显著高于野生型拟南芥,该结果进一步表明,盐胁迫对转JcHDZ28基因拟南芥细胞膜的破坏程度显著高于野生型拟南芥。脯氨酸能够用来作为稳定剂降低高盐、干旱等极端环境胁迫对植物的危害[16-17]。本研究结果表明,在盐胁迫条件下,转JcHDZ28基因拟南芥叶片脯氨酸的含量显著低于野生型拟南芥,该结果进一步表明,在盐胁迫条件下,脯氨酸也许是一个导致转JcHDZ28基因拟南芥具有更高敏感性的因子。以上结果进一步表明,盐胁迫对转基因拟南芥的破坏程度显著高于野生型拟南芥。
除了上述生理指标外,转基因植物对盐胁迫敏感性的增加也归因于非生物胁迫响应基因的下调表达[18]。例如,HsfA3s通过降低非生物胁迫响应基因的表达增加了转基因植物对盐胁迫的敏感性[18]。与此类似,在我们的研究中,在盐胁迫条件下,一些非生物胁迫应答基因 (SNAC1、AtCATA、LEA3和P5CS1)在转基因拟南芥中的相对表达量显著低于在野生型拟南芥中的相对表达量。综上,过表达JcHDZ28降低了转基因拟南芥对盐胁迫的抗性可能是因为降低了非生物胁迫相关基因的表达。本研究结果将有助于我们进一步了解HD-Zip转录因子基因JcHDZ28在麻风树中的生理功能。

