基于Caspase-3/PARP通路探究龟鹿二仙胶及拆方对IL-1β诱导的退变软骨细胞凋亡及细胞外基质的影响
吴伟欣,郑珍萍,顾富城,杨美鑫,王和鸣,李 楠,3
(1. 福建中医药大学中医学院,福建 福州 350122;2. 福建中医药大学,福建 福州 350122;3. 中医骨伤及运动康复教育部重点实验室,福建 福州 350122)
膝骨关节炎是一种以关节软骨退变为特征的慢性退行性骨关节疾病,其发生后,软骨细胞的稳态环境受到破坏,继而发生软骨细胞凋亡、软骨下骨硬化,而软骨退变又与软骨细胞凋亡程度及细胞外基质(ECM)分解合成密切相关,因此,如何减少软骨细胞凋亡及调节ECM分解合成平衡成为治疗膝骨关节炎的关键[1-4]。王和鸣教授从“肾主骨生髓”理论出发,在临床上运用龟鹿二仙胶填精补髓治疗膝骨关节炎取得良好疗效[5]。课题组前期研究证实,龟鹿二仙胶及拆方均能有效抑制软骨细胞凋亡,对软骨ECM也有一定调控作用[6-7]。但龟板胶和鹿角胶对ECM分解合成平衡的影响还有待进一步观察。此外有研究表明半胱氨酸蛋白酶3/多聚腺苷二磷酸核糖聚合酶(Caspase-3/PARP)信号通路参与细胞凋亡[8],但目前国内外研究尚未见中药治疗膝骨关节炎的作用机制是否与该信号通路有关。因此本研究基于该信号通路,探究了龟鹿二仙胶及拆方对白细胞介素-1β(IL-1β)诱导的退变软骨细胞凋亡及ECM的作用及可能保护机制。
1 实验材料与方法
1.1动物 2月龄清洁级SD大鼠40只,体重(200±20)g,雌雄各半,委托福建中医药大学动物实验中心代购和饲养(动物使用许可证号:[SYXK(闽)2019-0007]),用于含药血清的制备;4周龄清洁级C57BL/6小鼠60只,体重(90±10)g,雌雄不限,用于原代野生型软骨细胞提取。动物均由上海斯莱克实验动物有限责任公司提供,实验动物合格证号:SCXK(沪)2017-0005。
1.2药物 龟鹿二仙胶由龟板胶9 g、鹿角胶6 g、人参6 g、枸杞9 g构成,各味药物批号分别为1175,951,448,203,均购自闽侯县上街致诚医药商店。
1.3主要设备 ChemiDocXRS化学发光成像系统(美国Bio-Rad公司),9600 PCR扩增仪(美国PE公司),ABI7500 7500 Real-Time PCR仪(美国ABI公司),E163302 CO2培养箱(美国Thermo Scientific公司),荧光显微镜(麦克奥迪实业集团有限公司),DG5033A酶联免疫检测仪(上海继锦化学科技有限公司)。
1.4主要试剂 IL-1beta protein[亚科因(武汉)生物技术有限公司,批号:prp1119-5μg];CCK-8试剂盒(北京全式金生物技术有限公司,批号:fc101-03);基质金属蛋白酶-13(MMP-13)Rabbit PolyClonal antibody[美国proteintech(PTG)公司,批号:18165 -1-AP];Mouse anti GAPDH Monoclonal antibody[美国proteintech(PTG)公司,批号:60004-1-Ig];PARP-1 Mouse Monoclonal Antibody[美国proteintech(PTG)公司,批号:66520-1-Ig];Anti-聚集蛋白聚糖(Aggrecan) antibody(美国abcam公司,批号:ab36861);Anti-Caspase-3 antibody(美国abcam公司,批号:ab13847);HiScript II Q RT SuperMix for qPCR(+gDNA wiper)(美国lablead公司,批号:R123-01);Peroxidase-conjugated Affinipure Goat Anti-Mouse IgG(H+L)(美国lablead公司,批号:SA00001-1);荧光定量PCR试剂盒(SYBR Green qPCR Mix,美国biosharp公司,批号:BL698A);TUNEL试剂盒(上海翊圣生物有限公司,批号:40306ES50)。
1.5实验方法
1.5.1空白血清和含药血清的制备 将SD大鼠按照随机数字表法分为4组各10只:空白血清组按10 mL/kg的量给予生理盐水灌胃;龟鹿二仙胶含药血清组、龟甲胶含药血清组及鹿角胶含药血清组按人与动物等效剂量比值换算给药量[9],分别灌胃2.7 g/kg龟鹿二仙胶、0.81 g/kg龟甲胶、0.54 g/kg鹿角胶;均2次/d,连续7 d。末次灌胃2 h后,采用1.25 g/kg乌拉坦麻醉大鼠[10],腹主动脉采血,室温静置2 h,3 000 r/min离心15 min,吸上清,灭活后0.22 μm滤膜过滤,-20 ℃冰箱保存备用。
1.5.2软骨细胞的培养 参考文献[11]方法进行小鼠软骨细胞提取,无菌操作,用刀片刮取双侧膝关节透明的软骨组织,更换新刀片将软骨组织切碎至约1 mm3大小,经消化后获得软骨细胞悬液,用含10% FBS及1%青链霉素双抗的DMEM培养基重悬软骨细胞,接种于T25细胞培养瓶中,置于培养箱中培养(5%CO2、37 ℃),标记为原代,待细胞融合约90%后进行传代培养。采用Ⅱ型胶原免疫荧光染色对第1代软骨细胞进行鉴定[12]。
1.5.3细胞分组及干预培养 将软骨细胞分为空白组、模型组、龟鹿组、龟板组、鹿角组,每组各1块6孔板。除空白组外,其余组均给予10 ng/mL IL-1β干预24 h,之后空白组、模型组加入10%空白血清培养,龟鹿组加入10%龟鹿二仙胶含药血清培养,龟板组加入10%龟板胶含药血清培养,鹿角组加入10%鹿角胶含药血清培养。培养24 h后,倒置相差显微镜观察,进行相应指标检测。
1.5.4检测指标及方法
1.5.4.1软骨细胞活性 各组细胞培养24 h后,向每孔加入10 μL CCK-8试剂,孵育2 h,酶标仪检测细胞在450 nm下的光密度(OD)。
1.5.4.2软骨细胞凋亡情况 采用TUNEL法检测:各组细胞培养24 h后,弃培养液,PBS洗3次,4%多聚甲醛固定,配制Proteinase K工作液,1×Equilibration Buffer室温孵育,TdT孵育缓冲液避光孵育,DAPI染核封片,荧光显微镜观察。
1.5.4.3软骨细胞中Caspase-3、PARP-1表达情况 采用免疫荧光染色法检测:各组细胞培养24 h后,弃培养液,PBS洗3次,4%多聚甲醛固定,常规通透、封闭,Caspase-3及PARP-1抗体孵育过夜,加入荧光二抗,DAPI染核封片,荧光显微镜观察,采用Image-Pro Plus 6.0软件分析检测数据,计算平均荧光强度。
1.5.4.4软骨细胞中Caspase-3、PARP-1、MMP-13、Aggrecan蛋白表达情况 采用Western blot法检测:各组细胞培养24 h后,加入含有RIPA裂解液的蛋白酶抑制剂混合液提取总蛋白并定量,每组按50 μg总蛋白在恒压条件下进行电泳,然后采用湿转法进行转膜,封闭,加入GAPDH及Caspase-3、PARP-1、MMP-13、Aggrecan一抗(抗体稀释比例分别为1∶10 000,1∶1 000,1∶1 000,1∶1 000,1∶3 000)孵育过夜,洗膜后加二抗(1∶10 000),37 ℃孵育1 h,洗膜,滴加超敏ECL化学发光剂凝胶显影。采用Image Lab软件对条带进行成像,选取曝光恰当的图片保存,分析并计算相应条带的灰度值。
1.5.4.5软骨细胞中Caspase-3、PARP-1、MMP-13、Aggrecan mRNA表达情况 采用qRT-PCR法检测:各组细胞培养24 h后,以Simply P总RNA提取试剂盒提取软骨细胞的总RNA,使用紫外分光光度计测量细胞的总RNA浓度和纯度。根据所测得的浓度计算含有500 ng的总RNA所需体积,按照HiScript II Q RT SuperMix for qPCR(+gDNA wiper)试剂盒说明进行反转录,最后按照SYBR Green qPCR Mix说明进行qRT-PCR反应,采用2-ΔΔCT法计算基因相对表达量。Caspase-3、PARP-1、MMP-13、Aggrecan引物均由上海博尚生物工程技术有限公司进行合成,引物序列见表1。

表1 Caspase-3、PARP-1、MMP-13、Aggrecan及GAPDH基因的引物序列
1.6统计学方法 通过SPSS 23.0统计软件对本

2 结 果
2.1软骨细胞形态 倒置相差显微镜下见原代软骨细胞培养至第3天细胞贴壁完成,进入快速增殖阶段;培养至第11天,软骨细胞均匀铺满瓶底,呈典型的“铺路石”状。第1代软骨细胞形态结构与原代一致,增殖速度较快,随着传代次数的增加,ECM减少,COL2A1结构发生改变,细胞增殖速度减慢,逐渐表现为长梭形或形态不规则,因此选用第1代软骨细胞进行后续实验。见图1。

图1 倒置相差显微镜下小鼠软骨细胞形态
2.2软骨细胞鉴定 荧光显微镜下,在不同吸收光波及发射光波激发下,COL2A1染色阳性为红色荧光;经DAPI试剂复染后,细胞核出现清晰蓝色荧光,细胞质及胞膜均出现清晰的红色荧光,表明软骨细胞表达COL2A1,具有软骨细胞特性。见图2。

图2 荧光显微镜下小鼠第1代软骨细胞形态
2.3软骨细胞活性及凋亡情况 与空白组比较,模型组软骨细胞活性明显降低(P<0.05),软骨细胞凋亡率明显升高(P<0.05);与模型组比较,龟鹿组、龟板组及鹿角组软骨细胞活性均明显升高(P均<0.05),软骨细胞凋亡率均明显降低(P均<0.05);与龟板组及鹿角组比较,龟鹿组软骨细胞活性更高(P均<0.05),软骨细胞凋亡率更低(P均<0.05);龟板组软骨细胞活性和软骨细胞凋亡率均明显低于鹿角组(P均<0.05)。见表2及图3。

图3 空白组和白细胞介素-1诱导各组小鼠软骨细胞凋亡情况(TUNEL检测)
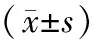
表2 空白组和白细胞介素-1诱导各组小鼠软骨细胞活性及凋亡情况比较
2.4软骨细胞中Caspase-3、PARP-1阳性表达情况 模型组Caspase-3、PARP-1平均荧光强度均明显高于空白组(P均<0.05);龟鹿组、龟板组及鹿角组Caspase-3、PARP-1平均荧光强度均明显低于模型组(P均<0.05),且龟鹿组Caspase-3、PARP-1平均荧光强度均明显低于龟板组及鹿角组(P均<0.05),龟板组Caspase-3、PARP-1平均荧光强度均明显低于鹿角组(P均<0.05)。见图4、图5及表3。

图4 空白组和白细胞介素-1诱导各组小鼠软骨细胞中Caspase-3表达情况(免疫荧光染色)

图5 空白组和白细胞介素-1诱导各组小鼠软骨细胞中PARP-1表达情况(免疫荧光染色)
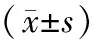
表3 空白组和白细胞介素-1诱导各组小鼠软骨细胞中Caspase-3、PARP-1阳性表达平均荧光强度比较
2.5软骨细胞中 Caspase-3、PARP-1、MMP-13、Aggrecan蛋白表达情况 与空白组比较,模型组Caspase-3、PARP-1、MMP-13蛋白相对表达量均明显升高(P均<0.05),Aggrecan蛋白相对表达量明显降低(P<0.05);与模型组比较,龟鹿组、龟板组及鹿角组Caspase-3、PARP-1、MMP-13蛋白相对表达量均明显降低(P均<0.05),Aggrecan蛋白相对表达量均明显升高(P均<0.05);与龟板组及鹿角组比较,龟鹿组Caspase-3、PARP-1、MMP-13蛋白相对表达量均更低(P均<0.05),Aggrecan蛋白相对表达量更高(P均<0.05);龟板组Caspase-3、PARP-1、MMP-13、Aggrecan蛋白相对表达量均明显低于鹿角组(P均<0.05)。见图6及表4。

图6 空白组和白细胞介素-1诱导各组小鼠软骨细胞中Caspase-3、PARP-1、MMP-13、Aggrecan蛋白表达免疫印迹
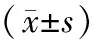
表4 空白组和白细胞介素-1诱导各组小鼠软骨细胞中Caspase-3、PARP-1、MMP-13、Aggrecan蛋白相对表达量比较
2.6软骨细胞中Caspase-3、PARP-1、MMP-13、Aggrecan mRNA表达情况 与空白组比较,模型组Caspase-3、PARP-1、MMP-13 mRNA相对表达量均明显升高(P均<0.05),Aggrecan mRNA相对表达量明显降低(P<0.05);与模型组比较,龟鹿组、龟板组及鹿角组Caspase-3、PARP-1、MMP-13 mRNA相对表达量均明显降低(P均<0.05),Aggrecan mRNA相对表达量均明显升高(P均<0.05);与龟板组及鹿角组比较,龟鹿组Caspase-3、PARP-1、MMP-13 mRNA相对表达量均更低(P均<0.05),Aggrecan mRNA相对表达量更高(P均<0.05);龟板组Caspase-3、PARP-1、MMP-13、Aggrecan mRNA相对表达量均明显低于鹿角组(P均<0.05)。见表5。
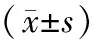
表5 空白组和白细胞介素-1诱导各组小鼠软骨细胞中Caspase-3、PARP-1、MMP-13、Aggrecan mRNA相对表达量比较
3 讨 论
膝骨关节炎属于中医“痹证”范畴,其中辨证为肝肾亏虚证者多表现为腰膝酸软、倦怠乏力,甚或肌萎无力,不耐久行[13]。龟鹿二仙胶出自《医方考》,具有填补精髓、益气壮阳之功,正是针对膝骨关节炎肝肾亏虚而设。
目前认为关节局部长期存在的炎症环境在膝骨关节炎软骨退变中发挥着至关重要的作用,其中IL-1β起到尤为关键的作用[14-15]。IL-1β激活能够引起ECM降解,诱导软骨细胞凋亡[16-17]。关节软骨由软骨细胞和ECM组成,而软骨细胞是关节软骨的主要组成部分,软骨细胞凋亡是膝骨关节炎发生的主要原因[18-19]。因此,抑制软骨细胞凋亡可能是防治膝骨关节炎的有效途径。本实验结果表明,IL-1β诱导的软骨细胞活性明显降低,细胞凋亡率升高;给予龟鹿二仙胶及拆方干预后,软骨细胞活性升高,细胞凋亡率降低,其中龟鹿二仙胶抑制凋亡的作用优于龟板胶及鹿角胶,龟板胶优于鹿角胶,这与前期研究报道一致[6-7];而鹿角胶提高软骨细胞活性的作用强于龟板胶。
ECM分解代谢大于合成代谢是膝骨关节炎发生的另一重要机制[20]。相关研究表明,IL-1β在诱导ECM降解过程中也发挥了重要作用[21],其既可抑制软骨细胞Aggrecan合成,又能促进MMP-13的表达以促进ECM的降解,从而加速软骨组织的破坏[22]。本研究结果也发现,IL-1β能显著上调软骨细胞MMP-13蛋白及mRNA表达,下调Aggrecan蛋白及mRNA表达;在龟鹿二仙胶及拆方作用下,MMP-13 蛋白及mRNA表达下调,Aggrecan蛋白及mRNA表达上调,从而维持ECM合成与分解代谢之间的平衡,且龟鹿二仙胶药效强于龟板胶及鹿角胶。
为了进一步探究龟鹿二仙胶及拆方抑制IL-1β诱导软骨细胞凋亡及ECM降解的作用机制,本研究对Caspase-3通路相关因子进行检测。Caspase属于IL-1转化酶家族,Caspase-3是凋亡通路的关键基因,可通过激活下游靶基因PARP,促进细胞凋亡[23]。本实验结果表明,龟鹿二仙胶及拆方各组IL-1β诱导的软骨细胞中Caspase-3及PARP-1平均荧光强度、蛋白及mRNA表达均明显下调,说明龟鹿二仙胶及拆方可抑制Caspase-3/PARP信号通路的激活。
综上所述,龟板胶可抑制软骨细胞凋亡及ECM降解,鹿角胶可促进软骨细胞增殖和ECM合成代谢,龟鹿二仙胶作用效果优于龟板胶及鹿角胶,其作用机制可能与抑制Caspase-3/PARP信号通路的激活有关。
利益冲突:所有作者均声明不存在利益冲突。

