基于网络药理学与分子对接技术探讨脉管复康片治疗动脉粥样硬化的作用机制*
吴思敏,盛雯,陈春晓,黄雪云,张锦明△,赵玲
1 广州中医药大学,广东 广州 510405; 2 广东省中医院,广东 广州 510105
动脉粥样硬化(atherosclerosis,AS)是一种初期发病隐匿,中后期危害严重的慢性疾病,随着人口老龄化的不断加剧,AS发病率明显上升[1-2]。AS不断进展可导致血管管腔狭窄,血栓风险增加,继而引发缺血性中风、心源性猝死等疾病[3]。在全球范围内,每年约有2000万人死于该疾病[4],AS相关心血管疾病是35~70岁成年人的主要死亡原因[5]。2020年美国心脏病学会发表《全球心血管疾病和危险因素负担1990—2019》显示,AS导致的死亡占心血管疾病总死亡的3/4[6]。
AS的发病机制具有多样性、复杂性,近年来针对中药单体或中药复方治疗AS的多通道、复合调节的机制研究广受关注。脉管复康片(天津同仕堂集团股份有限公司生产,国药准字Z12020023)由丹参、鸡血藤、没药、乳香、郁金组成,具有活血化瘀、通经活络功效。相关基础及临床研究表明脉管复康片可改善下肢动脉硬化闭塞症患者血流变、踝肱指数以及肢体疼痛、怕冷、麻木、酸胀与间歇性跛行等症状,提高治疗有效率[7]。但其内在药理学机制仍在探索中。本研究通过网络药理学方法探析脉管复康片治疗AS的潜在机制和作用靶点,并通过分子对接技术进行验证,为下一步的分子机制研究提供参考。
1 研究方法
1.1 脉管复康片活性成分及靶基因筛选通过中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)对脉管复康片成分及靶基因进行筛选。依次检索关键词“丹参”“鸡血藤”“没药”“乳香”“郁金”,选择“Ingredients”,再根据口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18进行筛选,得到脉管复康片活性成分。选择“Related Targets”,获取脉管复康片所有成分对应的靶基因。使用UniProt数据库,将收集到的成分靶点转化为相应的基因名称,再利用计算机程序语言软件Strawberry Perl得到所有药物的活性成分及其对应的靶基因。
1.2 AS相关基因获取分别在5个疾病基因数据库:人类基因数据库(the human gene database,GeneCards)、在线人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM)、药物靶标数据库(therapeutic target database,TTD)、遗传药理学与药物基因组学数据库(pharmacogenetics and pharmacogenomics knowledge base,PharmGKB)、DrugBank数据库输入关键词“Atherosclerosis”,整合搜索结果,获得AS相关基因。运用R语言将脉管复康片靶基因与AS相关基因进行匹配,选择重叠部分作为脉管复康片治疗AS的关键靶基因,用R语言绘制韦恩图。
1.3 “药物-有效活性成分-关键靶基因”网络构建通过Cytoscape平台,将脉管复康片治疗AS的关键靶基因与脉管复康片活性成分映射,建立有效活性成分与关键靶基因对应关系。创建“有效活性成分”“关键靶基因”“属性”“有效活性成分-关键靶基因关系”文件,导入Cytoscape(Version 3.8.2)构建“脉管复康片-潜在活性成分-关键靶点-AS”网络。网络中的节点代表有效活性成分、关键靶基因;边代表有效活性成分与关键靶基因相互作用关系;红色、黄色、蓝色、绿色、紫色分别代表丹参、鸡血藤、没药、乳香、郁金;用CentiScape计算活性成分度中心性(degree centrality,DC)。节点DC越大该活性成分在网络中越重要。
1.4 构建蛋白-蛋白互作(protein-protein interactions,PPl)网络通过STRING数据库整合已知和预测的蛋白质与蛋白质之间相互作用。选择“multiple proteins”,输入关键靶基因,选择“Homo sapiens”进行检索。选择高等置信度为0.700,下载蛋白-蛋白相互作用tsv文件。将tsv文件导入Cytoscape,使用cytoNCA插件计算介数中心性(betweenness centrality,BC)、紧密中心性(closeness centrality,CC)、度中心性(degree centrality,DC)、特征向量中心性(eigenvector centrality,EC)、局部平均连接度(local average connectivity,LAC)、网络中心性(network centrality,NC)值,筛选得到PPI网络核心基因。BC、CC、DC、EC、LAC、NC值越高说明该节点在PPI网络中处于越核心的位置。
1.5 基因本体(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)分析在R软件(Version 4.0.3)安装Bioconductor软件包“org.Hs.eg.db”并运行,将脉管复康片治疗AS关键靶基因转换成entrez ID。然后在R软件安装“clusterProfiler”包,根据已转换的entrez ID,以P<0.05,Q<0.05进行关键靶基因GO与KEGG功能富集分析,并将结果以条形图和气泡图形式输出。
1.6 分子对接分析将“药物-有效活性成分-关键靶基因”网络图中DC值最高的前6个有效活性成分与PPI网络筛选的前4个核心靶基因进行分子对接。化合物2D结构通过PubChem数据库获取;靶基因3D结构通过PDB数据库获取。使用ChemOffice对化合物2D结构进行3D再处理,Autodock Vina软件进行活性口袋分析及分子对接,利用Pymol软件对结果进行输出优化。
2 结果
2.1 脉管复康片活性成分和靶基因筛选后共获得157个活性成分,其中丹参65个,鸡血藤24个,没药45个,乳香8个,郁金15个。对应靶基因丹参2566个,鸡血藤1142个,没药1425个,乳香659个,郁金1370个,使用Strawberry perl软件处理获得238个活性成分对应的靶基因。见表1。

表1 脉管康复片药物部分活性成分信息(排名前5)
2.2 AS相关基因共获得AS相关基因2419个。GeneCards中2372个,OMIM中1个,DrugBank中46个,PharmGKB中26个,TTD中22个。与活性成分对应的238个靶基因进行映射,得到活性成分治疗AS的153个靶基因。见图1—2。
2.3 “药物-有效活性成分-关键靶基因”网络DC排名前6:槲皮素为100,木犀草素为43,柚皮素为28,丹参酮ⅡA为28,刺芒柄花素为21,甘草查尔酮A为20。见图3。

图3 脉管复康片-AS-潜在活性成分-关键靶点网络
2.4 PPl网络首次筛选阈值为DC大于9、BC大于1.273448773、CC大于0.561643836、EC大于0.068733819、NC大于7,LAC大于6.222222222,共有42个节点和428个节点边缘。再次筛选阈值为DC大于13、BC大于1.17225274725274、CC大于0.76、EC大于0.188819929957389、NC大于11.4999999999999,LAC大于10.6153846153846,第二次筛选结果为20个节点和157个边缘,核心靶基因包括JUN、STAT3、MAPK1、TP53、CXCL8、Akt1、PTGS2、EGF、FOS、MAPK3、VEGFA、RELA、STAT1、MMP9、IL-1β、MAPK14、EGFR、CCL2、MYC、ICAM1。见图4。

图4 脉管复康片-AS靶点PPI网络
2.5 GO功能富集分析GO富集结果显示共富集关键靶基因2425个。生物学功能主要涉及脂多糖反应、细菌来源分子反应、金属离子反应氧化应激反应等。分子功能主要涉及配体激活的核受体活性、转录因子活性等。见图5。

图5 GO功能富集分析气泡图
2.6 KEGG通路富集分析将关键靶基因与KEGG通路进行映射,共富集167条通路,根据校正后P值进行排序,选择前30个进行气泡图展示。关键蛋白模块的相关通路主要涉及流体剪切应力和AS、AGE/RAGE、PI3K/Akt等信号通路,提示脉管复康片可能作用于多条信号通路、多个靶点发挥治疗AS的作用,其中流体剪切应力和AS通路最显著,红色部分是筛选出的靶基因在通路上的作用靶点。见图6—7。
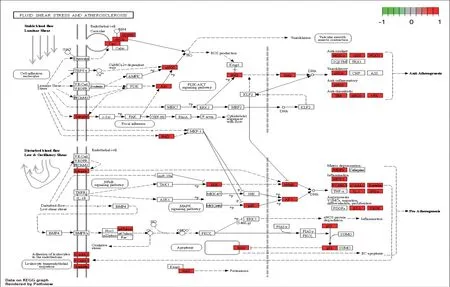
图7 流动剪切应力和AS信号通路图
2.7 分子对接结果度值最高的前6个有效活性成分:槲皮素、木犀草素、柚皮素、丹参酮ⅡA、刺芒柄花素、甘草查尔酮A,分别与PPI筛选的前4个相关核心蛋白(JUN、MAPK1、TP53、STAT3)进行分子对接。配体和受体结合越稳定,结合能越低,结果表明槲皮素、木犀草素、柚皮素、丹参酮ⅡA、刺芒柄花素、甘草查尔酮A与4个核心蛋白结合能均≤-8 kcal/mol,见表2。将结果导入PyMol软件进行视觉优化,输出分子对接三维图,蓝色为小分子配体,绿色为大分子受体。见附图1。

表2 核心活性成分与核心蛋白结合能量(kcal/mol)
3 讨论
现代医学研究发现,AS可由血管内皮损伤、脂质代谢异常、免疫反应发生、血流动力学改变等因素诱发形成[8]。血管内皮细胞作为血管壁的重要组成部分,其损伤所致的异常增殖和凋亡是AS发生、发展的病理生理基础[9-10],主要病理表现为粥样硬化的动脉局部高脂质积聚、纤维组织增生、多泡沫细胞和高炎症特征[4]。早期血液中单核细胞在血管平滑肌细胞功能受损时迁移至内皮,分化成巨噬细胞,摄入大量脂质,各种因素作用下大量胆固醇酯聚积至细胞转化成泡沫细胞,而泡沫细胞是AS斑块形成脂质条纹的特征性标志[11]。瘀血为AS的主要致病因素之一,既是致病的始动因子,又是其病理产物[12-13]。
本研究发现,脉管复康片治疗AS与153个靶基因关系密切,其中包括JUN、STAT3、MAPK1等20个核心靶基因。脉管复康片主要通过槲皮素、木犀草素、柚皮素、丹参酮ⅡA、刺芒柄花素、甘草查尔酮A等活性成分发挥治疗作用。槲皮素通过调控PI3K/Akt信号通路,减少活性氧的产生,抑制细胞凋亡和炎症反应,从而抑制高果糖所致AS[14];木犀草素可通过抑制NF-κB信号通路抑制炎症,从而保护单核细胞不黏附到内皮细胞[15],并通过抑制NOX2(还原型辅酶Ⅱ氧化酶的一个亚型)活化阻断佛波酯诱导的活性氧的产生,从而抑制AS发展[16];柚皮素通过增加AMP活化蛋白激酶磷酸化水平促进自噬,进而抑制AS中泡沫细胞形成,延缓AS的发生与发展[17]。研究发现[18],丹参酮ⅡA可能通过下调Yes关联蛋白磷酸化水平,影响活性氧的产生,对血管平滑肌细胞及血管内皮细胞增殖具有直接调控作用,进而延缓AS进展并发挥心血管保护作用。刺芒柄花素可通过调节Kruppel样因子4和类固醇受体RNA激活剂的相互作用,抑制AS发展[19]。甘草查尔酮A能抑制MH7A细胞增殖并诱导其凋亡,可能与其促进MAPK通路相关蛋白磷酸化的表达继而抑制炎症因子表达有关[20]。
本研究通过GO及KEGG富集分析发现,脉管复康片具有多通路、多靶点治疗AS的作用。主要涉及流体剪切应力和动脉粥样硬化、AGE/RAGE信号通路、PI3K/Akt信号通路等。剪切应力代表血流施加在血管壁内皮表面的摩擦力,其在血管生物学中起核心作用,扰动的血流和相关往复运动,低剪切应力通常会上调内皮细胞基因和蛋白,从而促进动脉壁的氧化和炎症状态,导致AS[21]。病理状态下,活跃的氧化应激会在减少一氧化氮合成的同时加快一氧化氮分解,增厚的血管内膜会阻碍一氧化氮向平滑肌扩散[22]。AGE/RAGE信号通路涉及还原型辅酶Ⅱ氧化酶、蛋白激酶C和MAPKs的多个细胞内信号途径的激活,通过NF-κB促进血管内皮生长因子表达,特异性促进血管内皮细胞有丝分裂,刺激内皮细胞合成一氧化氮并上调一氧化氮合酶表达,促进新生血管形成。新生血管管壁不完整,通透性强,可为斑块局部提供养分,是对缺氧的有益补偿,进一步促进AS进展[23]。PI3K/Akt信号通路动脉粥样硬化可促进细胞凋亡相关基因表达升高,加剧血管内皮细胞损伤及单核细胞聚集、分化和凋亡,引起血管平滑肌细胞功能异常及血管异常收缩,在血管内壁早期斑块的形成过程中至关重要[24-25]。
综上所述,本研究探析了脉管复康片治疗AS的核心基因靶点及信号通路,阐明了脉管复康片多通路、多靶点的潜在治疗优势,为后续脉管康复片治疗AS的机制研究奠定了基础。
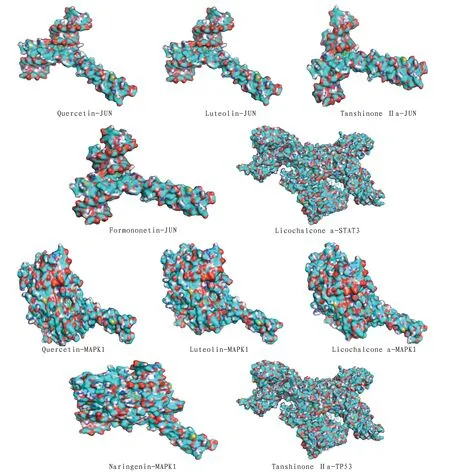
附图1 核心蛋白与活性成分分子对接结果

