脂联素通过上调PPARα/HOXA10 通路改善多囊卵巢综合征大鼠的子宫内膜容受性
王 娟,杨雯钦,刘 进,石金凤,肖 萍,李美香
1南华大学衡阳医学院//组织胚胎学教研室//应用解剖与生殖医学研究所//显微形态实验中心,湖南 衡阳 421001;2湖南省人民医院生殖医学中心//湖南师范大学附属第一医院,湖南 长沙410002
多囊卵巢综合征(PCOS)是一种复杂的内分泌和代谢异常所致的疾病,是育龄期女性不孕的最常见原因[1]。子宫内膜容受性受损和排卵障碍/无排卵都是多囊卵巢综合征相关不孕的重要原因[2,3]。然而,子宫内膜的变化从未像排卵功能障碍那样受到关注[4]。
子宫内膜容受性指子宫内膜接受胚泡着床、发育成胚胎的能力。哺乳动物的子宫内膜在“种植窗期”表现出最大的容受性。研究表明,子宫内膜容受性差是引起着床失败的主要原因[4,5]。影响子宫内膜容受性的因素主要有子宫内膜上皮细胞的胞饮突发育、子宫内膜的厚度、血流灌注水平和分子生物学等[6,7]。如何对PCOS患者子宫内膜容受性做出合适的评价和相应的改善措施来提高妊娠成功率,已成为生殖医学系统研究的焦点[2,4,5]。
脂联素(APN)作为一种具有胰岛素增敏、抗炎、抗动脉粥样硬化和抗增殖作用的新型脂肪因子[8,9]能直接调节生殖和胚胎着床过程[9,10]。研究发现子宫内膜中APN的动态平衡和抗炎作用可影响子宫内膜容受性和胚泡植入[10]。PCOS患者体内APN水平低于正常人[11],其血清APN水平与胰岛素抵抗(IR)呈负相关[12]。PCOS大鼠子宫内膜APN信号通路受损[13]。以上研究结果提示,APN与PCOS子宫内膜容受性有关,但其作用及机理目前尚未阐明。
过氧化物酶体增殖物激活受体(PPARs)是一种激素激活核受体和转录因子,可调节脂质代谢、脂肪生成、胰岛素敏感、炎症反应、细胞生长和分化[14],可参与卵巢雌、孕激素的合成并影响受孕,与生殖活动密切相关等[15]。PPAR家族存在PPARα、PPARβ和PPARγ3种亚型,在PCOS大鼠子宫内膜中均表达下调[16],其中PPARα可能和PCOS患者代谢紊乱有关[17],但其是否参与生殖功能的调节目前尚无相关报道。有研究发现APN可以通过其受体I 活化p38/MAPK 从而保护妊娠[18]。但APN是否可以通过上调PPARα的表达,改善PCOS子宫内膜容受性目前尚不明确。
本研究拟利用来曲唑建立大鼠PCOS模型,用APN及PPARα特异性抑制剂处理PCOS大鼠,观察大鼠动情周期的改变、卵巢和子宫组织形态学改变、血清激素和相关蛋白水平的变化,检测大鼠子宫内膜胞饮突的发育及评估大鼠生育能力,探讨APN对PCOS大鼠子宫内膜容受性的作用及可能机制,为APN应用于临床提供实验依据和理论基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 6周龄SD雌性大鼠50只,SPF级,购于长沙市天勤生物技术有限公司,合格证号:NO.43006700 017929;体质量160~212 g。
1.1.2 药物和试剂 来曲唑(浙江海正药业股份有限公司);APN(Sino Biological);玉米油(山东三星玉米产业科技有限公司);PPARα抑制剂(GW6471)(MCE);兔抗HOXA10 多克隆抗体(Gene Tex);兔抗PPARα抗体(Affinity Biosciences);兔抗Tubulin抗体(武汉三鹰生物技术有限公司);二抗:羊抗兔(Proteintech);广谱预染蛋白Marker(北京索莱宝生物科技有限公司);锇酸(Ted Pella);SDS-PAGE凝胶制备试剂盒、化学发光试剂盒和BCA蛋白浓度检测试剂盒(北京康为世纪生物科技有限公司);通用二步法免疫组化检测试剂盒和DAB kit(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 动物模型的建立、分组和后期干预 SD大鼠适应性喂养1周后随机分为正常组(CON组,n=10)、PCOS模型组(n=40)。CON组用生理盐水2 mL/d灌胃,模型组用来曲唑1 mg/(kg·d)溶于生理盐水中连续灌胃21 d,诱导PCOS模型。每日行阴道涂片(瑞氏染色)监测动情周期,动情周期紊乱视为造模成功。造模成功后,模型组随机分为4组(n=10):PCOS对照组(PCOS)、PAN干预组(PCOS+APN 组)、APN 联合PPARα抑制剂(GW6471)干预组(PCOS+APN+GW组)、APN联合玉米油阳性对照组(PCOS+APN+VEH组)。PCOS+APN组、PCOS+APN+GW组和PCOS+APN+VEH组均腹腔注射APN 10 μg/(kg·d),连续20 d。其中PCOS+APN+GW组于第11天起同时腹腔注射PPARα特异性抑制剂(GW6471)1 mg/(kg·d)溶于玉米油中,PCOS+APN+VEH组于第11天起同时腹腔注射玉米油,连续10 d。每天检测大鼠动情周期,每3 d检测1次体质量。实验期间动物自由饮水。所有操作均按照实验动物伦理学要求进行(伦理号:USC202007DS38)。
1.2.2 取材及生化指标检测 给药结束后处死大鼠。处死前1 d,大鼠晚9点开始禁食12 h,于次日9点经乌拉坦(0.6 mg/kg)麻醉后,快速心脏取血,离心取血清分装于-80 ℃保存备用。放射免疫法检测血清激素浓度,罗氏血糖仪测定空腹血糖(FBG)。取卵巢、子宫,拍照并称质量。将一半组织固定于4%多聚甲醛液中用于组织切片;另一半组织-80 ℃冰箱冻存待用。
1.2.3 大鼠动情周期监测 用生理盐水浸湿的消毒棉签擦拭子旋转插入大鼠阴道侧壁上1/3处,顺时针方向涂抹1周,取出的棉签沿同一方向涂抹于载玻片上,加1%瑞氏染色,在显微镜下观察阴道涂片的细胞学变化,判断动情周期。
1.2.4 卵巢和子宫形态学观察 将固定于4%多聚甲醛溶液中的卵巢和子宫按常规方法制作石蜡切片后,苏木素染色10 min,流水冲洗,盐酸酒精分色3 s,流水冲洗,伊红染色10 min,流水冲洗,自来水蓝化直至细胞核染色清晰为止,经常规脱水、透明后封片,镜下观察。
她一一向我介绍她的家具:懒人沙发,逍遥椅,水晶吊灯和银台灯。并说,老同学喜欢什么就搬走什么,没有问题。
1.2.5 免疫组织化学染色检测子宫组织中PPARα和HOXA10蛋白的表达 采用SP二步法,将组织切片脱蜡、水化、水浴锅加热进行抗原修复;3%H2O2去离子水孵育阻断内源性过氧化物酶,一抗PPARα(1∶1000)、HOXA10(1∶1000)4℃孵育过夜;PBS洗涤后,加反应增强液,室温孵育20 min;PBS洗涤后,加相应二抗孵育,DAB显色,自来水充分冲洗、苏木素复染、梯度酒精脱水、透明、封片,显微镜下阅片并拍照。
1.2.6 Western blot免疫印迹检测子宫组织中PPARα和HOXA10蛋白的表达 取子宫组织加裂解液研磨后,4 ℃、12 000 r/min离心20 min后取上清。按BCA试剂盒说明书操作检测蛋白浓度,按比例加入5×的上样缓冲液,煮沸后经聚丙烯酰胺凝胶电泳分离蛋白;转膜,5%的脱脂牛奶封闭。TBST 洗膜后,分别加入一抗PPARα(1∶5000)、HOXA10(1∶51000)、Tubulin(1∶5000)4 ℃冰箱孵育过夜;洗涤后分别加入相应的二抗标记物,常温孵育2 h;用增强化学发光法显色,凝胶成像仪成像,经Image J软件分析后得到灰度值。
1.2.7 扫描电镜观察大鼠子宫内膜胞饮突的发育 取动情期大鼠新鲜子宫中段,用PBS漂洗后迅速投入戊二醇中室温固定2 h,再转移至4 ℃保存。固定好的样品经PBS漂洗后用1%的锇酸和PBS混合液(1∶1)室温2 h,经乙醇梯度脱水后再干燥,金属镀膜处理后扫描电镜观察采图。发育中的胞饮突,细胞表面形成光滑、菲薄的内膜突起;发育完全的胞饮突,微绒毛减少,子宫内膜表面突起,极大程度折叠,形如蘑菇;退化的胞饮突,突起减少,微绒毛在子宫内膜表面再次出现,突起物表面褶皱增多,细胞体积增大。如果在同一标本中观察到不同发育阶段的胞饮突,本资料仅描述了其最普遍存在的表达方式。胞饮突的数量根据子宫内膜表面被覆胞饮突面积的百分比(>50%,20%~50%,<20%)可被分成丰富、中等、少量3种[4]。在高倍扫描电镜(×5000)下计数完全发育胞饮突数量,每例样本选择3个高倍镜视野,取平均值。
1.2.8 大鼠生育力评估 正常组取4只、PCOS组3只及PCOS+APN、PCOS+APN+GW组、PCOS+APN+VEH组各取5只雌性大鼠,与同等情况下且具有生育能力的正常雄性大鼠按照雌雄1∶1比例分别合笼饲养,次日晨9∶00观察阴栓及阴道涂片。发现阴栓或精子的大鼠记为孕第1天(D1),其余妊娠天数类推。于孕D10取材,观察胚胎数量及发育情况。
1.2.9 图像分析及统计学处理 图片均采用Image J软件处理和分析。所有计量数据均采用均数±标准差表示。统计学分析采用GraphPad Prism 8.0软件进行统计学处理。两组比较采用t检验,以Ρ<0.05为差异有统计学意义。
2 结果
2.1 APN干预可恢复PCOS大鼠动情周期、降低PCOS大鼠体质量
CON组大鼠保持规律的动情周期。与CON组相比,PCOS 组大鼠动情周期紊乱,PCOS+APN 组、PCOS+APN+GW组和PCOS+APN+VEH组的动情周期逐渐恢复正常(图1A)。5组大鼠体质量均有增加。与CON组比较,PCOS组大鼠的体质量增加显著(Ρ<0.01);而PCOS+APN组和PCOS+APN+VEH组的体质量均较PCOS组显著下降(Ρ<0.01);与PCOS+APN+GW组比较,PCOS+APN组和PCOS+APN+VEH组的体质量也均下降(Ρ<0.01,图1B)。

图1 APN干预对PCOS大鼠动情周期及平均体质量的影响Fig.1 Effects of APN administration on vaginal cytology and body weight of PCOS rats.A:Estrous cycles of the rats in the 5 groups. B: Average body weight of the rats after modeling and treatments (n=10).**P<0.01.P: Proestrus;E: Estrus;M:Metestrus;D:Ditestrus.
2.2 APN干预对PCOS大鼠生化指标的影响
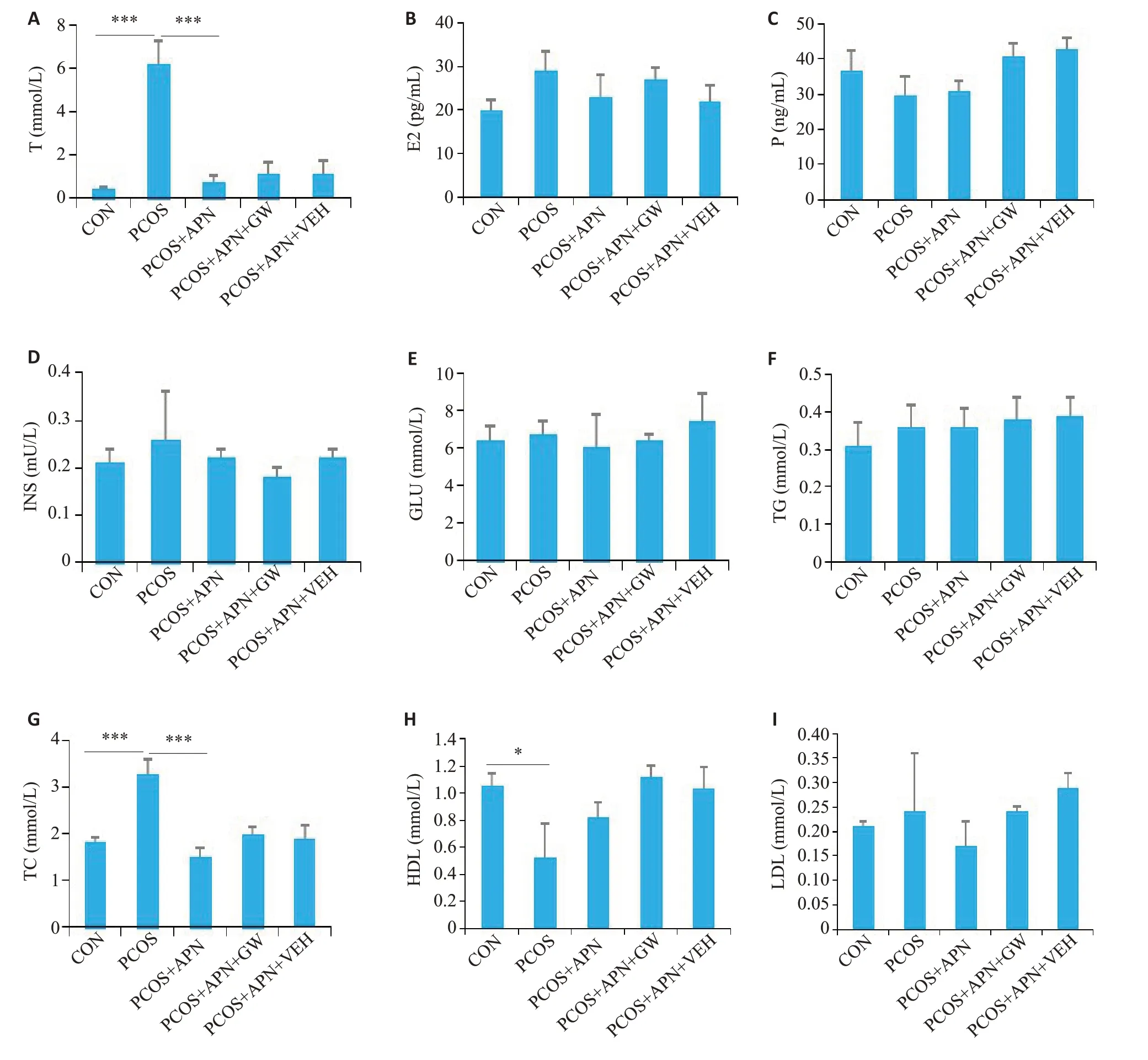
图2 APN对各组大鼠血清激素浓度、血糖和血脂的影响Fig.2 Effects of APN on sex hormone levels and blood glucose and lipid levels of PCOS rats.A-C:Serum levels of sex hormones including testosterone(T),estrogen(E)and progestational hormone(P)(n=10).D:Blood insulin levels(n=10).E:Blood glucose(GLU)levels.F-I:Serum levels of blood lipids including total triglyceride(TG),total cholesterol(TC),high-density lipoprotein(HDL)and low-density lipoprotein(LDL)(n=10).(*P<0.05,***P<0.001).
2.3 APN干预可降低PCOS大鼠卵巢指数、改善卵泡发育
大鼠卵巢肉眼观察可见,PCOS组大鼠卵巢表面苍白,体积较CON组稍大,表面可见多个囊性透亮卵泡(图3A);PCOS+APN组卵巢较PCOS组体积稍小。与CON组相比,PCOS组的卵巢指数显著升高(Ρ<0.05);PCOS+APN组与PCOS+APN+GW的卵巢指数均低于PCOS组(Ρ<0.05);PCOS+APN组与PCOS+APN+GW比较,卵巢指数差异无统计学意义(Ρ>0.05,图3B)。HE染色可见,与CON组比较,PCOS组大鼠卵巢内可见较多的囊性扩张卵泡,颗粒细胞数量减少、层数变少,结构较紊乱,黄体少见(图3C)。PCOS+APN 组、PCOS+APN+GW组和PCOS+APN+VEH组大鼠卵巢多囊情况较PCOS组均有所改善。
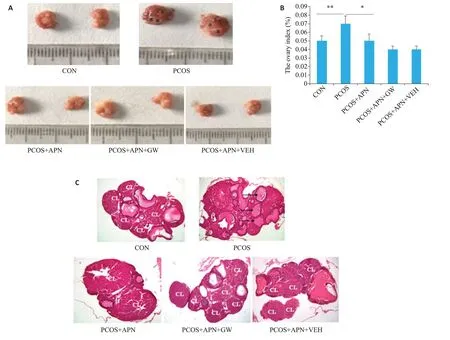
图3 APN对PCOS大鼠卵巢指数及形态学的影响Fig.3 Effects of APN on ovarian index and ovarian morphology.A:Appearance of the ovaries in the 5 groups.B:Effects of APN treatment on ovary index of PCOS rats(n=10).C:HE staining of the ovaries in each group(Original magnification,10×4).* and ↑indicates the cystic follicles.CL indicates the corpus luteum.*P<0.05,**P<0.01.
2.4 APN干预后PCOS大鼠子宫指数升高、子宫内膜增厚
与CON组相比,PCOS组的子宫细长,子宫指数显著降低(Ρ<0.05);PCOS+APN组与PCOS+APN+GW的子宫指数均较PCOS 组升高,子宫变粗(Ρ<0.05);PCOS+APN组与PCOS+APN+GW相比,子宫指数无显著性差异(Ρ>0.05)。HE染色可见,PCOS组大鼠的子宫内膜上皮相对于其他各组增厚,其他各组间则无明显差异(图4)。
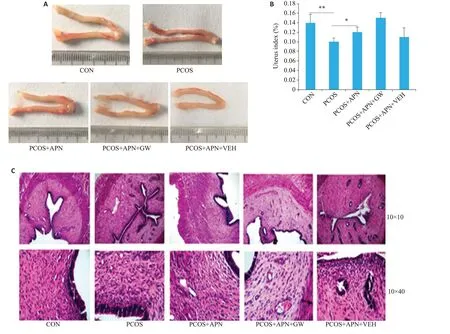
图4 APN对PCOS大鼠子宫指数及形态学的影响Fig.4 Effects of APN on uterine index and uterine morphology.A:Appearance of the uterus in the 5 groups.B:Effects of APN treatment on uterine index of PCOS rats(n=10).C:HE staining of the uterus in each group.*P<0.05,**P<0.01.
2.5 PPARα和HOXA10在大鼠子宫内膜的定位及表达情况
PCOS组大鼠的子宫内膜组织中,与CON组相比,PPARα和HOXA10的表达显著减少,与PCOS+APN组相比,PPARα和HOXA10的表达显著增多。PPARα和HOXA10主要表达在子宫内膜上皮细胞和子宫腺细胞胞浆中,呈棕褐色,血管内皮及固有层中也有阳性细胞,呈棕黄色。而在PCOS+APN+GW 组中,PPARα和HOXA10 的表达较PCOS+APN 组与PCOS+APN+VEH组相比均显著减少,颜色变浅(图5)。

图5 免疫组织化学检测各组大鼠子宫内膜组织PPARα和HOXA10的表达Fig.5 Expression of PPARα and HOXA10 in the endometrial tissue of rats in each group detected by immunohistochemical staining(×400).
Western blot检测处于同一动情周期时期的各组大鼠子宫内膜中PPARα和HOXA10蛋白的表达水平,结果显示,变化趋势与免疫组化结果一致(图6)。与CON比较,PCOS组大鼠子宫内膜PPARα和HOXA10表达显著降低(Ρ<0.001);与PCOS组比较,PCOS+APN组大鼠子宫内膜中PPARα和HOXA10表达显著上调(Ρ<0.01);与PCOS+APN组比较,PCOS+APN+GW组大鼠子宫内膜中PPARα和HOXA10表达显著降低(Ρ<0.05),PCOS+APN+VEH组大鼠子宫内膜中PARα和HOXA10表达无统计学差异;与PCOS+APN+GW组较,PCOS+APN+VEH 组大鼠子宫内膜中PPARα和HOXA10表达显著上调(Ρ<0.05)。
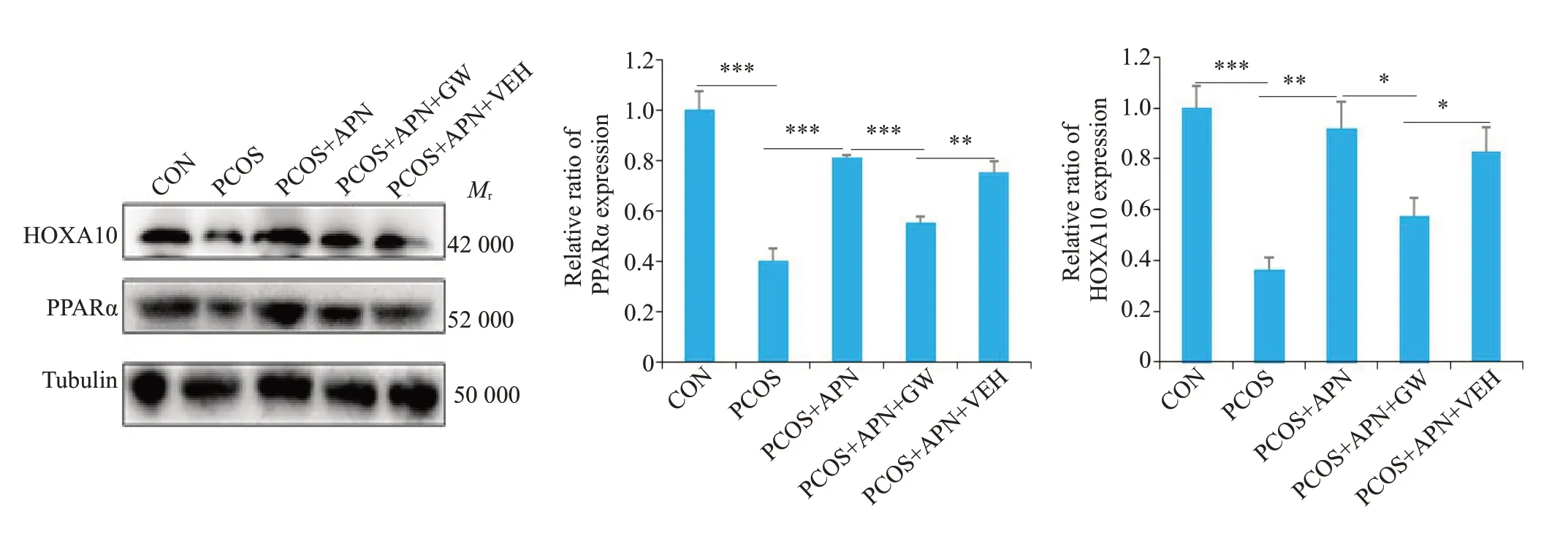
图6 各组大鼠子宫内膜组织中PPARα、HOXA10蛋白表达Fig.6 PPARα and HOXA10 protein expression in the endometrial tissue of the rats in each group detected by Western blotting.*P<0.05,**P<0.01,***P<0.001.
2.6 APN对大鼠子宫内膜的胞饮突发育情况的影响
CON组大鼠子宫内膜有完全发育胞饮突形成,而PCOS 大鼠子宫内膜胞饮突发育较CON 组欠佳。PCOS+APN组大鼠子宫内膜胞饮突的发育较PCOS组良好,PCOS+APN+GW组大鼠子宫内膜胞饮突的发育较PCOS+APN组欠佳,而PCOS+APN+VEH组大鼠子宫内膜胞饮突发育较PCOS+APN+GW组良好(图7)。
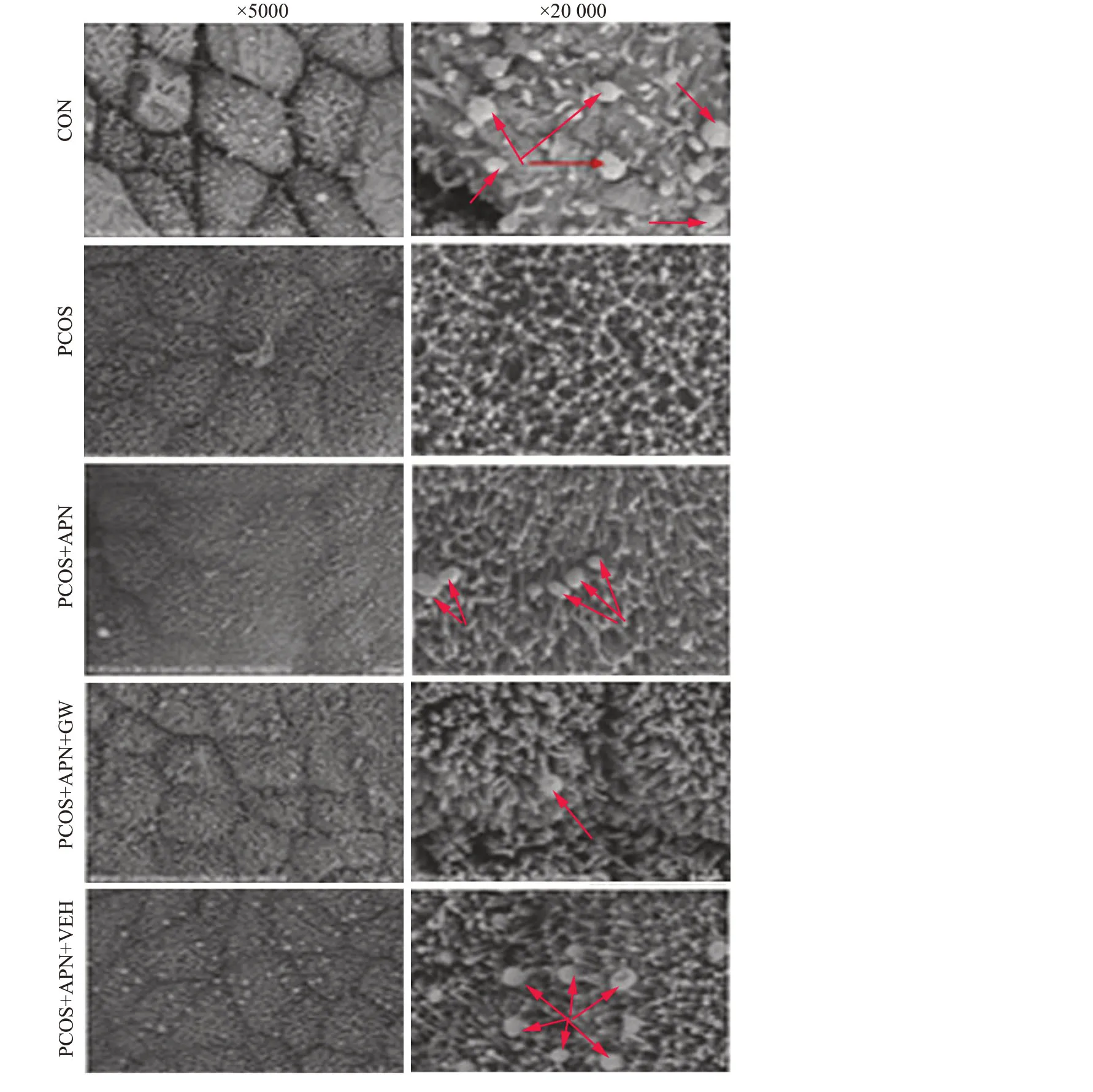
图7 APN各组大鼠子宫内膜胞饮突发育的影响Fig.7 Effects of APN on the development of endometrial pinopodes (PP) in each group.Red arrows indicate the pinopodes.
2.7 APN对大鼠妊娠的影响
各组大鼠均有妊娠(图8A),与PCOS组大鼠妊娠率(33%)相比,其余各组大鼠妊娠率(100%)一致。与CON组比较,PCOS组大鼠胚胎数量显著减少;APN干预后大鼠胚胎数量明细增多;而加入PPARα特异性抑制剂干预后(PCOS+APN+GW组),大鼠胚胎数量显著减少,且胚胎发育迟缓(图8C、D)。
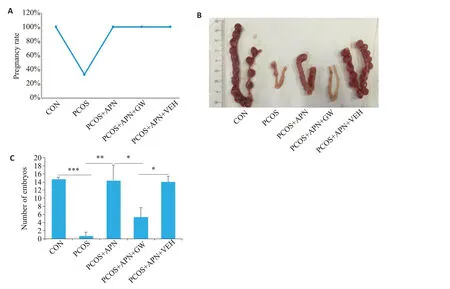
图8 APN对各组大鼠妊娠的影响Fig.8 Effects of APN on pregnancy of the rats in each group.A: Statistics of pregnancy rate in each group.B:Pregnant uterine specimens of the rats in each group.C:Statistics of the number of embryos.*P<0.05,**P<0.01,***P<0.001.
3 讨论
PCOS是最常见的全身性生殖内分泌疾病之一,由于影响因素的多样性和症状的异质性[19],给女性健康和生活带来多方面的影响。育龄期PCOS患者最严重的生殖障碍表现为不孕和流产风险增加[20,21]。其原因除与卵泡发育及排卵障碍、卵子发育潜能受损有关外,子宫内膜容受性差也是一个主要原因。已有研究报道,高雄激素血症和胰岛素抵抗是PCOS的核心病因和临床症状,可干扰卵泡的生长发育和卵母细胞的产生,从而影响妊娠[21,22];但对有关PCOS患者因子宫内膜容受性下降而引起不孕的机制关注较少。本研究采用来曲唑成功复制PCOS大鼠模型,旨在探讨PCOS大鼠子宫内膜容受性的变化及对妊娠的影响。
评价子宫内膜容受性的指标主要有子宫内膜的厚度、血流灌注水平、子宫内胞饮突发育情况和分子生物学等[4,6,23,24]。研究报道HOXA10的表达水平和胞饮突的发育情况会随着人的月经周期或啮齿类动物的动情周期变化而变化,在人子宫内膜的分泌中晚期HOXA10表达水平显著升高,随之胞饮突发育9[25,26]。本研究发现PCOS 大鼠子宫内膜组织中PPARα及HOXA10的蛋白表达水平较对照组下调;子宫内膜胞饮突的发育较对照组欠佳,提示PCOS大鼠子宫内膜容受性下降。在用APN干预后,PCOS大鼠动情周期得到恢复、体重下降、卵巢多囊样改变得到改善、卵巢指数下降、子宫指数增加、血清激素与脂质代谢紊乱得到部分恢复等,这些结果与文献报道一致[13,27]。在APN干预后,PCOS大鼠子宫内膜中PPARα、HOXA10表达上调,胞饮突发育良好,提示APN 可改善子宫内膜的容受性。但同时加入PPARα特异性抑制剂GW6471 后(PCOS+APN+GW组),APN的这些作用被抑制,子宫内膜PAPRα、HOXA10 表达水平下降、胞饮突发育欠佳,与PCOS组相似。以上研究结果提示APN可能是通过PPARα提高HOXA10在PCOS大鼠子宫内膜的表达,进而改善子宫内膜容受性。
在本研究中,PCOS大鼠有典型的高雄激素血症,且子宫内膜容受性下降,提示高雄激素血症和子宫内膜容受性之间有潜在联系。这与PCOS 患者子宫内膜HOXA10 的表达与睾酮(T)呈负相关[28]结果一致。PCOS患者子宫内膜容受性受损发生机制复杂。研究报道PCOS患者子宫内膜容受性受损、妊娠率降低与胰岛素抵抗相关[12,21];也有报道认为PCOS患者子宫内膜也受到炎症微环境的影响[19],促炎因子可以通过促进丝氨酸残基来干扰胰岛素信号通路,导致PCOS患者子宫内膜容受性受损[21]。研究报道,肌醇和二甲双胍(胰岛素增敏剂)均可通过AMPK信号通路增加子宫内膜GLUT4水平,提高患者生育能力[29]。最近研究发现,在子宫内膜中APN可通过激活APN受体来发挥对AMPK信号通路的作用,从而改善PCOS病人的内质网活性,发挥能量代谢作用,增加胰岛素敏感性[11,13,30]。APN 或许还能通过改善PCOS 大鼠子宫内膜能量代谢来提高子宫内膜容受性,这还有待后续的进一步研究。
该研究首先应用来曲唑诱导PCOS大鼠模型,随后用APN和PPARα特异性抑制剂GW6471干预PCOS大鼠。结果发现APN 干预后,PCOS 大鼠子宫内膜中PPARα、HOXA10表达上调,胞饮突发育良好;但同时加入GW6471后(PCOS+APN+GW组),APN的这些作用被抑制,子宫内膜组织中PAPRα、HOXA10表达水平下降、胞饮突发育欠佳,而阳性对照组(PCOS+APN+VEH组)各指标不受影响。以上研究结果提示APN可能是通过PPARα提高HOXA10在PCOS大鼠子宫内膜的表达,进而改善子宫内膜容受性。随后对各组大鼠的生育能力的评估结果也进一步提示APN可以通过PPARα/HOXA10通路改善PCOS大鼠子宫内膜容受性,提高生育能力。但APN通过PPARα增强下游HOXA10启动子作用的具体机制还有待进一步研究。研究结果提示APN或PPARα有望成为未来改善PCOS病人妊娠结局的治疗靶点,为临床PCOS治疗提供理论依据。