吡非尼酮联合PD-L1抑制剂抑制小鼠异位膀胱肿瘤的生长
陈守峰,张舒超,樊伟林,孙 巍,刘贝贝,刘建民,郭园园
蚌埠医学院第一附属医院泌尿外科,安徽 蚌埠233040
膀胱癌是泌尿系统常见的恶性肿瘤[1],其发病率和死亡率一直居高不下且逐年升高[2]。目前,转移性膀胱癌的标准一线治疗仍为基于顺铂的全身化疗,其总生存期(OS)仅为13~15个月,不耐受顺铂条件的患者中,以卡铂为基础的化疗的中位OS仅为8~9个月,且5年总体生存率<10%[3]化疗方式局限,化疗效果欠佳是目前膀胱肿瘤治疗急需解决的问题。以程序性死亡受体-配体1(PD-L1)抑制剂为代表的免疫检查点抑制剂(ICIs)因其对肿瘤微环境(TME)的明显作用成为膀胱肿瘤新的治疗方案[4]。尽管ICIs疗法实现了相对较长时间的肿瘤缓解,但只有不到30%的膀胱肿瘤患者从中受益,这使得ICI 的临床应用明显受限[5,6]。髓源性抑制细胞(MDSCs)作为一种表型异质细胞群,可诱导T细胞功能障碍并减少其增殖,从而促进细胞毒性T 淋巴细胞(CTL)细胞凋亡[7]。因此,调节PD-L1在肿瘤细胞上的表达,缓解TME促进CTL的浸润,对于提高PD-1/PDL1 ICB治疗的反应率至关重要。
吡非尼酮(PFD)是一种通过下调TGF-β信号传导达到广谱抗纤维化作用的吡啶酮类化合物,能够防止和逆转纤维化和瘢痕形成[8],已获批用于特发性肺纤维化(IPF)的临床治疗[9]。最近,一项基于转录组学的研究表明,在IPF患者中,PFD改变的基因不仅在“细胞外基质”中富集,并且在“免疫反应”中也发现大量富集,在体外PFD可通过调节癌症相关成纤维细胞(CAF)细胞因子释放来降低其免疫抑制能力[10]。此外,小鼠的肺癌模型中PFD可增加T细胞和NK细胞在肿瘤组织中的浸润并抑制肿瘤生长[11]。这提示PFD可通过调控免疫微环境抑制肿瘤的进展[12],但在膀胱癌中的作用未见相关报道。
有研究发现,PFD可增强PD-1/PD-L1对肿瘤的免疫治疗疗效,减缓了小鼠肺癌肿瘤增长提高了生存率[10]。PD-L1在抑制T细胞介导的免疫反应中起重要作用[13]。PD-L1与PD-1的结合导致效应T细胞的衰竭和肿瘤细胞的免疫逃逸,导致预后不良。已有研究结果证明,PD-L1 阳性膀胱肿瘤对PD-1/PD-L1 抑制剂(ICIs)的反应优于阴性肿瘤[14],如何将抗PD-L1的作用不局限在部分病例当中也是本研究的重点。这些对ICIs反应不佳的肿瘤大多T细胞被限制在富含成纤维细胞的肿瘤周围区域[15]。
本研究以C57BL/6小鼠研究对象,观察吡非尼酮联合PD-L1抑制剂对小鼠膀胱肿瘤的抑制作用,探讨吡非尼酮通过影响肿瘤微环境来增强PD-L1抗膀胱肿瘤效应的机制。
1 材料和方法
1.1 主要试剂
小鼠膀胱癌细胞(MB49)、1640培养基、胰酶及胎牛血清(武汉普洛赛生物科技有限公司),吡非尼酮购于APExBIO公司,PD-L1 抑制剂(克 隆10 F.9G2,BioXcell),辣根过氧化物酶标记山羊抗鼠IgG、鼠抗CD3单克隆抗体、鼠抗CD8单克隆抗体、鼠抗CD8单克隆抗体(武汉三鹰公司),根过氧化物酶标记山羊抗兔IgG、兔抗Ly-6G单克隆抗体、兔抗CD11b多克隆抗体购自Abclonal;Matrigel基质胶(康宁);工作台、CO2培养箱、多功能酶标仪、冷冻离心机(Thermo)。
1.2 实验动物
选取C57BL/6雌性小鼠40只(江苏省协同医药生物工程责任有限公司),体健,6周龄,体质量18 g,饲养室温20~24 ℃,自由饮食,12 h昼夜交替。本实验遵循国家实验动物管理保护条例,并通过蚌埠医学院伦理委员会批准(伦动科批字[2017]第021号)。
1.3 小鼠异位肿瘤模型的建立
于接种前1 d备皮,用0.1 mL的PBS及稀释后的基质胶2∶1混匀重悬2×106个MB49细胞,于20 ℃的环境中向抓取固定的小鼠右侧腋下进行皮下注射肿瘤细胞。于肿瘤达200 mm³时开始干预给药,肿瘤体积(TV)计算为肿瘤最长直径(D)和短直径(d',d'')的乘积:TV=D×d'×d''[16]。
1.4 小鼠分组及处理
将40只荷瘤鼠随机分为对照组(建立肿瘤模型正常饮食)、PD-L1 抑制剂组(腹腔注射PD-L1 抑制剂,12.5 mg/kg,1次/3 d,)、PFD组(PFD 500 mg/kg口服,1 次/d),联合治疗组(PFD及PD-L1抑制剂按上述剂量联合应用),每组10只小鼠。建模14及21 d时,处死小鼠,手术剥离小鼠肿瘤,制作石蜡切片保存。眼眶取血留存待测。
1.5 免疫组织化学(IHC)和免疫荧光染色(IF)
脱蜡水化后将组织切片浸入柠檬酸-磷酸氢二钠缓冲液中行抗原修复。3%H2O2溶液浸泡15 min后,PBS冲洗3次,每次5 min。加入抗体4 ℃孵育过夜。加入二抗,放入湿盒,37 ℃放置20 min,PBS冲洗。DAB工作液显色,苏木青复染,然后进行1%盐酸分化、脱水、透明、中性树脂封片。光学显微镜下对组织切片分别按染色程度(0~3分为阴性着色、淡黄色、浅褐色、深褐色)、阳性范围进行评分(1~4 分为0~25%、26%~50%、51%~75%、76%~100%),最终将分数相乘,进行比较。对于免疫荧光,用DAPI染色细胞核,用奥斯巴林显微镜进行观察。
1.6 生物安全性评价
对于血液生化评估,如上所述收集血液,通过Chemray 240自动生化分析仪(雷托科学,中国深圳)进行分析对比不同分组小鼠血清中丙转氨酶(ALT)、谷草转氨酶(AST)及肌酐(Cr)的差异。
1.7 统计学分析
采用SPSS 25.0 统计软件进行分析,计量资料采用均数±标准差表示,两组间比较采用t检验,多组间采用单因素方差分析(one-way ANOVA),以Ρ≤0.05为差异有统计学意义。
2 结果
2.1 PFD联合PD-L1抑制剂抑制膀胱癌生长
在药物干预后第21 天,联合用药组小鼠肿瘤体积(F=136.800,Ρ<0.05)明显小于单药组及对照组,并且小鼠肿瘤抑制率(F=126.800,Ρ<0.05)和生存率(Ρ<0.05)也明显高于单药组及对照组(图1)。
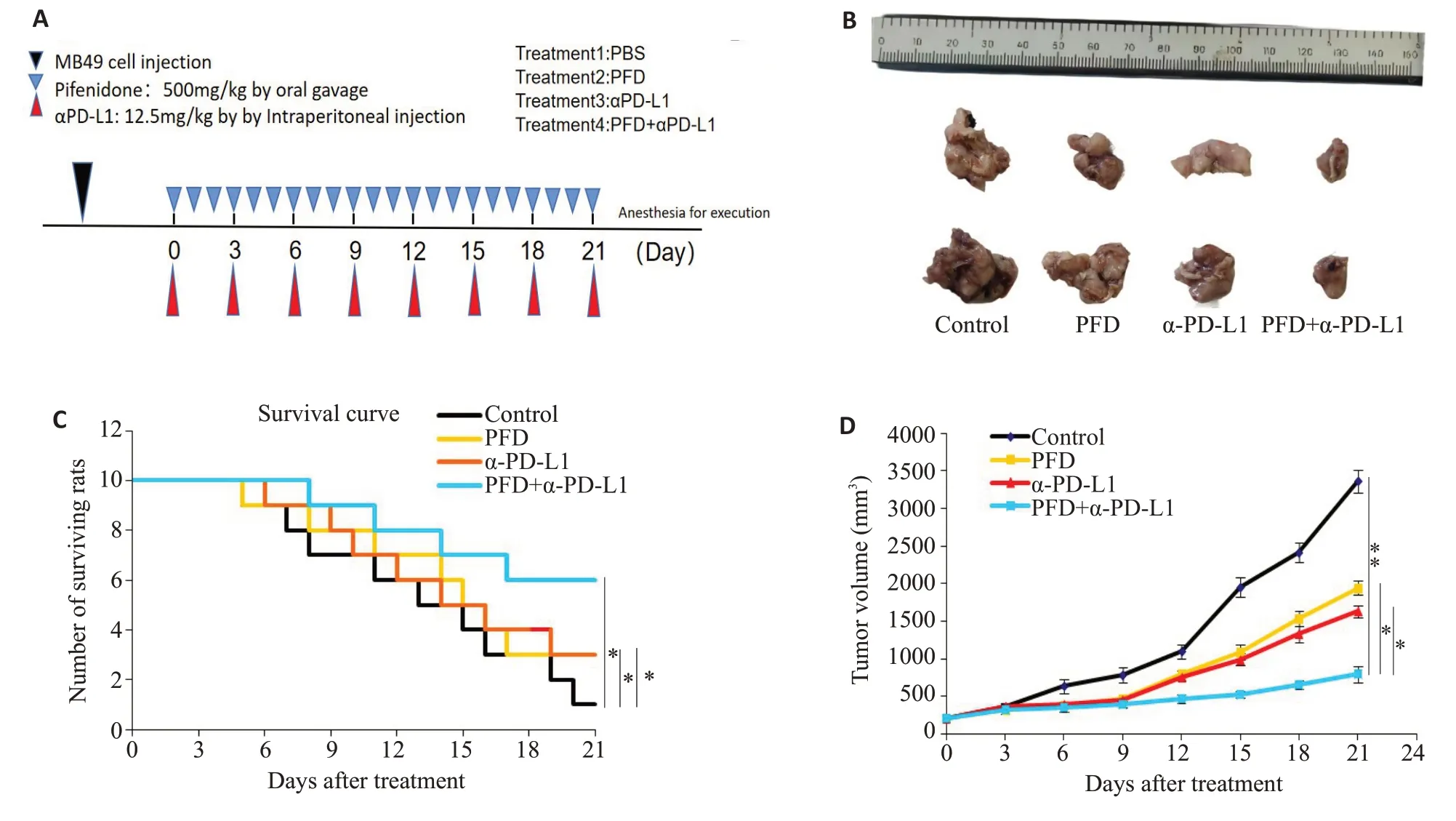
图1 药物干预小鼠膀胱肿瘤模型Fig.1 Effect of pirfenidone and PD-L1,alone or in combination,in the mouse models bearing bladder cancer xenografts.A:Treatment protocol diagram. B: Comparison of tumor volume at 21 days. C: Survival curves in the 4 groups.*P<0.05 vs control.D:Tumor growth rate in each group.*P<0.05,**P<0.01 vs PFD+α-PD-L1 group.
2.2 联合治疗抑制了膀胱肿瘤细胞的上皮间充质转化
通过IHC实验对小鼠膀胱肿瘤组织进行检测发现,单药和联合用药小鼠较对照组小鼠肿瘤组织中上皮细胞标志物E-cadherin表达量(图2A、C)增加(Ρ<0.05),而间充质标志物N-cadherin 表达量(图2B、D)降低(Ρ<0.05)。尤其联合用药显著减少N-cadherin。
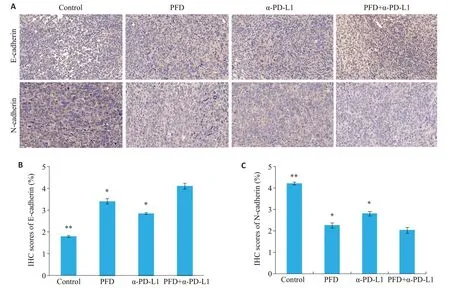
图2 4组小鼠肿瘤组织中E钙粘蛋白与N钙粘蛋白表达量比较Fig.2 Comparison of E-cadherin and N-cadherin expression in the tumor tissues among the 4 groups.A:Immunohistochemistry(IHC)for E-cadherin(Original magnification: ×200).B:IHC for N-cadherin(×200).C,D:Quantitative analysis of IHC staining results of E-cadherin and N-cadherin.*P<0.05,**P<0.01 vs PFD+α-PD-L1 group.
2.3 PFD联合PD-L1抑制剂增强免疫微环境T细胞浸润
联合治疗后CD3+T 细胞分布发生了明显变化(图3A、D),更多CD3+T细胞聚集在肿瘤中心(Ρ<0.05),而不仅限于肿瘤基质。并且肿瘤组织中CD8+T细胞(图3B、E)及CD45+T 细胞(图3C、F)浸润明显增加(Ρ<0.05)。
2.4 PFD联合PD-L1抑制剂减少了肿瘤微环境MDSCs表达
行IF对肿瘤组织进行CD11b及Ly6G双染。发现PFD单药组肿瘤CD11b阳性染色与对照组无显著差异,联合用药组肿瘤组织中相比对照组及单药组CD11b+和Ly6G+染色均明显减少(图4,Ρ<0.05)。
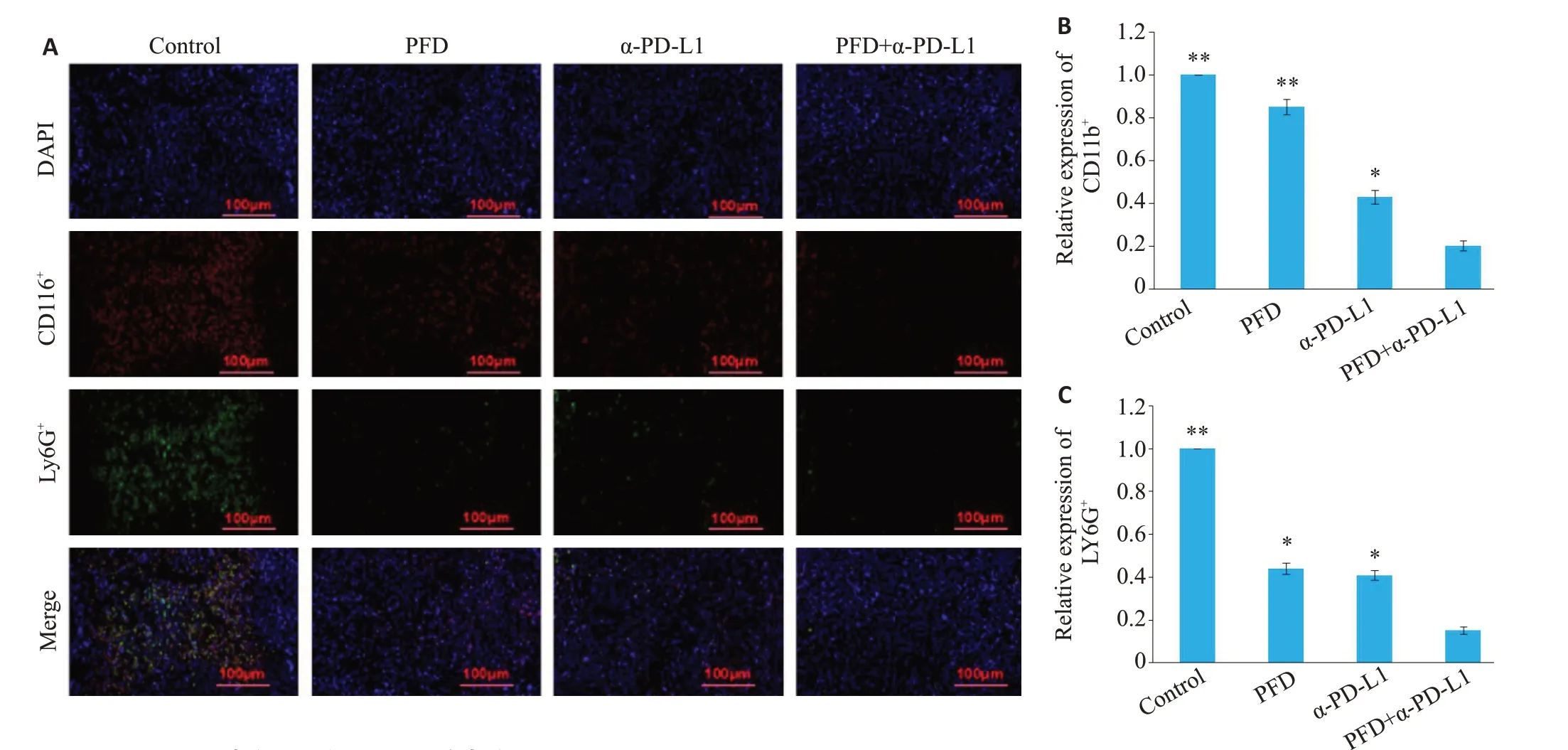
图4 4组小鼠肿瘤组织中MDSCs的表达量Fig.4 Expression of MDSCs in the tumor tissues in the 4 groups. A: Immunofluorescence staining of MDSCs (×200). B, C:Quantitative analysis of immunofluorescence staining results of CD11b+and Ly6G+cells.*P<0.05,**P<0.01 vs PFD+α-PD-L1 group.
2.5 联合治疗在体内是安全性
小鼠血清中丙转氨酶(ALT)、谷草转氨酶(AST)、血尿素氮(BUN)、及肌酐(CRE)及乳酸脱氢酶(LDH-L)的水平均在正常范围内(图5,Ρ>0.05)。
图5 4组小鼠体质量变化及血清生化结果Fig.5 Changes in body weight and blood biochemical parameters of the mice in the 4 groups.A:Changes in body weight of the mice.B-F:Quantitative analysis ofALT,AST,BUN,CRE and LDH-Llevels.
3 讨论
在临床试验和实际经验中,PFD是一种耐受性良好的口服药物,在IPF 患者中观察到PFD 治疗下肺癌发病率降低[17],这证明PFD除了具有抗纤维化特性外,还可能对肺癌具有预防或治疗的功能。在本研究中,我们同样发现在膀胱肿瘤的小鼠身上,PFD也具有一定的抗肿瘤作用,既表现在抑制肿瘤的增长速率,也表现在增加了小鼠的生存率。事实上,多项体外研究报告了PFD干预后癌细胞的增殖和迁移减少[18,19]。并且有近期有实验证明在小鼠肾癌中PFD通过抑制肿瘤细胞EMT从而阻止了细胞增殖,迁移和侵袭,并且通过限制肿瘤组织中MDSC募集来调节免疫环境[19]。有实验表明,在接种肿瘤异种移植物的免疫功能低下的小鼠中,单药PFD抗肿瘤作用在很大程度上是有限的[10]。然而,使用免疫功能低下动物的早期研究可能并不全面,因为PFD的免疫调节作用可能被忽略。而我们的实验结果也确实验证了这一点,即使单药使用PFD时,其对小鼠肿瘤生长速率的影响有限,但在免疫组化的结果中,我们发现其对免疫细胞在肿瘤中心的聚集作用明显。这也提示本实验后续应将研究的方向聚焦于免疫微环境中。
为深入了解PD-L1抑制剂的单药使用的局限性,有研究发现在接受PD-L1抑制剂治疗的黑色素瘤患者中,有40%~65%出现了原发性耐药[20],而剩下的患者中也有43%在3年后获得性耐药[21]。本实验同样观察到在单独使用PD-L1抑制剂时,不论是对小鼠肿瘤的抑制作用,还是在免疫细胞聚集的作用都想到有限。在了解了ICIs的起效需要免疫周期的每一步都必须启动并完成。首先是癌症抗原呈递和T细胞活化,然后是T细胞向肿瘤的运输和浸润,最后是T细胞的识别来消除肿瘤细胞[22,23]。所以,原发性和获得性耐药的关键原因是:(1)抗原呈递和识别不足[24];(2)肿瘤微环境中T细胞缺失[25];(3)上调免疫抑制标志物[26];(4)T 细胞活化不足[27];(5)对IFN-γ信号的敏感性降低[28]。本实验发现了联合用药对肿瘤微环境中T细胞的聚集作用及活化作用。并且有研究表明,PD-L1抑制剂治疗依赖于CTL的浸润和治疗性抗体在肿瘤部位的积累[29,30]。然而,肿瘤微环境中由免疫抑制细胞(例如肿瘤相关巨噬细胞(TAM)、调节性T细胞(Treg)和髓源性抑制细胞(MDSC)引起的免疫抑制限制了CTL的活化和增殖[31]。这也符合本实验中联合用药相比单药使用对小鼠MDSC的影响作用。而PFD联合PD-L1抑制剂是否可以促进肿瘤抗原的提呈及其对免疫微环境的影响的具体机制仍需要进一步实验验证。
本研究存在一些局限性。首先,相比使用PFD和PD-L1抑制剂单药治疗,联合治疗没有在肿瘤发展的后期达到更加明显的抑制作用,因此,PFD 对免疫活化的确切分子作用方式仍有待进一步探讨。尽管在实验中PFD 服用的频率很高,但通过对血液的生化分析,我们并未发现药物的干预对各组小鼠的肝肾功能带来明显损伤。所以后期实验可考虑在肿瘤生长不同阶段增加药物剂量进行治疗,以探究PFD联合PD-L1抑制剂治疗对肿瘤的抑制作用及对CTL的影响是否呈浓度依赖性。并收集各时段中肿瘤组织,动态观察各类肿瘤微环境中免疫抑制细胞及各种趋化因子的分布及数量。
综上所述,本研究确定了PFD的一项新作用,即通过促进膀胱肿瘤中T细胞的浸润并减少肿瘤细胞EMT及MDSC的浸润调节肿瘤免疫微环境,增强PD-L1抑制剂的抗肿瘤作用。我们的发现初步揭示了PFD的免疫调节作用,为临床上治疗膀胱肿瘤化疗药物的应用提供了新的思路。