白藜芦醇对帕金森病模型小鼠多巴胺能神经元的保护作用:基于抑制TLR4/MyD88/NF-κB通路
桂建军,孙晓东,温 舒,刘 欣,覃冰清,3,桑 明
1湖北医药学院基础医学院,湖北 十堰 442000;2湖北医药学院附属襄阳市第一人民医院转化医学中心,湖北襄阳 441000;3湖北省帕金森病临床医学研究中心,湖北 襄阳 441000;4武当特色中药研究湖北省重点实验室,湖北 十堰442000
帕金森病(PD)主要病理表现为多巴胺能神经元的损失和背外侧纹状体多巴胺(DA)水平的下降等[1]。目前该疾病的标准疗法是DA替代疗法,但这种疗法治标不治本,且存在着较大的副作用[2]。因此,探索新的治疗方案迫在眉睫。“肠-脑”轴是将大脑和肠道功能整合的双向信息交流系统,在PD等神经退行性疾病的研究中备受关注[3]。肠黏膜屏障(IBF)作为“肠-脑”轴的组成是阻止肠道内细菌及内毒素进入机体的第一道防线[4]。研究表明,IBF功能受损及通透性增加与PD、阿尔茨海默病、多发性硬化等中枢神经疾病有关[5]。PD患者保持较高的脂多糖(LPS)水平,LPS与LPS结合蛋白(LBP)结合并被放大效应,以CD14 和TLR4 作为受体,激活免疫细胞,导致促炎症因子瀑布式释放,进一步引起神经炎症和氧化应激反应[6]。TLR4通过调节先天免疫来维持肠道微生物耐受性和炎症之间的平衡,肠上皮TLR4表达增加与IBF受损和上皮细胞分化改变相关[7]。白藜芦醇(RES)是一种广泛存在于植物中的天然多酚类化合物,具有抗氧化、抗炎、神经保护等多种生物活性[8]。研究表明,RES通过抑制TLR4信号通路活性减轻炎症反应[9]。但RES是否通过抑制TLR4表达修复IBF,进而抑制神经炎症的发生,减少DA能神经元的损失,目前尚未见报道。
本研究以MPTP诱导的PD模型小鼠为研究对象,评估RES对该模型小鼠的保护效果,探究RES通过抑制TLR4介导的“肠-脑”轴炎症信号分子的级联反应,保护PD小鼠DA能神经元的作用机制,为PD的临床治疗提供新的思路。
1 材料和方法
1.1 实验动物
10周龄雄性C57BL/6J小鼠52只,体质量30±5 g,由湖北医药学院动物中心提供,生产许可证号:SYXK(鄂)2019-0031,动物合格证号:SYXK(鄂)2019-0008。实验动物饲养于SPF级动物饲养室,每笼5只,自由饮水及进食,室温20~26 ℃,每日交替12 h的光明与黑暗周期。饲养过程中严格按照《实验动物管理条例》,使用的3R原则给予人道的关怀,确保实验动物的福利伦理,该动物实验通过湖北医药学院附属襄阳市第一人民医院生物医学基础研究伦理委员会审批(审批号:XYYYE20230035)。
1.2 主要试剂及仪器
1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP,MedChemExpress);白藜芦醇(Sigma-Aldrich);SDSPAGE凝胶配制试剂盒[碧云天生物科技有限公司(杭州)]、Pierce™BCA蛋白检测试剂盒(Thermo Scientific™),TLR4 多克隆抗体,MyD88 多克隆抗体,NF-κB p65多克隆抗体,ZO-1 多克隆抗体,Claudin-1,TH 多克隆抗体,Synuclein-α 多克隆抗体[武汉三鹰生物技术有限公司(武汉)],Synuclein-α(phospho Ser129)多克隆抗体(ImmunoWay),NF-κB p65 多克隆抗体(Cell Signaling Technology),HRP标记的山羊抗小鼠及山羊抗兔的二抗(Jackson ImmunoResearch);0.22 μm PVDF 膜(MILLEX GP);蛋白/核酸凝胶成像仪(Bio-Rad)。LPS检测试剂盒和LBP检测试剂盒(厦门仑昌硕生物公司)。
1.3 实验分组及模型的构建
小鼠适应性喂养1周,按照随机数字表法分为对照组(n=12)、MPTP组(n=14)、MPTP+RES30组(n=13)和MPTP+RES90组(n=13)。模型组连续腹腔注射MPTP(30 mg/kg)7 d[10-11],对照组相应的腹腔注射等剂量PBS。治疗组在造模的第2天分别给予低剂量(30 mg/kg)和高剂量(90 mg/kg)RES灌胃治疗,每2 d灌胃1次,连续灌胃3周。每周称体质量1次,以便根据体质量调整灌胃量[12]。末次给药后,小鼠禁食不禁水,异氟烷气体麻醉,经心脏采血于抗凝管,500×g离心10 min后,分离血浆,分装后置于-20 ℃冰箱保存备用;取下完整脑组织,沿矢状缝将其分为左右两部分,一半液氮速冻后,转移至-80 ℃冰箱,用于提取组织RNA或蛋白,另一半置于4%多聚甲醛中固定,石蜡包埋,对黒质区和纹状体区后进行免疫荧光检测,每个蜡块的切片深度保持一致;取临近回盲部(<4 cm)的近端结肠组织,部分液氮速冻后,转移至-80 ℃冰箱,用于提取组织RNA或蛋白,部分用4%多聚甲醛固定。
1.4 小鼠运动功能检测
在给药前对小鼠预先进行训练,在预先训练及正式实验期间,每只小鼠进行3次实验,每次实验间隔一定的时间,计算3次实验结果的均值。
1.4.1 平衡木实验 采用一根结实的平行棒(直径1 cm,长115 cm),末端与平台上放置的黑色小暗箱(15 cm×15 cm×15 cm)相连接,平衡棒离地高度30 cm,记录被测小鼠经过平行棒上的时间,以及一侧后肢掉下或者摔倒、摇摆等情况[13]。记录小鼠通过平衡木的时间,评价实验动物后肢的协调能力。
1.4.2 悬挂实验 实验前准备一根不锈钢棒用于小鼠的悬挂实验,可缠上纱布防滑,两头放于架子上便于固定,不锈钢棒离地高度30 cm,被测小鼠倒置悬挂于不锈钢棒中点后放开小鼠,观察小鼠后肢抓绳状况,进行评价。评分标准:两后肢均抓不锈钢棒记3分,一只抓棒记2分,均不抓棒记1分,实验重复3次取平均值,每次实验间隔10 min[14]。
1.4.3 爬杆实验 自制一根直径为1 cm、长50 cm的木杆,顶端固定有一直径2.5 cm的软木小球,木杆缠上纱布防滑并倾斜45°放置于小鼠生活的笼中,将被测小鼠头向下放置在软木小球的顶部,使其沿着杆自然爬下,从小鼠接触小球开始计时,到小鼠前爪着地为止,观察小鼠在下行过程中的行为并记录小鼠从从木杆顶部小球爬至杆底所用时间[14]。每只小鼠要完成3次爬杆实验,每次实验间隔10 min,取3次爬杆耗时的平均值作为该只小鼠的实验成绩。
1.5 HE染色和尼氏染色
HE染色法观察脑组织及结肠组织形态病理改变:将小鼠处死后,取脑组织和结肠组织,采用4%多聚甲醛固定,经石蜡包埋后进行切片,厚度为脑组织3 μm,肠组织4 μm;切片在二甲苯中脱蜡,梯度乙醇脱水,捞片,65 ℃烤片过夜,HE染色。切片使用奥林巴斯显微镜拍照观察。
尼氏染色观察脑组织神经元形态及树突棘的数量:生理盐水进行小鼠心脏灌流,麻醉处死小鼠后分离完整脑组织,进行石蜡包埋。取脑组织切片5 μm,尼氏染液染色15 min,950 mL/L酒精分色;再次经梯度酒精脱水和二甲苯透明后,进行中性树胶封片,完成尼氏染色。200倍显微镜下观察脑组织黑质和纹状体部位神经元形态和树突棘的数量。
1.6 免疫组织化学
取小鼠中脑组织和结肠组织,4%的多聚甲醛固定、石蜡包埋,5 μm连续切片,经乙醇梯度脱水,用EDTA(pH=9.0)抗原修复,冷却后PBS洗涤5 min;放入3%双氧水溶液,室温避光孵育25 min,PBS洗涤(3×5 min);在组化圈内滴加3%BSA均匀覆盖组织,室温封闭30 min;滴加一抗P-α-Syn(S129)、TH、α-syn、TLR4,4 ℃过夜。添入二抗工作液,室温孵育50 min;PBS洗涤(3×5 min)。DAB溶液显色,阳性染色为棕黄色,自来水终止反应,在显微镜下观察组化染色结果并进行拍片。
1.7 免疫荧光(IF)和透射电镜(TEM)
免疫荧光检测组织表达的蛋白:取脑组织,脱水固定后冰冻切片包埋剂包埋,使用冰冻切片机(Leica)连续切成10 μm厚的冠状切片。切片先后经历复温、丙酮固定、柠檬酸钠抗原修复、封闭、孵育一抗、孵育二抗、成像等过程,随后进行免疫荧光染色。所用抗体分别为抗TH抗体(1∶50)、抗GFAP抗体(1∶100)、抗Iba-1抗体(1∶100)、抗TLR4抗体(1∶100)和山羊抗兔IgG荧光二抗(1∶200)(以上抗体均购于武汉三鹰生物技术有限公司)。二抗清洗后,用DAPI染核5 min,PBS清洗3次,5 min/次,滴加荧光淬灭封片液,盖玻片封片,指甲油固定。风干后置于200倍倒置显微镜下观察并拍照。
TEM观察造模方法对小鼠结肠组织超微结构变化的影响:将固定在电镜固定液中的结肠组织进行固定、梯度脱水、渗透、包埋、固化、切成超薄片、醋酸铀和枸酸铅双染色,进行透射电镜观察和拍照,观察细胞超微病理学变化,步骤如下:戊二醛前固定→漂洗→脱水→包埋→超薄切片→铀、铅染色→电镜观察。
1.8 Western blotting检测
中脑组织20~40 mg和结肠组织50 mg,加入RIPA裂解液200~400 μL,用超声破碎仪裂解至无明显粘稠状匀浆,BCA 法测定总蛋白浓度,-20 ℃保存。通过SDS-PAGE凝胶电泳分离蛋白,恒流转膜90 min结束后,室温下于5%脱脂牛奶中封闭1.5 h。1×TBST洗涤3次后,置于一抗稀释液(TH、α-syn、ZO-1、Claudin-1、TLR4、MyD88、NF-κB)中,4 ℃过夜孵育,用TBST洗膜(4×7 min);于相应1∶4000比例稀释的二抗中37 ℃孵育1.5 h,TBST洗涤(4×7 min),ECL显色,曝光、洗片,应用凝胶成像系统(Bio-Rad)对膜进行检测,以GAPDH和β-actin为内参,利用Image J软件进行目的条带灰度分析,结果取目的蛋白与GAPDH 或β-actin 条带灰度值的比值。
1.9 酶联免疫吸附试验(ELISA)
小鼠麻醉后经心脏采血于抗凝管,500×g离心10 min分离血浆,小份分装保存于-20 ℃,测定前复融,混匀。收集粪便后,-80 ℃保存,测定前复融,用PBS(1∶9)稀释混匀,500×g离心10 min 后取上清。按照ELISA测定试剂盒说明书测定小鼠血浆和粪便中LPS、LBP的含量。
1.10 统计学分析
数据分析采用GraphPad Prism 9.0 软件完成,计量数据采用均数±标准差表示,两组间比较采用t检验,多重比较采用方差分析及q检验,Ρ<0.05为差异有统计学意义。
2 结果
2.1 RES改善PD小鼠的运动功能障碍
平衡木实验结果显示,与Control组相比,MPTP组小鼠通过平衡木的总时长增加;与MPTP组相比,RES不同剂量治疗组小鼠通过平衡木的总时长缩短(Ρ<0.01,图1B)。悬挂实验结果显示,与Control组相比,MPTP组小鼠评分降低(Ρ<0.01);与MPTP组相比,RES治疗组小鼠评分升高,但差异没有统计学意义(图1C)。爬杆实验结果显示,与Control组相比,MPTP组小鼠爬杆总时长增加(Ρ<0.001);与MPTP组相比,RES不同剂量治疗组小鼠爬杆总时长缩短(Ρ<0.01,图1D)。
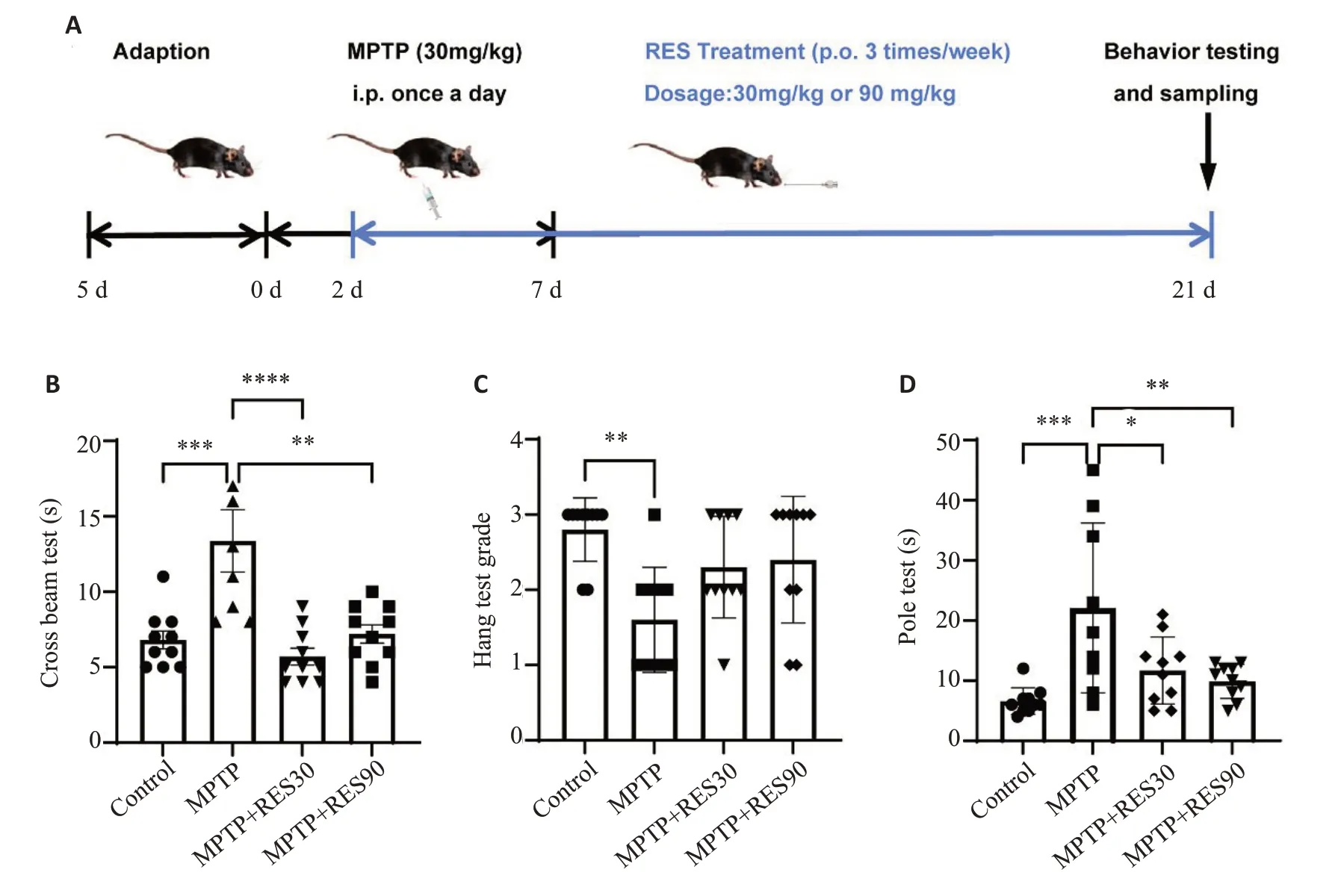
图1 RES改善PD小鼠的运动功能障碍Fig.1 Resveratrol(RES)improves dyskinesia in PD mice.A:Timeline of the animal experiment.B:Cross beam test.C:Hang test.D:Pole test.*P<0.05,**P<0.01,***P<0.001.
2.2 RES改善PD小鼠DA能神经元损伤
尼氏染色观察脑组织黑质和纹状体区神经元状态及数量变化,结果显示:Control组切片整体着色较深,黑质区神经元多且排列紧密,细胞轮廓清晰;MPTP组切片整体着色较浅,黑质区神经元数量明显减少,排列松散,且细胞轮廓模糊;MPTP+RES30组切片整体着色较深,黑质区神经元排列较致密、细胞轮廓清晰;MPTP+RES90组整体着色较深,黑质区神经元排列整齐、清晰(图2A);纹状体区尼氏染色结果在各组间的差异不明显(图2A)。免疫组织化学染色观察黑质和纹状体区α-突触核蛋白(α-syn)的表达量,结果显示:在黑质区,与Control组相比,MPTP组有明显的棕色阳染;当给予不同剂量RES治疗后,阳性染色减少。在纹状体区,各组阳性染色比例差异不明显(图2B)。Western blotting检测结果显示,与Control组相比,MPTP组的TH表达降低(Ρ<0.05),α-syn的表达有所升高。与MPTP组对比,MPTP+RES30组的TH表达升高,α-syn的表达降低,MPTP+RES90组TH的表达升高(Ρ<0.05),而α-syn的表达降低(Ρ<0.05);与Control组相比,RES不同剂量治疗组TH、α-syn的表达差异无统计学意义(图2C~E)。
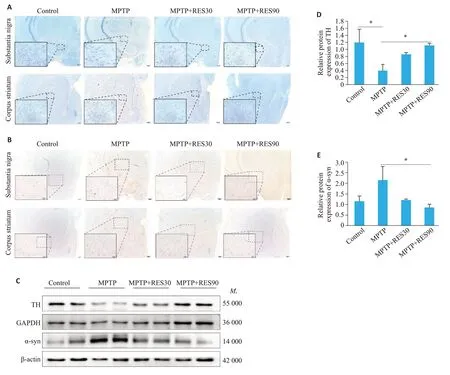
图2 RES改善PD小鼠DA能神经元损伤Fig.2 RES improves dopaminergic neuronal damage in PD mice.A:Nissl staining of the substantia nigra region of the midbrain and the striatum (scale bar: 20 μm and 200 μm). B:Immunohistochemical detection of α-syn protein in brain tissue sections(Scale bar:50 μm and 200 μm).C:Protein levels of TH and α-syn in the brain tissue detected using Western blotting.D:Quantitative analysis of relative TH protein expression levels.E:Quantitative analysis of relative α-syn protein expression levels.*P<0.05.
2.3 RES减轻PD小鼠的神经炎症
HE结果显示,Control组小鼠黑质区神经元形态正常,细胞数量较多,排列整齐;与Control组相比,MPTP组神经元数量明显减少,排列紊乱,部分神经元胞体固缩,胞质深染。与MPTP 组相比,不同浓度的RES治疗组神经元数量明显增多,细胞排列较整齐,胞质深染的细胞数量减少(图3A)。在纹状体区,各组细胞形态变化不明显(图3A)。免疫荧光检测发现,与Control组相比,MPTP 组小鼠黑质区GFAP和Iba-1的表达明显增加;与MPTP 组相比,不同浓度的RES治疗组小鼠黑质区GFAP和Iba-1阳性细胞及其表达明显减少(图3B)。

图3 RES减轻PD小鼠的神经炎症Fig.3 RES reduces neuroinflammation in PD mice. A:HE staining of the substantia nigra in the midbrain and the striatum (scale bar:20 μm and 200 μm).B:GFAP-and Iba-1-positive neurons and DAPI(blue)immunofluorescence double staining of GFAP-and Iba-1-positive neurons(green)in the substantia nigra of the mice(Scale bar:50 μm).
2.4 RES改善PD小鼠的肠道屏障功能
ELISA结果显示,与Control组对比,MPTP组小鼠粪便中LPS、LBP水平升高(Ρ<0.01);与MPTP组相比,MPTP+RES30组粪便中LPS(图4A)、LBP(图4B)水平降低(Ρ<0.05,Ρ<0.01)。与Control组对比,MPTP组小鼠血清LPS、LBP水平升高(Ρ<0.05,Ρ<0.01);与MPTP组相比,MPTP+RES30组LPS(图4C)、LBP(图4D)水平降低(Ρ<0.001,Ρ<0.05)。利用TEM观察各组小鼠结肠组织的超微结构(图4E),Control组结肠壁紧密连接复合体形态正常,肠绒毛排列整齐且紧密;MPTP组连接复合体数量减少,肠绒毛形态异常且排列紊乱;MPTP+RES30组结肠组织细胞超微结构有所改善,与Control组比较无明显差别。Western blotting检测结果显示,与Control组相比,MPTP组的ZO-1、Claudin-1表达降低(Ρ<0.01);与MPTP组对比,MPTP+RES30组的ZO-1、Claudin-1表达升高(Ρ<0.01,图4F)。

图4 RES改善PD小鼠的肠道屏障功能Fig.4 RES improves intestinal barrier function in PD mice.A-D:Fecal and plasma levels of LPS and LBP in the mice measured using ELISA.E:Transmission electron microscopy of the ultrastructure of the intestinal mucosa of the mice(Scale bar:2000 nm and 500 nm).Red arrows indicate tight junction complexes and blue arrows indicate the intestinal villi.F:Protein levels of ZO-1 and Claudin-1 in colon tissue detected using Western blotting. G:Quantitative analysis of relative ZO-1 protein expression levels.H:Quantitative analysis of relative Claudin-1 protein expression levels.*P<0.05,**P<0.01,***P<0.001.
2.5 RES 抑制PD 小鼠结肠中α-syn 的累积和TLR4/MyD88/NF-κB信号通路的激活
免疫组化结果显示,与Control组对比,MPTP组结肠壁和肠粘膜都有大量的棕黄色沉积;经过RES治疗后,大量沉积减少(图5A)。进一步检测各组小鼠结肠组织蛋白的表达情况,与Control组相比,MPTP组的TLR4、MyD88、NF-κB表达升高(Ρ<0.05、Ρ<0.01、Ρ<0.001);与MPTP组对比,MPTP+RES30组TLR4、MyD88、NF-κB表达降低(Ρ<0.05、Ρ<0.01、Ρ<0.001,图5B~E)。
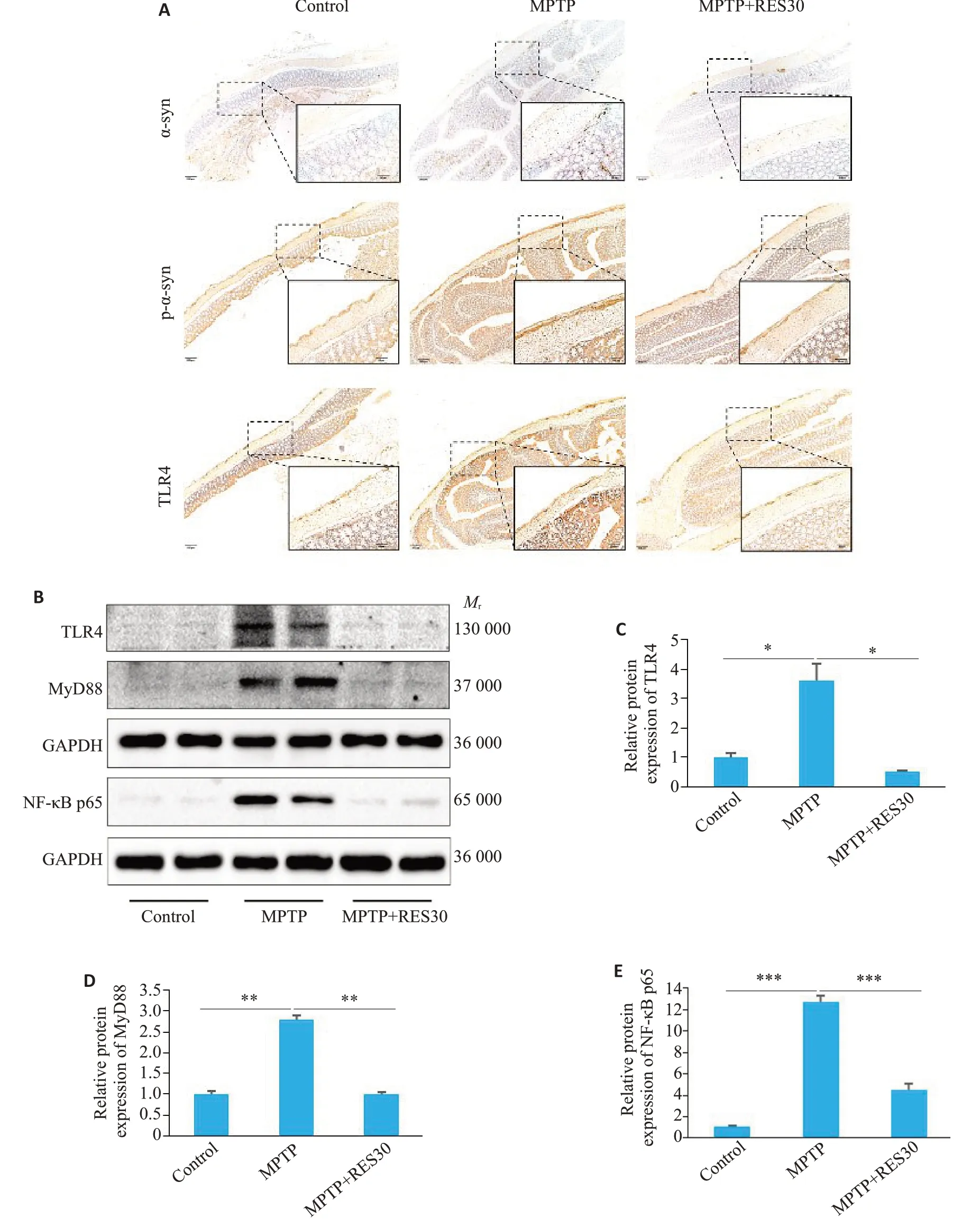
图5 RES抑制PD小鼠结肠中α-syn的累积和TLR4/MyD88/NF-κB信号通路的激活Fig.5 RES inhibits accumulation of α-syn and activation of the TLR4/MyD88/NF-κB signaling pathway in the colon of PD mice. A:Immunohistochemical detection of α-syn,p-αsyn,and TLR4 proteins in colon tissue sections(scale bar:50 μm and 200 μm).B:Protein levels of TLR4,MyD88,and NF-κB in colon tissue detected using Western blotting. C:Quantitative analysis of relative TLR4 protein expression levels. D:Quantitative analysis of relative MyD88 protein expression level.E:Quantitative analysis of relative NF-κB protein expression levels.*P<0.05,**P<0.01,***P<0.001.
2.6 RES下调脑黑质区TLR4的表达,上调TH的表达
免疫荧光检测发现,TLR4 阳性神经元细胞呈红色,TH阳性神经元细胞呈绿色,DAPI标记细胞核呈蓝色。与Control组相比,MPTP 组小鼠中脑黑质区蛋白表达TLR4阳性神经元的数目明显增加、TH阳性神经元的数目明显减少(Ρ<0.05、Ρ<0.01);与MPTP 组相比,MPTP+RES 组小鼠中脑黑质区TLR4阳性细胞的数目明显减少、TH 阳性神经元的数目明显增加(Ρ<0.05,Ρ<0.01,图6)。
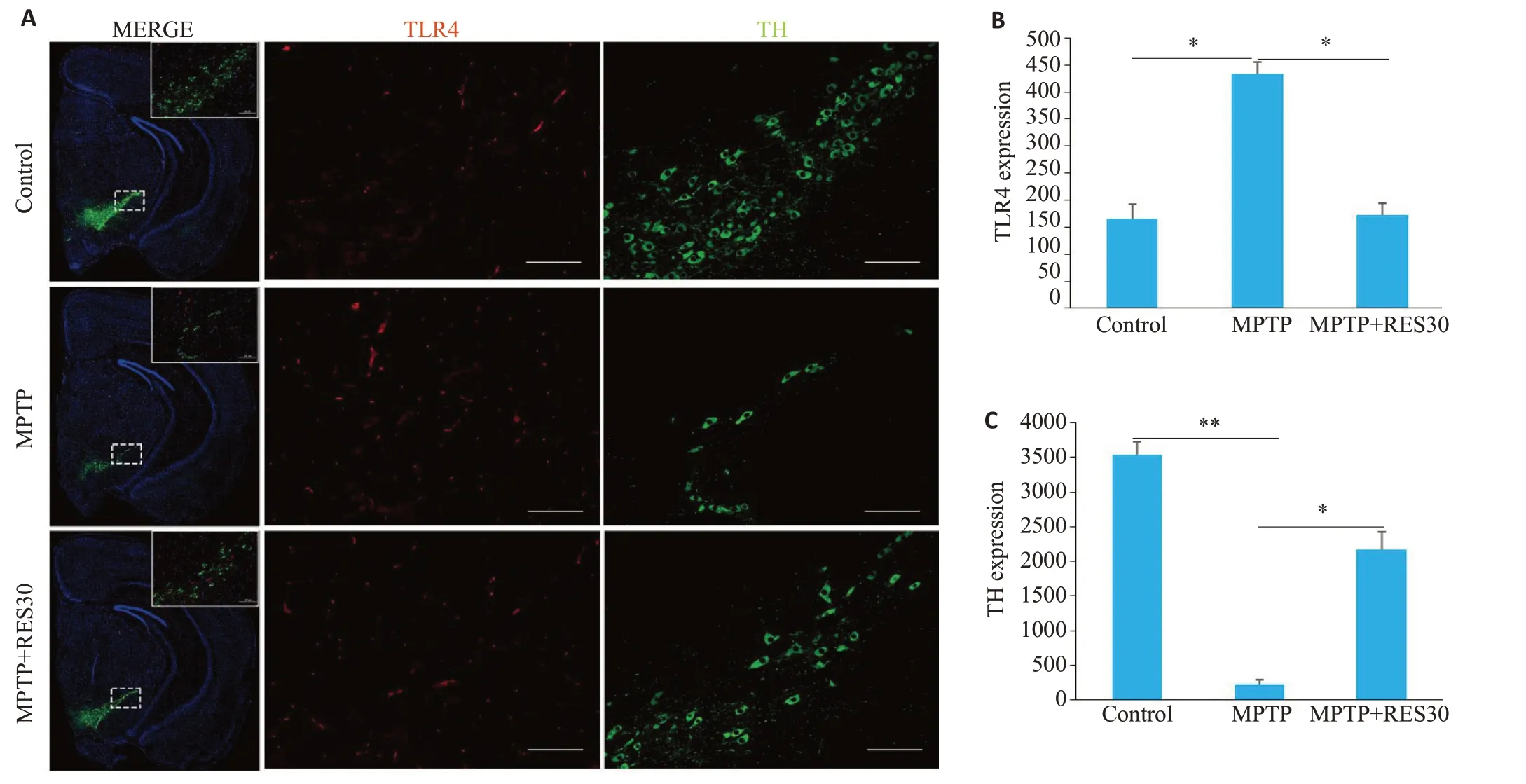
图6 RES下调脑黑质区TLR4的表达,上调TH的表达Fig.6 RES downregulates the expression of TLR4 and upregulates the expression of TH in the substantia nigra of the mice. A:Immunofluorescence double-stained image of TLR4-positive neurons (red fluorescence) and TH-positive neurons (green fluorescence)in the substantia nigra of the mice.The fluorescence intensity represents the level of expression(Scale bar:100 μm).B:Expression of TLR4.C:Expression of TH.*P<0.05,**P<0.01.
3 讨论
本研究发现RES可以显著改善MPTP诱导的PD小鼠模型的DA能神经元丢失、神经炎症和运动功能障碍,这和以往的相关研究结果是一致的[15]。同时,观察到MPTP 诱导的小鼠模型结肠组织中TLR4/MyD88/NF-κB炎症信号通路活化和显著的肠道屏障功能下降,而RES可以显著抑制TLR4/MyD88/NF-κB信号通路的激活,并保护肠屏障功能。在PD模型上的广泛研究大都证明RES可以通过抑制神经炎症[16]、抗氧化应激[17]、保护线粒体功能[18]以及表观遗传修饰等[19]途径发挥作用。最近的研究发现RES还可以通过调节肠道菌群发挥对PD模型的神经保护作用[20]。自Braak等[21]提出了帕金森病肠道起源假说以来,“微生物-肠-脑”轴在PD病理进展中的重要作用已被广泛研究[22]。研究人员发现一种特定的益生菌-枯草芽孢杆菌能够清除表达人α-syn的线虫模型中的α-syn团块,并改善运动障碍[23]。本研究发现MPTP诱导的PD小鼠黑质区α-syn表达升高,肠道中α-syn也存在异常累积;更重要的是,该模型小鼠粪便和外周血中LPS、LBP水平均显著升高,TEM检测和Western blotting检测的结果进一步支持了MPTP诱导的PD小鼠模型存在肠屏障损伤。研究表明,PD前驱期患者肠道中存在α-syn的异常聚集[24-25];PD患者外周血中LPS水平显著升高[26];而且,PD患者往往伴随着便秘、胃胀气、消化不良等胃肠问题[27]。由此可见,MPTP诱导的PD小鼠模型也在一定程度上模拟了PD相关的非运动功能障碍。
研究证明,肠道中的LPS水平升高会导致肠道通透性增加[28],进一步引起免疫炎症反应,从而损伤神经系统[29]。有研究发现,LPS通过与肠道屏障和血脑屏障的TLR4相互作用来激活免疫细胞[30]。本研究发现RES对模型小鼠肠道和中脑的TLR4激活现象有显著抑制效应。TLR4作为一种跨膜受体,外在受体区域与LPS等分子结合激活跨膜区域,促使信号转导区域激活下游途径[31]。因此认为TLRs是介导肠道菌群改变引起的肠道炎症与基因相关相互作用的重要桥梁[32]。而TLR4的信号转导途径主要包括两种:MyD88 依赖性途径和TRIF依赖性途径。在MyD88依赖性途径中,TLR4激活后,MyD88蛋白介导下游信号,引起IL-1β和TNF-α等炎症因子的产生。在TRIF依赖性途径中,TLR4可激活IRF3和NF-κB等转录因子,进而介导IFN-α/β的合成,进一步加剧炎症反应[33]。基于TLR4/MyD88/NFκB炎症通路,我们发现在PD小鼠结肠组织中,TLR4、MyD88 和NF-κB 的表达均显著上调,RES 治疗后TLR4、MyD88、NF-κB的表达显著下调,同时,小鼠粪便和外周血中LPS、LBP 水平均在RES 治疗后显著降低。研究表明,LPS 不能通过血脑屏障,但通过激活TLR4后导致3,4-二羟基苯乙酸(DOPAC)和DA的代谢失衡,引起基底节和黑质神经元的损害[34]。TLR4活化刺激天然免疫细胞释放细胞因子和趋化因子,炎症因子的过度分泌,则会导致相关神经元损伤和炎症反应的加剧,形成炎症病变的恶性循环[35]。因此,我们的研究结果表明,MPTP 诱导的PD 小鼠结肠组织中TLR4/MyD88/NF-κB炎症信号通路被高水平的LPS激活,进而发生炎症反应介导的肠屏障损伤。而RES对该模型肠道炎症信号通路的显著抑制提示LPS/TLR4调节的“肠-脑”轴可能是RES发挥神经保护效应的重要途径。
研究发现RES能够重塑PD小鼠的肠道菌群,并通过释放短链脂肪酸(SCFAs)和降低LPS 的产生,抑制LPS的易位[36]。RES可以通过下调TLR4通路减轻大鼠局灶性脑缺血后的炎症、血脑屏障破坏和脑损伤[37]。生物信息学和机器学习的应用也预测了RES与TLR4的相互作用在PD相关的铁死亡中的显著意义[38]。结合我们的实验结果,推测RES可能通过抑制TLR4的活化,降低炎症级联反应,保护肠屏障,进而减少LPS的溢漏;也可能通过调节肠道菌群,减少LPS的释放,保护肠屏障,避免TLR4的活化和炎症级联反应。但无论是哪种作用途径,肠道屏障功能的修复是RES在MPTP诱导的PD小鼠模型中发挥神经保护作用的关键环节。肠道菌群、LPS产量、肠屏障功能、TLR4活化水平之中,任一个环节的平衡被打破,最终都导致炎症级联反应的发生,而在MPTP诱导的PD小鼠模型中,α-syn在肠道的累积量增加,可能是炎症级联反应的“导火索”。以往研究表明,MPTP小鼠模型和人PD临床表现的一个显著区别是没有路易小体[39],但该模型中脑黑质区DA能神经元的丢失和运动功能障碍与人的PD临床情况相似。因此,MPTP小鼠模型可以用来测试神经元保护药物的疗效[40]。本研究在该小鼠模型中证实了RES的神经保护效应,也证实了该模型存在肠道病变,特别是肠屏障损伤、LPS释放和TLR4/MyD88/NF-κB通路的激活。但其它类型的PD动物模型中是否也存在这一病理特征,以及肠道屏障受损、α-syn累积与TLR4活化之间的因果关系仍需要进一步探究。
综上所述,TLR4介导的炎症反应在帕金森病发病机制中的作用被广泛关注,本研究证实,MPTP诱导的帕金森病小鼠模型同样存在TLR4活化的现象,并可能通过“肠-脑”轴双向作用加剧炎症级联反应。而白藜芦醇可能通过抑制LPS诱导的TLR4/MyD88/NF-κB信号通路的激活缓解炎症反应,修复肠道屏障,并减少α-syn在肠道的累积,进而发挥保护多巴胺能神经元的效应。