中美低剂量药物混合均匀度和中控剂量单位均匀度技术要求对比
徐 云
(南京海辰药业股份有限公司,江苏 南京 210046)
口服固体药物是指片剂、胶囊剂、颗粒剂等经口服递送的化学药物固体制剂。低剂量药物的活性成分通常为高活性药物,具有生物利用度高、治疗窗窄等特点[1]。《美国药典》(USP)和《英国药典》(BP)中对低剂量药物制剂的定义区别在于载药量,分别为1%[2]、2 mg或2%[3]。目前,国内尚未明确低剂量药物的定义。2010年版《中国药典》中规定,对于单剂量标示量不大于25 mg或主药含量不大于25%的药物制剂,需进行含量均匀度检查[4-5]。低剂量药物一般具有极低的单元药物含量,辅料/主药比例大,生产过程中易损失或受污染,检测方法要求灵敏度高。低剂量固体药物需根据药物特点制订关键质控指标,含量均匀度是其关键质量属性之一[6]。为保证低剂量药物终产品含量均匀度始终符合既定的质量标准要求,参照国际人用药品技术要求国际协调理事会(ICH)关于质量源于设计(QbD)理念,进行生产过程中混合、压片/填充步骤物料混合均匀度和中控剂量单位均匀度研究和评估。在药品的设计与研发阶段,通过充分验证,确定合理、可行的生产工艺,并根据生产控制质量模式的要求进行生产与检验,可较全面地控制药品质量。2022年,国家药品监督管理局(NMPA)药品审评中心(CDE)发布的《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(试行)》(以下简称《指导原则》)指出,制剂申请人应基于风险评估的原则,结合产品和生产工艺的特点,对混合或压片/填充工艺步骤评估为中高风险的产品进行研究[7]。《药品GMP指南(第2版):口服固体制剂与非无菌吸入制剂》规定,进行含量均匀度测试的化药口服固体制剂,应进行混合阶段混合均匀度和中控剂量单位均匀度的研究[8]。本研究中对比了当前中美药品监管机构关于低剂量口服固体药物混合均匀度和中控剂量单位均匀度研究的技术要求,并以实例分析,为国内上市许可持有人进行国内注册申报、美国注册申报及中美双报时提供研究思路。现报道如下。
1 中美技术指南要求与异同点对比
1.1 美国技术指南要求
2003年,美国食品和药物管理局(FDA)发布了Guidance for Industry:Powder Blends and Finished Dosage Units—Stratified In - Process Dosage Unit Sampling and Assessment,正式以过程分层取样来评价混合均匀性。2013年8月,FDA 认为基于USP <905 >剂量单位均匀度的检测结果不足以保证整个批次的含量均匀度,故撤回了该行业指南。2013年8月,国际制药工程协会(ISPE)赞助支持的混合均匀度和含量均匀度工作组(简称工作组)成立,旨在讨论混合均匀度和含量均匀度的评价方法。2015年,工作组提出了需对撤回的分层取样指南草案进行修改,以评估粉末混合充分性和成品含量均匀度[9],并提供了关于统计方法的示例和技术讨论[10]。该统计方法提供了高水平的置信度,即批次中的样品能以较高的概率通过USP <905 >剂量单位均匀度的检查,可并入工作组提出的《对撤回的FDA 分层取样指导原则草案(修订案)》,为统计分析和验收标准提供指导。目前,FDA 对工作组的提案仍予以默示许可。美国技术指南要求的混合均匀度和含量均匀度的评估流程见图1 A。
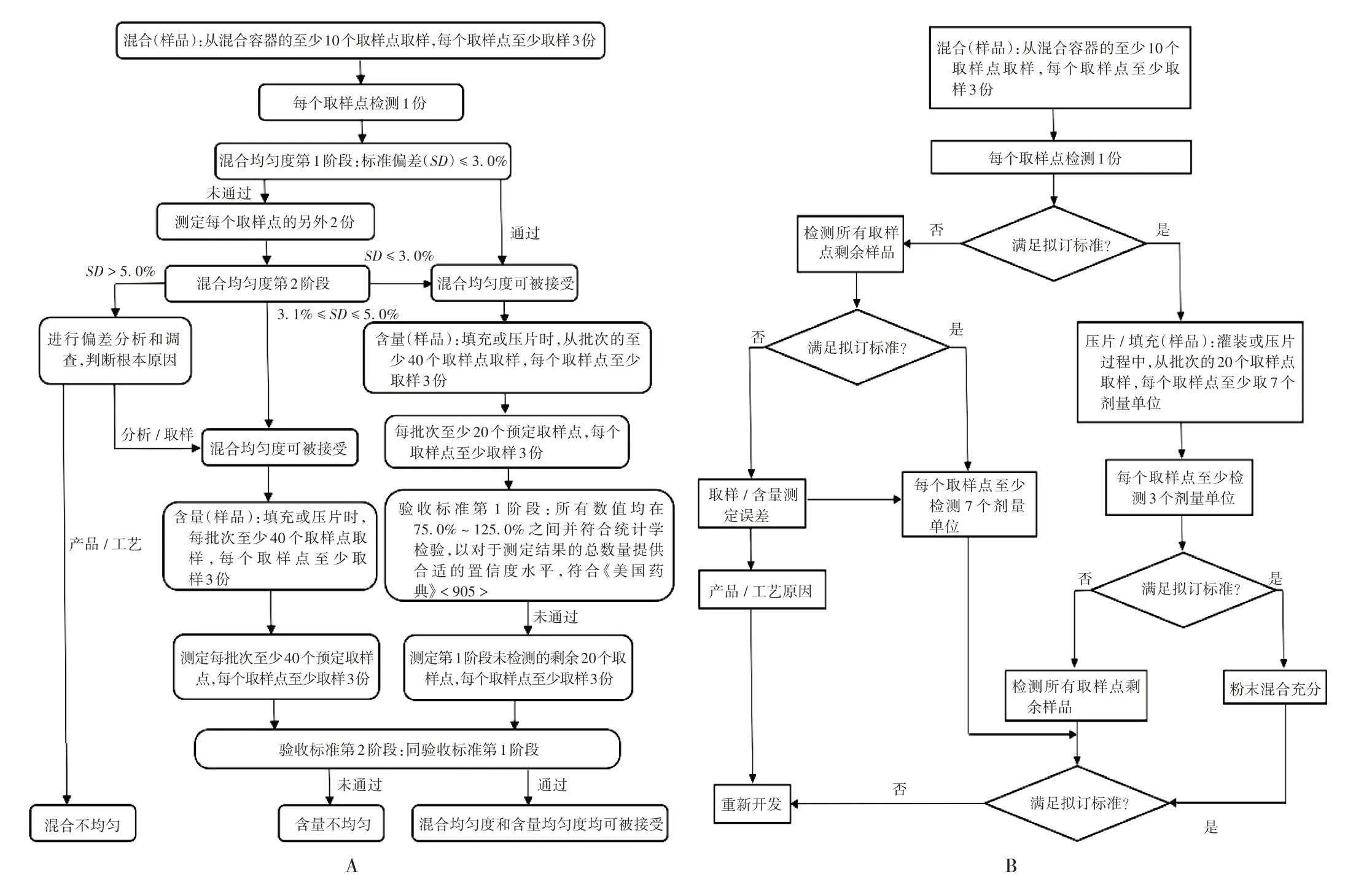
A. 美国 B. 中国图1 中国和美国技术指南要求的混合均匀度和含量均匀度的评估流程A.The USA B.ChinaFig.1 Flow chart of assessment of blend uniformity and content uniformity in technical guidelines in China and the USA
1.2 中国技术指南要求
《指导原则》[7]指出,上市许可持有人应基于风险评估的原则,结合产品和工艺特点,对混合、压片/填充工艺步骤评估为中高风险的产品进行研究。如《中国药典》规定应进行含量均匀度测试的产品,其混合不充分的风险较高,应进行混合均匀度和中控剂量单位均匀度研究。应对产品全生命周期的关键批次进行研究,如工艺验证、临床研究、上市后变更等批次,根据研究结果,并结合质量风险管理,建立商业化生产批次混合均匀度和中控剂量单位均匀度的有效控制措施。中国技术指南要求的混合均匀度和含量均匀度的评估流程见图1 B。
1.3 中美技术指南异同点对比
取样方案:该方案是用来提供混合样品或剂量单位待检测样品,通过检查以支持批生产批次放行。常见的取样方法有简单随机取样、分层取样和系统取样[10]。简单随机取样是指每个剂量单位被抽中为待检验样品的概率大致相等。理论上,可通过对批次中的每个剂量单位编号,然后通过完全随机的过程选择n个剂量单位来获得真正的随机样本,但样本可能无法涵盖批次中最受关注的位置,如批次开始和结束等。分层取样是将批次划分为若干个层,所有层的组合必须覆盖整个批次,然后在每个层内随机取样。系统取样是通过在整个批次内以相等的间隔取样,通常按剂量单位总数或生产时间划分取样间隔,第1个样本位置是随机确定的,然后以相等的间隔采集剩余样本。以上3种取样方案在统计学上都是可接受的,但只有系统取样在批次开始、中间或结束时的任何趋势都能在样本中得到相应反映。
混合阶段混合均匀度评估:通过中美混合阶段技术指南对比发现,中美取样方案基本一致;国内评价标准技术指南更严格。上市许可持有人在进行一地研发、中美双报时,建议按国内技术要求进行混合阶段混合均匀度评估。详见表1。
压片阶段中控剂量单位均匀度评估:通过中美压片阶段中控剂量单位均匀度评估技术指南对比发现,取样方案方面,中国技术要求采用分层取样,美国技术要求系统取样,取样方案有差异但不显著,均可接受;评价标准方面,中国技术要求采用单纯的相对标准偏差(RSD)值、单值及均值控制,美国技术要求单值和统计学检验(90%置信区间/95%覆盖率),便于进行趋势检查分析,如位置内/位置间变异,要求更严格。上市许可持有人在进行一地研发、中美双报时,建议按美国技术要求进行压片阶段中控剂量单位均匀度评估。详见表2。
2 案例分析
案例选择:混合均匀度和中控剂量单位均匀度的评估应涵盖药品的全生命周期,包括早期工艺设计阶段、工艺验证阶段及持续工艺确认阶段。本研究中提供的示例主要为早期工艺设计阶段,以阿哌沙班片为例,该药由百时美施贵宝制药公司研发,于2013年1月22日获NMPA 批准上市,国内上市规格为每片2.5 mg,商品名为艾乐妥®[11-12]。参考文献[13],其片芯质量为100 mg,载药量为2.5%,采用干法制粒工艺制备,产品质量标准中规定应进行含量均匀度检查。结合该产品处方组成与工艺特点,认为混合不充分的风险较高,则混合、压片工艺步骤影响产品关键质量属性含量均匀度的风险较高。因此,本研究中分别采用工作组修订的技术指南和CDE 发布的技术指南,在工艺设计阶段进行了混合均匀度和中控剂量单位均匀度的研究评估,并对检测数据进行了统计学分析。
混合阶段混合均匀度评估:混合物料结束后,在混合容器内11 个不同取样点取样。按工作组修订的技术指南评价混合均匀度,SD=0.001%<3.0%;按CDE 发布的技术指南评价,RSD=0.43%<5.0%,且所有单值在均值的± 10%以内,表明测试通过。可见,按中美技术指南要求评估,均符合标准要求,表明物料混合均匀度良好。详见表3。
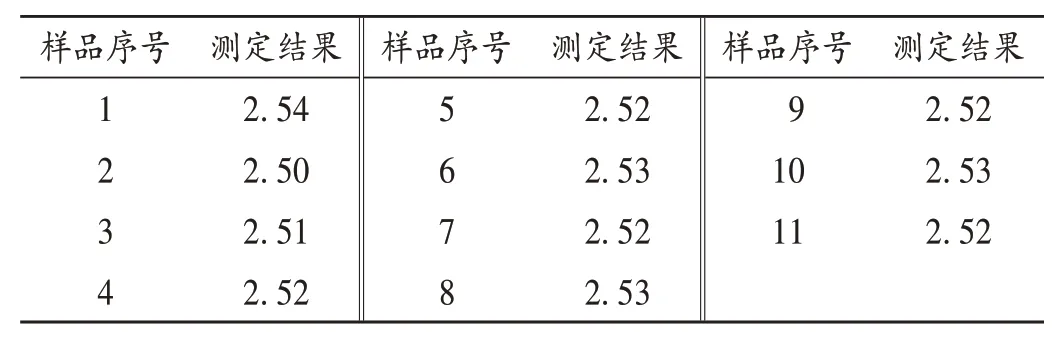
表3 混合阶段物料混合均匀度研究结果(mg/100 mg)Tab.3 Research results of blend uniformity of materials during the blending stage(mg/100 mg)
压片阶段中控剂量单位均匀度评估:按工作组修订的技术指南评价,95%覆盖率表示未来样品通过USP <905 >剂量单位均匀度检查的概率至少为95%。根据美国材料实验协会(ASTM)E2810文献进行统计学分析,将位置均值标准偏差从0.72 修约至0.80(见表4和表5)。查询可接受的极限值表,总体平均值的90%置信区间/ 95%覆盖率接受限度为87.3%~112.7%,总体平均值为98.8%(见表6),通过了限度评估。同时,所有样品的单值在目标剂量的75.0%~125.0%之间(见表7和图2)。经统计学分析,样品通过测试,认为阿哌沙班片工艺设计阶段压片过程片剂中控剂量含量均匀度良好。按CDE发布的技术指南评价,20个取样点共60份样品的RSD值为0.93%(≤6.0%),且每个取样点的平均值在目标剂量的90.0%~110.0%之间,所有单值在目标剂量的75.0%~125.0%之间,认为阿哌沙班片工艺设计阶段压片过程片剂中控剂量含量均匀度良好。
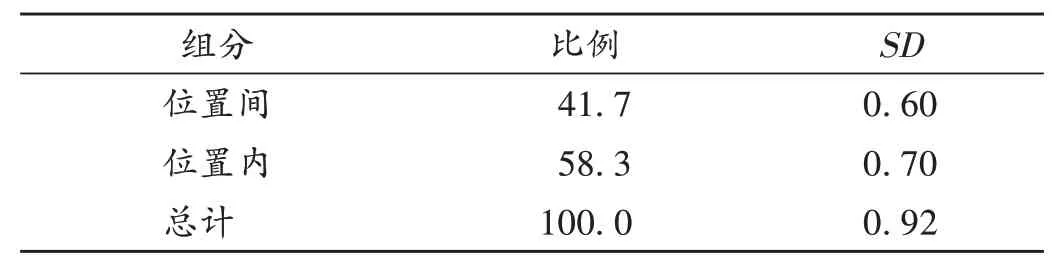
表4 位置内、位置间方差分析结果(%)Tab.4 Results of the analysis of variance between and within location(%)

表5 总体均值、位置内标准偏差和位置均值标准偏差分析结果(%)Tab.5 Results of overall mean,within location standard deviation,standard deviation of location means(%)
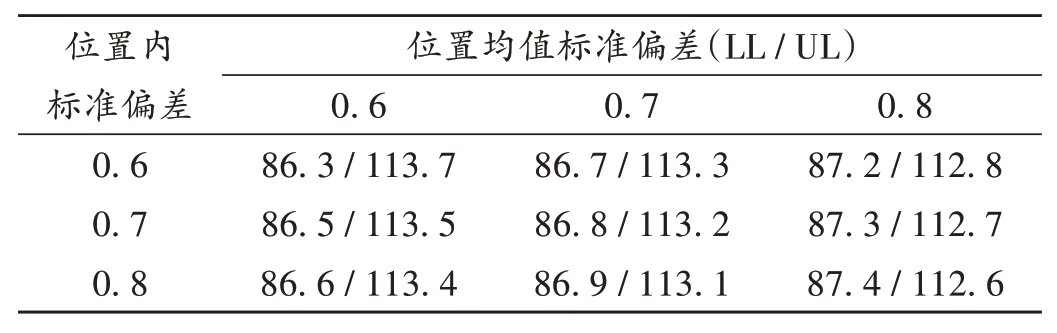
表6 样品通过《美国药典》剂量单位均匀度检查的90%置信区间/95%覆盖率(%)Tab.6 The 90% confidence interval/95% coverage rate of samples passing the uniformity test of the dosage units in the USP(%)
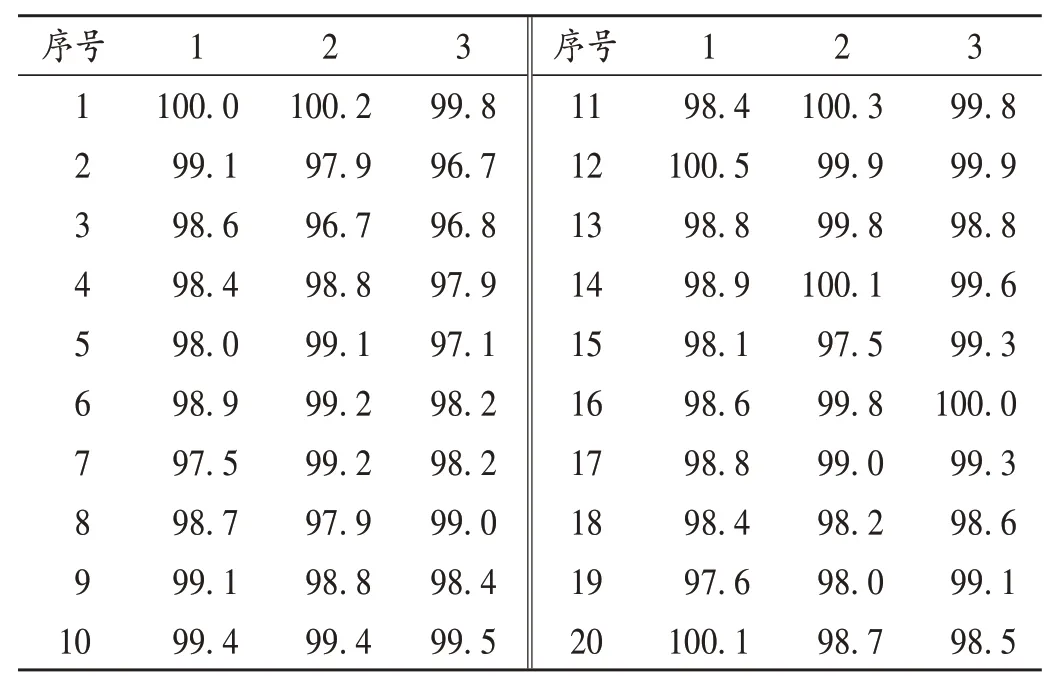
表7 压片阶段中控剂量单位均匀度研究结果(%)Tab.7 Research results of in - process dosage unit uniformity during tablet pressing stage(%)
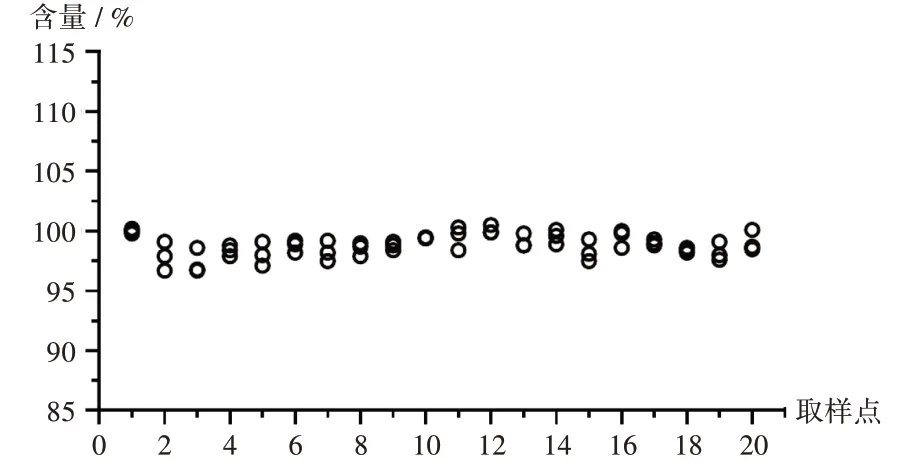
图2 中控剂量单位均匀度散点图Fig.2 Scatter plot of in - process dosage unit uniformity
3 讨论
含量均匀度是指小剂量药物在单位剂量中的含量是否偏离标示量及偏离的程度,是低剂量固体药物的关键质量属性。根据ICH QbD 理念,为保证低剂量药物终产品含量均匀度始终符合既定的质量标准要求,上市许可持有人应基于风险评估的原则,结合产品和生产工艺的特点,对生产过程中混合或压片/填充工艺步骤物料进行混合均匀度和中控剂量单位均匀度研究与评估,应涵盖早期工艺设计阶段、工艺验证阶段及持续工艺确认阶段。本研究中对比分析了中美药品监管机构关于混合均匀度和中控剂量单位均匀度的技术要求。混合均匀度方面,中美技术指南取样方案基本一致,但评价标准中国技术指南要求更严格。中控剂量单位均匀度方面,取样方案中国技术要求采用分层取样,而美国技术要求采用系统取样,取样方案有差异但不显著,均可接受;评价标准方面,中国技术要求采用单纯的RSD值、单值及均值控制,而美国技术要求单值和统计学检验(90%置信区间/95%覆盖率),便于进行趋势检查分析(如位置内/位置间变异)。建议国内上市许可持有人在进行一地研发、中美双报时,应结合中美技术指南要求,在混合阶段和压片阶段选择要求更高的技术指南进行均匀度评估。

