影像组学特征预测周围型肺癌Ki-67 水平的CT 研究
魏伟 韩冬 贾永军 雷雨欣 于楠 于勇 樊丽华
肺癌是全世界癌症死亡的主要原因[1],其中周围型肺癌约占70%以上[2]。虽然肺癌的疗法越来越多,但即使是早期肺癌患者,部分预后仍很差[3],最重要的原因可能是癌症在空间和时间上的异质性所致[4]。随着精准治疗的临床应用,肿瘤治疗法以分子病理学为金标准的方法代替传统手术模式。肿瘤细胞在增殖、分化及扩散时会产生很多有代表性的生物学标志物,用更便捷的分子生物学标志物来动态观察肺癌的生物学行为成为趋势。
癌症发生、发展最直接的原因是不可控性细胞增殖[5],Ki-67 是反映肺癌病灶增殖状态、评估预后及分子靶向药物设计[6]中最常用的指标,然而Ki-67 表达水平只能由术后组织标本确定。活检穿刺可能导致出血、气胸和增加转移的可能性[7],故在术前寻找一种无创方法预测Ki-67 的表达水平至关重要。CT 增强成像是诊断肺癌最常用的检查手段。有文献证实随着Ki-67 表达水平升高,CT 强化程度越高、分化程度越低、强化越不均匀[8]。影像组学较传统的影像图像能更好地显示病灶内部特征,提供肿瘤的形状、大小、强度和体积等信息[9],准确评估肿瘤生物学行为和癌症遗传学[10],体现了无创和便捷的优点。本研究主要基于CT 增强动脉期图像构建影像组学标签来预测周围型肺癌的Ki-67 表达水平,为评估肿瘤侵袭性和预后情况提供更多依据。
1 资料与方法
1.1 研究对象
本研究经机构伦理委员会审核通过(审批号:SZFYIEC-YJ-KYBC-2022 年第[07]号)。回顾性收集本单位2017 年5 月—2020 年11 月行胸部CT 平扫及增强扫描并在检查后2 周内经病理证实、行Ki-67 表达水平检测的117 例周围型肺癌患者,并符合以下纳入及排除标准。纳入标准:1)经手术或穿刺活检病理证实并有完整CT 增强动脉期图像数据、Ki-67 表达结果和病理结果的周围型肺癌患者;2)病灶为实性结节及肿块;3)未接受放化疗等治疗。排除标准:1)合并其他脏器原发恶性肿瘤;2)因呼吸运动伪影导致图像质量差,影响病灶分割;3)肿瘤呈浸润性生长难以分割。共纳入周围型肺癌患者117 例,男43 例,女74 例,年龄35~79 岁(中位年龄54 岁)。病理证实Ki-67 高表达组54 例,Ki-67 低表达组63 例,采用分层抽样方法按7∶3 的比例将患者随机分为训练组(n=82)和验证组(n=35)。
1.2 影像数据采集
所有患者于CT 扫描前均签署增强CT 知情同意书,采用GE Discovery CT 750 HD(GE 医疗)对所有受检者进行常规平扫及对比剂注射30 s 和60 s后采集的双期增强扫描。扫描范围从胸廓入口至最低侧肋膈角水平。扫描参数:层厚5 mm,层间距5 mm;重组层厚1 mm,重组层距1 mm,管电压120 kV,管电流自动毫安。对比剂应用碘海醇(300 mg I/mL),采用德国Ulrich 高压注射器经右肘前静脉注射对比剂,注射流率3.5~4.0 mL/s。
1.3 Ki-67 免疫组化分析
所有病理结果均经穿刺或术后病理证实,穿刺取3 个地方以保证Ki-67 检测能代表整个肿瘤。Ki-67 表达水平分为高表达组(Ki-67≥50%)和低表达组(Ki-67<50%)。
1.4 兴趣区勾画及影像组学特征计算
将CT 增强动脉期图像导入ITK-SNAP 软件,然后由具有8 年胸部影像诊断经验的影像科医师勾画瘤灶的容积兴趣区(volume of interest,VOI),包含分叶、空洞、出血、坏死及血管区域。将肿瘤的VOI 保存为边界文件(.nii 格式),两个月后再经另外一位中级以上影像诊断医师对文件进行手动修正,以确保边界文件的准确度。将肿瘤的影像DICOM 数据及边界文件导入A.K 软件,396 个影像组学特征被提取,特征包含6 类(图1),其中GLCM 及GLRLM 步长设置为1、4 及7。
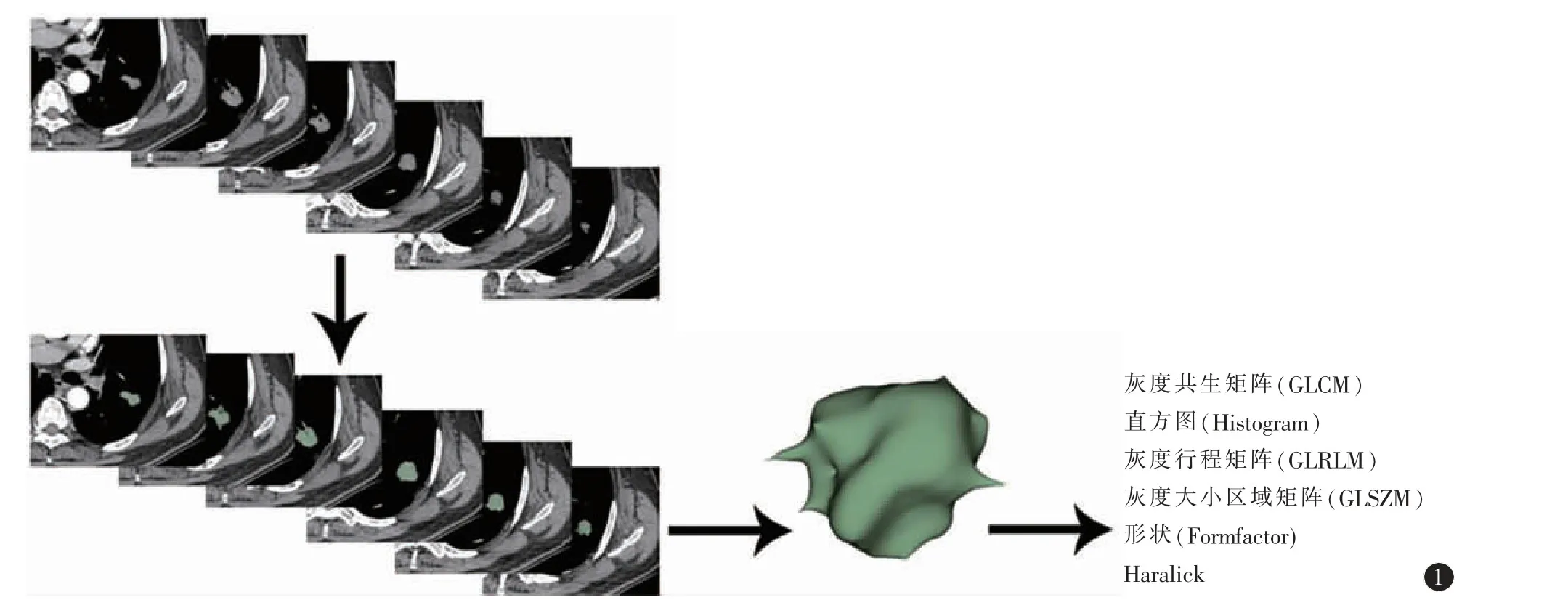
图1 病灶分割及特征提取。增强CT 动脉期原始DICOM 图像;病灶分割以及3D View;提取影像组学特征,包括灰度共生矩阵(GLCM)、直方图(Histogram)、灰度行程矩阵(GLRLM)、灰度大小区域矩阵(GLSZM)、形状(Formfactor)及Haralick。
1.5 影像组学特征筛选及模型的建立
本研究使用LASSO 回归模型进一步筛选训练组周围型肺癌病灶的影像组学特征,并且将筛选的影像组学特征与其回归系数建立影像组学标签,并计算每例患者的影像组学评分,再结合临床基本资料进行二元多因素Logistic 回归分析,选择出预测Ki-67 表达水平的独立危险因素。使用影像组学模型对验证组的数据进行内部验证。
1.6 影像组学标签效能评估
根据受试者工作特征(receiver operating characteristic,ROC)曲线,计算敏感度及特异度,使用ROC 曲线下面积(area under the curve,AUC)观察影像组学标签预测能力。根据Hosmer-Lemeshow 检验分别评估在训练组和验证组影像组学标签的校准度。影像组学预测标签采用决策曲线分析法(decision curve analysis,DCA)[11]分析不同概率阈值下患者的净受益情况,评估影像组学标签的临床价值。
1.7 统计分析
统计分析采用SPSS 22.0 软件及R 语言,P<0.05 被认为具有统计学差异。满足正态分布且方差齐的计量资料采用独立样本t 检验,以均数±标准差表示。计数资料采用卡方检验,用n/%表示。一致性检验时二分类参数采用Kappa 检验,有序多分类参数采用Weighted-Kappa 检验。
2 结果
2.1 预测周围型肺癌Ki-67 表达的危险因素
在训练组和验证组中将Ki-67 表达水平分为高表达组和低表达组。在对患者性别、年龄、吸烟和影像组学评分的Logistic 回归分析显示,在训练组和验证组Ki-67 高低表达患者的年龄、性别和吸烟之间的差异均无统计学意义(P>0.05),影像组学评分被认为是预测周围型肺癌Ki-67 表达水平的独立预测因子(表1)。
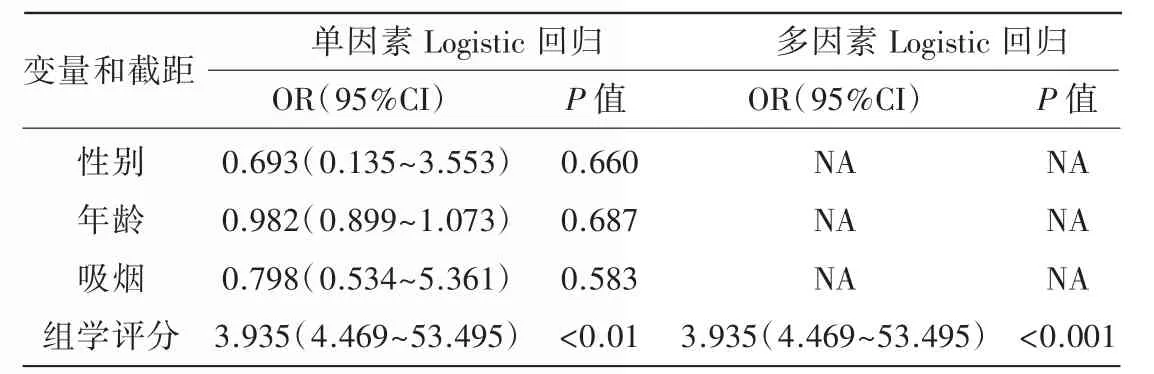
表1 预测周围型肺癌Ki-67 的危险因素
2.2 影像组学评分
对396 个影像组学特征进行Z 分数标准化,应用LASSO 回归模型对数据进行降维,再通过十字交叉验证获得最优λ 值(图2)。共筛选出7 个非零系数特征(图3)。Ki-67 高、低表达组CT 动脉期图像与影像组学特征见图4、5。然后通过影像组学标签计算影像组学风险评分。Ki-67 高、低表达组影像组学评分在训练组分别为-1.89±1.13及0.51±1.18,具有统计学差异(t=-7.89,P<0.01),在验证组分别为-1.28±1.21 及0.74±0.87,差异有统计学意义(t=-3.76,P<0.01)。
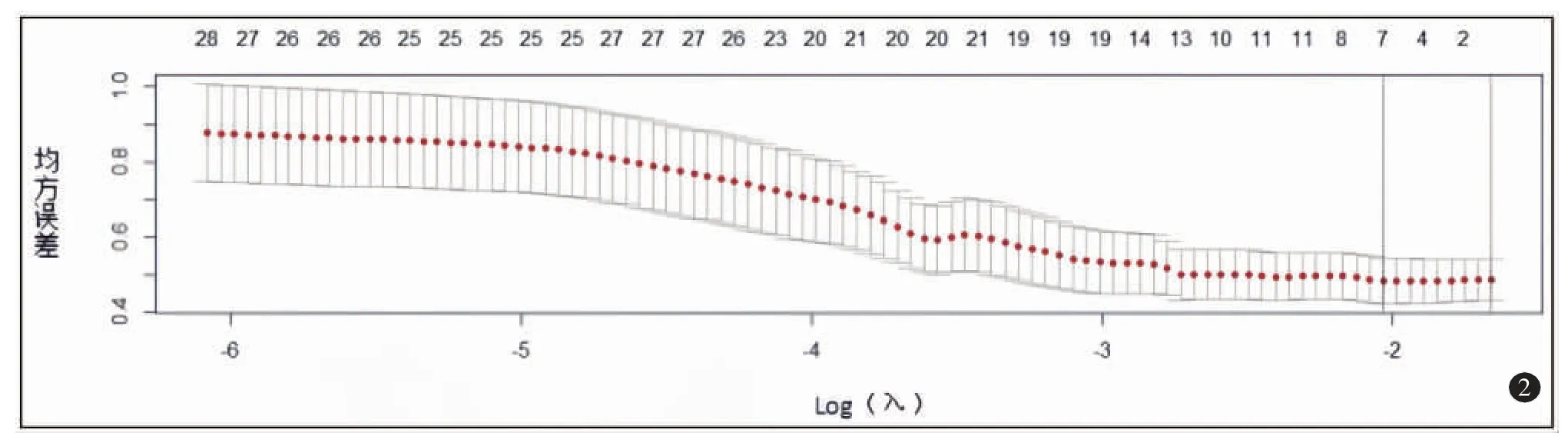
图2 交叉验证图。Log(λ)=-2.045,得出最优λ 值为0.1309。
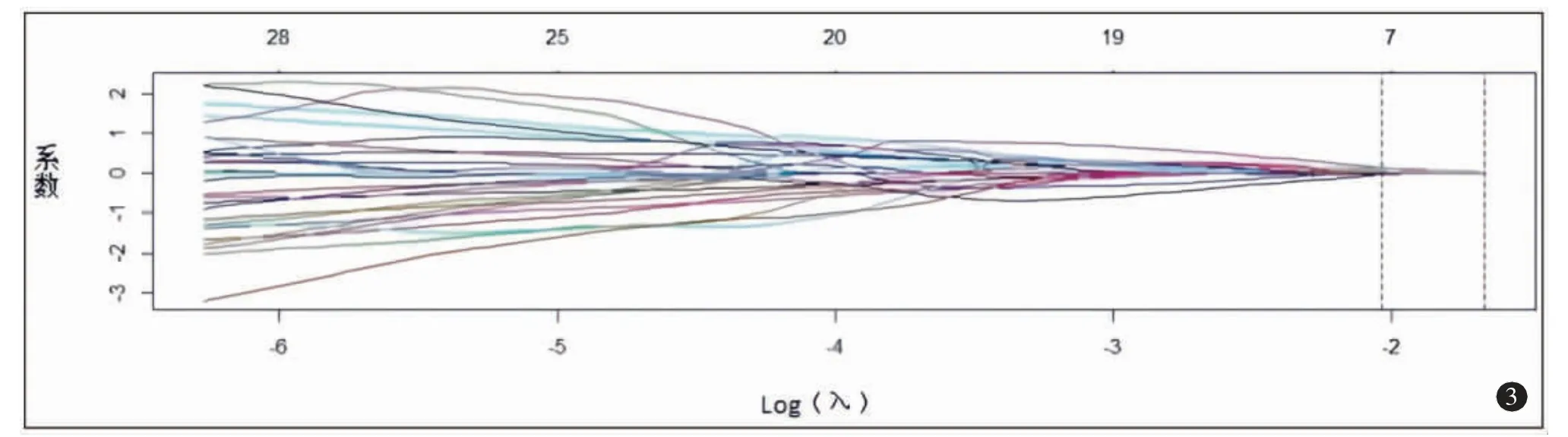
图3 系数图。通过Log(λ)共筛选出7 个非零系数特征。
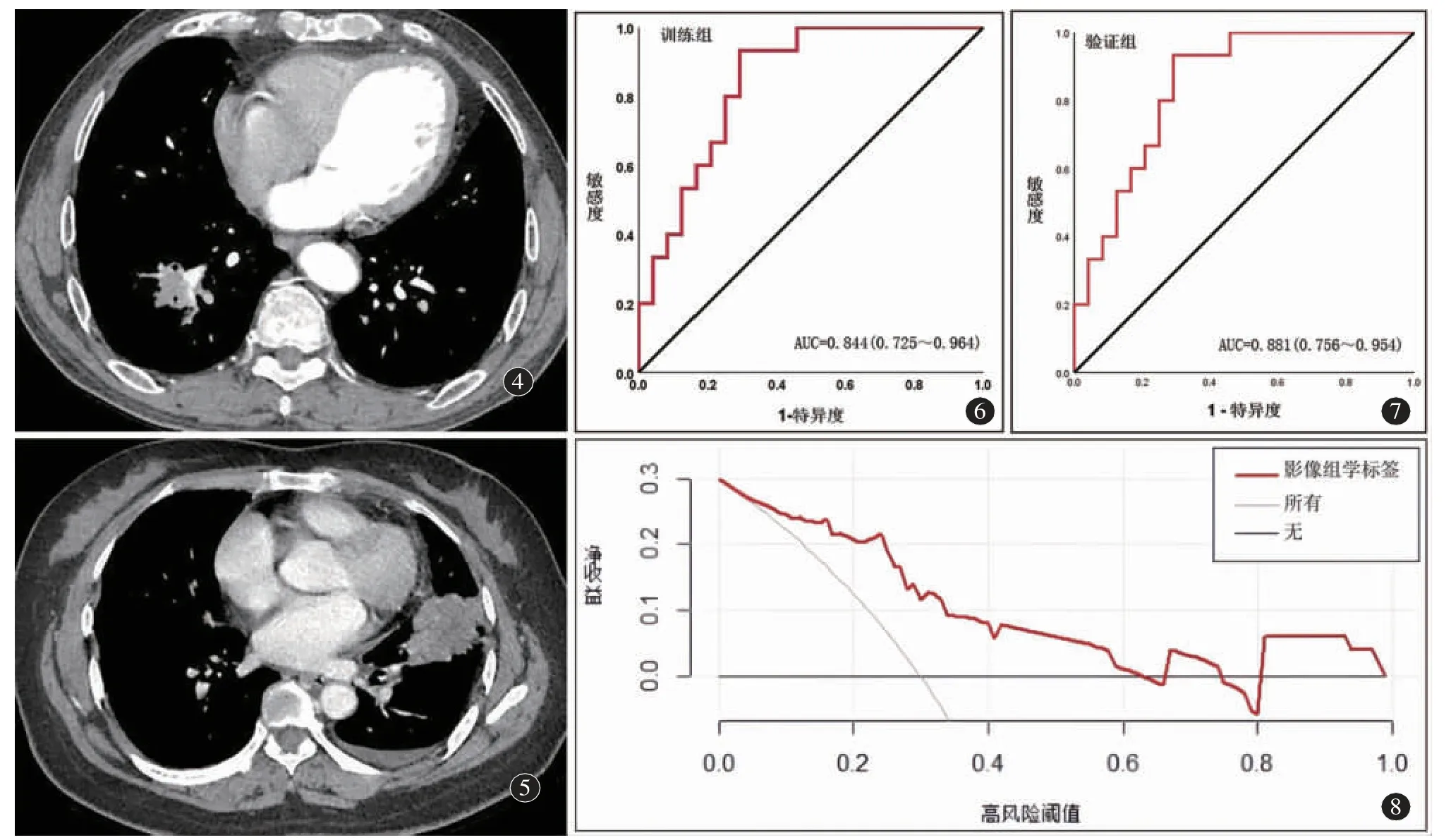
图4 男,66 岁,右肺下叶周围型肺癌。Ki-67 高表达CT 动脉期横断位图像。Ki-67 高表达影像组学特征ZShortRunEmphasis_AllDirection_offset7_SD、ZdifferenceVariance、ZSphericity、ZMaximum3DDiameter、ZCorrelation_angle135_offset4、ZIntensityVariability、ZCompactness1。图5 女,47 岁,左肺下叶周围型肺癌。Ki-67 低表达CT 动脉期横断位图像。Ki-67 低表达影像组学特征:ZMaxIntensity、ZMeanDeviation、ZPercentile45、ZQuantile0.975、ZClusterProminence_AllDirection_offset1、ZClusterProminence_angle135_offset4、ZLowIntensityLargeAreaEmphasis。图6 训练组。图7 验证组。图8 决策曲线图。所有:将所有患者都认为Ki-67 高表达;无:将所有患者都认为Ki-67 低表达。
2.3 影像组学预测模型公式
以Ki-67 表达水平为因变量,将周围型肺癌的影像组学评分作为自变量,纳入二元Logistics回归。预测周围型肺癌Ki-67 表达水平的独立预测因素是影像组学评分。该预测模型为Y=1/[1+exp(-Z)],Z=2.275×Radiomics_score+0.712。
2.4 影像组学标签预测性能
对影像组学标签进行ROC 分析,在训练组AUC 为0.844(95%CI:0.725~0.964),敏感度93%,特异度71%。Hosmer-Lemeshow 检验结果显示,校准度是0.709(图6)。在验证组AUC 为0.881(95%CI:0.756~0.954),敏感度91%,特异度75%,校准度0.950(图7)。在两个受试组中,影像组学标签可较好地预测Ki-67 表达。
2.5 决策曲线分析
DCA 图分析显示,当阈值概率在3%~63%之间时,基于CT 增强动脉期图像的影像组学标签预测周围型肺癌Ki-67 表达情况优于将所有患者都认为Ki-67 高表达及将所有患者都认为Ki-67 低表达(图8)。
3 讨论
周围型肺癌的发病率越来越高,那么对于该疾病的早期筛查、预测及预后显得尤为重要[12]。当发现周围型肺癌时,通过用一定的影像学检查及生物学标记物判断其恶性程度及预后,对其后续治疗有一定的价值。周围型肺癌CT 影像特征相对复杂,术前明确良恶性并不一定准确,故需要凭借影像学、肿瘤生物学标记物、病理组织切片染色等方法诊断周围型肺癌。Ki-67 作为一种与细胞增殖相关的生物标志物[13],是研究较多的增殖细胞标记物之一。有研究[14]表明,Ki-67 增殖指数与肿瘤的分化程度及侵袭性显著相关,Ki-67 表达水平越高,说明肿瘤生长越快,恶性程度越高,侵袭能力越强,预后越差,可用来评估肿瘤恶性程度。不同的肺癌生长方式不同,故其CT 表现呈现出不同的影像学特征,Ki-67 等肿瘤标记物的表达情况决定了肿瘤生长方式。“影像组学”的概念自2010 年由Gillies 等[15]第一次提出并后续经Lambin等[16]完善后,逐步发展成当前影像学界的研究热点,通过影像组学方法分析图像,可以获得影像图像中包含的分子水平信息,可辅助临床医师为患者制作独立的治疗方案[17]。通过影像组学方法分析胸部增强CT 图像,不同的影像特征预测分子生物学标志物Ki-67 表达水平具有显著效果,并且可指导治疗和评估预后。
本研究采用基于CT 增强动脉期图像的影像组学标签预测周围型肺癌Ki-67 的表达情况,研究结果:影像组学标签在预测周围型肺癌Ki-67 ROC 曲线显示,在训练组AUC 为0.844,在验证组AUC 为0.881,在两个受试组中,影像组学标签可以较好地预测周围型肺癌Ki-67 表达程度,进而预测肿瘤的恶性程度和预后情况,为临床制定治疗措施提供了一定的指导。本研究应用A.K 软件提取肺癌影像组学特征,采用LASSO 回归对特征数据进行进一步降维并建立模型,对其代价函数添加一定的惩罚项,使建立的模型具有更锐利的函数,不易产生过拟合。应用十字交叉验证得到最优λ 值,使影像组学预测模型更接近理想模型。既往研究表明,影像组学评分是预测恶性肿瘤的独立危险因素[18],本研究基于影像组学预测模型中只有影像组学评分是预测Ki-67 的表达情况的独立危险因素,与之相符。有研究表明Ki-67 表达水平与临床资料(性别、年龄、吸烟)关系紧密[19,20],但是本研究年龄、性别、吸烟在Ki-67 高低表达组之间差异无统计学意义(P>0.05),与既往研究结果不同,可能与本研究病例数较少有关。有研究发现,Ki-67 是早期肺腺癌患者行肺段切除后复发的独立危险因素[23],故在术前选用无创性检测方式测定Ki-67 的表达情况,对于手术的术式选择非常重要。本研究发现影像组学标签可以较好地无创性预测Ki-67 的表达水平。
本研究有以下几个局限性:第一,病例数较少。第二,以周围型肺癌为研究对象,尚区分具体的病理类型。第三,仅用增强CT 动脉期图像进行特征提取。第四,部分病例是经皮穿刺活检证实的,虽然也可用于预估Ki-67 表达水平,但小活检组织并不能代表全部肿瘤组织。
综上所述,本研究基于增强CT 动脉期图像创建的影像组学标签预测周围型肺癌Ki-67 表达水平有较高的价值。

