新生儿败血症病原学特征及革兰阴性菌感染影响因素分析
——基于5 年临床分析
卞赵男 查新祎 张 熙 陈旭婷 陈彦如 许 敏 张永红 钱继红
1.上海交通大学医学院附属新华医院新生儿科(上海 200092);2.上海交通大学医学院附属新华医院临床研究与创新中心(上海 200092)
新生儿败血症是病原体侵入新生儿血液循环后生长、繁殖、产生毒素引起的全身性炎症反应,由于固有免疫细胞大量激活,炎症性损伤可导致多器官功能障碍,是目前引起新生儿死亡的主要原因。在全球范围内,高发病率和高死亡率使得新生儿败血症成为各国医院和公共卫生机构共同面对的难题。目前血培养是新生儿败血症诊断的金标准,抗生素的选择也主要依靠血培养的药敏结果,然而血培养所需时间较长,在药敏结果之前主要依赖广谱抗生素进行治疗[1]。革兰阴性菌(gram‐negative bacteria,G-菌)和革兰阳性菌(gram‐positive bacteria,G+菌)在对不同抗生素的敏感性上具有明显差异[2],盲目使用抗生素可能导致病原菌的耐药性增加,同时造成医疗资源的浪费。早期判断不同种革兰病原菌,选择更加合适的抗生素进行治疗,对改善患者的疗效和减少耐药菌具有重要意义。本研究采取回顾性研究方法,分析了本中心新生儿败血症病原学特征,并通过对患儿临床特征的分析,了解G-菌感染的可能影响因素,为今后早期判断新生儿败血症的病原菌及抗生素选择提供临床依据。
1 资料与方法
1.1 资料来源
选取2018 年1 月1 日至2022 年12 月31 日5 年内新华医院新生儿科收治、诊断为新生儿败血症且血培养阳性的患儿作为研究对象。纳入标准:①出生后0~28 天;②符合2019 年版《新生儿败血症诊断及治疗专家共识》[1]中新生儿败血症确定诊断要求:有感染相关临床表现,血培养阳性;③凝固酶阴性葡萄球菌(coagulase negative staphylococci,CoNS)感染纳入研究需符合以下标准,有感染相关临床表现且符合下述任意1条:①双份血培养阳性结果;②单份血培养阳性结果同时伴有血液非特异性检查异常(白细胞计数、C‐反应蛋白和降钙素原)。排除标准:①有严重出生缺陷或先天性遗传代谢病的患儿;②真菌感染或混合G-菌和G+菌感染的患儿。
1.2 方法
设计信息采集资料表记录纳入研究患儿的住院年度、性别、起病日龄、胎龄及相关出生史;记录血培养结果及病原菌药敏结果;记录与血培养结果相对应的血常规和相关生化检查的实验室检查结果;记录患儿发病时的临床表现。以入院时的日期定义入院年度。根据2019 年版《新生儿败血症诊断及治疗专家共识》定义起病日龄≤3天为早发型败血症,>3天为晚发型败血症;白细胞计数<5×109/L被定义为白细胞减少[1]。院内感染定义为入院时无感染相关临床表现及实验室检查异常,出现感染情况在入院后48 h 以上[3]。实验室检查结果超出检测限则记录为检测限数值,如C‐反应蛋白(C‐reactive protein,CRP)检测限为8,<8的检测结果记录为8。
1.3 统计学分析
应用SPSS 26.0 统计软件进行数据分析。计数资料采用n(%)进行描述,组间比较采用卡方检验;计量资料符合正态分布采用()描述,组间比较采用独立样本t检验;计量资料不符合正态分布采用M(P25~P75)进行描述,组间比较采用非参数检验。采用非条件二分类logistic回归探索G-菌感染的影响因素,绘制不同影响因素对G-菌感染的受试者工作特征曲线(ROC),计算曲线下面积(AUC)以判断联合指标在鉴别G-菌感染中的预测价值,P<0.05为差异具有统计学意义。
2 结果
2.1 新生儿败血症一般情况
纳入研究的201 例确诊败血症患儿中,男性患儿129例(64.2%),女性患儿72例(35.8%)。患儿最小胎龄25.1周,患儿最大胎龄42.4周,中位胎龄38.2(34.7~39.6)周,早产儿74例(36.8%)。最小出生体重680 g,最大出生体重4 600 g,平均出生体重(2 809±896)g。早发型败血症20例(10.0%),晚发型败血症181例(90.0%)。
201 例确诊患儿中,死亡11 例,总体死亡率为5.5%。201 例确诊患儿中G-菌感染患儿82 例(40.8%);G+菌感染患儿119 例(59.2%)。不同革兰细菌感染所致败血症的合并症情况和死亡率结果显示,G-菌感染合并凝血功能障碍、泌尿道感染及胆汁淤积症比例高于G+菌感染(分别为28.0%对10.9%;24.4%对12.6%;7.3%对0.8%,差异有统计学意义(P<0.05);G-菌感染死亡率更高(9.8%对2.5%),但是两者差异无统计学意义。
2.2 新生儿败血症病原菌分布及耐药情况

图1 纳入病例流程图
201例新生儿确诊败血症患儿共检出G-菌和G+菌株208株,7例患儿检测出两种不同的G+菌。208株病原菌中G+菌126 株,占比60.6%,G-菌82 株,占比39.4%。G+菌主要病原体为CoNS和粪肠球菌;G-菌主要病原体为肺炎克雷伯菌和大肠埃希菌。CoNS对青霉素G(91.8%)、红霉素(65.8%)和苯唑西林(76.7%)耐药程度较高,对利奈唑胺和万古霉素均敏感;粪肠球菌对高浓度庆大霉素(30.8%)存在耐药风险。肺炎克雷伯菌对青霉素类抗生素和头孢菌素耐药程度均较高,同时对碳青霉烯类抗生素具有一定的耐药性,对替加环素和阿米卡星敏感性高;大肠埃希菌对氨苄西林耐药性高,对碳青霉烯类抗生素敏感。具体病原菌分布、例数和构成比见表1。
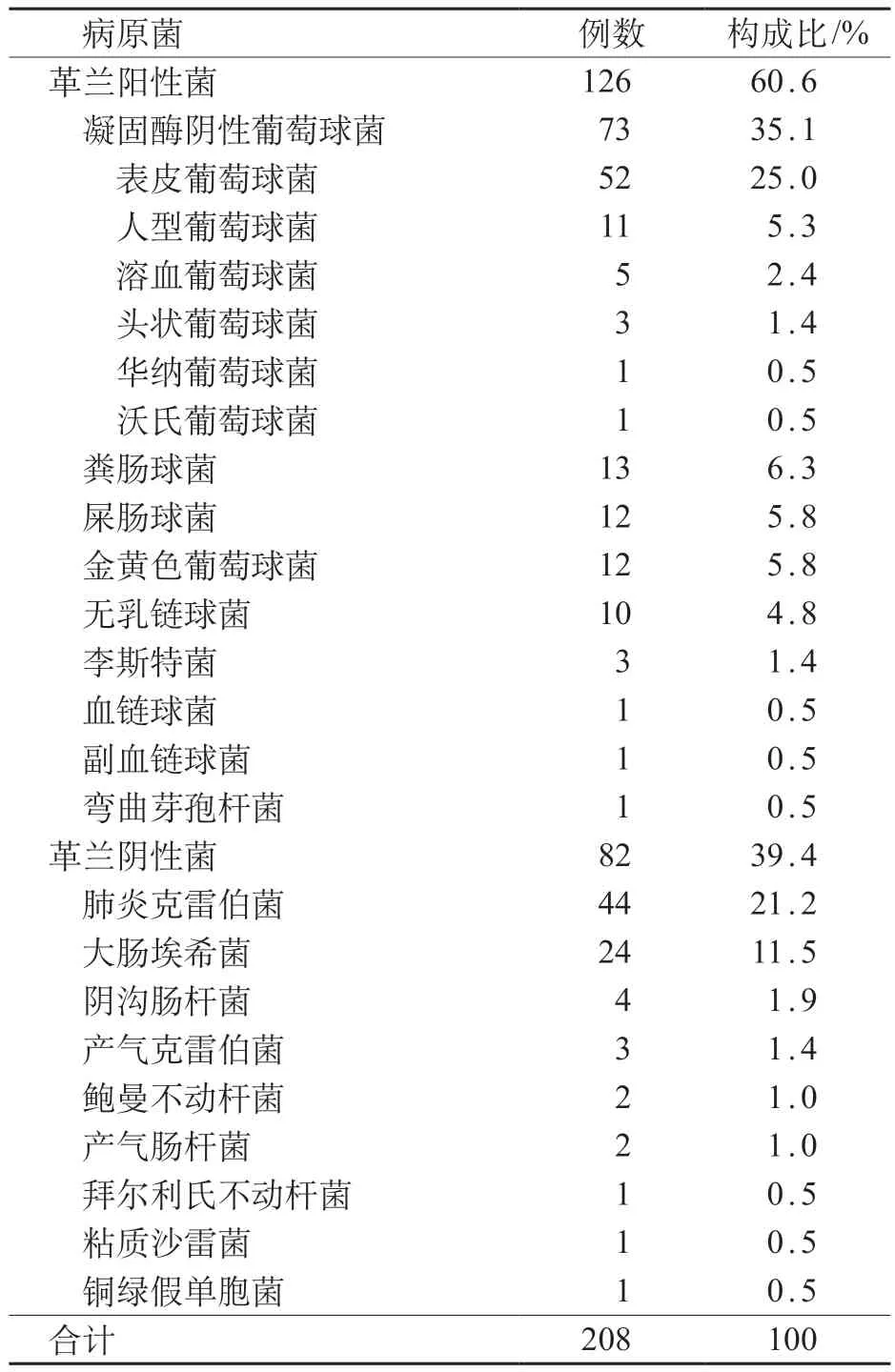
表1 病原菌分布情况
对2018—2022 年不同年度检出的病原菌进行统计,2018 年共检出病原菌31 株,其中G-菌8 株(25.8%),G+菌23株(74.2%);2019年共47株,G-菌15 株(31.9%),G+菌32 株(68.1%);2020 年共35 株,G-菌14 株(40.0%),G+菌21 株(60.0%);2021 年共50 株,G-菌20 株(40.0%),G+菌30 株(60.0%);2022 年共45 株,G-菌25 株(55.6%),G+菌20 株(44.4%)。检出病原菌总体数量在过去5 年呈现波动变化,革兰阴性菌占比呈现上升趋势(卡方趋势检验结果,χ2trend=7.54,P<0.01)。2022年革兰阴性菌占比首次超过革兰阳性菌,趋势变化见图2。
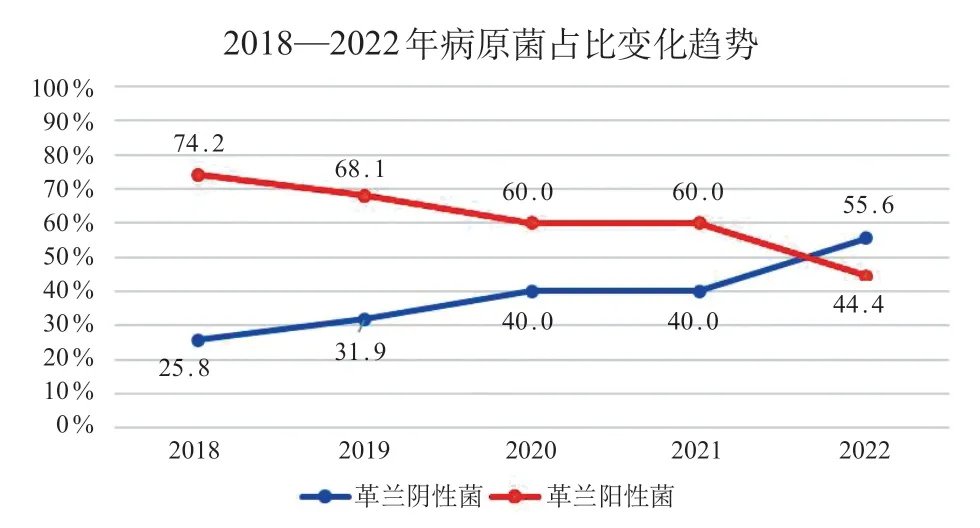
图2 病原菌占比变化趋势
2.3 G-菌、G+菌感染患儿的临床资料分析
单因素分析结果显示,G-菌感染早产儿占比更高,出生体重分布低于G+菌感染患儿。胎膜早破、产前激素使用和院内感染情况均在G-菌感染中占比更高,差异具有统计学意义(P<0.05);性别比例、起病日龄、是否剖宫产出生和羊水污染情况在两组中差异没有统计学意义。对起病时实验室检查分析结果显示G-菌感染患儿中性粒细胞百分比(N%)、CRP、降钙素原(PCT)更高,而血小板计数低于G+菌感染患儿。G-菌感染所致白细胞计数(WBC)<5×109/L的患儿比例高于G+菌感染,差异具有统计学意义(P<0.05)。
对两组患儿起病时的临床表现进行统计,结果提示G-菌感染患儿出现水肿、腹胀、呼吸道、消化道出血和呼吸暂停、呼吸困难占比高于G+菌G+菌感染患儿,脐部异常占比低于G+菌感染患儿(P<0.05)。发热和皮肤黄染均为两组患儿最常见的临床表现。临床资料分析见表2。
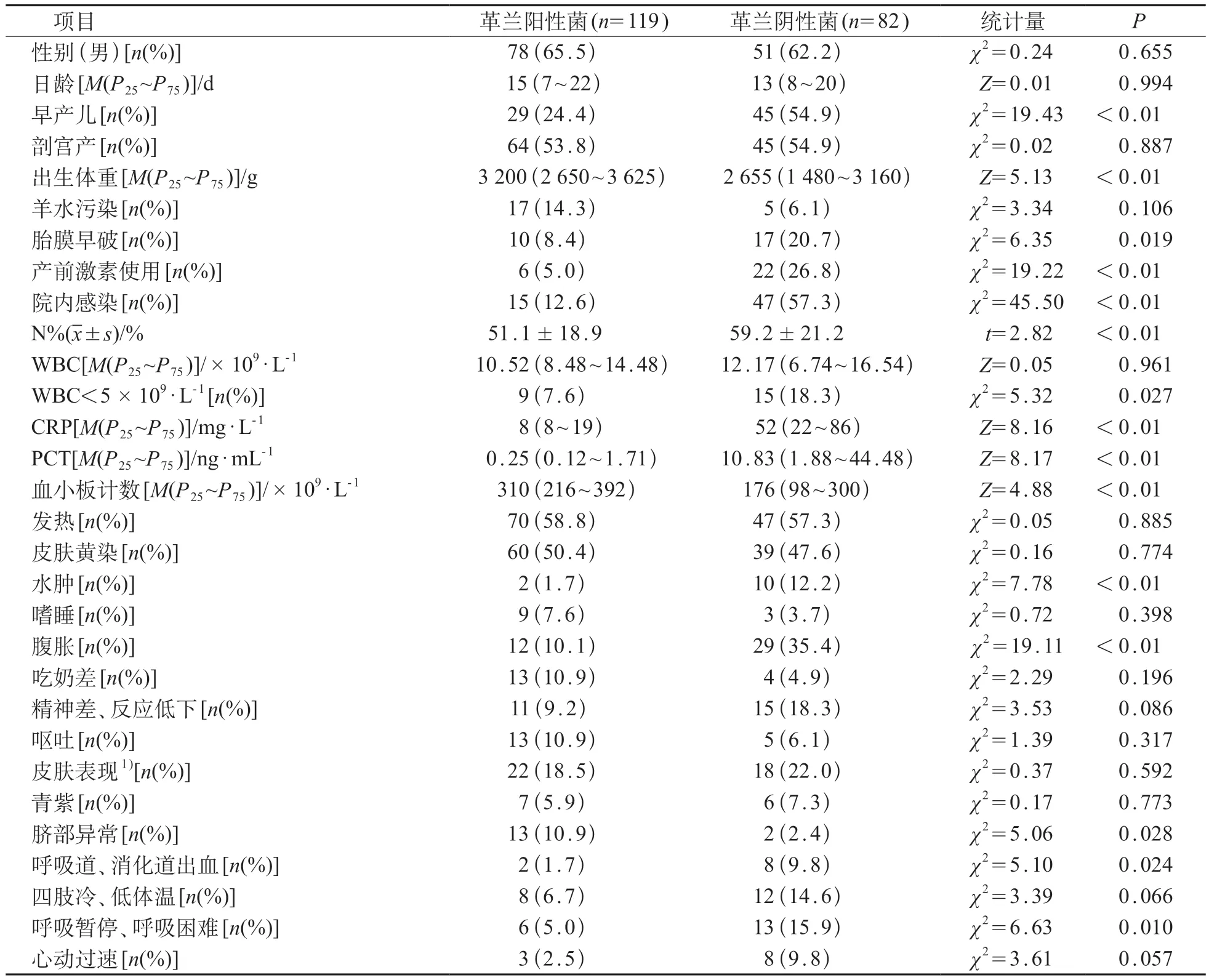
表2 G-菌和G+菌感染患儿临床资料分析
2.4 多因素分析判断G-菌感染的影响因素
将单因素分析中差异具有统计学意义的变量纳入二分类logistic回归分析,因变量设置为G-菌感染为结局,变量筛选方法设置为向前法。结果显示上述变量中院内感染,WBC<5×109/L,CRP和PCT是判断G-菌感染的影响因素(P<0.05)。见表3。
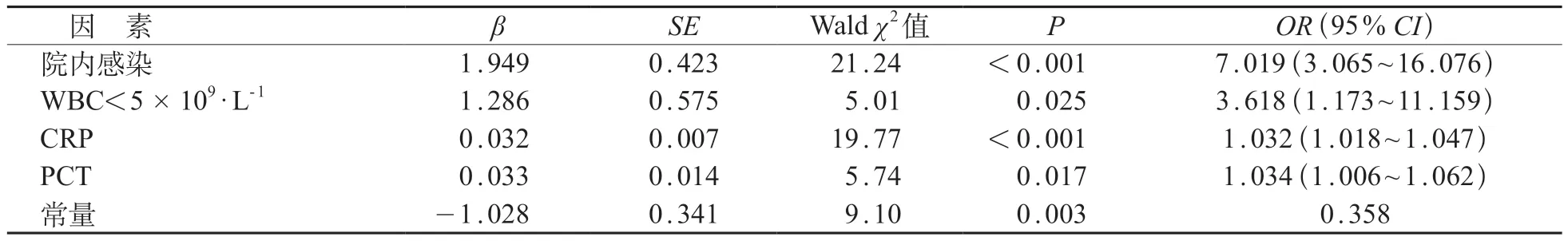
表3 二分类logistic回归分析导致G-菌感染的影响因素
影响因素中院内感染和WBC<5×109/L 为分类变量,CRP 和PCT 为连续性变量,利用ROC 曲线计算CRP 和PCT 的截断值。结果显示CRP 的截断值为16.5 mg/L时,预测革兰阴性菌感染的AUC值为0.828(0.769~0.887),特异度73.1%,灵敏度为81.7%;PCT的截断值为0.98 ng/mL时,预测革兰阴性菌感染的AUC值为0.839(0.784~0.895),特异度为70.6%,灵敏度为89%。同时联合上述影响因素计算的预测概率对早期鉴别G-菌感染的价值较高,曲线下面积AUC值为0.888(0.840~0.936),灵敏度为76.8%,特异度为89.1%。ROC曲线见图3。
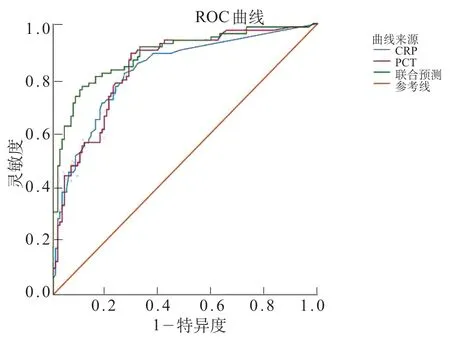
图3 ROC 曲线
3 讨论
新生儿败血症是引起新生儿死亡的主要原因,全球每年约有300 万新生儿败血症病例,死亡率为11%~19%[4]。既往研究表明,G-菌感染所致新生儿败血症的死亡率以及合并坏死性小肠结肠炎、化脓性脑膜炎和胆汁淤积症的风险显著高于G+菌感染[5‐7]。因此,早期识别G-菌所致的新生儿败血症有助于早期选择更为敏感的抗生素,有利于改善患儿预后,同时减少细菌耐药的发生。目前主要依靠血培养鉴别出不同病原菌感染,但是临床工作中血培养阳性率往往不高,在血培养阴性情况下无法区分不同革兰细菌感染,从而导致抗生素的盲目使用和病原菌耐药。本研究联合患儿基本信息、非特异性检查和临床表现对不同革兰细菌感染患儿进行评估,可以弥补血培养阳性率低的情况下,不同革兰细菌感染的鉴别,为临床诊疗提供参考。
本研究发现本中心新生儿败血症的主要病原菌为CoNS、肺炎克雷伯菌和大肠埃希菌。与近年来国内报道的新生儿败血症病原菌分布总体差别不大[8],部分研究报道G-菌中大肠埃希菌占比高于肺炎克雷伯菌,考虑不同中心的广谱抗生素使用和产科抗生素使用均有可能影响新生儿败血症病原菌的检出[9‐10]。同时本研究发现2018—2022 年间,新生儿败血症中G-菌感染占比呈明显上升趋势,与全国血流感染细菌耐药检测联盟报告的G-菌感染引起血流感染呈上升趋势相符[11],G-菌感染占比升高可能与G-多耐药甚至泛耐药有密切关联[12],因此在临床实践中需要重视抗生素的合理使用,减少耐药菌的产生。
在本研究中,我们对比了G-菌和G+菌感染患儿的基本情况、临床表现和实验室检查,结果显示院内感染是G-菌感染的影响因素。既往研究报道,中国新生儿院内感染所致败血症病原菌主要为肺炎克雷伯菌和大肠杆菌[13];而西方发达国家新生儿院内感染主要病原菌为CoNS[14]。在本研究中,62例患儿为院内感染,共检出62株病原菌,其中47株(75.8%)为G-菌。发达国家院内感染以CoNS为主考虑与低胎龄低出生体重的新生儿救治率更高有关,长期中心静脉置管是院内CoNS 感染的危险因素[15]。在发展中国家,新生儿院内感染以G-菌为主可能与长时间广谱抗生素治疗、未注意手卫生和缺乏必要的消毒设备等相关[16‐17]。手部卫生和无菌操作对于减少院内感染至关重要,长期住院的新生儿由于发育不完全,需要进行较多的侵入性操作,未严格遵循无菌操作和注意手卫生容易引起医院内交叉感染[18]。必要消毒设备的缺乏使得附着在设备和器械上的定植菌无法清除,从而导致院内感染。因此降低院内感染风险需要注意病房内消毒,防止环境中的病原菌导致新生儿感染;重视无菌操作和尽量避免不必要的侵入性操作,密切关注患儿状态以减少呼吸机和气管插管的使用时间;做好正确的新生儿清洁和护理,避免皮肤和环境病原体感染。
本研究发现WBC<5×109/L 以及更高的CRP和PCT水平是G-菌感染的影响因素。WBC、CRP和PCT是目前常用的炎症指标,既往研究表明G-菌主要通过脂多糖与Toll样受体4结合,从而介导病原体相关分子模式,而G+菌主要通过磷壁酸与Toll样受体2 结合继而产生免疫学反应,虽然两种受体最终引起相同的转录因子变化,但G-菌感染往往引起更高的炎症因子水平[19‐21]。WBC<5×109/L是目前国内指南中用于诊断新生儿败血症的标准之一,且指南表示WBC 降低比增高更有意义[1]。本研究中G-菌感染引起WBC降低的比例高于G+菌感染,WBC降低往往更能反映疾病的严重程度[22]。Guo等[23]报道了G-菌感染导致WBC降低的比例高于G+菌感染,与本研究相符,WBC在严重感染时降低可能与免疫力降低和骨髓作用受到抑制有关[24],但是目前有关WBC 降低在鉴别不同革兰细菌所致新生儿败血症的研究较少,需要进一步探索。本研究中CRP 水平在G-菌感染患儿中显著高于G+菌感染患儿,与既往报道相符[5]。但是在成人感染研究中CRP水平在不同革兰细菌感染中似乎差别不大[25],在不同年龄段的研究差异考虑可能是由于CRP 水平不仅受到炎症影响,还与机体应激、肿瘤等具有相关性。早在2013年Brodská等[26]就报道了PCT对于不同类型病原体的鉴别能力,本研究中更高的PCT水平是提示G-菌感染的影响因素。目前国内针对新生儿败血症中PCT对不同类型病原体的鉴别报道较少,在败血症儿童中,PCT 被证明具有良好的鉴别价值[27]。但一项2018年发布的研究认为PCT水平差异不能用于区分G-菌和G+感染,该研究认为PCT 水平主要取决于具体的病原菌种类和不同的感染起始部位[28],因此针对PCT在不同病原菌中的鉴别价值仍需要更多研究。
本研究从患儿基本情况、临床表现和实验室检查多个角度对G-菌和G+菌感染进行了对比,整体评估较为完整,发现了联合院内感染、WBC<5×109/L、CRP和PCT对判断G-菌感染具有较高的预测价值。由于临床工作中血培养阳性率低,利用患儿临床相关信息早期预测G-菌感染,在临床工作中对于抗生素的选择具有指导意义,有助于改善患儿的治疗效果和预后,同时减少耐药菌的产生。但本研究具有一些局限性,首先这是一项单中心临床研究,同时回顾性研究的性质可能导致偏倚。未来需要多中心大样本量的前瞻性临床试验来验证上述影响因素对新生儿G-菌感染所致败血症的鉴别价值。
本中心新生儿败血症患儿的病原菌主要以CoNS 和肺炎克雷伯菌为主,G-菌感染在2018—2022 年间占比呈上升趋势;院内感染、WBC<5×109/L和更高的CRP、PCT水平是G-菌感染的影响因素。联合院内感染、WBC <5×109/L、CRP和PCT对G-菌感染具有较高的鉴别价值。

