胰岛素生产工艺及车间设计
王小明,程翔
(中国医药集团联合工程有限公司,武汉 430077)
1 胰岛素发展概述
胰岛素是由胰脏内的胰岛β细胞受内源性或外源性物质如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等的刺激而分泌的一种蛋白质激素。胰岛素是机体内唯一降低血糖的激素,同时促进糖原、脂肪、蛋白质合成。外源性胰岛素主要用来治疗糖尿病。胰岛素自发现、应用以来,已走过百年征程。
20 世纪20 年代至60 年代,从动物胰腺中提取胰岛素被广泛开发,开启了动物源第一代胰岛素。因为动物胰岛素的生物结构与人胰岛素存在一定的差别,注射体内后可能产生免疫反应,使得胰岛素的降糖功效下降,还有少数患者出现皮肤过敏等[1]。
20 世纪80 年代,丹麦知名制药企业诺和诺德公司率先实现了通过基因工程技术规模化生产人胰岛素,标志着第二代胰岛素(重组人胰岛素)时代的到来。重组人胰岛素的结构与人胰岛素完全相同,注射后全身免疫反应和局部过敏反应的发生率较动物胰岛素显著减少,且降糖效率提高,是目前常用的皮下注射胰岛素[1]。
20 世纪末至21 世纪初,利用基因工程技术通过对胰岛素结构的修饰或改变其理化性质,使其更符合生理需要的胰岛素被广发开发。开启了第三代胰岛素即胰岛素类似物的发展。临床广泛应用的胰岛素类似物有赖脯胰岛素、甘精胰岛素、门冬胰岛素、地特胰岛素、德古胰岛素等。
2 重组胰岛素的蛋白质表达系统
利用基因工程技术规模化生产胰岛素或胰岛素类似物,首先要选择合适的蛋白质表达系统。目前被广泛应用于大规模生产的蛋白质表达系统主要有两种:大肠杆菌表达系统和毕赤酵母表达系统。
2.1 大肠杆菌表达系统
长期以来,大肠杆菌被用来作为宿主表达了多种蛋白,这是因为大肠杆菌具有若干优点,如遗传背景和生化特性清楚、容易操作、生长迅速、营养需求简单等。不过大肠杆菌表达系统也有若干缺点,如缺少蛋白翻译后修饰和加工、表达蛋白以包涵体的形式存在,需要经过复杂的复性才能恢复构象和活性,纯化过程复杂、表达量不高等[2]。
近几年来,大肠杆菌表达系统在不断的创新与优化,一些新型表达纯化系统如IMPACT-TWIN[3]的出现,提供了一步亲和纯化重组蛋白的方法。该系统利用自含肽自剪切的原理减少了后续的纯化步骤,使得纯化方法更简便。目前,已有制药企业采用自主研发的创新型大肠杆菌表达系统生产新一代超长效胰高糖素样肽类似物—司美格鲁肽。
2.2 毕赤酵母表达系统
毕赤酵母表达系统是一种表达外源蛋白的真核表达系统。它既具有原核表达系统繁殖快、操作简单的优点,同时又能对表达的目的蛋白进行正确加工、折叠及适度糖基化[4]。而且该系统分泌表达的杂质蛋白较少,易于进行分离纯化,因此越来越广泛的应用于重组蛋白的表达。但毕赤酵母表达不同的外源蛋白的表达水平相差很大,再者发酵周期长,易污染、利用易燃的甲醇作为诱导物,表达产物的卫生安全性需要考虑。
在毕赤酵母表达系统中,不同目的蛋白的表达条件各不相同,因此研究者门常常需要通过优化表达条件来提高目的蛋白的表达量。国内已有多家制药企业使用毕赤酵母表达系统生产超长效胰岛素—德古胰岛素。
3 胰岛素原料药生产工艺
利用基因工程和蛋白质工程技术制备胰岛素原料药(不包括制剂工艺),可概括为基因重组、蛋白表达和分离纯化三大过程。具体来说包含以下步骤:
(1)从人类的DNA 中提取胰岛素基因,使用限制性内切酶将目的基因从原DNA 中分离出来;
(2)从毕赤酵母(或大肠杆菌)的细胞质中提取质粒,质粒为环状DNA;
(3)先利用同种限制性内切酶将质粒切开,再使用DNA 连接酶将目的基因与质粒“缝合”,重组成一个能表达胰岛素的DNA 质粒;
(4)将重组后的质粒植入毕赤酵母细胞(或大肠杆菌);
(5)从菌种库中取出基因重组后的菌种进行复苏和扩增;
(6)在种子罐中进一步扩大培养,对数生长期时转入发酵罐培养;
(7)对发酵液进行固液分离,回收目标蛋白;
(8)通过多步层析法,配合酶切洗涤修饰等工艺过程纯化目标蛋白,纯化工艺过程中需添加甲类试 剂。
(9)对产品进行冻干和包装。
图1 以毕赤酵母表达系统为例,展示了胰岛素原料药生产的主要工艺过程及其常用洁净级别。事实上,无论是何种表达系统,其基因重组的过程是类似的,区别在于发酵液的分离纯化工艺不同。
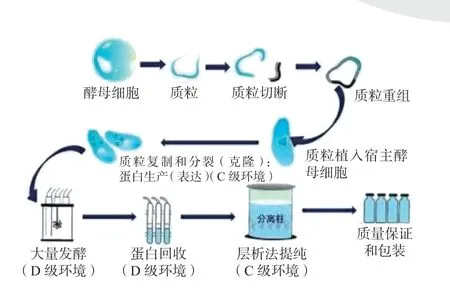
图1 胰岛素原料药生产工艺简图Fig.1 Schematic diagram of the process of insulin API
对毕赤酵母表达系统,目标蛋白存在于发酵液上清液中,离心实现固液分离,收取上清液,进行后续的提纯。层析过程需要使用大量的缓冲液,其中部分层析过程会使用到甲类试剂,缓冲液及甲类试剂的种类和数量根据目标蛋白的不同而不同。
对大肠杆菌表达系统,目标蛋白存在于包涵体内,分离工艺更为复杂。首先需要离心收取包涵体,然后对包涵体进行破碎、均质、洗涤溶解,才能获得包含目标蛋白的液体,进行下一步的纯化。纯化过程同样需要大量的缓冲液和部分甲类试剂。
4 胰岛素原料药生产车间设计
大规模生产胰岛素原料药,重点在于控制发酵培养和分离纯化工艺。胰岛素原料药生产车间的设计,包含从种子扩增至纯化冻干的工艺及其过程中所需要的缓冲液和辅助系统的设计。
胰岛素原料药属于非无菌原料药,《药品生产质量管理规范》(2010 年修订)附录2 第二章第三条规定“非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应当按照D 级洁净区的要求设置[5]”。可见,GMP 对于与非无菌原料药直接接触的工艺过程最低要求为D 级洁净区。然而,由于胰岛素产品本质属于生物制品,最终的胰岛素注射剂属于无菌制剂,根据《药品生产质量管理规范》(2010 年修订)附录1 第十三条C 级洁净区的操作示例“灌装前可除菌过滤的药液或产品的配制[5]”,胰岛素注射剂灌装前的过滤和配制过程应设计在C级洁净环境。因此,根据经验,为了保障胰岛素原料药产品质量,精纯工艺通常设计在C 级洁净区。
4.1 工艺功能间设计
平面方案布局时,功能间的设计要综合考虑工艺流程、防爆需求、设备操作习惯及参观需求。通常按照工艺过程的先后顺序确定功能间的位置关系,例如采用直线型布局或者环形布局。同时要确保防爆间有足够大的卸爆面积。顶层防爆间可以采用顶卸爆的方式,非顶层防爆间通常采用侧卸爆的方式,因此非顶层甲类房间一般靠外墙布置。
根据已知的胰岛素原料药生产工艺,简要介绍各大功能间的作用和设计要求。
(1)种子库
使用超低温冰箱或液氮罐,储存生产菌种,以备放大培养。种子库设计在控制区,且靠近种子扩增间布置为宜。
(2)种子扩增间
在生物安全柜内,对从种子库中取出的菌种进行复苏,然后利用摇床培养实现种子扩增。种子扩增是实现放大生产的关键步骤,根据经验通常设计为C级洁净环境。
(3)发酵间
通过种子罐—发酵罐逐级放大培养。培养过程中需要添加多种培养基,因此发酵系统通常配有补料罐。背景环境为D 级。
发酵间排水应作为生物废水进行收集灭活处理。发酵尾气含有二氧化碳、氮气和挥发性氨气,需要经过尾气吸收装置处理。
(4)离心收获间。
与发酵间共用一个D 级区域,使用蝶式离心机对发酵液进行固液分离。排水应作为生物废水进行收集灭活处理。
如果是酵母发酵,那么离心收取上清液;如果使用大肠杆菌发酵,那么离心收取的是下层包涵体,还需利用均质机对包涵体进行多次破碎均质,并经过洗涤溶解才能收取含目标蛋白的溶液。
(5)酶切反应间
酶切是将胰蛋白酶或其他酶制剂加入到胰岛素前体溶液进行酶切转化反应,以恢复人胰岛素分子结构和活性。大肠杆菌表达的人胰岛素表现为单链或胰岛素原,因为形成包涵体,发酵后会变性和重折叠[6]。因此,对于大肠杆菌表达系统,酶切过程通常在层析之前进行,与收获间共用D 级区域。
酵母能够表达胰岛素单体或是二聚体,通过二硫键的正确配对形成正确折叠的产物,后经过酶切转化成人胰岛素[6]。例如,利用巴斯德毕赤酵母表达系统获得的胰岛素原和胰岛素类似物在纯化后需要经过酶切去除C 肽,方能成为有功能的胰岛素[6]。因此,对于毕赤酵母表达系统,酶切通常于第一步层析之后进行,在平面布局中,酶切间则位于下游纯化区域。
(6)纯化间
胰岛素的纯化工艺复杂,通常需进行三到四步层析和其他的沉淀洗涤修饰过程。根据具体工艺工程,可分为粗纯和精纯两个区域。粗纯区的背景环境为D 级,精纯区的背景环境通常为C 级。
不同胰岛素产品的纯化过程可能不同,同一产品的不同生产厂家工艺也不一定相同。但是,根据已有的项目经验,无论是哪一种产品工艺,胰岛素的纯化过程中都需要使用大量甲类试剂,对防爆区面积有较大的需求,设计不但要满足规范对防爆面积的要求,还要满足工艺需求。因此,纯化间的数量和设计,需要具体情况具体分析。
以某企业胰岛素类似物生产车间为例,业主提供的纯化过程包含四步层析以及修饰缩合工艺,如图2 所示。本车间属丙类厂房,共两层,单层建筑面积5 200 m2,根据工艺过程和设备布置情况,防爆区面积需求约700 m2,远超出规范要求。
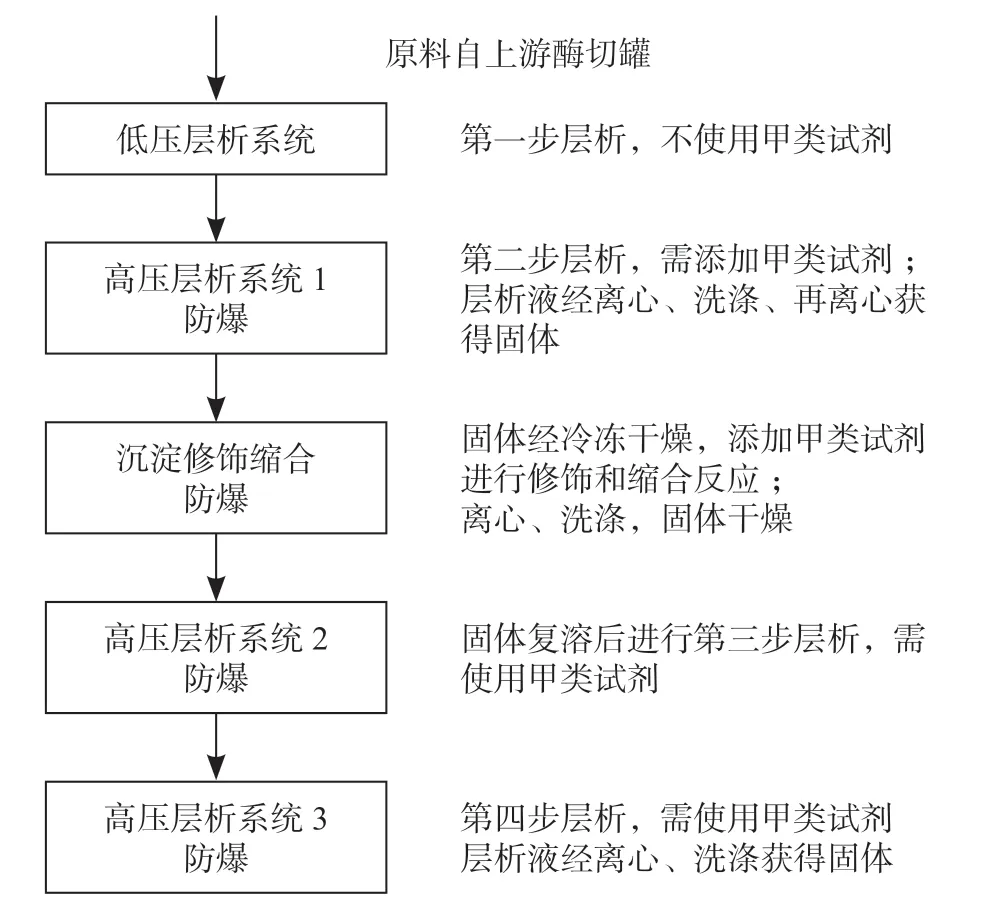
图2 某胰岛素类似物纯化工艺Fig.2 The purification process of an insulin analogue
通过与业主深入讨论工艺过程,得知高压层析出料中甲类试剂含量极低无需防爆,且后续的离心洗涤过程不涉及甲类试剂,因此我们将高压层析与离心过程分设在两个功能间,以减少防爆区面积,离心洗涤间位于非防爆区。同时将第三、四步层析过程合并在同一个功能间内以节省面积。
因此,最终的纯化过程共设计为低压层析间、防爆高压层析间一、离心洗涤间、防爆修饰缩合间、防爆高压层析间二、离心间等六个功能间,图3 显示了改造之后的工艺步骤,修饰缩合及其后续工艺定义为精纯。防爆间分设在两层,每层防爆区控制在250 m2,满足工艺需求和规范要求。
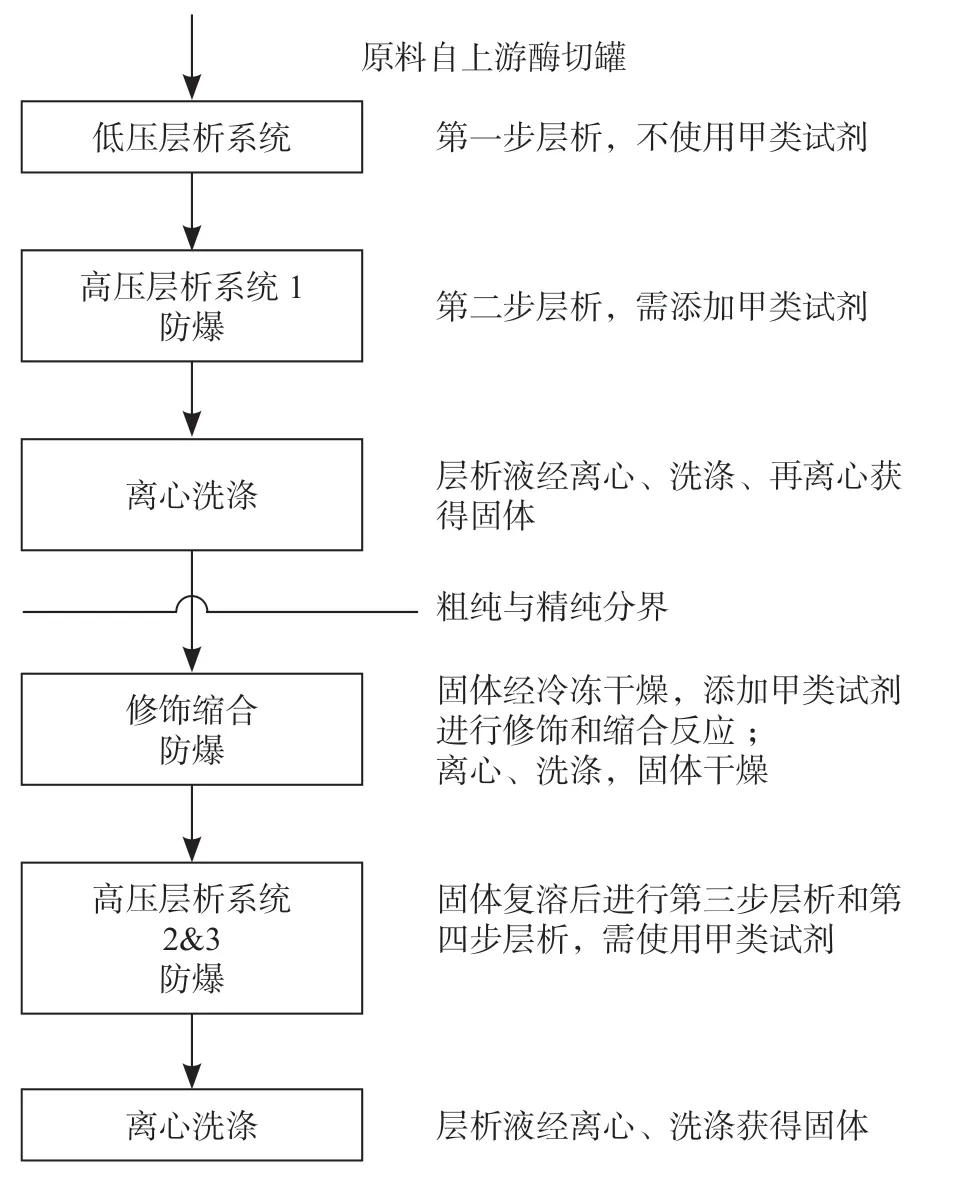
图3 改造后的纯化工艺步骤Fig.3 The reorganizing purification process
(7)冻干间
纯化后收获的固体产物,添加注射用水溶解后,进冻干机冻干得成品原料药。溶解及装载过程位于C级区,冻干机置于非洁净区的冻干机房。
(8)分装间
冻干后的产品进行粉碎、分装,为保护人员与产品,建议粉碎及分装过程在隔离器中进行。同时分装间最好有气锁保护。
4.2 辅助功能间设计
胰岛素原料药生产车间涉及的辅助功能间包括:培养基配制、缓冲液配制、缓冲液暂存、器具清洗灭菌、工衣清洗灭菌、废弃物灭活、CIP 工作站、物料暂存等。
(1)培养基配制间
为上游发酵准备培养基,通常紧邻发酵间布置,也可以与发酵间共用一个D 级走廊。
(2)缓冲液配制&暂存间
为纯化工艺过程配制缓冲液,通常单独设计一个缓冲液配制区,靠近使用点,与纯化区洁净级别相同。因缓冲液种类多、用量大,配制罐和暂存罐较多,通常设计为两个贴邻的房间,即缓冲液配制间和缓冲液暂存间。缓冲液暂存间设计在非洁净区。
甲类试剂的配制需要设计独立的防爆配液间,防爆配液暂存间应贴邻防爆纯化间设计,避免甲类物料管道穿越非防爆区。缓冲液配制区布局如图4 所示。其中红色范围为防爆区。
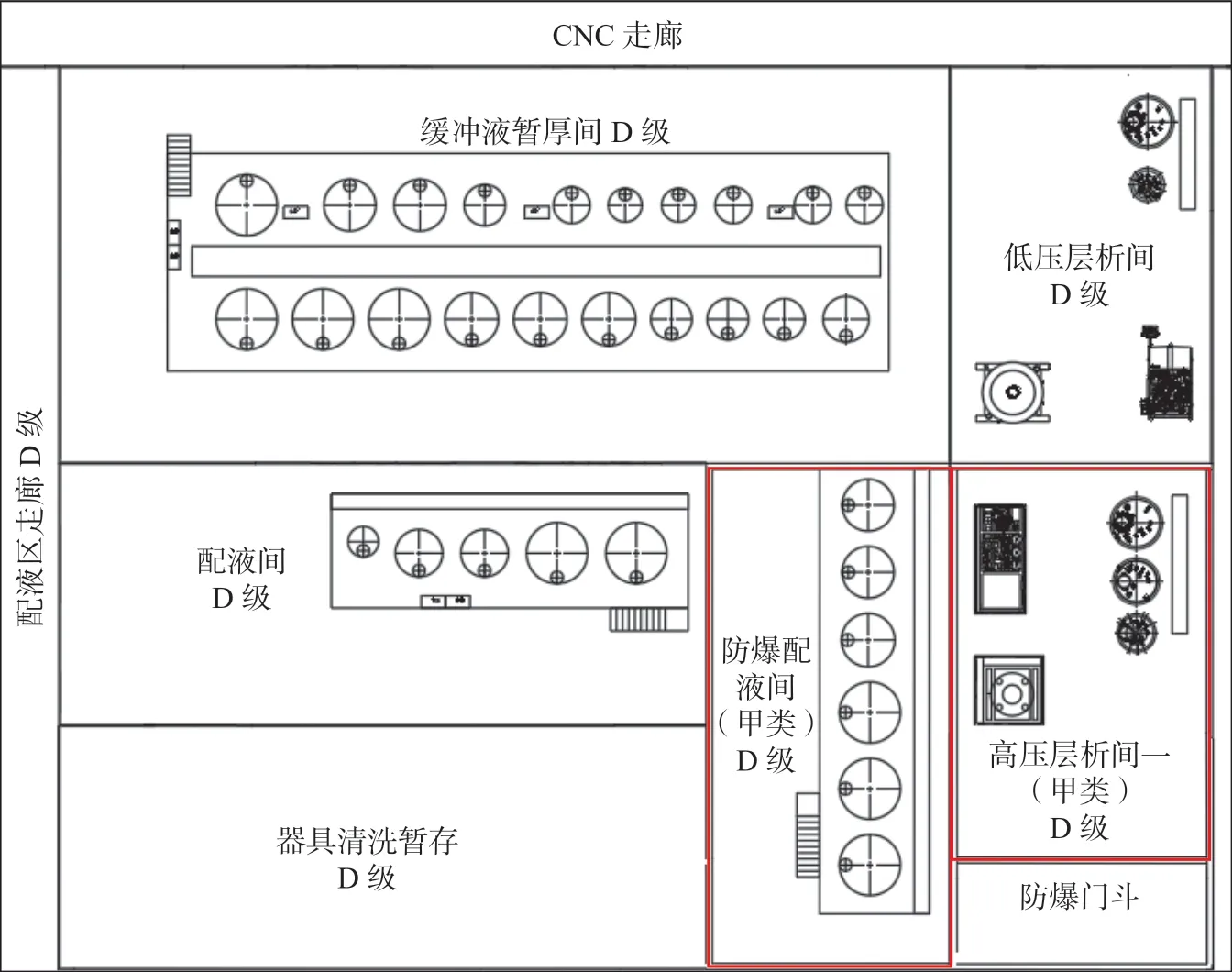
图4 缓冲液配制区布置示意图Fig.4 The layout diagram of a buffer preparation area
(3)其他辅助功能间
洁净区域内应设计配套的器具清洗间、灭菌间。工衣清洗灭菌可设计统一的洗衣中心。上游发酵区域废弃物含有或粘有生物活性物质,需要设计灭活退出 间。
4.3 公用工程设计
医药厂房设计通常涉及以下公用工程房间:空调机房、冷冻站、空压站、变配电室、发电机房、制水间、生物废水灭活、蒸汽减压、冷凝水回收、气瓶间等。根据项目厂区情况和产品工艺需求的不同,当前生产车间需要设计的公用工程房间种类和数量也不尽相同。对于胰岛素生产车间,重点说明以下几点:
(1)非顶层的空调机房建议靠外墙布置,以便于空调系统取风。顶层空调机房可设置在使用区域上方。由于胰岛素的生产过程中需要使用甲类试剂,车间包含防爆区,因此建议为防爆区设计单独的防爆空调机房。
(2)胰岛素的分离纯化过程中,除了对离心机、换热器等设备进行换热降温之外,还通常需要对中间品控温至2~ 8°C 甚至更低,因此需要为其设计冷冻水系统和乙二醇系统。另外,通常冻干机设备对进水温度的要求比较苛刻,如果已有冷冻水和乙二醇系统不能满足其要求,则需要为冻干机单独设计一套冷却循环水系统。因此,如果厂区内没有统一的动力中心,那么则需要在胰岛素原料药生产车间内设计冷冻站。
(3)无论使用大肠杆菌还是毕赤酵母表达蛋白,其发酵培养过程中均需使用大量的洁净压缩空气,有些生产工艺还要消耗氧气。另外,防爆区配液罐和工艺罐必须使用氮气密封。所以,胰岛素原料药的生产需配备压缩空气制备系统、氮气制备系统和氧气制备系统(如需要)。空压站可能在厂区的动力中心或者生产车间内。
(4)上游工艺过程排水含有活性生物,需收集灭活后方可排放。如果胰岛素原料药生产车间分多层布置,建议将发酵工艺置于二层及以上,生物废水收集灭活装置设计在一层,便于楼上的生物废水利用重力作用自流进入废水收集罐,然后泵至灭活罐。如果车间只有一层,那么生物废水收集罐需要设计为埋地暂存罐,或者置于局部地下室中。
4.4 全车间布局示意图
车间二层、一层布局示意图见图5~ 6。

图5 车间二层布局示意图Fig.5 The layout diagram of the second floor

图6 车间一层布局示意图Fig.6 The layout diagram of the first floor
5 结束语
利用基因工程技术生产胰岛素或胰岛素类似物,是目前市场上的主流工艺。其中,大肠杆菌和毕赤酵母蛋白质表达系统的应用最为广泛。在进行胰岛素原料药车间的设计时,首先要明确生产使用的是何种蛋白质表达系统,因为不同表达系统的分离工艺大不相同。其次,应与业主进行充分的沟通,根据其生产工艺特点,确定工艺功能间的数量和空气洁净度级别,重点关注防爆功能间的设计。最后,完善辅助功能间和公用工程系统设计,保障工艺需求。

