基于两样本孟德尔随机化探究甲状腺功能减退症与膝骨关节炎的因果关系
徐小东 王配婕 谢文鹏 李琦 傅永升 王卫国

【摘 要】目的:通过两样本孟德尔随机化方法研究甲状腺功能减退症与膝骨关节炎发病风险的因果关系。方法:获取甲状腺功能减退症和膝骨关节炎的全基因组关联研究(GWAS)数据并进行汇总,两者的数据均来自欧洲人群;将单核苷酸多态性(SNP)作为工具变量(IVs)并选择敏感的SNPs进行分析,通过逆方差加权法(IVW)、加权中位数法(WME)、MR-Egger回归法进行两样本孟德尔随机化分析,将OR值作为标准评估甲状腺功能减退症与膝骨关节炎发病风险的因果关系,通过异质性和多效性检验对得到的结果进行验证。结果:共纳入27个SNPs位点作为IVs,IVW法的OR = 4.737,95%CI = [1.038,20.524],P = 0.038,表明甲状腺功能减退症和膝骨关节炎之间有因果关系。MR-Egger回归方程截距项为0.001 5(P = 0.775),表明该结果不受基因多效性的影响。结论:甲状腺功能减退症与膝骨关节炎存在因果关系,且膝骨关节炎的发病风险随着甲状腺功能减退症发病风险增加而增加。
【关键词】 膝骨关节炎;甲状腺功能减退症;孟德尔随机化研究;全基因组关联分析;工具变量;单核苷酸多态性;因果关系
Exploring the Causal Relationship Between Hypothyroidism and Knee Osteoarthritis Based on a Two Sample
Mendelian Randomization Method
XU Xiao-dong,WANG Pei-jie,XIE Wen-peng,LI Qi,FU Yong-sheng,WANG Wei-guo
【ABSTRACT】Objective:To investigate the causal relationship between hypothyroidism and the risk of knee osteoarthritis using a two sample Mendelian randomization method.Methods:Genome Wide Association Study(GWAS)data on hypothyroidism and knee osteoarthritis were obtained and summarized,both of which were from the European population.Single Nucleotide Polymorphisms(SNPs)were used as instrumental variables(IVs)and sensitive SNPs were selected for analysis.Two sample Mendelian randomization analysis was performed using inverse variance weighting(IVW),weighted median(WME),and MR Egger regression.OR values were used as criteria to evaluate the causal relationship between hypothyroidism and the risk of knee osteoarthritis.The results were validated through heterogeneity and pleiotropy tests.Results:A total of
27 SNPs loci were included as IVs,with an OR = 4.737,95%CI =[1.038,20.524]and P = 0.038 for the IVW method,indicating a causal relationship between hypothyroidism and knee osteoarthritis.The intercept term of the MR-Egger regression equation was 0.001 5(P = 0.775),indicating that the result is not affected by gene pleiotropy.Conclusion:There is a causal relationship between hypothyroidism and knee osteoarthritis,and the risk of knee osteoarthritis increases as the risk of hypothyroidism increases.
【Keywords】 knee osteoarthritis;hypothyroidism;mendelian randomization research;whole genome association analysis;instrumental variables;single nucleotide polymorphism;causal relationship
膝骨關节炎(knee osteoarthritis,KOA)使患者生活质量下降,社会活动参与能力下降。在我国,本病的发病率随着年龄的增长而显著增加,并且女性发病率大于男性[1]。在所有膝关节疼痛的人群中,KOA患病率接近70%,近25%的KOA患者会遭受严重膝关节疼痛的折磨[2-3]。
甲状腺功能减退症是比较常见的甲状腺功能障碍疾病,女性比男性患病率更高[4]。有研究揭示甲状腺功能障碍疾病影响某些骨科疾病的发
生[5-8],抗甲状腺过氧化物酶抗体指标较高的患者膝关节软骨钙化程度更高[9],有更大的概率患KOA。除KOA外,甲状腺功能异常对骨质疏松症等其他退行性骨关节疾病存在影响[10-12]。
全基因组关联分析(GWAS)将人类基因组中的单核苷酸多态性(SNP)作为分子遗传标记物,进行全基因组水平上的对照分析或相关性分析,通过比较发现影响复杂性状的基因变异。孟德尔随机化(MR)[13]使用GWAS数据分析不同暴露和结果之间的因果关系,所以基因和疾病之间的关联不会受到环境等常见混杂因素的干扰,使效应估计值更接近真实情况。MR分析有效克服了传统随机对照研究的局限性,是分析甲状腺功能减退症与KOA之间因果关系的可行方法。本研究进行两样本MR分析,使用GWAS探索甲状腺功能减退症与KOA之间的因果关系。
1 资料與方法
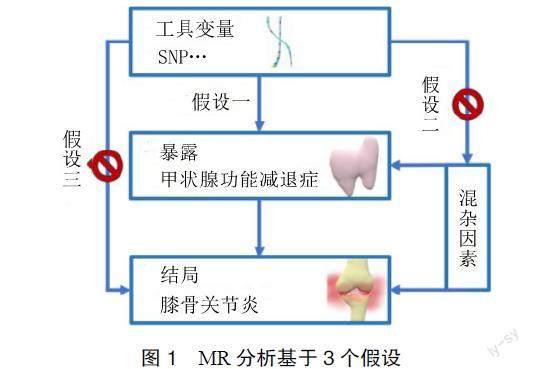
1.1 研究设计 本研究使用两样本MR分析甲状腺功能减退症与KOA的因果关系,将甲状腺功能减退症作为暴露因素,利用与甲状腺功能减退症相关的SNPs作为工具变量(IVs),将KOA作为结局变量,分别进行异质性检验、多效性分析、留一法分析,以确保结果的可靠性。MR分析主要基于3个假设(见图1)[14]:IVs与暴露之间有很强的相关性,所选的IVs与混杂因素相互独立,IVs只能通过暴露影响结局(无水平多效性)。在本研究中,即甲状腺功能减退症相关的SNPs与KOA之间相关性强,与混杂因素相互独立,且只能通过甲状腺功能减退症影响KOA的发生。
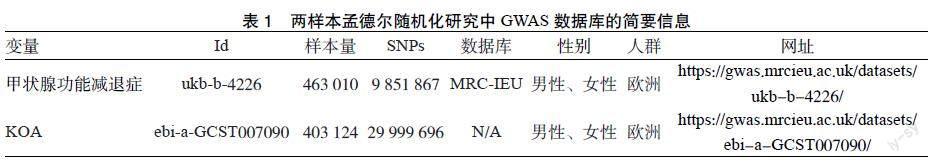
1.2 资料来源 通过IEU Open GWAS项目(https://gwas.mrcieu.ac.uk/)搜索获得甲状腺功能减退症和KOA的GWAS数据[15]。甲状腺功能减退症的数据来源于英国布里斯托尔大学的MRC综合流行病学研究所的IEU GWAS数据库,共包含463 010个样本量,有9 851 867个SNPs;KOA数据由Tachmazidou I为作者收集,包含403 124个样本量,有29 999 696个SNPs。以上数据均来自欧洲人群,见表1。
1.3 工具变量 为了选择满足MR 3个假设的SNPs,参照千人全基因组,执行如下操作。筛选与甲状腺功能减退症差异有统计学意义(P < 0.05)的SNPs,为了排除SNPs之间的连锁不平衡(LD),对基因组数据进行处理,将R2阈值定为0.001,千碱基对设置为10 000 kb。为了消除工具变量之间的水平多效性,使用工具[16-17](http://www.phosanner.medschl.cam.ac.uk/)查找受SNPs强影响的表型,并且剔除与结局相关的SNPs。得到与甲状腺功能减退症明显相关的有效SNPs作为IVs。
1.4 MR分析 本研究中的双样本MR数据分析基于R软件中的TwoSampleMR程序包。首先使用逆方差加权[18](IVW)作为主要方法初步评估甲状腺功能减退症与KOA之间的因果关系,这个方法的可靠性取决于IVs的多效性。此外,还选择了MR-Egger回归和加权中位数(WME)作为补充方法[19-20],如果所有纳入的SNP都符合有效的IVs假设,那么IVW可以被认为是最可靠的结果[21]。所有结果均以OR值和95%置信区间(95%CI)表
示,暴露与结果表型之间的相关性被认为差异有统计学意义(P < 0.05)。统计强度F值设定为 > 10,计算公式为F = β2exposure = SE2exposure[22]。
1.5 敏感性分析 MR结果需要利用敏感性分析检测结论是否稳健。由于两样本MR的暴露和结局分别来自不同的样本,可能存在人群不同等异质性,因此需要通过异质性检验说明。异质性检验目的是检验每一个IVs之间有无差异,不同IVs之间的差异越大代表这些IVs的异质性就大,P > 0.05表示不存在异质性;多效性检验[23]主要用于检验纳入研究的IVs之间是否存在水平多效性,常用MR-Egger法的截距项表示,如果该值无限接近于0,说明选择的IVs之间不存在水平多效性;逐个剔除检验法[24]是指每次分析剔除一个IVs,计算剩余IVs的MR结果,观察效应值是否发生较大改变,从而估计单个SNP对因果关联的影响。如果剔除某个IV后,其他IVs估计出来的MR结果和总结果差异很大,说明MR结果对该IVs敏感。
2 结 果
2.1 工具变量 经过筛选之后,排除有连锁不平衡的IVs,被选为与甲状腺功能减退有效IVs的SNPs为27个,见表2。所有用作IVs的SNP的F值均> 10(30.418~290.893),表明本研究所包括的IVs均有效,受到弱工具变量偏倚影响较小。
2.2 甲状腺功能减退症与KOA的MR分析 使用IVW法、MR-Egger法和WME法评估甲状腺功能减退症和KOA风险之间是否存在因果关系。根据IVW结果,研究发现甲状腺功能减退症与KOA呈正相关,甲状腺功能减退症可增加KOA的风险(OR = 4.737,95%CI = [1.038,20.524],P = 0.038),见表3、图2;MR-Egger法和加权中位数法比较,差异无统计学意义(P > 0.05)。但3种方法得到的效应方向均为甲状腺功能减退症可增加KOA的发病风险,见图3。
2.3 敏感性分析 异质性检验分别采用IVW法的q检验,P = 0.828 ﹥ 0.05,表示SNPs之间不存在异质性。多效性分析MR-Egger的egger_intercept截距项为0.001 5,无限接近于0,P = 0.775 ﹥ 0.05,表示不存在多效性。漏斗图显示纳入的所有SNPs基本对称,代表因果关联的点对称分布,说明IVs之间差异较小,表明因果关联受到潜在偏倚影响的可能性较小,见图4。敏感性分析采用留一法逐一排除各SNPs后,未发现对因果关联估计值影响较大的SNPs,见图5。
3 讨 论
KOA主要特征是膝关节软骨丢失,软骨下骨改变,滑膜炎症以及半月板变性[25],影像学表现为关节间隙变窄,边缘骨赘形成。本病可导致膝关节疼痛、晨僵、肿胀、僵硬、畸形。
研究发现,甲状腺功能减退症与各种运动系统疾病存在某些联系,甲状腺癌可引起局部性肌张力障碍,在甲状腺功能减退症患者服用安定类药物后,药物可导致运动障碍[26-27]。有学者发现,甲状腺激素的异常信号转导可以增加骨关节炎和其他退行性骨关节疾病的发病风险[11-12]。研究表明,膝关节周围软骨内甲状腺激素受体表达情况与KOA有较大的联系[28]。在增生的骨赘中,尤其是软骨内的成骨部位广泛分布着甲状腺α1、变异型甲状腺α2、甲状腺β1和甲状腺β2的mRNA基因。在骨改建部位,超过90%的成骨细胞表达甲状腺α1基因,约75%的細胞表达变异型甲状腺α2基因和甲状腺β1基因。甲状腺受体基因的表达在关节骨赘和破骨细胞中的分布与其受体蛋白的表达相似;但甲状腺受体基因在破骨细胞和软骨细胞中高表达,与其受体蛋白的表达相反。在KOA患者的膝关节软骨组织中,脱碘酶的存在可以调节局部甲状腺激素水平,该化合物可以降低关节软骨周围甲状腺激素的浓度[29]。
大量实验研究证明,骨骼对甲状腺激素敏感,甲状腺激素在骨和关节软骨中的生物学作用也越来越受到人们的关注。但是,甲状腺功能减退症与KOA之间正向因果关系背后的具体生物学机制仍不清楚。既往研究发现,甲状腺激素是骨代谢的重要调节剂,对骨重塑至关重要,甲状腺激素分泌不足或过量都可能导致骨代谢紊乱[11,30]。
本文采用双样本MR研究甲状腺功能减退症与KOA之间的因果关系,证明甲状腺功能减退症与KOA之间存在正向因果关系。甲状腺功能减退症会增加患KOA的风险。本研究为预测甲状腺功能减退症患者KOA的发生、早期预防和延缓病情进展提供了建议,但是,研究结果还需要通过基础实验进一步证实。
参考文献
[1] TANG X,WANG S,ZHAN S,et al.The prevalence of symptomatic knee osteoarthritis in China:results from the China health and retirement longitudinal study[J].Arthritis Rheumatol,2016,68(3):648-653.
[2] MICKLE AM,DOMENICO LH,TANNER JJ,et al.
Elucidating factors contributing to disparities in pain-related experiences among adults with or at risk for knee osteoarthritis[J].Front Pain Res,2023,22(4):1058476-1058483.
[3] BARBOUR KE,BORING M,HELMICK CG,et al.Prevalence of severe joint pain among adults with doctor-diagnosed arthritis-united states,2002—2014[J].MMWR Morb Mortal Wkly Rep,2016,65(39):1052-1056.
[4] SCHNEIDER SA,TSCHAIDSE L,REISCH N.Thyroid disorders and movement disorders-a systematic
review[J].Mov Disord Clin Pract,2023,10(3):
360-368.
[5] EK?I M?,ORHUN ?,DEMIR YN,et al.Are serum thyroid hormone,parathormone,calcium,and vitamin D levels associated with lumbar spine degeneration?
A cross-sectional observational clinical study[J].Eur Spine J,2023,32(5):1561-1574.
[6] DENG Y,HAN Y,GAO S,et al.The Physiological functions and polymorphisms of typeⅡ deiodinase[J].Endocrinol Metab,2023,38(2):190-202.
[7] SZULC M,?WI?TKOWSKA-STODULSKA R,PAW?OWSKA E,et al.Vitamin D3 metabolism and its role in temporomandibular joint osteoarthritis and autoimmune thyroid diseases[J].Int J Mol Sci,2023,24(4):4080-4100.
[8] NOH HM,PARK YS,LEE J,et al.A cross-sectional study to examine the correlation between serum TSH levels and the osteoporosis of the lumbar spine in healthy women with normal thyroid function[J].Osteoporosis Int,2015,26(3):997-1003.
[9] TAGOE CE,WANG W,WANG S,et al.Association of anti-thyroid antibodies with radiographic knee osteoarthritis and chondrocalcinosis:a NHANES Ⅲ study[J].Ther Adv Musculoskelet Dis,2021,13(4):199-208.
[10] WILLIAMS GR.Thyroid hormone actions in cartilage and bone[J].Eur Thyroid J,2013,2(1):3-13.
[11] BASSETT JHD,WILLIAMS GR.Role of thyroid hormones in skeletal development and bone mainten-
ance[J].Endocr Rev,2016,37(2):135-187.
[12] NEHLSV.Osteoarthropathies and myopathies associated with disorders of the thyroid endocrine system[J].Dtsch Med Wochenschr,2018,143(16):1174-1180.
[13] BIRNEY E.Mendelian randomization[J].Cold Spring Harb Perspect Med,2022,12(4):a041302-a041315.
[14] DAVIES NM,HOLMES MV,DAVEY SMITH G.Reading Mendelian randomisation studies:a guide,
glossary,and checklist for clinicians[J].BMJ,2018(362):k601-k608.
[15] TACHMAZIDOU I,HATZIKOTOULAS K,SOUTHAM L,et al.Identification of new therapeutic targets for osteoarthritis through genome-wide analyses of UK Biobank data[J].Nat Genet,2019,51(2):230-236.
[16] KAMAT MA,BLACKSHAW JA,YOUNG R,et al.PhenoScanner V2:an expanded tool for searching human genotype-phenotype associations[J].Bioinformatics,2019,35(22):4851-4853.
[17] STALEY JR,BLACKSHAW J,KAMAT MA,et al.PhenoScanner:a database of human genotype-phenotype associations[J].Bioinformatics,2016,32(20):3207-3209.
[18] LAWLOR DA,HARBORD RM,STERNE JAC,et al.
Mendelian randomization:using genes as instruments for making causal inferences in epidemiology[J].Stat Med,2008,27(8):1133-1163.
[19] BOWDEN J,DAVEY SMITH G,HAYCOCK PC,et al.
Consistent estimation in mendelian randomization with some invalid instruments using a weighted median estimator[J].Genet Epidemiol,2016,40(4):304-314.
[20] BOWDEN J,DEL GRECO MF,MINELLI C,et al.Assessing the suitability of summary data for two-sample Mendelian randomization analyses using MR-Egger regression:the role of the I2 statistic[J].Int J Epidemiol,2016,45(6):1961-1974.
[21] HARTWIG FP,DAVIES NM,HEMANI G,et al.
Two-sample Mendelian randomization:avoiding the down sides of a powerful,widely applicable but potentially fallible technique[J].Int J Epidemiol,2016,45(6):1717-1726.
[22] BURGESS S,THOMPSON SG,CRP CHD GENETICS COLLABORATION.Avoiding bias from weak instruments in Mendelian randomization studies[J].Int J Epidemiol,2011,40(3):755-764.
[23] BOWDEN J,DAVEY SMITH G,BURGESS S.Mendelian randomization with invalid instruments:effect estimation and bias detection through Egger regression[J].Int J Epidemiol,2015,44(2):512-525.
[24] GRONAU QF,WAGENMAKERS EJ.Limitations of bayesian leave-one-out cross-validation for model selection[J].Comput Brain Behav,2019,2(1):1-11.
[25] MADRY H,KON E,CONDELLO V,et al.Early osteoarthritis of the knee[J].Knee Surg Sports Traumatol Arthrosc,2016,24(6):1753-1762.
[26] JAMORA RDG,ESPIRITU AI,SANTIAGO JJ,et al.
Blepharospasm as the presenting feature of papillary thyroid cancer and parathyroid adenoma[J].J Clin Neurosci,2020,72(1):460-463.
[27] SANDYK R.Tardive dyskinesia induced by sulpiride in a patient with hypothyroidism[J].Clin Neuropharmacol,1986,9(1):100-101.
[28] ABU EO,HORNER A,TETI A,et al.The localization of thyroid hormone receptor mRNAs in human bone[J].Thyroid,2000,10(4):287-293.
[29] P?RINGS AS,LOWIN T,DUFNER B,et al.A thyroid hormone network exists in synovial fibroblasts of rheumatoid arthritis and osteoarthritis patients[J].Sci Rep,2019,9(1):13235-13248.
[30] TUCHENDLER D,BOLANOWSKI M.The influence of thyroid dysfunction on bone metabolism[J].Thyroid Res,2014,7(1):12-16.
收稿日期:2023-09-05;修回日期:2023-10-10