紫藤根及含紫藤根经验方的初步药效研究
罗健菱,胡家震,唐娟,邓斌,马彬焰,邰通芝,胡成刚
(贵州中医药大学,贵州贵阳,550025)
0 引言
紫藤药用历史悠久,始载《本草拾遗》。紫藤在贵州很多地区称藤萝,苗语为ghad hlet,紫藤根的苗语为ghad jongx ghad hlet[1];紫藤根具有祛风除湿、舒筋止痛等功效,一般用于风湿疼痛的治疗。《贵州草药》中记载,用紫藤根、苦皮藤、白金条各一两,泡酒服,可治疗风湿、劳伤、关节疼痛[2]。目前,对于苦皮藤和白金条的研究基础比较多[3-12],而紫藤根较少,因此,为了探索紫藤根在此含紫藤根经验方中是否贡献抗炎、镇痛的作用,本研究以小鼠棉球肉芽肿炎症模型为参考,研究紫藤根及含紫藤根经验方对慢性增生性炎症的药理作用,同时以小鼠扭体实验探索紫藤根及含紫藤根经验方的镇痛作用,以期为紫藤根及含紫藤根经验方临床应用的发展提供科学依据。
1 实验材料
1.1 实验动物
SPF 级昆明小鼠,雄性,体质量(20 ± 2)g,由长沙市天勤生物有限公司提供,实验动物生产许可证号:SCXK(湘)2019-0013。
1.2 实验试剂及材料
羧甲基纤维素钠、氯化钠均为分析纯;醋酸泼尼松片(浙江仙琚制药股份有限公司,批号:LA22275);阿司匹林肠溶片(北京海王中新药业股份有限公司,批号:220601);医用棉球;血细胞分析用稀释液(北京红星双北医疗器材有限公司);多酶清洁液(北京宝灵曼阳光科技有限公司);溶血剂(北京红星双北医疗器材有限公司)。
水为蒸馏水;醋酸(天津富宇精细化工有限公司,批号:20220107);一次性使用人体静脉血样采集容器(型号:EDTAK2;厂家:浏阳市三力医用科技发展有限公司)。
1.3 实验仪器
BM830 型全自动血细胞分析仪(北京宝灵曼阳光科技有限公司);JJ523BF 电子天平(常熟市双杰测试仪器厂);101-1AB 型干燥箱(天津市泰斯特仪器有限公司);LaboGene CoolSafe 55-4 真空冷冻干燥机(丹麦LaboGene)。
1.4 紫藤根及含紫藤根经验方的制备
称取紫藤根、苦皮藤、白金条各120 g,剪碎,打成粗粉,将三味药的粉末充分混合,加入10 倍量的60%食用乙醇溶液,浸泡隔夜,超声提取1 h,重复三次,合并滤液,减压浓缩至无醇味,再经过冷冻干燥即得(浸膏量44.8 g,得膏率12.44%);称取紫藤根30 g,剪碎,打成粗粉加入10 倍量的60%食用乙醇溶液,浸泡隔夜,超声提取1 h,重复三次,合并滤液,减压浓缩至无醇味,再经过冷冻干燥即得(浸膏量4.11 g,得膏率13.71%)。
2 方法与结果
2.1 实验方法
2.1.1分组及剂量
2.1.1.1药物不同剂量对于正常动物的血常规影响[13-16]
本次实验共计5 组,即空白组、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)。紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)的剂量分别为90.5 mg/kg、274.0 mg/kg、62.2 mg/kg、248.8 mg/kg(剂量参考《中华本草》和《贵州草药》,小鼠剂量按人的10 倍量计)。
2.1.1.2紫藤根及含紫藤根经验方对小鼠棉球肉芽肿实验
本次实验共计8 组,即空白组、模型组、阳性药物组(简称阳性组)、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方中剂量组(JM)、经验方高剂量组(JH)。阳性药物组、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方中剂量组(JM)、经验方高剂量组(JH)的剂量分别为7.0 mg/kg[17]、90.5 mg/kg、274.0 mg/kg、62.2 mg/kg、124.4 mg/kg、248.8 mg/kg(剂量参考《中华本草》和《贵州草药》,小鼠剂量按人的10 倍量计)。
2.1.1.3紫藤根及含紫藤根经验方对小鼠扭体实验
本次实验共计6 组,即空白组、阳性药物组、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)。阳性药物组、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)的剂量分别为200.0 mg/kg[18]、90.5 mg/kg、274.0 mg/kg、62.2 mg/kg、248.8 mg/kg(剂量参考《中华本草》和《贵州草药》,小鼠剂量按人的10 倍量计)。
2.1.2药物的配制
药物不同剂量对于正常动物的血常规影响:分别精密称取提取物冻干粉,酌加少量1.0%羧甲基纤维素钠溶液研磨溶解后,再加1.0%羧甲基纤维素钠溶液稀释配制成各组所需要浓度的混悬液。
紫藤根及含紫藤根经验方对小鼠棉球肉芽肿实验:同“2.1.1.2”方法制备受试药。将醋酸泼尼松片充分碾碎、酌加少量1.0%羧甲基纤维素钠溶液研磨溶解后,再加1.0%羧甲基纤维素钠溶液稀释配制成含醋酸泼尼松0.7 mg/mL 的混悬液,备用,为阳性对照药物。
紫藤根及含紫藤根经验方对小鼠扭体实验:同“2.1.1.2”方法制备受试药。实验前将阿司匹林片捣碎、酌加少量1.0%羧甲基纤维素钠溶液研磨溶解后,再加1.0%羧甲基纤维素钠溶液稀释配制成含阿司匹林20 mg/mL 的混悬液,为阳性对照药物。
2.1.3造模
动物适应性饲养3 天后,除空白组外,给小鼠颈背部皮下注射3%水合氯醛(0.15 mL/10g)麻醉,无菌条件下(在每只鼠的胸腔正中用碘酒消毒,75%酒精棉球脱碘后),在其胸腔正中剪出1 cm 小口,将精密称取10 mg 棉球分别植入左右腋下(皮下),用无菌手术线缝合伤口并涂以碘氟消毒。
2.1.4给药
药物不同剂量对于正常动物的血常规影响:动物分组,空白组给予1.0%羧甲基纤维素钠溶液(0.1 mL/10 g),其余各组均按配制的浓度给药,每日一次,连续给药14 天,取血,置于一次性使用人体静脉血样采集容器中,用全自动血细胞分析仪测定小鼠的血常规。
紫藤根及含紫藤根经验方对小鼠棉球肉芽肿实验:造模实验后第1 天开始,空白组与模型组均给予1.0%羧甲基纤维素钠溶液(0.1 mL/10 g),阳性药物组给予醋酸泼尼松7.0 g/kg,其余各组均按配制的浓度给药。连续给药14 天,每日一次,第14 天给药2 h 后,取血,置于一次性使用人体静脉血样采集容器中,用全自动血细胞分析仪测定小鼠的血常规,同时立即对棉球周围的结缔组织剥离,剔除棉球上多余的脂肪组织后,于烘箱中70℃干燥4 小时,冷却后精密称重棉球,减去原棉球净重,即得肉芽肿净重。
抑制率(%)=[(模型对照组肉芽质量均值-给药组肉芽质量均值)/模型对照组肉芽质量均值]×100%。
紫藤根及含紫藤根经验方对小鼠扭体实验:空白组给予1.0%羧甲基纤维素钠溶液(0.1 mL/10 g),阳性药物组给予含阿司匹林20 mg/mL 的混悬液,其余各组均按配制的浓度给药。连续给药10 天,每日一次,第10天给药2 h 后,每只小鼠根据体重(0.1 mL/10 g),腹腔注射0.6%冰醋酸溶液[19],注射后立即观察30 min,记录小鼠扭体次数(腹部内凹,伸展后肢,臀部抬高)。
镇痛率(%)=[(空白对照组扭体次数均值-给药组扭体次数均值)/空白对照组扭体次数均值]×100%。
2.1.5统计方法
紫藤根及含紫藤根经验方对小鼠棉球肉芽肿实验:实验所得数据以SPSS 26.0 统计软件进行统计分析,统计分析采用单因素方差分析,用于比较与模型组的差异,采用表示结果,p<0.05 表示有显著性差异。
紫藤根及含紫藤根经验方对小鼠扭体实验:实验所得数据以SPSS 26.0 统计软件进行统计分析,采用单因素方差分析,用于比较与空白组的差异,采用表示结果,p<0.05 表示有显著性差异。
2.2 实验结果
2.2.1药物不同剂量对于正常动物的血常规影响
血常规检测项目中白细胞数、淋巴细胞数、单核细胞数、粒细胞数结果见表1,图1;淋巴细胞百分比、单核细胞百分比、中性粒细胞百分比见表2,图2;平均红细胞体积、平均血红蛋白含量见表3,图3。由图可知,低剂量的紫藤根提取物有升高白细胞的作用;而经验方组中高剂量白细胞有所增高,但不显著。
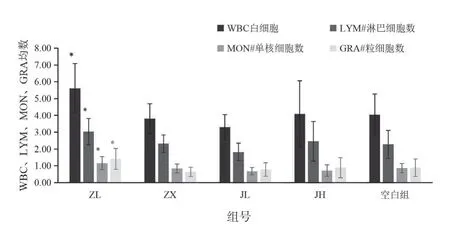
图1 各组小鼠血中WBC、LYM、MON、GRA 均值的柱状图
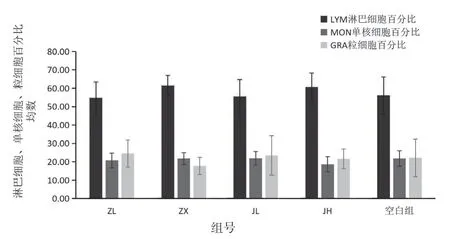
图2 各组小鼠血中LYM%、MON%、GRA%影响的柱状图
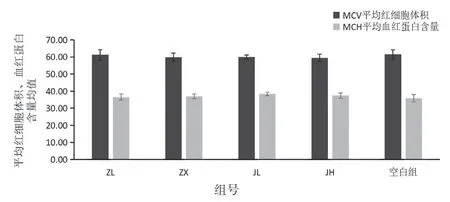
图3 各组小鼠血中平均红细胞体积、平均血红蛋白含量影响的柱状图
表1 各剂量组对于正常动物WBC、LYM、MON、GRA 的影响(±s,n=10)
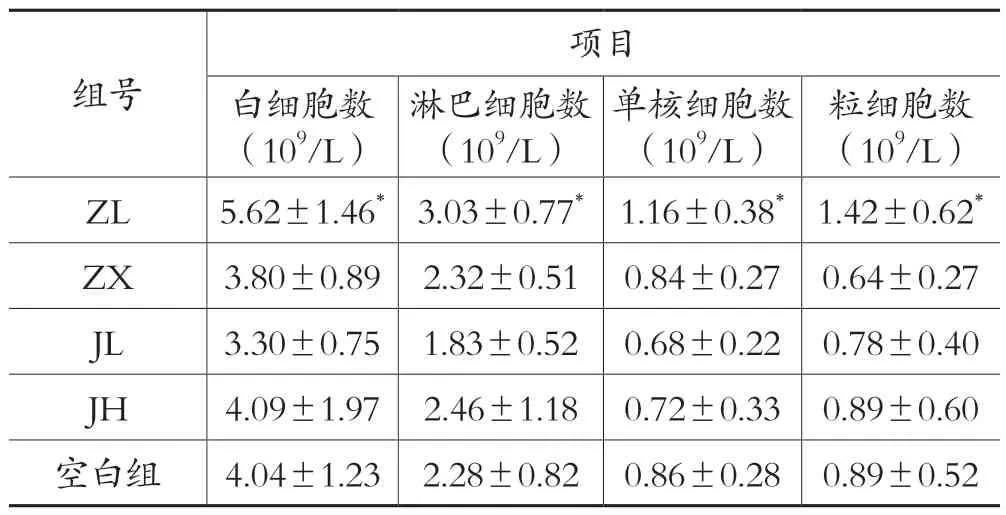
表1 各剂量组对于正常动物WBC、LYM、MON、GRA 的影响(±s,n=10)
注:与空白组比较:*表示:P <0.05,**表示:P <0.01
组号项目白细胞数(109/L)粒细胞数(109/L)ZL 5.62±1.46* 3.03±0.77* 1.16±0.38* 1.42±0.62*ZX 3.80±0.89 2.32±0.51 0.84±0.27 0.64±0.27 JL 3.30±0.75 1.83±0.52 0.68±0.22 0.78±0.40 JH 4.09±1.97 2.46±1.18 0.72±0.33 0.89±0.60空白组4.04±1.23 2.28±0.82 0.86±0.28 0.89±0.52淋巴细胞数(109/L)单核细胞数(109/L)
表2 各剂量组对于正常动物LYM%、MON%、GRA%的影响(±s,n=10)
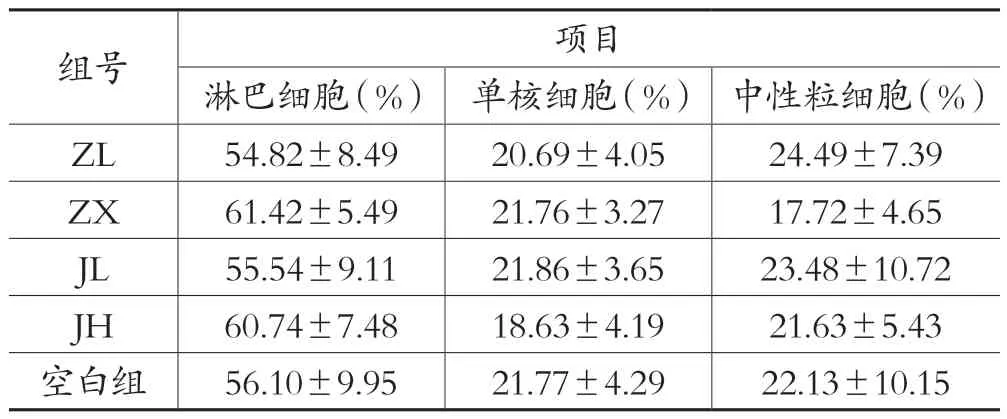
表2 各剂量组对于正常动物LYM%、MON%、GRA%的影响(±s,n=10)
注:与空白组比较:*表示:P <0.05,**表示:P <0.01
组号项目淋巴细胞(%) 单核细胞(%) 中性粒细胞(%)ZL 54.82±8.49 20.69±4.05 24.49±7.39 ZX 61.42±5.49 21.76±3.27 17.72±4.65 JL 55.54±9.11 21.86±3.65 23.48±10.72 JH 60.74±7.48 18.63±4.19 21.63±5.43空白组56.10±9.95 21.77±4.29 22.13±10.15
表3 各剂量组对于正常动物平均红细胞体积、平均血红蛋白含量的影响(±s,n=10)
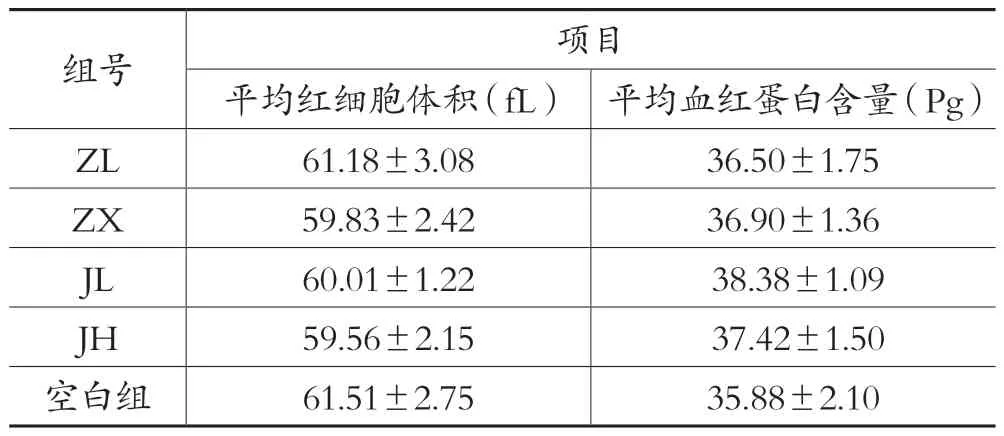
表3 各剂量组对于正常动物平均红细胞体积、平均血红蛋白含量的影响(±s,n=10)
注:与空白组比较:*表示:P <0.05,**表示:P <0.01
组号项目平均红细胞体积(fL) 平均血红蛋白含量(Pg)ZL 61.18±3.08 36.50±1.75 ZX 59.83±2.42 36.90±1.36 JL 60.01±1.22 38.38±1.09 JH 59.56±2.15 37.42±1.50空白组61.51±2.75 35.88±2.10
2.2.2紫藤根及含紫藤根经验方对小鼠棉球肉芽肿实验
(1)肉芽增生结果
与模型组比较:醋酸泼尼松组(阳性组)的肉芽组织重量明显下降,p<0.01,极具有显著性差异;经验方高剂量组(JH)的肉芽组织重量下降,p<0.05,说明其肉芽组织重量有显著性差异;而紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方中剂量组(JM)组的肉芽组织均有不同程度减少,但p>0.05,说明其无显著性差异。结果见表4、图4。
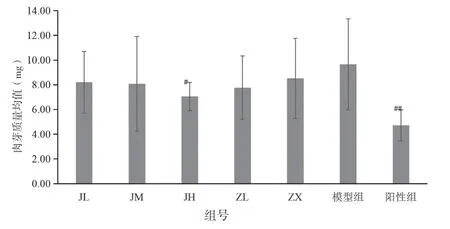
图4 各剂量组对小鼠棉球肉芽肿重平均值的影响
表4 各剂量组对小鼠棉球肉芽形成的影响(±s)
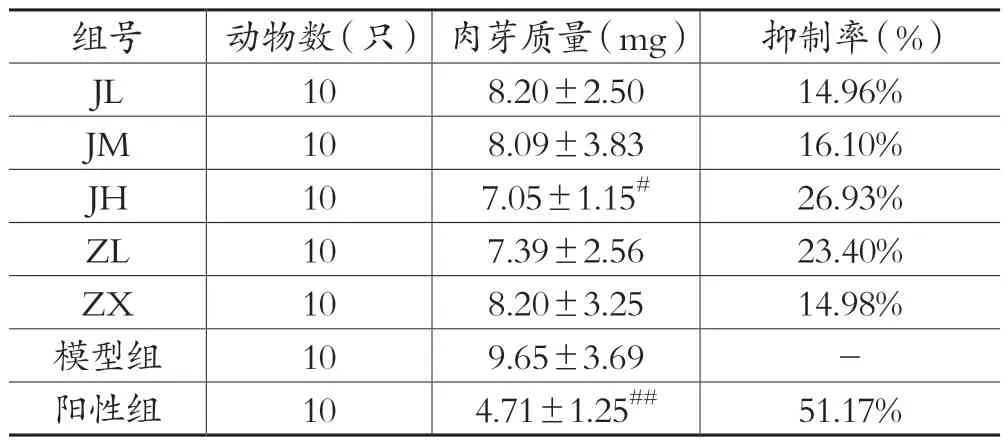
表4 各剂量组对小鼠棉球肉芽形成的影响(±s)
注:与模型组比较: #表示:P <0.05,##表示:P <0.01
组号动物数(只) 肉芽质量(mg)抑制率(%)JL 10 8.20±2.50 14.96%JM 10 8.09±3.83 16.10%JH 10 7.05±1.15#26.93%ZL 10 7.39±2.56 23.40%ZX 10 8.20±3.25 14.98%模型组10 9.65±3.69-阳性组10 4.71±1.25##51.17%
(2)血常规结果
血常规检测项目中的白细胞数、淋巴细胞数、单核细胞数、粒细胞数结果见表5,图5;淋巴细胞百分比、单核细胞百分比、中性粒细胞百分比见表6,图6;平均红细胞体积、平均血红蛋白含量见表7,图7。治疗14 天后发现,紫藤根组炎症基本消除,而经验方组炎症未解除。红细胞均无异常变化。
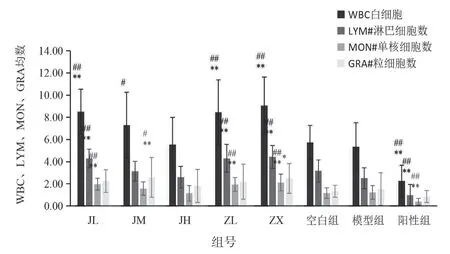
图5 各组小鼠血中WBC、LYM、MON、GRA 均值的柱状图
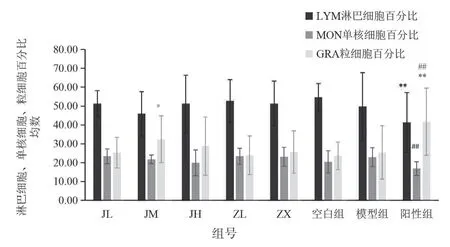
图6 各剂量组对LYM%、MON%、GRA%影响的柱状图
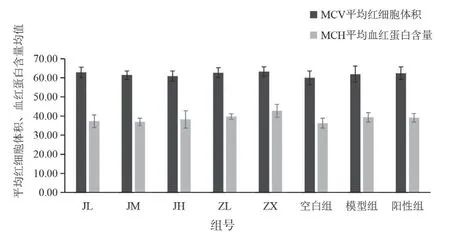
图7 各剂量组对平均红细胞体积、平均血红蛋白含量影响的柱状图
表5 各剂量组对WBC、LYM、MON、GRA 的影响(±s,n=10)
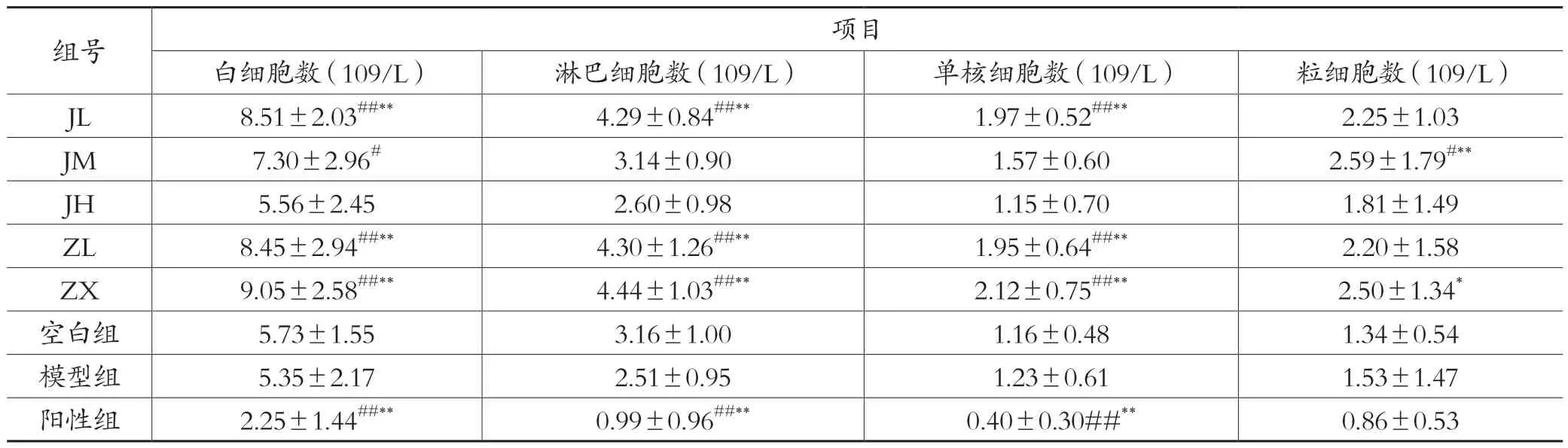
表5 各剂量组对WBC、LYM、MON、GRA 的影响(±s,n=10)
注:与模型组比较:#表示:P <0.05,##表示:P <0.01;与空白组比较:*表示:P <0.05,**表示:P <0.01
组号项目白细胞数(109/L)淋巴细胞数(109/L)单核细胞数(109/L)粒细胞数(109/L)JL 8.51±2.03##**4.29±0.84##**1.97±0.52##**2.25±1.03 JM 7.30±2.96#3.14±0.90 1.57±0.60 2.59±1.79#**JH 5.56±2.45 2.60±0.98 1.15±0.70 1.81±1.49 ZL 8.45±2.94##**4.30±1.26##**1.95±0.64##**2.20±1.58 ZX 9.05±2.58##**4.44±1.03##**2.12±0.75##**2.50±1.34*空白组5.73±1.55 3.16±1.00 1.16±0.48 1.34±0.54模型组5.35±2.17 2.51±0.95 1.23±0.61 1.53±1.47阳性组2.25±1.44##**0.99±0.96##**0.40±0.30##**0.86±0.53
表6 各剂量组对LYM%、MON%、GRA%的影响(±s,n=10)
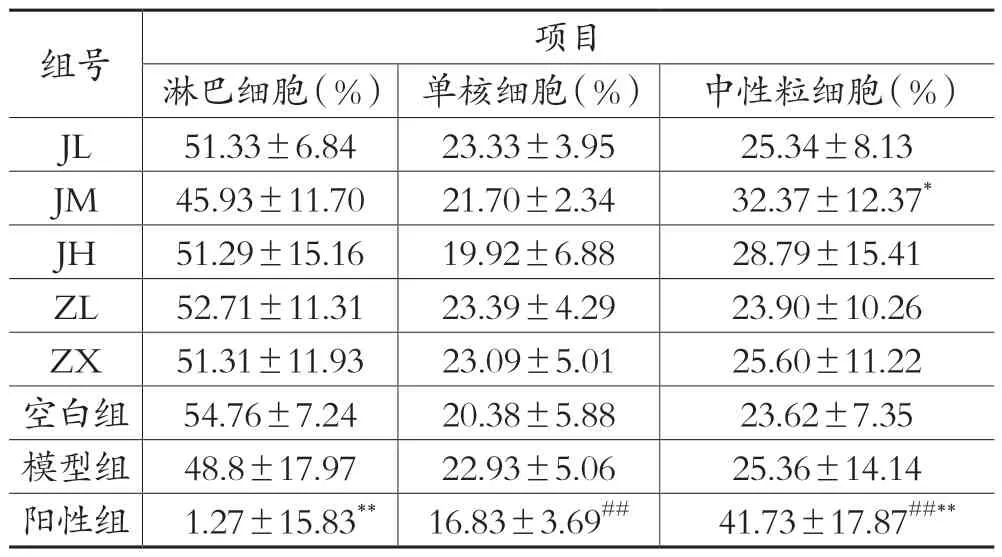
表6 各剂量组对LYM%、MON%、GRA%的影响(±s,n=10)
注:与模型组比较:#表示:P<0.05,##表示:P<0.01;与空白组比较:*表示:P <0.05,**表示:P <0.01
组号项目淋巴细胞(%) 单核细胞(%) 中性粒细胞(%)JL 51.33±6.84 23.33±3.95 25.34±8.13 JM 45.93±11.70 21.70±2.34 32.37±12.37*JH 51.29±15.16 19.92±6.88 28.79±15.41 ZL 52.71±11.31 23.39±4.29 23.90±10.26 ZX 51.31±11.93 23.09±5.01 25.60±11.22空白组 54.76±7.24 20.38±5.88 23.62±7.35模型组 48.8±17.97 22.93±5.06 25.36±14.14阳性组 1.27±15.83** 16.83±3.69## 41.73±17.87##**
表7 各剂量组对平均红细胞体积、平均血红蛋白含量的影响(±s,n=10)
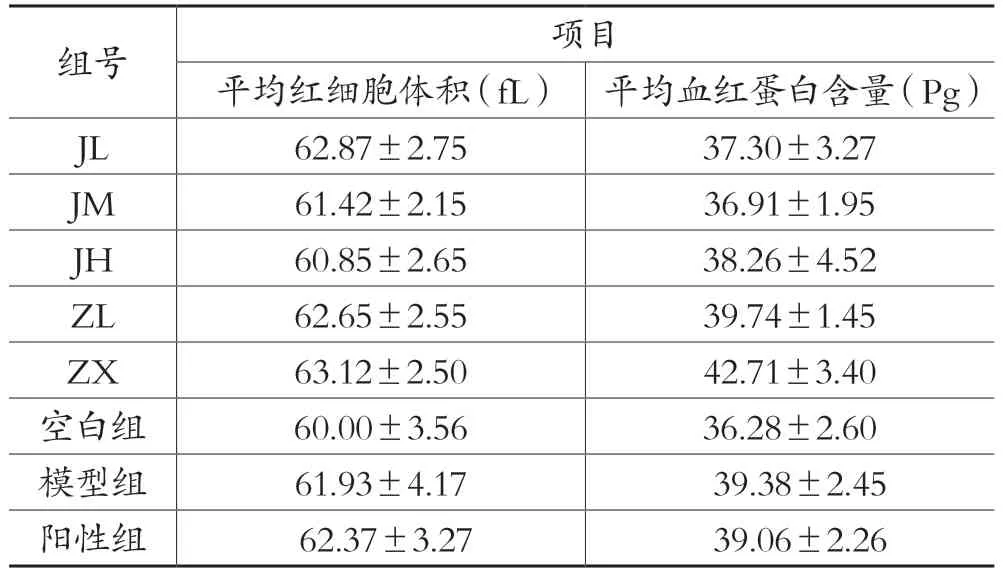
表7 各剂量组对平均红细胞体积、平均血红蛋白含量的影响(±s,n=10)
组号项目平均红细胞体积(fL) 平均血红蛋白含量(Pg)JL 62.87±2.75 37.30±3.27 JM 61.42±2.15 36.91±1.95 JH 60.85±2.65 38.26±4.52 ZL 62.65±2.55 39.74±1.45 ZX 63.12±2.50 42.71±3.40空白组60.00±3.56 36.28±2.60模型组61.93±4.17 39.38±2.45阳性组 62.37±3.27 39.06±2.26
注:与模型组比较:#表示:P<0.05,##表示:P<0.01;与空白组比较:*表示:P <0.05,**表示:P <0.01
2.2.3紫藤根及含紫藤根经验方对小鼠扭体实验
与空白组对比:阳性药物组、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)全部p<0.01,表明其极具显著性,同时,扭体次数显著减少,说明阳性药物组、紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)都能减少对小鼠注射醋酸所致的疼痛,结果见表8,图8。
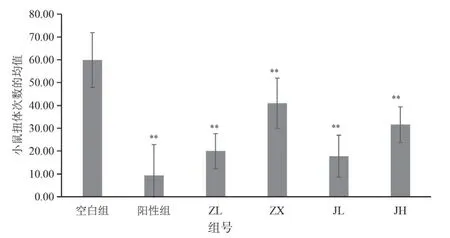
图8 各剂量组对小鼠扭体次数平均值的影响
表8 各剂量组对小鼠扭体实验影响(±s)
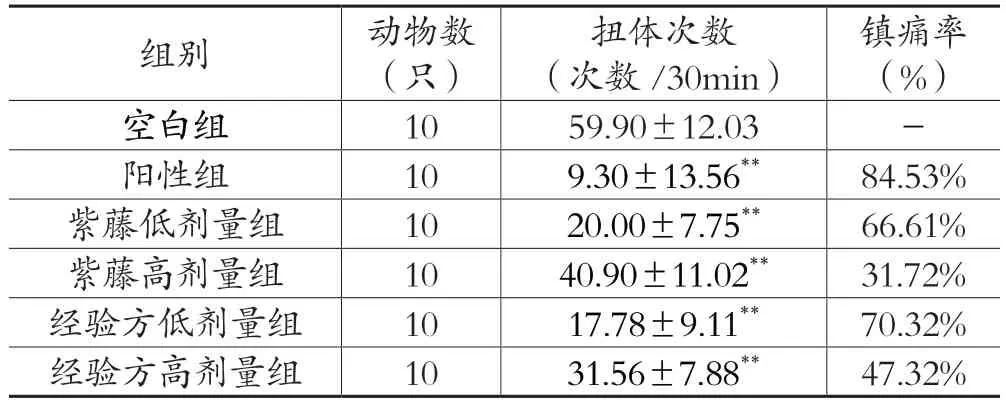
表8 各剂量组对小鼠扭体实验影响(±s)
注:与空白组比较:*表示:P <0.05,**表示:P <0.01
组别动物数(只)扭体次数(次数/30min)镇痛率(%)空白组10 59.90±12.03-阳性组10 9.30±13.56**84.53%紫藤低剂量组10 20.00±7.75**66.61%紫藤高剂量组10 40.90±11.02**31.72%经验方低剂量组10 17.78±9.11**70.32%经验方高剂量组10 31.56±7.88**47.32%
3 结果与讨论
结果:通过研究不同剂量药物对于正常动物的血常规数据的影响发现,低剂量的紫藤根提取物有升高白细胞的作用,这可能预示低剂量的紫藤根在抗炎作用中会取得比较好的效果;经验方组则使高剂量的白细胞有所增高,但不显著;没有发现有白细胞抑制的作用。同时,在血细胞影响上,各组之间没有显著性差异,均未发现对血细胞的抑制作用。在14 天的动物饲养过程中,动物无异常、无死亡,血常规无明显异常,未发现明显的药物毒性。模型组肉芽增生明显,经验方高剂量组(JH)、紫藤根低剂量组(ZL)能较好抑制小鼠棉球肉芽肿所致的慢性炎症。根据肉芽生长情况可知模型组与空白组血常规水平相当,证明14 天的时间内动物的病程发展已经结束,动物身体的炎症状态基本解除,阳性药物出现白细胞偏低的状况,这可能和药物本身的抗炎作用就是抑制白细胞的增殖有关;同时,除经验方高剂量组外,动物的白细胞还处于较高的水平,说明给药组大部分动物的炎症状态还没有解除,动物还处于比较强的炎症期。动物的红细胞无显著异常。从小鼠醋酸扭体镇痛实验来看,紫藤根及含紫藤根经验方各个剂量组均有极显著性,说明紫藤根低剂量组(ZL)、紫藤根高剂量组(ZX)、经验方低剂量组(JL)、经验方高剂量组(JH)都具有镇痛作用。
讨论:紫藤根低剂量组(ZL)可以升高白细胞,而在棉球肉芽实验中也发现紫藤根低剂量组(ZL)的肉芽较轻,表现出较强的抑制作用。紫藤根高剂量组(ZX)没有表现出较强的抑制作用,这与血常规中紫藤根低剂量组(ZL)对于白细胞的调控是相关联的。经验方高剂量组(JH)也体现了升白的作用,肉芽重量较轻。同时,经验方高剂量组(JH)动物的炎症状态已趋于正常水平,说明经验方高剂量组(JH)也起到了治疗作用。而其他给药组相对于模型组,肉芽都偏轻,其他给药组的抗炎作用推测能通过延长动物的病程在某个时间段内减少肉芽的产生。阳性组的肉芽是最少的,但是阳性组是通过抑制白细胞来实现的,实验结束后动物白细胞的水平非常低,这显示出给药组的优势,给药组可以通过不抑制白细胞的途径来达到抗炎的作用。紫藤根低剂量有升白的作用而高剂量没有,经验方高剂量显现,低剂量不显现。这说明紫藤根:苦皮藤:白金条在经验方中的比例为1:1:1 是值得优化的,紫藤根的配伍比例应该偏低更合理,紫藤根高剂量在抗炎上不明显,传统经验方的配伍比例是值得优化的。紫藤根低剂量对止痛的作用更好,这再次佐证紫藤根在经验方所占配伍比例应该偏少。紫藤根在经验方中的占有量少会使整个经验方的效果更好。在止痛方面,经验方高剂量不如低剂量好,经验方高剂量在抗炎方面更好,而低剂量经验方在止痛方面更占优势。紫藤根在处方中占据重要位置,低剂量时既能升白又能止痛。

