烟草青枯病的发生流行及生防菌防控的根际微生物效应研究进展
刘 勇,韦树谷*,叶鹏盛*,孙小芳,代顺冬,曾华兰,赖 佳,阳苇丽,黄 玲,盛玉珍
1.四川省农业科学院经济作物研究所,成都市青白江区华金大道三段159 号 610300 2.四川省烟草公司达州市公司,四川省达州市达川区三里坪街道办仰天湾社区 635000
烟草青枯病是影响烟草生产的重要病害,对热带和亚热带烟草产区烟叶生产危害较严重,其病原菌为青枯雷尔氏菌(Ralstonia solanacearum)[1-2],是第二大破坏性植物病原细菌,可侵染54 科254 种植物[3-4],对烟草和其他重要茄科作物具有致死作用,现已成为目前深入研究的植物病原菌之一。
在中国22个省烟草产区中,14个省烟区记载有烟草青枯病的发生[5],平均发病率为15%~35%,而且当它与烟草疫霉菌引起的黑胫病一起流行时,发病率可达75%。在连作地块的产量损失在50%~60%,最高可达100%[6]。尽管人们已采取施用农药、作物轮作和土壤消毒等措施来控制青枯病[7],但都没有达到很好的防治效果[8]。同时,农药的过度使用对环境造成危害,使病原菌产生抗性,并引起公共健康问题[9]。
微生物在保护植物免受病原菌侵袭方面具有重要作用,根际微生物多样性和土壤健康在土传病害的发生中起着至关重要的作用[10-11],掌握微生物群落特征是防控土传病害的关键。研究表明含钙、钼的土壤改良剂[12]和生物炭[10]通过降低病原菌载量、改善土壤理化性质和根际微生物多样性来降低青枯病的发病率。生物防治因其广谱性、持久性和环境友好性被广泛应用于土传病害的防治[13-14]。近年来,利用不动杆菌(Acinetobacter spp.)、芽孢杆菌(Bacillus spp.)、肠杆菌(Enterobacter spp.)、溶杆菌(Lysobacter spp.)、链霉菌(Streptomyces spp.)和假单胞菌(Pseudomonas spp.)等生防细菌进行生物防治,是一种有效、生态友好的控制土传病害的方法。生物菌通过生态位排斥、直接拮抗、定殖和产生次生代谢产物等多种机制抑制土传病害[8,15],且生防菌在寄主植物固氮作用、抗菌化合物、植物生长促进剂的形成方面具有广谱效应,并可诱导植物产生免疫抗性[5,16-17]。目前,利用内生菌和根际细菌等进行生物防治是降低青枯病发病率的有效措施[18-19]。
根际土壤中的微生物种类众多,有些发挥着积极作用,促进植物生长并维持植株健康[20];而另一些植物病原微生物对植株生长造成不利影响,能破坏植物的先天防御系统,打破保护性微生物屏障,定居在根际引起植物病害[21-23]。植物-土壤-微生物生态系统中的微生物失衡是导致病害发生的主要因素[24],一些土传病原菌,如水稻纹枯病菌(Rhizoctonia solani)、青枯菌和尖孢镰刀菌(Fusarium oxysporum),均被证实与土壤中的微生态失衡密切相关[25-26]。根际微生物群落的复杂性和多样性对于维持生态系统的动态平衡至关重要[27]。根际微生物群落平衡的健康土壤能更好地应对胁迫,促进植物生长,减少土传病害发生[28-29]。因此,深入了解根际土壤微生物在土传病害发展过程中的变化,探讨烟草根际土壤真菌群落组成和多样性与青枯病的关系,对于阐明根际土壤微生物与土传病害之间的相互作用具有重要意义,以期为青枯病的有效预防和生态防治提供科学依据。
1 症状及病原
烟草青枯病从苗期至成熟期均可发生,以团棵期至成熟期为主,可系统为害烟株的根、茎和叶。发病初期烟株下部叶片主脉一侧叶肉组织萎蔫、发黄,湿度大时呈水渍状褪绿斑。随着病害发展,烟株一侧叶片枯萎,呈“半边疯”状,或整株枯萎。成熟期爆发时整株发黄,并在茎部的一侧形成黑色条斑[8,30]。发病烟茎横切后发现,茎部导管系统由红棕色变为棕色。由于髓部的腐烂,茎部表面出现深黑色的水浸病斑,而健康植株茎秆则保持绿色(健康植株:图1 A~B和F;发病植株:图1 C~E)[8,31-32]。

图1 烟草青枯病的症状Fig.1 Symptoms of tobacco bacterial wilt
烟草青枯菌具有丰富的遗传多样性。我国烟草上分离的青枯菌属于1号生理小种,在生化变种分类上属于3号或4号,大部分为3号变种;依据演化型分类框架属于演化型I型,又可根据内切葡聚糖酶基因(endoglucanase gene, egl)等保守基因进一步分为8个序列变种,分别为序列变种13、14、15、17、34、44、54和55[33]。该病原菌在MNB培养基上培养24 h后形成透明的小菌落,36 h 后形成不规则或近圆形菌落,具有较宽的白边,流动性较强,中间呈粉红色或浅红色稀液状[32](图2)。在病原体的整个生命周期中,该病原菌均有活力,且可以从植株的患病部位分离出来[34-35]。在没有宿主植物的情况下,它可在患病植物残渣、营养繁殖材料、野生宿主和淡水中存活较长时间,最长可达40年[36]。

图2 青枯菌菌落形态Fig.2 Bacterial colony morphology of R.solanacearum
2 分布及流行病学
烟草青枯病在西南(云南、四川、贵州和广西)、东南(福建、安徽、浙江、广东和江西)、长江中游(湖北、湖南和重庆)、黄淮下游(河南、山东和山西)和东北(黑龙江、吉林和辽宁)等烟区均有发生。Li 等[33]在2012—2014年从以上5个烟区共分离到89株烟草青枯菌,除吉林和黑龙江以外,其他15个省(直辖市)烟叶产区都有发现。89 个菌株中的70 个进一步分成已知序列变种13、14、15、17、34和44,其余19个菌株暂时命名为序列变种54。在7个不同的序列变种中,序列变种15 在上述前4 个烟区中构成了最大的群体,占33.7%;其次是序列变种17,分布在西南和长江中游烟区,占23.6%;序列变种54 分布在西南、东南和长江中游烟区,占21.3%;序列变种14和44仅见于西南烟区,分别占1.1%和9.0%;序列变种13 和34仅见于东南烟区,分别占3.4%和7.9%[33]。其中发病面积较大、为害较重的产区有广东、广西、福建、湖南、浙江等省(自治区)及安徽省的皖南烟区、四川省的宜宾和泸州等烟区。广东南雄市该病的年平均发病率在20%左右;广西烟区发病率一般为5%~15%,严重的达30%~50%或更高;福建的永定、宁化、沙县、清流等县是烟草青枯病的重发区,发病率在13.3%~94.9%;四川的筠连、兴文、叙永等县的烟草青枯病也是毁灭性病害,发病率达30%~100%。
病土和病残体是烟草青枯病菌的主要初侵染源(图3)[36]。与假单胞菌和链霉菌相比,青枯菌更易引起系统感染,它通过机械操作产生的伤口和初生根、次生根发育部位伤口[37-38]进入易感宿主后,随着维管系统中的蒸腾流而传播,在木质部中系统繁殖,阻碍水分运输,使植株产生典型的萎蔫症状[39]。病原菌侵染植株时,大量细菌从患病植株的根部渗出到根际,通过雨水和灌溉水传播并感染健康植株[40]。

图3 烟草青枯菌的一般生活周期[8]Fig.3 General life cycle of R.solanacearum causing bacterial wilt of tobacco[8]
3 生防微生物
针对烟草青枯病的防治技术,国内外学者从化学、生物、农业措施等方面进行防控研究[41-44],主要包括喷施化学药剂、施用生物菌剂和生物有机肥、培育抗病品种、土壤改良、合理轮作与施肥等,均取得了一定的防治效果。
微生物介导的生物防治是农业可持续发展的基本策略。生防菌和植物之间存在互利关系,直接或间接保护植物免受生物和非生物胁迫[45],主要包括定殖诱导宿主抗性、抗菌、调控根际微生态、竞争生态位和营养等。直接作用机制是通过生防菌获取必需的大量营养元素(氮和磷)、微量营养元素(铁)和产生某些激素(赤霉素、生长素和细胞分裂素)[8,46-47];间接作用机制是产生抗菌物质[48-50]或挥发性有机化合物(Volatile organic compounds, VOCs)[51-52],一方面通过拮抗作用抑制植物病原菌的生长,并与病原菌竞争铁,另一方面诱导植物产生抗性[53-55]。
在农业和土壤生态学中,根际土壤微生物群落的组成和结构是理解根际微生态系统和作物健康之间关系的核心[56]。研究表明,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZM9 通过生态位排斥机制有效控制烟草青枯病,生防抑制率为38.2%[57]。成功定殖在烟草根部和根际土壤中的解淀粉芽孢杆菌WS-10由于生物膜的形成和水解酶及胞外多糖的分泌,对烟草青枯病田间防效高达72.02%[5]。Ahmed等[58]在烟草青枯病田间试验中发现,烟草移栽1个月后,同时接种青枯菌和芽孢杆菌WS-10、接种青枯菌3 d后再接种芽孢杆菌WS-10、接种芽孢杆菌WS-10 3d后再接种青枯菌3种处理方式均能显著降低烟草青枯病的发病率,分别降低73.36%、43.82%和86.82%,因为WS-10 改善了土壤理化性质和根际微生物的功能多样性,直接促进烟草生长,增强抗病性。Li等[59]报道解淀粉芽孢杆菌Y4和假单胞菌Y8的添加改变了根际土壤细菌群落,使烟草青枯病的发病率与对照组相比降低了3~4倍。Tahir等[60]研究发现,萎缩芽孢杆菌(B.artrophaeus)LSSC22 和解淀粉芽孢杆菌FZB42通过产生挥发性有机化合物抑制青枯病菌,同时也可作为植物生长促进剂。也有生防菌通过提高烟草中过氧化氢酶和多酚氧化酶的活性来诱导植物产生抗性,在盆栽试验中,用贝莱斯芽孢杆菌(B.velezensis)EM-1处理的烟草接种青枯菌5 d后,青枯病病情指数为5.8,较对照组降低45.23%[61]。铜绿假单胞菌(Pseudomonas aeruginosa)NXHG29 在体外对烟草赤星病菌(Alternaria alternata)和青枯菌具有很强的拮抗活性,应用在盆栽试验中显著降低了黑胫病和青枯病的发病率[62]。
由于青枯菌宿主范围广和遗传多样性丰富[63],仅使用生物防治剂不能产生较好的防治效果。然而,当生防菌株与(生物)有机肥和生物质炭联合使用时,生物防治效果可达到95%以上[64-66]。Yang等[65]描述了高度丰富的土壤生态网络可能有助于抑制烟草青枯病的发生。Yuan等[66]在温室和田间试验中,施用芽孢杆菌强化的有机肥显著延缓了烟草青枯病的发生与发展,有效控制病害发病率。解淀粉芽孢杆菌ZM9 和米糠、氰氨化钙的混合施用对烟草青枯病的田间控制效果较好[45],将该菌与万寿菊粉联合施用则通过改善土壤理化性质、土壤代谢产物和微生物结构来抑制烟草青枯病的发生[67]。单独施用解淀粉芽孢杆菌ZM9和氰氨化钙对烟草青枯病田间防效分别为46.43%和51.92%,而两者的联合施用其防效则达到65.79%[68]。此外,两者配合施用还可提高土壤pH值、全氮、碱解氮和交换性钙含量,且可以提高某些拮抗菌的比例,这些拮抗菌种与烟草青枯病的病情指数呈负相关。Yuan 等[69]研究表明,混合施用哈茨木霉(Trichoderma harzianum)SQR-T037 改良的生物有机肥和丛枝菌根真菌(Glomus mosseae)171,烟草青枯病发病率较低,田间防效为68.2%,显著高于两者单独施用的防效26.8%和14.7%,且对根际土壤中青枯菌的抑制效果较强,较单施增加21.3%。在田间条件下,将含有娄彻氏链霉菌(Streptomyces rochei)L-9 的生物有机肥施入土壤中,烟草青枯病的防效可达95.4%,优于单独施用拮抗菌[70]。Chang 等[71]将5 株芽孢杆菌和1 株布氏杆菌(Brucella sp.)混合,利用它们降解植烟土壤中11 种酚类化感物质从而控制青枯病,使其盆栽试验发病率从81.11%降至19.37%。
4 根际土壤微生物群落
根际土壤是植物和土壤微生物的关键介质,其中发生了大量化学和生物化学相互作用[72]。许多研究结果证实,根际微生物群是抵御土传病原菌入侵的第一道防线[73-76]。研究表明,植物根系分泌某些物质,这些分泌物有助于招募有益微生物类群,构成防止病原菌感染的主要屏障。此外,这些有益微生物产生的抗菌代谢物能够抑制病原菌活性[77]。例如,Guo 等[78]研究发现哈茨木霉产生的代谢物在体外和体内都能有效地抑制番茄植株中青枯菌的生长。同时,有益微生物群落还可以提高土壤肥力,促进植物生长[79-80],以及刺激植物免疫系统[81]。然而,植物和微生物群落以及微生物群落之间的相互作用非常复杂。迄今为止,关于植物如何与土壤微生物合作以降低病害敏感性的研究相对较少[82]。因此,深入了解有益微生物群在植物病原菌防御中的作用,对病害生物防治、促进土壤健康具有重要意义。
4.1 根际土壤微生物群落多样性
近年来,许多学者从门、属和种的水平分析了烟草青枯病根际土壤和健康根际土壤中微生物群落优势菌群和相对丰度的差异[83-85]。众多研究表明,在门水平上,烟草健康根际土壤中细菌群落以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、蓝菌门(Cyanobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chlorofexi)等为主;子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)是真菌群落的主要类群,其中子囊菌门的相对丰度低于患病根际,而担子菌门的相对丰度则相反。在属水平上,烟草健康根际土壤中以不动杆菌属(Acinetobacter)、青霉菌属(Penicillium)和木霉菌属(Trichoderma)为主,感染青枯病的根际土壤中镰孢菌属(Fusarium)高于健康根际土壤,而木霉菌的相对丰度则相反[86]。
土传病害的发病率在一定程度上受到与病害相关的微生物群落多样性变化的影响,一些生防菌剂通过改变根际微生物多样性、转移根际微生物群和减少根际微生物与病菌之间的相互作用,显著抑制土传病害的发生[85-89]。Ahmed等[5]研究报道,解淀粉芽孢杆菌WS-10的加入显著提高了烟草根际土壤微生物群落的α多样性指数(图4),McIntosh 指数也显著高于对照组[58]。类似的,在混施解淀粉芽孢杆菌ZM9 和万寿菊粉防治烟草青枯病的试验中,土壤微生物群落的OTUs、Chao1 和Shannon 指数均高于对照组,说明配施能够提高微生物群落的丰富度和多样性[67]。同时,解淀粉芽孢杆菌ZM9 和氰氨化钙配合施用后,根际土壤细菌和真菌的OTUs、Sobs、Chao1 和Shannon 指数显著提高[68]。此外,Zheng等[90]对云南省临沧市烟草根际土壤真菌群落分析时发现,临翔区博尚镇感染青枯病植株根际土壤真菌群落的Shannon、ACE和Chao1指数分别较健康植株提高了3.03%、10.52%和10.73%;耿马县勐撒镇感染青枯病植株根际土壤真菌群落的Shannon 指数较健康植株增加了3.04%,ACE和Chao1指数则分别减少了3.90%和2.71%(P<0.05)。同样,加入生物炭的根际微生物Shannon 指数及Shannon 均匀度指数分别提高了2%和3%(P<0.05)[10],病原菌种群减少,降低了烟草青枯病发生率。也有学者发现,解淀粉芽孢杆菌Y4和假单胞菌Y8处理的烟草根际土壤细菌群落的丰度指数(Chao1指数和ACE指数)和多样性指数(Shannon指数)与对照组差异不大,而谱系多样性指数(PD whole tree指数)则在解淀粉芽孢杆菌Y4处理中显著提高,但在假单胞菌Y8处理中显著降低[59]。此外,与对照相比,解淀粉芽孢杆菌Y4 处理的根际细菌群落的OTU 组成有所不同,而假单胞菌Y8 没有差异。Shi 等[91]在研究不同地区烟草抗青枯病和感青枯病根际土壤微生物群落变化时也获得了类似的结果,在健康和感病植株根际土壤中细菌群落Chao1 和Shannon 指数没有显著差异,但Zheng 等[92]却在研究中得出,健康植株根际土壤细菌群落Chao1和Shannon指数较高,显著高于患病植株。也有研究表明,解淀粉芽孢杆菌ZM9 处理组的细菌OTUs、Sobs和Chao1指数高于对照组,并且OTUs和Sobs与烟草青枯病发病率呈显著负相关[45],即丰富的根际土壤微生物群落多样性会降低烟草青枯病的发病率。
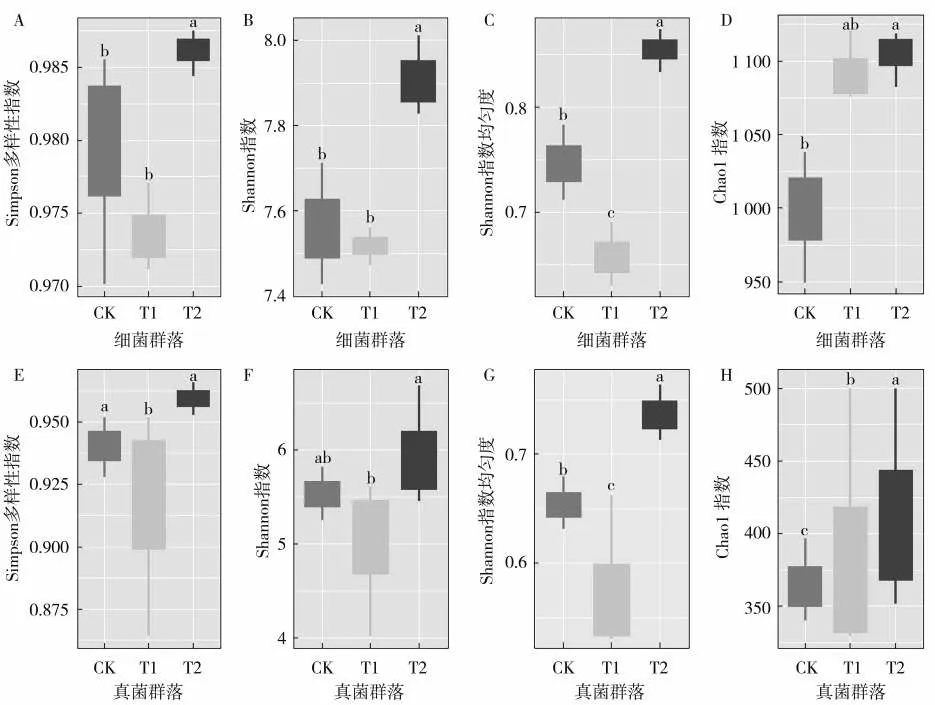
图4 不同处理下细菌(A~D)和真菌(E~H)群落的α多样性指数[5]Fig.4 Alpha diversity indices of bacterial(A-D)and fungal(E-H)communities under different treatments[5]
总之,生防菌剂的应用显著影响了烟草根际土壤细菌和真菌群落的多样性和结构,并在植株被青枯菌感染的情况下使根际微生物群落朝着更均衡的状态变化。
4.2 根际土壤微生物种群结构和数量
根际微生物群的扰动与植物健康和病害发展直接相关,土壤中有益微生物的引入改变了根际微生物群,诱导了植物抗性,抑制了土传病害的发生[5]。根际土壤中微生物群落的相互作用在维持微生物群落的稳定性和植物生长方面发挥着重要作用[82,93-94]。研究表明,青枯病、黑胫病和枯萎病等土传病害的发生与土壤理化性质的恶化、土壤微生物区系的失衡和根际微生物多样性的变化显著相关[2,18,95]。
Wang 等[72]比较了健康和感染青枯病的烟草根际土壤微生物群落,卡氏伯克霍尔德菌属(Burkholderia-Caballeronia-Paraburkholderia)、不动杆菌属、青霉菌属(Penicillium)和木霉菌属在健康植物中显著富集,相对丰度大于1%,显著高于患病植物,且与青枯菌的相对丰度呈显著负相关。对健康和患病植物根际土壤中微生物群落的共生模式网络进行分析,结果表明患病植株根际土壤的细菌和真菌群落构成了一个比健康植物更具互动性、复杂性的网络,并且包含更大比例的细菌关键类群(图5)。

图5 健康和患病烟草植株微生物群落网络结构[72]Fig.5 Network construction of microbial communities for healthy and diseased tobacco plants[72]
研究发现,解淀粉芽孢杆菌WS-10的应用显著影响了细菌和真菌群落的多样性和结构[5]。在门水平上,前10个细菌门和真菌门分别占总类群的97.35%和94.04%。变形菌门、放线菌门、酸杆菌门、绿弯菌门和厚壁菌门在土壤细菌群落中占优势,约占土壤细菌总数的84.55%。土壤真菌群落以子囊菌门、担子菌门和被孢霉门为主,约占土壤真菌群落总数的86.01%。施用芽孢杆菌后,烟草植株根际土壤担子菌门、蓝菌门和芽单胞菌门(Gemmatimonadetes)的相对丰度显著高于感病植株和健康植株。健康植株根际土壤被孢霉门、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)相对丰度显著高于感病植株。在属水平上,与感病植株相比,施用芽孢杆菌后,鞘氨醇单胞菌属(Sphingomonas)和镰孢菌属相对丰度显著提高,而朱氏杆菌属(Chujaibacter)相对丰度则显著降低,同时青枯雷尔氏菌属、青霉菌属和果胶杆菌属(Pectobacterium)相对丰度也显著降低。然而,患病植株根际土壤毛壳菌属(Chaetomium)和木霉菌属相对丰度显著高于健康植株和感病施用芽孢杆菌后的烟草植株,这表明不同处理下细菌和真菌群落组成发生了显著变化。基于根际土壤微生物共现网络,通过将烟草青枯病发病率和属水平上的微生物进行相关分析,发现青枯雷尔氏菌属、果胶杆菌属、被孢霉属(Mortierella)和木霉菌属与烟草青枯病发病率呈显著正相关(P<0.05),这表明果胶杆菌属可能增加了青枯雷尔氏菌属的数量,而被孢霉属和木霉菌属可能提供了一个有利的环境,从而加速了病害的发展。相反,芽孢杆菌属(Bacillus)与发病率呈负相关(P<0.05),表明芽孢杆菌属抑制了青枯雷尔氏菌属的生长,从而降低了发病率。
据前人研究,烟草根际土壤10个优势细菌门中,芽单胞菌门、酸杆菌门、厚壁菌门、变形菌门和放线菌门的相对数量约占总细菌的81.51%~91.16%;前6个优势真菌门占总真菌群落的68.79%~87.06%,其中子囊菌门占36.40%~60.98%,被孢霉门占6.21%~48.60%,担子菌门占0.25%~9.07%,毛霉菌门占4.23%~3.62%,壶菌门占0.25%~0.63%,罗兹菌门(Rozellomycota)占0.04%~0.35%[68]。单独施用解淀粉芽孢杆菌ZM9和氰氨化钙或将两者混合施用均使烟草根际土壤中变形菌门的相对数量提高,而厚壁菌门、放线菌门和芽单胞菌门的相对数量则低于对照组。单独施用氰氨化钙或将其和解淀粉芽孢杆菌ZM9混合施用使烟草根际土壤中担子菌门相对数量高于对照组,子囊菌门和被孢霉门的数量则显著降低。在属水平上,施用拮抗菌后,烟草根际土壤微生物与患病植株相比有40多个显著不同的属,其中拮抗菌芽孢杆菌属、类芽孢杆菌属(Paenibacillus)、溶菌杆菌属(Lysobacter)和链霉菌属的丰度均高于对照组,尤其Terracidiphilus 相对丰度显著高于对照组。此外,保护烟草植株健康和促进生长的细菌新鞘氨醇菌属(Novosphingobium)的数量显著高于未施用拮抗菌的处理组,氮循环细菌Gaiella、微枝形杆菌属(Microvirga)、亚硝化螺菌属(Nitrosospira)和碳循环细菌类固醇杆菌属(Steroidobacter)、Solirubrobacter丰度也显著高于对照组,但Chthonomonas 丰度则显著低于对照组。在真菌群落属水平上,施用拮抗菌的处理组和对照组之间的真菌比例没有显著差异,而作为拮抗菌的曲霉属(Aspergillus)和木霉菌属在施用生物防治剂处理组中比在对照组中更为丰富。
5 展望
在当代全球农业集约化背景下,维持土壤健康是维系农业生产力的重大挑战。土壤微生物是保持土壤健康的关键,其典型效益是抑制病害;根际微生物群落,在影响宿主生长发育、养分吸收及病害抵御等方面发挥重要作用,其构建受复杂的生物和非生物因素影响,其中病原菌侵染是典型的生物因素[96]。病原菌侵染下,植物根系通过改变根系分泌物或释放挥发性有机物质招募有益微生物以促进其后代或者邻近植物生存,这种策略目前被认为是植物的“呼救”策略。有益微生物可以作为根际微生物组关键类群,通过诱导宿主免疫、分泌抗生素或与病原菌竞争资源和生态位,从而促进宿主健康。土壤微生物多样性、组成和功能是维持长期生态系统平衡和控制植物土传病害暴发的重要因素。因此,掌握植物微生物群落构建、互作网络和生态功能,以及植物在外界胁迫下如何调控其微生物群落,是利用植物微生物组促进植物健康和推进农业可持续发展的基础和前提。
生物防治是控制土传病害的最有前途的方法之一[45]。微生物群落是影响土壤健康的重要生物指标,土壤环境中的微生物在维持土壤生态平衡,保护土壤健康方面发挥着重要作用[96-97]。植物、土壤和微生物之间的相互作用非常复杂,这导致根际中形成不同的微生物适应性、种群动态和功能能力[98]。土壤理化性质的恶化、土壤微生物区系的失衡和根际微生物多样性的变化会导致青枯病、黑胫病和枯萎病等土传病害的发生[76,99]。因此,筛选有针对性的防控烟草青枯病的有益微生物,调控土壤微生态平衡,增强土壤自身的免疫力,发展健康的土壤环境和多样的微生物菌群,对烟草青枯病等土传病害的生态防控具有重要意义。烟草青枯病的抑制不能归因于单一的细菌或真菌类群,这种抑制很可能是由微生物群落网络控制的[100-102]。因此,采用以内生菌和根际细菌形式的宿主特异性生物控制剂进行生物防治,为增强农业可持续发展能力提供了机遇[8]。
在此,提出一些适宜控制该病害的建议:①分离和鉴定拮抗烟草青枯菌的内生菌、根际微生物等,利用这些微生物在根际和植株其他部位的良好适应性和定殖能力来防控该病害;②多种微生物的联合应用或拮抗菌与(生物)有机肥和生物质炭等的配合施用,用以构建一个复杂的土壤微生物网络,重组根际微生物群落,从而控制烟草青枯病;③利用生物技术对生物控制剂进行基因改造,以提高其生物防治效果。因此,烟草青枯病生物防治在以下几个方面还需要进一步的研究:验证富集的根际微生物组是否能够抑制烟草青枯病菌;掌握这些微生物类群抑制烟草青枯菌生长的机制;提出控制烟草青枯病的有效生物防治方法等。通过采取上述策略再结合其他栽培技术、化学防治等措施,相信在不久的将来可以实现对烟草青枯病的有效防控。

