烟草NtHPL1基因克隆、表达及功能分析
和 顺,马兰馨,陈钰栋,武明珠,徐 馨,李泽锋,高 茜,杨 军,黄平俊,王 中*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001 2.云南中烟工业有限责任公司技术中心,昆明市五华区科医路41 号 650106 3.湖南中烟工业有限责任公司技术中心,长沙市劳动中路386 号 410007
脂氧合酶(lipoxygenase,LOX)途径是植物体内脂肪酸氧化的重要途径[1],LOX 可催化亚油酸和亚麻酸等脂肪酸形成脂氢过氧化物,这些脂氢过氧化物通常不稳定,能够被二乙烯基醚合成酶(divinyl ether synthase, DES)、丙二烯氧化物合酶(allene oxide synthase, AOS)、过氧合酶(peroxygenase,POX)和脂氢过氧化物裂解酶(hydroperoxide lyase,HPL)催化[2]。其中,HPL 是LOX 途径的关键酶,根据催化底物的过氧基位置分为3 个亚族(9-HPL[3]、13-HPL[4]和9/13-HPL[5]),可通过裂解脂氢过氧化物的碳-碳键形成挥发性醛和酸[6]。HPL 可参与甜瓜和鹰嘴豆等植物对盐和干旱胁迫的响应,相关研究已见报道。刘苗苗等[7]发现与未经胁迫处理(对照)的甜瓜幼苗相比,干旱和NaCl 胁迫处理后的幼苗CsHPL基因相对表达量升高,分别为对照的181.02%和162.41%。Domenico 等[8]发现鹰嘴豆根系中的HPL 基因(MtHPL1 和MtHPL2)干旱胁迫处理后相对表达量升高,MtHPL1 基因的相对表达量在处理2 h内上调,在2~72 h 内相对稳定;MtHPL2 的相对表达量随干旱胁迫处理时间的增加而升高,在72 h 达到最高值。然而,烟草(Nicotiana tabacum L.)HPL参与盐和干旱胁迫响应的相关研究还鲜见报道。为此,在普通烟草K326 中克隆1 个HPL 基因并命名为NtHPL1,采用生物信息学方法对NtHPL1 蛋白的理化性质、结构域、进化关系等进行系统分析,并采用qPCR 方法分析NtHPL1 基因在烟草不同组织、不同发育时期烟叶、盐和干旱胁迫处理下旺长期烟叶的相对表达量,创制过表达转基因植株,验证NtHPL1基因在烟草抗盐、抗旱方面的生物学功能,以期为创制抗逆烟草新品系提供依据。
1 材料与方法
1.1 试验材料
供试培养基分别为MS 固体培养基(MS 培养基粉4.40 g/L、蔗糖30 g/L、琼脂粉3 g/L,pH值5.8)、含NaCl(0 mmol/L)的固体培养基(MS培养基粉4.40 g/L、蔗糖30 g/L、琼脂粉3 g/L,pH 值5.8)、含NaCl(100 mmol/L)的固体培养基(NaCl 5.85 g/L、MS 培养基粉4.40 g/L、蔗糖30 g/L、琼脂粉3 g/L,pH 值5.8)和含NaCl(200 mmol/L)的固体培养基(NaCl 11.70 g/L、MS 培养基粉4.40 g/L、蔗糖30 g/L、琼脂粉3 g/L,pH值5.8)。
将普通烟草K326 种子用体积分数为10%的NaClO 消毒后,在MS 固体培养基中于25 ℃恒温培养,待种子萌发并长出4 片真叶时进行以下处理:①将烟苗移栽至上口径100 mm、下口径65 mm、高度85 mm 的花盆中,培养基质为品氏托普园艺(上海)有限公司的营养土和蛭石,营养土与蛭石的体积比为9 ∶1。移栽后的烟苗置于温室中生长,每天26 ℃光照处理15 h,20 ℃黑暗处理9 h。采集烟草苗期、旺长期、现蕾期、盛花期和成熟期的上部叶片,液氮速冻后保存于-80 ℃冰箱,用于提取烟草基因组DNA(gDNA)和检测不同发育时期烟叶的NtHPL1基因相对表达量;采集烟草盛花期的根、茎、叶片、花和腋芽,液氮速冻后保存于-80 ℃冰箱,用于检测烟草不同组织的NtHPL1 基因相对表达量。②选取长势相同、大小一致的烟苗分别移栽至含NaCl(0、100、200 mmol/L)的3种固体培养基上进行盐胁迫处理,每个培养基移栽8株烟苗,每种处理重复3 次,7 d 后将烟叶用液氮速冻并保存于-80 ℃冰箱,用于检测盐胁迫处理下旺长期烟叶的NtHPL1基因相对表达量。③将烟苗移栽至上口径120 mm、下口径80 mm、高度100 mm的花盆中,长至旺长期时,采用停止浇水的方法创造干旱条件,对烟株进行干旱胁迫处理,并取处理0、2、4、6 d 的烟草上部叶片,液氮速冻后保存于-80 ℃冰箱,用于检测干旱胁迫处理下旺长期烟叶的NtHPL1基因相对表达量。
1.2 烟草基因组DNA提取和RNA提取及反转录
使用新型植物基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取普通烟草K326基因组DNA。使用GenePure 多糖多酚植物RNA 快速提取试剂盒(北京艾德莱生物科技有限公司)分别提取1.1 节中采集的烟草不同组织、不同发育时期烟叶、盐和干旱胁迫处理的旺长期烟叶样品RNA,并使用All-in-One First-Strand Synthesis MasterMix(with dsDNase)反转录试剂盒(北京密码子生物科技有限公司)将提取的RNA分别反转录为cDNA。
1.3 烟草NtHPL1基因克隆
将拟南芥AtHPL 蛋白序列(GenBank ID:9306309)在中国烟草基因组数据库(http://218.28.140.17)中进行BLASTP 比对。从比对结果中选择同源性最高的序列,并使用Primer Premier 5 软件设计扩增引物NtHPL1-F 和NtHPL1-R(表1),分别以普通烟草K326 的gDNA 和cDNA 为模板进行PCR扩增。反应体系:gDNA(cDNA)模板(100 ng/μL)2 μL,上、下游引物(10 µmol/L)各0.5 μL,高保真聚合酶(北京全式金生物技术有限公司)10 μL,ddH2O补足至20 μL。反应程序:94 ℃预变性2 min;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸2 min,35 个循环;72 ℃保温7 min。使用凝胶回收试剂盒(北京艾德莱生物科技有限公司)回收PCR 产物,并使用DNA 连接酶将回收产物与克隆载体Peasy-T1 相连。将连接产物转化DH5α大肠杆菌感受态(北京全式金生物科技有限公司)后37 ℃过夜培养,对阳性克隆进行测序验证。引物合成和测序验证均由北京六合华大基因科技有限公司完成。

表1 供试引物序列Tab.1 Tested primer sequence
1.4 生物信息学分析
使用DNAMAN 软件将拟南芥(Arabidopsis thaliana)、番茄(Solanum lycopersicum)、辣椒(Capsicum annuum)、马铃薯(Solanum tuberosum)的HPL 蛋白与烟草NtHPL1 蛋白进行氨基酸序列比对。查找其他植物的HPL蛋白序列,使用MEGA 7.0软件构建NtHPL1 与其他植物HPL 蛋白的系统发育进化树。烟草NtHPL1蛋白的理化性质用ProtParam在 线 工 具 (https://www.expasy.org/resources/protparam)分析;亲疏水性用ProtScale 在线工具(https://www.expasy.org/resources/protscale)分析;跨膜结构特性用TMHMM 在线工具(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测;二级结构用Sopma在线工具(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)分析。
1.5 烟草NtHPL1基因相对表达量分析
分别以1.2节中获得的烟草不同组织、不同发育时期烟叶、盐和干旱胁迫处理的旺长期烟叶样品cDNA 为模板,采用qPCR 方法检测烟草NtHPL1 基因的相对表达量。根据NtHPL1基因的CDS序列,使用Primer Premier 5 软件设计qPCR 引物,命名为qRT-NtHPL1-F 和qRT-NtHPL1-R;内参基因为烟草NtL25 基因(GenBank ID:L18908)[9],内参引物命名为qRT-NtL25-F 和qRT-NtL25-R,引物序列如表1 所示。qPCR 反应体系:cDNA 模板(100 ng/μL)1 μL,上、下游引物(10 µmol/L)各0.5 μL,2×SYBR Green qPCR Mix(北京艾德莱生物科技有限公司)7.5 μL,ddH2O 补足至15 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸30 s,45个循环,混合3个样品为1个生物学重复,设置3次生物学重复。采用2-ΔΔCT法计算NtHPL1 基因的相对表达量[10],使用Microsoft Excel软件对相对表达量进行方差分析,采用LSD法进行数据间的差异显著性分析。
1.6 过表达遗传材料创制及抗逆性分析
为分析NtHPL1 基因在烟草抵抗盐和干旱胁迫过程中的作用,将NtHPL1 基因的CDS 序列连接pCambia 1300 表达载体,构建35S:NtHPL1 过表达载体。将经过测序验证后的过表达载体转化普通烟草K326 无菌苗,创制NtHPL1 基因的过表达遗传材料。采用1.2 节中的方法获得过表达遗传材料的cDNA,并通过1.5节中的方法检测NtHPL1基因相对表达量,鉴定阳性的NtHPL1 过表达转基因株系,筛选出NtHPL1 基因相对表达量最高的过表达株系(NtHPL1-OE),并收集该株系T2代纯合种子。
将过表达烟草(NtHPL1-OE)和野生型烟草(WT)种子培养于MS 固体培养基上,待长至4 片真叶后分别进行盐和干旱胁迫处理。将NtHPL1-OE和WT的烟苗同时移栽至含NaCl(200 mmol/L)的固体培养基上进行盐胁迫处理,并以移栽至MS固体培养基上的处理作为对照(CK1)。每个培养基上NtHPL1-OE 和WT 分别移栽8 株,每个处理设置3 次生物学重复。观察处理7 d 烟苗的生长状况并拍照记录;分别取处理0、5、10、15、20 d NtHPL1-OE(3株)和WT(3株)的叶片,检测叶绿素[11]、脯氨酸和丙二醛(MDA)[12]含量(质量分数)并计算3株含量的平均值。将NtHPL1-OE和WT的种子消毒后分别培养于含NaCl(200 mmol/L)的固体培养基上,重复3次,每个培养基培养30 粒种子,25 ℃培养7 d。分别统计0~7 d 每天累计的发芽数,计算每天的发芽率(发芽率=种子发芽数/测试种子总数×100%)[13]。此外,将NtHPL1-OE 与WT 的烟苗移栽到花盆中,生长至旺长期后各分为4 份,每份NtHPL1-OE 和WT 各3盆,采用1.1节中的方法对4份烟株分别进行0、4、6、10 d 的干旱胁迫处理,以处理0 d 为对照(CK2),观察不同处理下烟株的生长状况并拍照记录;分别取不同处理下NtHPL1-OE(3株)和WT(3株)的上部叶片,检测可溶性糖[14]、叶绿素、脯氨酸、丙二醛(MDA)含量(质量分数)并计算3株含量的平均值。
2 结果与分析
2.1 烟草NtHPL1基因克隆及序列分析结果
分别以普通烟草K326 的gDNA 和cDNA 为模板进行PCR 扩增,扩增产物的琼脂糖凝胶电泳检测结果如图1A 所示。测序结果显示,克隆获得的NtHPL1 基因全长为4 670 bp,包含2 个外显子和1个内含子(图1B),其编码区全长为1 365 bp,编码454个氨基酸,命名为NtHPL1。通过比对拟南芥、番茄、辣椒和马铃薯的HPL 和烟草NtHPL1 蛋白的氨基酸序列,发现NtHPL1 蛋白属于细胞色素P450(CytP450)蛋白质家族,具有CytP450 家族典型的A、B、C和D结构域[15](图2)。
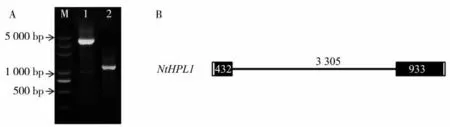
图1 NtHPL1基因的琼脂糖凝胶电泳图及基因结构Fig.1 Agarose gel electrophoresis and gene structure of NtHPL1 gene

图2 不同植物HPL蛋白序列对比Fig.2 Sequence alignment of HPL proteins in different plants
使用MEGA 7.0 软件构建NtHPL1 与其他植物HPL蛋白的系统发育进化树,结果如图3所示。烟草NtHPL1 蛋白属于13-HPL 亚家族,与渐狭叶烟草(Nicotiana attenuata)关系最近,与番茄、马铃薯、辣椒、拟南芥、葡萄(Vitis vinifera)HPL蛋白也具有较近的亲缘关系。

图3 不同植物HPL蛋白的系统进化树Fig.3 Phylogenetic tree for HPL proteins in different plants
2.2 NtHPL1蛋白结构分析结果
使用ProtParam在线工具分析NtHPL1蛋白的理化性质,分析结果如表2 所示。NtHPL1 蛋白含454个氨基酸,相对分子量为51.20 kDa,脂肪系数为82.38,理论等电点为6.16,正、负电荷残基数分别为47和50个,不稳定性系数为34.46。该蛋白的总平均亲水性为-0.206(正值为疏水性,负值为亲水性);通过ProtScale 在线工具对该蛋白的亲/疏水性进行分析(图4),发现NtHPL1蛋白的亲水区域(亲/疏水性得分为负值)多于疏水区域(亲/疏水性得分为正值),推测烟草NtHPL1 蛋白属于亲水性蛋白。使用TMHMM在线工具预测NtHPL1蛋白的跨膜区域(图5),发现该蛋白的454个氨基酸均位于膜外,不存在跨膜区域。

图4 NtHPL1蛋白的亲/疏水性预测结果Fig.4 Hydrophilicity/hydrophobicity prediction results of NtHPL1 protein

表2 NtHPL1蛋白的理化性质分析结果Tab.2 Physicochemical properties analysis results of NtHPL1 protein
NtHPL1蛋白的二级结构主要包含a-螺旋、延伸链、β-转角、无规则卷曲,a-螺旋和无规卷曲分别占38.55%和40.97%(表3)。由图6 可见二级结构在NtHPL1蛋白中的具体分布。其中,a-螺旋主要分布在蛋白的中间,延伸链主要分布在两端。

图6 NtHPL1蛋白的二级结构预测结果Fig.6 Secondary structure prediction results of NtHPL1 protein

表3 NtHPL1蛋白二级结构Tab.3 Secondary structure of NtHPL1 protein
2.3 烟草不同组织及不同发育时期烟叶的NtHPL1基因相对表达量
检测烟草不同组织、不同发育时期烟叶的NtHPL1基因相对表达量,结果如图7A所示。NtHPL1基因在烟草所有组织中均表达,在花中相对表达量最高,在茎中相对表达量最低。烟草不同发育时期烟叶的NtHPL1基因相对表达量不同(图7B),盛花期的相对表达量最低,成熟期的相对表达量最高。
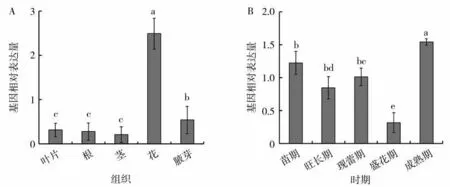
图7 烟草不同组织及不同发育时期烟叶的NtHPL1基因相对表达量Fig.7 Relative expression levels of NtHPL1 gene in different tissues of tobacco and in tobacco leaves at different developmental stages
2.4 干旱和盐胁迫下旺长期烟叶的NtHPL1基因相对表达量
检测干旱胁迫处理0、2、4、6 d 旺长期烟叶的NtHPL1 基因相对表达量,结果如图8A 所示。干旱胁迫处理后烟叶中NtHPL1基因相对表达量升高,处理6 d 的基因相对表达量最高,是处理0 d 基因相对表达量的3.19 倍。为分析盐胁迫对NtHPL1 基因相对表达量的影响,对普通烟草K326 分别进行0、100和200 mmol/L NaCl 处理(图8B),发现100 和200 mmol/L NaCl 处理后的烟叶中NtHPL1 基因相对表达量显著高于0 mmol/L NaCl 处理后的烟叶,分别是0 mmol/L NaCl 处理后烟叶的1.94 倍和2.63 倍。可见,NtHPL1基因表达受干旱和盐胁迫的诱导。

图8 干旱和盐胁迫下烟叶的NtHPL1基因相对表达量Fig.8 Relative expression levels of NtHPL1 gene in tobacco leaves under drought and salt stress
2.5 NtHPL1基因过表达烟草的抗盐和抗旱性
通过转基因技术获得NtHPL1过表达株系,采用qPCR方法从中筛选出NtHPL1基因相对表达量最高的植株(NtHPL1-OE)(图9)。NtHPL1-OE 株系的NtHPL1 基因相对表达量显著高于K326,是K326 NtHPL1基因相对表达量的22.46倍。
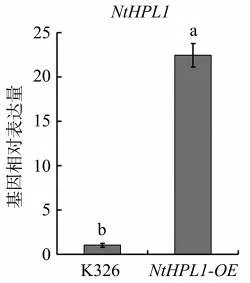
图9 NtHPL1转基因烟草的鉴定Fig.9 Identification of NtHPL1 transgenic tobacco
观察NaCl 和CK1 处理下NtHPL1-OE 和WT 的生长状况(图10),发现CK1处理的NtHPL1-OE和WT的生长状况无明显差异;NaCl 处理的NtHPL1-OE 能够正常生长,而WT 叶片发黄萎蔫、根茎矮小,表明过表达NtHPL1 基因能够增强烟草对盐胁迫的抗性。检测盐胁迫处理下NtHPL1-OE和WT的种子发芽率及烟叶中的叶绿素、脯氨酸、丙二醛含量,结果如图11 所示。将种子培养于含NaCl 的固体培养基上,培养7 d 后NtHPL1-OE 的种子发芽率为78.75%,WT 的种子发芽率为66.67%;NaCl 处理0~20 d NtHPL1-OE的叶绿素含量高于WT,且处理15 d NtHPL1-OE的叶绿素含量最高,是处理15 dWT叶绿素含量的6.31 倍;NaCl 处理下NtHPL1-OE 的脯氨酸含量逐渐升高,处理20 d NtHPL1-OE 的脯氨酸含量是处理20 d WT脯氨酸含量的2.41倍;NaCl处理0~20 d NtHPL1-OE 的丙二醛含量均低于WT。以上结果表明,过表达NtHPL1基因能够提高盐胁迫处理下烟草种子的发芽率,调控烟叶中的叶绿素、脯氨酸和丙二醛含量,增强烟草对盐胁迫的抗性。

图10 盐胁迫下NtHPL1过表达烟草的生长情况Fig.10 Growth of NtHPL1-overexpressed tobacco under salt stress
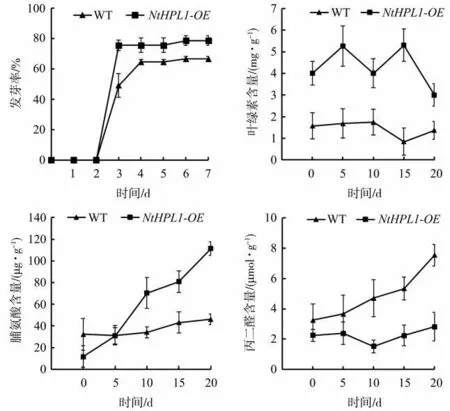
图11 盐胁迫对烟草发芽率及烟叶叶绿素、脯氨酸、丙二醛含量的影响Fig.11 Effects of salt stress on germination rate of tobacco and contents of chlorophyll, proline and malondialdehyde in tobacco leaves
观察干旱胁迫处理下NtHPL1-OE 和WT 的生长状况(图12),发现处理4和6 d的NtHPL1-OE生长正常,与CK2 相比无明显差异,而WT 叶片萎蔫,生长被抑制;处理10 d 的WT 和NtHPL1-OE 均有植株矮小、叶片发黄的症状,但NtHPL1-OE比WT的叶片更大,叶片数量更多。检测干旱胁迫处理下NtHPL1-OE 和WT 叶片中的可溶性糖、叶绿素、脯氨酸和丙二醛含量,结果如图13 所示。干旱处理0~10 d NtHPL1-OE 的可溶性糖含量和叶绿素含量均高于WT。相比处理0 d,处理10 d NtHPL1-OE 的可溶性糖含量降低46.98%,而WT 的可溶性糖含量降低31.81%;处理10 d WT的叶绿素含量降低38.06%,而NtHPL1-OE的叶绿素含量升高4.51%;处理10 d WT和NtHPL1-OE的脯氨酸含量分别增加1.79倍和3.39倍;处理0~10 dNtHPL1-OE的丙二醛含量均低于WT。以上结果表明,NtHPL1-OE受干旱胁迫的影响低于WT,NtHPL1-OE过表达烟草抵御干旱胁迫的能力更强。

图12 干旱胁迫下NtHPL1过表达烟草生长情况Fig.12 Growth of NtHPL1-overexpressed tobacco under drought stress

图13 干旱胁迫对烟叶可溶性糖、叶绿素、脯氨酸及丙二醛含量的影响Fig.13 Effects of drought stress on contents of soluble sugar, chlorophyll, proline, and malondialdehyde in tobacco leaves
3 讨论
本研究中发现烟草NtHPL1 蛋白与同为茄科植物的马铃薯、番茄和拟南芥亲缘关系最近。由于马铃薯[16]、番茄[17]和拟南芥的HPL 蛋白均被定位于叶绿体中[18-20],推测烟草NtHPL1蛋白可能也位于叶绿体中,但仍需进一步验证。本研究中发现盐和干旱胁迫处理下烟叶的NtHPL1基因相对表达量升高,表明NtHPL1基因可能参与烟草抗逆过程,这与对葡萄VvHPL1 基因的研究结果[21]相似。在盐和干旱胁迫下,NtHPL1过表达烟草叶片的脯氨酸含量比野生型烟草高,丙二醛含量比野生型烟草低,说明NtHPL1过表达烟草的细胞损害程度更小,抗盐性和抗旱性更强,这与Lim 等[22]的研究结果一致。NtHPL1基因是否响应除盐和干旱以外的其他非生物胁迫仍需进一步研究。
4 结论
在普通烟草K326 中同源克隆NtHPL1 基因,该基因编码含454 个氨基酸的蛋白。蛋白结构和发育进化分析结果表明烟草NtHPL1 蛋白属于13-HPL 家族。在烟草根、茎、叶片、花和腋芽中均检测到NtHPL1 基因的表达,在花中NtHPL1 基因相对表达量最高;烟草不同发育时期烟叶的NtHPL1基因相对表达量不同,盛花期最低,成熟期最高;盐和干旱胁迫均能诱导NtHPL1 基因表达,表明该基因可能参与烟草的抗盐、抗旱过程。创制NtHPL1-OE 过表达遗传材料,对野生型烟草和NtHPL1 过表达烟草同时进行盐和干旱胁迫处理,发现处理后的NtHPL1 过表达烟草能够正常生长,而野生型烟草叶片发黄萎蔫;与野生型烟草相比,处理后的NtHPL1 过表达烟草叶片中的叶绿素和脯氨酸含量更高,丙二醛含量更低,具有更强的盐和干旱胁迫耐受性,表明过表达NtHPL1 基因可提高烟草的抗盐性和抗旱性。

