辣木叶水提物对大鼠肝纤维化的改善作用及机制
杨学芳,董馨忆,普吉霞,刘建昆,马 立 ,张志毕,
(1.昆明医科大学,云南昆明 650500;2.解放军联勤保障部队第九二〇医院,云南昆明 650032;3.大理农林职业技术学院,云南大理 671003)
肝脏纤维化(Hepatic Fibrosis,HF)是一种肝脏组织无效的损伤-修复,是多种慢性肝脏疾病中后期共同的病理过程,主要的病理表现为细胞外基质(Extracellular Matrix,ECM)积累和瘢痕形成[1]。当肝脏受到严重破坏或持续损伤时,ECM 大量积累,纤维增生向肝实质细胞间隙延伸,并逐渐形成纤维索及纤维间隔,纤维间隔继续发展则连接形成纤维包裹[2]。HF 之前的肝脏病变都是可逆的,但是当肝脏疾病发展到肝硬化和肝癌阶段,是不可逆转的,所以在HF 阶段及时阻止并逆转肝脏疾病的发展,对于各种肝脏疾病的治疗具有重要的意义[3]。
人类机体很容易受到氧化应激的伤害,氧化应激是指机体内活性氧(ROS)积累过多,造成细胞和组织损伤的一种病理状态,ROS 诱导的细胞损伤及炎症反应,影响细胞膜和细胞器的结构,释放大量的炎症因子,导致肝星状细胞(Hepatic Stellate Cells,HSC)活化、增殖和细胞外基质的合成、积累,导致HF 的形成[4]。研究发现ROS 与酒精性肝病和病毒性肝炎导致的HF 发生具有密切的关系,在HF 患者或实验性HF 模型动物的血清和肝脏组织中,都检测到高浓度的ROS 表达[5-6]。研究表明转化生长因子β1(Transforming Growth Factorβ1,TGF-β1)与ROS具有协同作用,共同介导HF 的发生。一方面TGFβ1 激活细胞膜氧化酶和促进细胞线粒体复合物IV 活性,导致细胞ROS 合成增加;另一方面,TGFβ1 抑制抗氧化还原酶的表达,降低细胞清除ROS 的能力,导致细胞内ROS 积累[7]。ROS 的积累会促进了TGF-β1 的表达,TGF-β1 与细胞膜表面受体结合后招募Smad2 和Smad3 形成蛋白复合物,Smad2/3蛋白复合物被ROS 介导的磷酸化激活后转移进入细胞核,作为转录因子与下游靶基因DNA 结合,激活a-SMA、胶原纤维等HF 基因的表达,导致HF 发生[8],因此抗氧化是治疗HF 的重要方法。
辣木(Moringa oleiferaLam.)主要分布于我国云南、广东、福建、台湾等地[9],2012 年,辣木叶被卫生部批准为新资源食品。辣木含有丰富的蛋白质、维生素、多糖、多酚等多种营养成份和活性物质,具有抗氧化、抑菌、降血糖、降血脂、抗肿瘤、清热解毒等功效,是一种药食同源的中草药[10-11]。研究发现辣木叶乙醇提取物具有较强的抗氧化作用[12],对高脂饮食导致的肝损伤及高脂血症[13]、CCl4诱导的肝损伤[14]、奥氮平诱导的糖脂代谢紊乱[15]和肝癌[16]都具有一定的保护作用,其保护作用机制与抗氧化损伤、提高脂肪代谢速率和促进肝癌细胞凋亡有关,但是对辣木叶对肝纤维化是否具有改善作用缺乏目前尚无报道。
因此,本研究建立大鼠肝纤维化模型,用辣木叶水提物(LM)灌胃治疗后检测LM 对大鼠肝纤维化病理损伤、肝脏功能和氧化应激的影响,旨在探讨LM 对肝纤维化的改善作用,为辣木叶资源的开发利用提供研究基础。
1 材料与方法
1.1 材料与仪器
SPF 级雄性大鼠 60 只,6 周龄的,体重180~200 g,购买自昆明医科大学实验动物学部,动物生产使用许可证SYXK(滇)K2020-0006,本研究获得昆明医科大学实验动物伦理委员会的批准通过(批准编号:kmmu20211491);硫代乙酰胺(纯度≥98%)Sigma 公司;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、羟脯胺酸(HYP)试剂盒 南京建成生物工程有限公司;PCIII、IV-C ELISA试剂盒 上海酶联生物科技有限公司;LN ELISA 试剂盒、HA ELISA 试剂盒 武汉华美生物工程有限公司;TGF-β1、α-SMA 一抗 武汉华美生物工程有限公司;Smd2 一抗、Smad3 一抗 ABclonal 公司;总RNA提取试剂盒 Axygen 公司;逆转录试剂盒 Thermo Scientific 公司;实时荧光定量PCR 试剂盒 宝生生物工程有限公司;秋水仙碱片 云南昊邦制药有限公司;辣木叶干粉 陕西泰科生物科技有限公司。
Synergy2 型多功能酶标仪 美国Biotek 公司;Centrifuge5804R 型冷冻离心机 德国Eppendorf 公司;EG1150 石蜡包埋机、RM2245 切片机、DMLIM显微镜 德国Leica 公司;GCZX3 型垂直电泳仪及转膜仪 美国BD 公司;QuantStudioTM 6 Flx 型实时荧光定量聚合酶链式反应(Real-time PCR)仪 美国Thermo Fisher 公司。
1.2 实验方法
1.2.1 辣木叶水提取物制备 辣木叶干粉200 g,加入2 L 超纯水煮沸10 min,冷却到室温后用2 μm 滤膜过滤,溶液经5000 r/min 离心10 min 后真空冷冻干燥,得到褐绿色的辣木叶水提物粉末(LM),-20 ℃冷冻保存,每次灌胃前需用生理盐水现配为相应的浓度。
1.2.2 动物分组及处理 60 只大鼠随机分为空白组、模型组、秋水仙碱组(100 mg/kg·d)、LM 高、中、低剂量组(剂量分别为200、100、50 mg/kg·d),每组10 只,除空白组外,其余组大鼠隔天注射硫代乙酰胺(TAA,剂量160 mg/kg)1 次,共注射8 周[17],自造模开始后的第5 周开始灌胃,药物组灌胃1 mL/kg 药物,1 次/d,空白组和模型组灌胃等量生理盐水,灌胃至第8 周结束后处死大鼠,取大鼠血清和部分肝脏-80 ℃保存,另一部分肝脏用10%甲醛溶液固定。
1.2.3 检测指标
1.2.3.1 体重和肝脏指数检测 给药处理期间每周检测1 次大鼠体重,给药结束后取大鼠肝脏,用预冷生理盐水快速清洗后滤纸吸干,称量肝脏质量,计算肝脏指数,肝脏指数=肝脏重量/大鼠体重×100。
1.2.3.2 肝脏功能、氧化应激水平和HF 指标检测大鼠血清样根据试剂盒说明书检测转氨酶ALT、AST 浓度评价肝脏功能;检测肝脏ROS、MDA 浓度和SOD 活性,评价肝脏氧化应激水平和抗氧化能力;检测血清HF 四项指标(PCIII、IV-C、LN、HA)和羟脯氨酸(HYP)浓度,评价HF 程度。
1.2.3.3 肝脏组织病理学观察 肝脏组织于甲醛固定液中固定7 d。脱水透明后石蜡包埋,切片后脱蜡、水化,然后进行Masson 染色,封片后显微镜下观察肝脏纤维化水平,根据Ishak 评分标准评估大鼠HF 程度,根据肝脏纤维化严重程度评分为0~6 分,分值越大代表纤维化程度越严重[18]。
1.2.3.4 肝脏TGF-β1/Smads 通路基因表达检测蛋白表达检测:肝脏组织约30 mg,加入蛋白裂解液后超声匀浆,冰浴裂解30 min 后12000 r/min 离心10 min,取上清用BCA 法检测蛋白浓度,10% SDS聚丙烯酰胺凝胶电泳后将蛋白质通过湿转转移到PVDF 膜上,5%脱脂奶粉室温2 h 封闭后加入一抗孵育过夜,清洗后加入二抗室温孵育2 h,ECL 化学放光检测蛋白表达,Image J 软件分析目的蛋白条带相对表达量。mRNA 表达检测:肝脏组织约20 mg提取总RNA,然后逆转录合成cDNA。NCBI 网站设计大鼠TGF-β1、Smad2/3、α-SAM、β-actin(内参)基因引物,并通过Blast 确定引物的特异性。根据实时荧光定量试剂盒操作说明检测目的基因mRNA表达水平。采用2-△△CT法分析每个基因mRNA 的相对表达量。引物信息见表1。

表1 PCR 引物序列Table 1 Sequence of PCR primer
1.3 数据处理
数据使用GraphPad Prism 5.0 进行统计分析和绘图,数据以平均值±标准差表示,组间比较采用单因素方差分析方法,P<0.05 代表组间差异有统计学意义。
2 结果与分析
2.1 大鼠一般情况观察
实验观察发现空白组大鼠精神状态好,毛发光泽,体重增长稳定。与空白组比较,模型组大鼠精神萎靡,毛发干枯且颜色暗淡,进食和饮水减少,行动迟缓,体重极显著降低(P<0.01),肝脏指数极显著增加(P<0.01),符合文献[17]报道的HF 模型特征。与模型组比较,给药后(第8 周)LM 组和秋水仙碱组大鼠精神状态均有所改善,进食和饮水量增加,毛发恢复光泽,体重均显著增加(P<0.05,P<0.01),肝脏指数也显著降低(P<0.05,P<0.01)。本结果显示LM 具有改善大鼠精神状态和显著下调肝脏指数的作用,见表2。
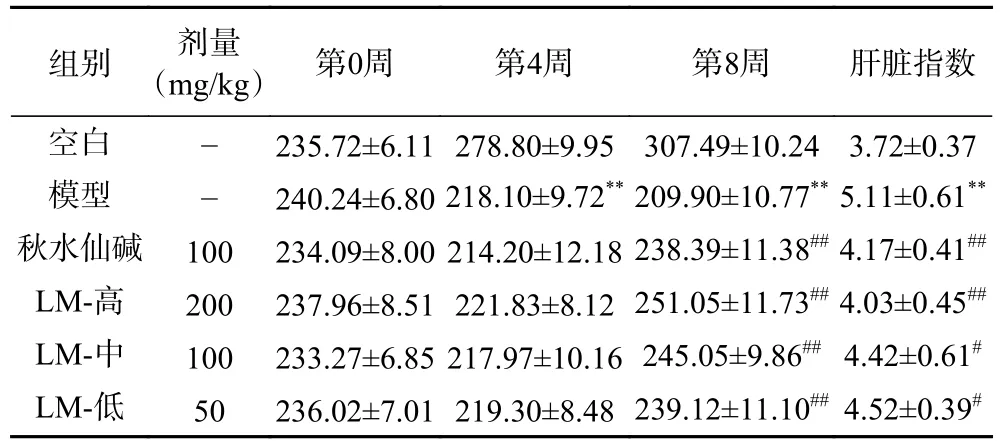
表2 LM 对HF 大鼠体重和肝脏指数的影响Table 2 Effects of LM on body weight and liver index in HF rats
2.2 辣木叶对HF 大鼠肝脏功能的保护作用
结果见表3,与空白组比较,模型组大鼠血清AST 和ALT 浓度都显著升高(P<0.01),表明HF 大鼠肝脏功能受到损伤。秋水仙碱是逆转肝纤维和的药物之一,陶柏楠等[19]、胥文娟等[20]研究发现秋水仙碱能够降低HF 大鼠血清ALT 和AST,改善肝脏功能,本研究也发现,秋水仙碱组大鼠血清ALT 和AST 浓度较模型组显著降低(P<0.01),表明秋水仙碱能够改善HF 大鼠肝脏功能。与模型组比较,LM高、中、低剂量都能够显著降低HF 大鼠血清AST和ALT 浓度(P<0.05 或P<0.01)。本结果显示LM能够改善大鼠肝脏功能。

表3 LM 对HF 大鼠血清AST、ALT 浓度和肝纤维化评分的影响Table 3 Effects of LM on serum AST,ALT levels and liver fibrosis score in HF rats
2.3 LM 改善HF 大鼠肝纤维化病理损伤
HF 病理损伤和肝纤维化评分如图1 和表2 所示,空白组大鼠肝脏组织细胞大小均匀,排列规整,细胞形态清晰,沿中央静脉呈现放射状分布,无炎性细胞浸润,也无变形和坏死。模型组大鼠肝脏细胞排列混乱,肝细胞显著变性,肝小叶结构遭到破坏,细胞染色不均,部分细胞呈空泡样改变,外基质分泌较多,汇管区纤维增生严重,形成清晰的纤维间隔,HF 评分极显著增加(P<0.01),表明本研究成功建立了大鼠HF模型。与模型组比较,秋水仙碱组HF 大鼠肝脏组织纤维增生显著减少,肝细胞空泡样改变得到显著缓解,炎性浸润程度降低,肝脏细胞排列相对规整,HF评分极显著降低(P<0.01)。而LM 高剂量组大鼠肝脏组仅能观察到少量纤维增生和聚集,无肝细胞变性盒空泡样改变,HF 评分较模型组极显著降低(P<0.01),LM 抗HF 病变的疗效和降低HF 评分较秋水仙碱组有更大程度的改善,LM 中、低剂量组也能在不同程度上缓解HF 大鼠HF 组织病变,并极显著降低HF 评分(P<0.01)。

图1 LM 减轻HF 大鼠肝纤维化损伤(200×)Fig.1 LM attenuates liver fibrosis injury in HF rats (200×)
2.4 LM 降低HF 大鼠肝纤维化指标
肝脏细胞的炎性改变可以刺激纤维组织增生,导致血清HF 四项指标(PCIII、IV-C、LN 和HA)的异常升高,升高的幅度随着HF 的程度加重而增加,因此血清肝纤四项的浓度可以作为评价HF 程度的指标[21]。HYP 是胶原纤维的主要成分之一,当肝脏内胶原纤维异常增多时,肝脏组织中的HYP 含量也会随之升高,因此HYP 含量与HF 程度密切相关[22]。血清肝纤四项检测结果见表4,与空白组比较,模型组大鼠血清肝纤四项指标和肝脏HYP 含量都极显著高于空白组(P<0.01),表明HF 大鼠肝纤维化病变严重。与模型组比较,秋水仙碱组肝纤四项和HYP 浓度都显著降低(P<0.05,P<0.01),而LM 也能够显著降低大鼠血清中肝纤四项指标和HYP 的含量(P<0.05,P<0.01),并且呈现剂量依赖关系。整体分析,LM 高剂量组对肝纤四项和HYP 含量的影响与秋水仙碱组相当。本结果显示LM 能够抑制大鼠HF 的发生和发展。
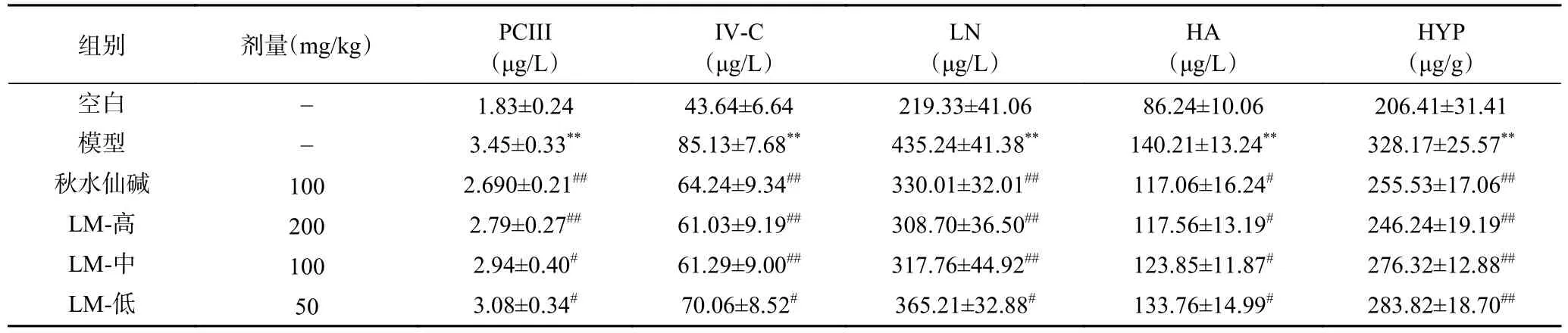
表4 LM 对HF 大鼠肝纤维化指标含量的影响Table 4 Effects of LM on the content of liver fibrosis markers in HF rats
2.5 LM 对肝脏组织氧化应激的影响
HF 的发生与氧化应激密切相关,课题组前期已证实LM 具有抗氧化作用[15],LM 对HF 大鼠肝脏氧化应激影响的结果见表5,与空白组比较,模型组大鼠肝脏组织氧化应激指标ROS 和MDA 含量都极显著高于空白组(P<0.01),抗氧化酶SOD 活力显著降低(P<0.01),表明HF 大鼠肝脏组织处于氧化应激状态,肝脏组织抗氧化损伤能力降低。与模型组比较,LM 组大鼠肝脏组织ROS 和MDA 含量显著降低(P<0.05,P<0.01),肝脏SOD 活力显著增加(P<0.05,P<0.01),表明LM 具有抗氧化作用,可降低HF 大鼠肝脏组织的氧化应激水平。

表5 LM 对HF 大鼠肝脏组织氧化应激的影响Table 5 Effects of LM on oxidative stress in liver tissue in HF rats
2.6 LM 对肝脏TGF-β1/Smads 通路基因表达的影响
mRNA 检测结果见表6,模型组大鼠肝脏组织TGF-β1/Smads 通路基因,包括TGF-β1、Smad2、Smad3和α-SMA基因mRNA 表达较空白组都极显著增加(P<0.01)。与模型组相比,秋水仙碱组α-SMA基因mRNA 表达极显著降低(P<0.01),而TGF-β1、Smad2、Smad3基因mRNA 表达无明显变化;LM 高剂量组TGF-β1基因mRNA 表达显著降低(P<0.05);LM 高、中剂量组Smds2基因mRNA表达显著降低(P<0.05);LM 高、中、低剂量组Smds3和α-SMA基因mRNA 表达都显著降低(P<0.05,P<0.01)。

表6 LM 对HF 大鼠肝脏TGF-β1/Smads 通路基因mRNA 表达的影响Table 6 Effects of LM on mRNA expression of TGF-β1/Smads pathway genes in the liver of HF rats
蛋白表达检测结果见图2,与空白组比较,模型组大鼠肝脏TGF-β1、Smad2、Smad3 和α-SMA基因蛋白表达都极显著升高(P<0.01)。与模型组比较,秋水仙碱组TGF-β1、Smad2、Smad3和α-SMA蛋白表达都极显著降低(P<0.01);LM 高、中剂量组TGF-β1、Smad2、Smad3和α-SMA蛋白表达都显著降低(P<0.05 或P<0.01);LM 低剂量组Smad3和α-SMA表达显著降低(P<0.05,P<0.01)。基因表达检测结果显示模型组大鼠肝脏组织TGF-β1/Smads 通路被激活,肝星状细胞被活化,而LM 能够下调TGF-β1/Smads 通路表达,抑制肝星状细胞的活化。
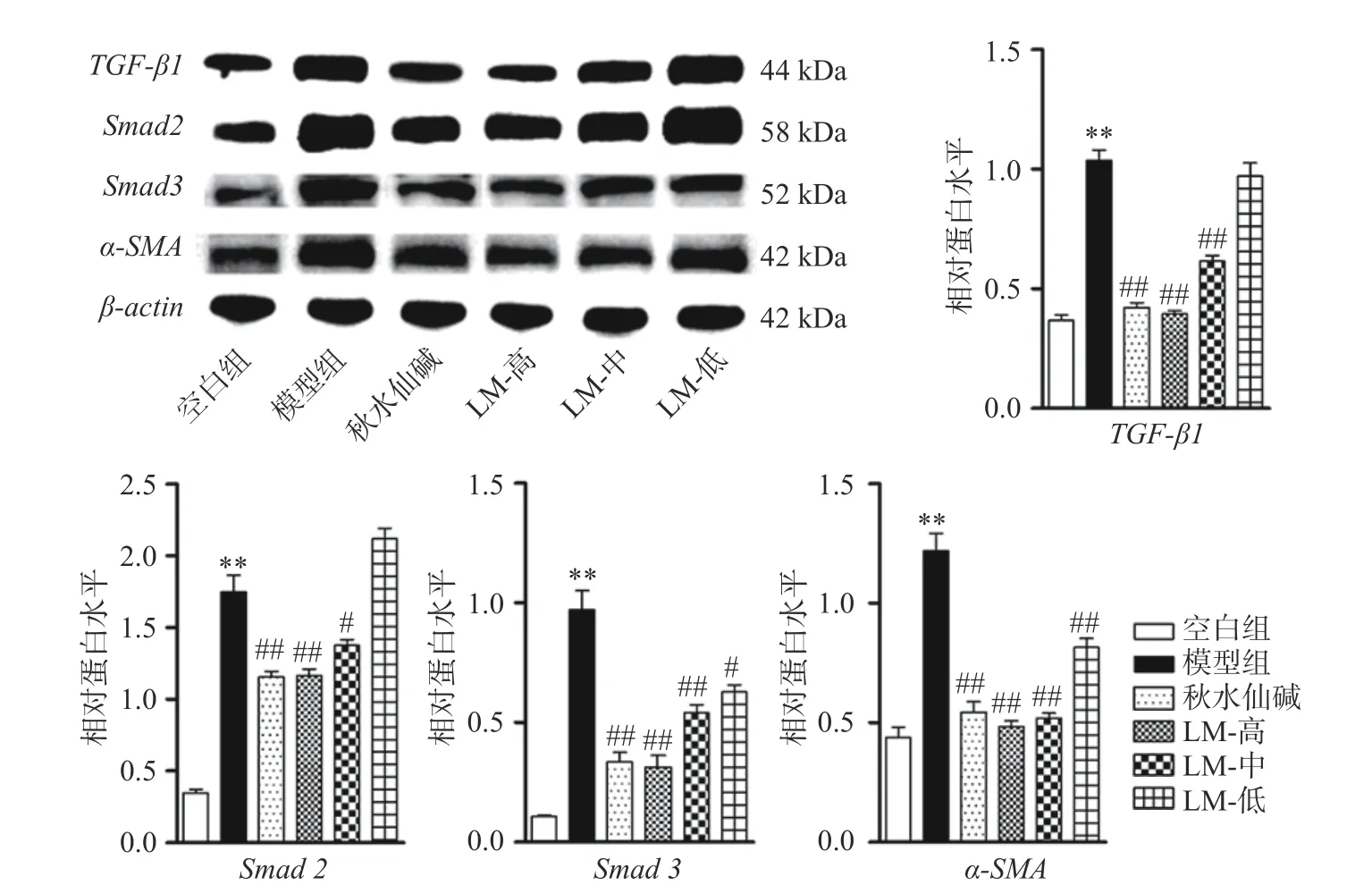
图2 LM 对HF 大鼠肝脏TGF-β1/Smads 通路基因蛋白表达的影响Fig.2 Effects of LM on protein expression of TGF-β1/Smads pathway genes in the liver of HF rats
3 讨论与结论
HF 的发生与氧化应激和炎症损伤密切相关,TGF-β1、血小板衍生生长因子(Platelet Derived Growth Factor,PDGF)、肿瘤坏死因子α(Tumor Necrosis Factor,TNF-α)等细胞因子使静息状态的HSC 被激活,合成以α-SMA 为标志物的活化蛋白,被活化的肝星状细胞进一步转化为肌成纤维细胞,肌成纤维细胞在各种细胞因子、趋化因子、生长因子的作用下,不断增殖并分泌ECM[23]。此外,ROS 等刺激会导致ECM 在肝脏组织中积累,形成纤维化瘢痕,影响肝脏的正常功能。所以消除损伤因素,降低HSC 的活化和增殖,是治疗HF 的主要策略之一[24]。辣木叶富含抗氧化活性物质,因此推测其可能通过抗氧化作用清除ROS 等肝损伤因素,逆转肝纤维化。
肝毒试剂TAA 诱导大鼠肝脏发生氧化应激,TAA 处理后大鼠肝脏ROS 含量和脂质氧化产物MDA[25-26]含量都显著增加,肝脏处于氧化应激损伤状态,肝脏组织内的ALT 和AST 会释放进入血液中[27],血清中ALT 和AST 含量可以作为评价肝脏功能的指标[28]。本研究检测也证实了TAA 诱导氧化应激损伤后,肝脏ROS 和MDA 含量都显著增加,血清ALT 和AST 浓度显著增加,大鼠肝脏功能受到损伤,而LM 能够显著的降低肝脏氧化应激状态,保护肝脏功能。
肝星状细胞被激活后,会大量合成、分泌PCIII、IV-C、LN、HA 等肝脏胶原纤维成份,这些成份血清含量可以作为评价HF 的指标[29]。HYP 是胶原蛋白中特有的氨基酸成份,肝脏组织中HYP 含量也可以评价HF 程度[30]。本研究检测了大鼠血清PCIII、IV-C、LN、HA 和肝脏HYP 含量,发现模型组大鼠上述指标都显著升高,表明TAA 处理成功诱导了大鼠HF 的发生。LM 处理后,大鼠HF 指标显著降低,表明LM 成功减缓了大鼠肝脏纤维组织沉积,该结果也通过Masson 染色的结果得到了验证。
在HF 发生过程中,ROS 能显著促进TGFβ1 的表达[31],而TGF-β1 可通过抑制抗氧化还原酶的表达,如谷氧还原蛋白、过氧化氢(catalase,CAT)、SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等,降低细胞清除ROS 的能力,导致细胞内ROS 进一步积累。TGF-β1 与受体结合后,招募Smads 蛋白形成复合物,Smads 蛋白复合物被磷酸化后转移进入细胞核内,激活下游HF靶基因的表达,导致肝星状细胞活化标志物α-SMA 表达上调[32]、ECM 合成和分泌增加[3]。因此,TGF-β1 和ROS 协同作用,一方面促进HSC 活化和增殖,增加ECM 的合成;另一方面能够抑制与ECM 降解相关的蛋白表达,抑制ECM 的降解。本研究发现,在TAA 诱导的纤维化肝脏组织内,肝脏组织ROS 和MDA 含量显著增 加,TGF-β1/Smads 通路激活,TGF-β1 表达显著增加,其结合蛋白Smad2/3 表达也显著增加,因此ROS-TGF-β1/Smads 通路的激活是HF 发生的重要因素。而LM 处理后,大鼠肝脏组织ROS 和MDA 浓度都显著降低,TGF-β1、Smad2/3和、下游靶基因α-SMA表达都显著降低,胶原纤维含量也显著降低,表明LM 可能通过抗氧化作用提高机体清除ROS 的能力,抑制ROS-TGF-β1/Smads通路的激活,进而抑制下游肝星状细胞的活化和ECM 的合成、分泌,减轻HF 损伤。
多项研究表明,辣木叶提取物具有抗氧化、抗炎、增强免疫力等广泛的药理作用[10],本研究结果显示LM 能够提高机体抗氧化能力,显著降低HF 大鼠肝脏ROS 含量,改善大鼠HF 损伤。作用机制研究结果显示,LM 能够显著抑制HF 大鼠肝脏TGFβ1/Smads 通路TGF-β1、Smad2/3和下游α-SMA、胶原纤维基因的表达,推测LM 可能通过调控ROSTGF-β1/Smads 通路发挥抗肝纤维化作用,但是LM改善HF 的药效物质基础还需要进一步的研究。

