Ti-Al-Fe-O熔体中氧化铝析出行为的研究
戎宇航, 朱翔鹰*, 陈军修, 吴长军,涂浩, 王建华, 苏旭平
(1.江苏省材料表面科学与技术重点实验室,江苏 常州 213164; 2.常州大学材料科学与工程学院,江苏 常州 213164)
近年来含钛钢种迅速发展,已经从传统的含钛不锈钢扩展至无间隙原子钢[1]、双相钢[2]、耐火钢[3]、低合金高强钢[4]、微合金碳钢[5-9]等。由于钛元素可以和碳、氮、氧等元素形成稳定的化合物,因此钢中添加钛元素可以起到钉扎碳原子、脱氧、脱气、晶粒细化和合金化等作用[10]。钛铁合金是炼钢中最重要的钛元素添加剂,不断涌现的先进含钛钢种对钛铁合金的成分要求也愈来愈高。钛铁合金尤其是高钛铁合金(ω(Ti)=65%~75%)须满足低铝低氧的要求,即ω(Al)和ω(O)须分别低于2 %。目前钛铁合金的生产方法主要是重熔法[10-11]和铝热还原法[12-14]。重熔法利用金属铁和金属钛重熔获得钛铁合金,该法能满足钛铁合金低铝低氧的要求,但金属钛资源少而且价格高,限制了应用范围。铝热法利用钛铁矿、金红石、铝粉、氧化剂、造渣剂在炉外点火熔炼获得钛铁合金,该法效率高、成本低、综合污染少。铝热法生产的ω(Ti) ≤ 40%钛铁合金能满足低铝低氧的要求,但高钛铁不能。
为了追求低铝低氧目标,研究人员开展了铝热法制备高钛铁的脱氧极限、ω(Al)和含氧相之间的关系的研究。CHUMAREV等[15]指出仅用铝作还原剂无法制备出ω(O)低于5%的高钛铁,原因是合金的初始凝固相中含有Ti-Fe-O固溶体和Ti4Fe2O化合物,除此以外合金中还有Ti3O2和TiO相。他们还总结了ω(Al)为8%~10%时,ω(Ti)、ω(O)遵循如下经验关系式:
牛丽萍等[16]、豆志河等[17-19]、宋雪静等[20]研究了基于铝热法的粗高钛铁和精炼高钛铁的制备工艺,其中粗高钛铁仅采用铝作为还原剂,其成分见表1;研究得出高钛铁中的含氧相主要为Al2O3、Fe2TiO4、Ti2O、钛氧固溶体相。程楚[21]系统研究了铝热法中铝、石灰、配热量对高钛铁中Al、O等含量的影响,以及对含氧相、合金收得率、渣金分离的影响,发现含氧相主要为Ti4Fe2O和TixO,并且随着合金中ω(Al)增高,这些含氧相会减少。张鉴等[22]还利用金属熔体共存理论,为Ti-Al-Fe-O系建立了理论计算模型,当式(2)的吉布斯自由能变化等于0时熔体的ω(O)定义为体系的脱氧极限。

表1 铝热法制备高钛铁合金成分Table 1 Chemical composition of high ferrotitanium prepared by aluminothermy单位:%(质量分数)
因为铝热反应条件(发热剂量、造渣剂量、温度、原料纯度等)各不相同,导致表1中的数据并没有很好的一致性,比如:序号1和序号4、序号3和序号6、序号7和序号8。每个研究者获得了不同条件下的脱氧参数,无法形成一个相对固定的比较基准。。
本文认为应该以一定温度下Ti-Al-Fe-O系熔体中Al2O3析出曲线作为脱氧极限的基准来研究,也就是Ti-Al-Fe-O系熔体的高温相图,排除造渣剂、温度、杂质元素的干扰,获得在不同成分下熔体析出Al2O3时的平衡浓度,同时研究该体系快速冷却析出相和顺序。有了相对不变的基准,那么造渣剂、温度和杂质等因素的影响就可以比较。然而由于体系中有些相熔点很高,而且钛铝元素非常活泼,相图实验难以展开。针对上述问题,设计了一套实验方案来近似模拟高温高速冷却析出实验。本实验固定ω(O)为5%,ω(Ti)变化范围为30%~75%,研究Ti-Al-Fe-O系高温熔体中临界析出Al2O3相所需的ω(Al),并根据快冷微观组织分析推断了固相的析出反应及顺序。
1 实验部分
1.1 实验原料
实验原料:Ti粉(纯度≥99.9%),Fe粉(纯度≥99.9%),Al粉(纯度≥99.9%),TiO2粉(纯度≥99%)。
1.2 实验步骤
本实验基本思路是:固定ω(O),然后在给定的ω(Ti)下,通过改变Al的配入量寻找Al2O3临界析出时Ti-Al-Fe-O熔体成分。具体实验方案为:①单个样品重量控制为14 g;②ω(O)固定为5%;③ω(Ti)分别取:30%、40%、50%、60%、65%、70%、75%;④ω(Al)分别以5%、1%、0.25%的步长寻找Al2O3临界析出点;⑤ω(Fe)为余量;⑥氧元素采取TiO2粉配入,其他不足元素采用纯元素配入。
将Ti粉、Fe粉、Al粉和TiO2粉按比例混匀并压片,放入WK -Ⅰ型真空非自耗电弧炉中抽真空并充入高纯氩气,在水冷铜坩埚中用电弧加热融化,最后快速冷却获得样品。熔炼前真空系统进行5次高纯氩气置换清洗,熔炼过程中样品翻面4次,每次熔4 min,随后立即停电使样品快速冷却,3~5 s后样品由白炽态转为银白色。熔炼过程中使用Raynger 3i plus型工业高精度高温红外测温仪对熔融状态下的样品测温,如图1所示。调控电流使熔炼温度处于1 800~2 000 ℃。熔炼后的样品如图2所示。
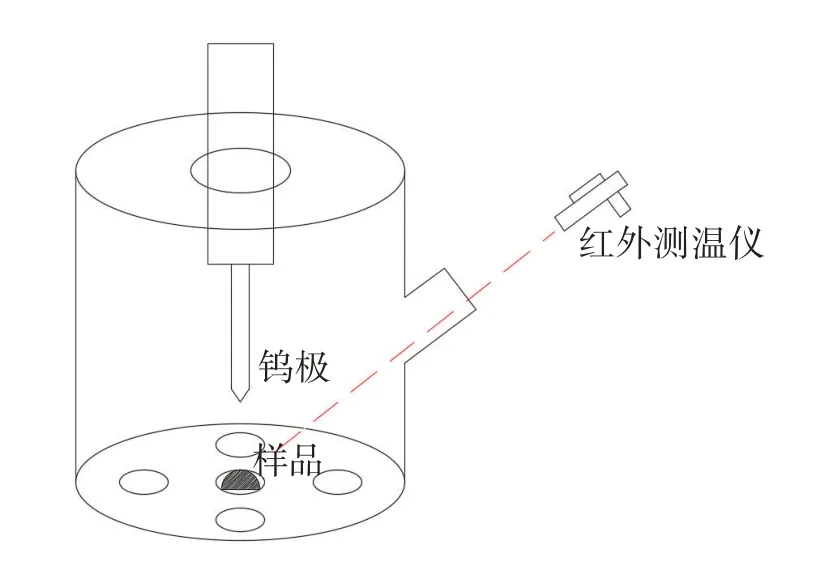
图1 实验装置示意Fig.1 Experimental facility

图2 熔炼后的样品:(a) 熔炼样品;(b) 样品断面Fig.2 Sample after melting:(a) melted sample;(b) sample section
1.3 分析表征
采用JSM-6510型扫描电子显微镜对样品的微观组织进行分析,采用理学2500PC型X射线衍射仪对样品的物相进行分析。
2 结果与分析
2.1 Ti-Al-Fe-O系熔体快冷析出行为
2.1.1 析出实验数据
以60TixAlyFe5O为例说明Al2O3析出过程和如何确定Al2O3临界析出时的ω(Al)。首先将ω(Al)以5%的步长从5%增至20%,样品的微观组织变化如图3、XRD如图4、EPMA数据见表2所示。需要指出我们的EPMA检测ω(O)是存在检测偏差的,但不影响趋势的分析。
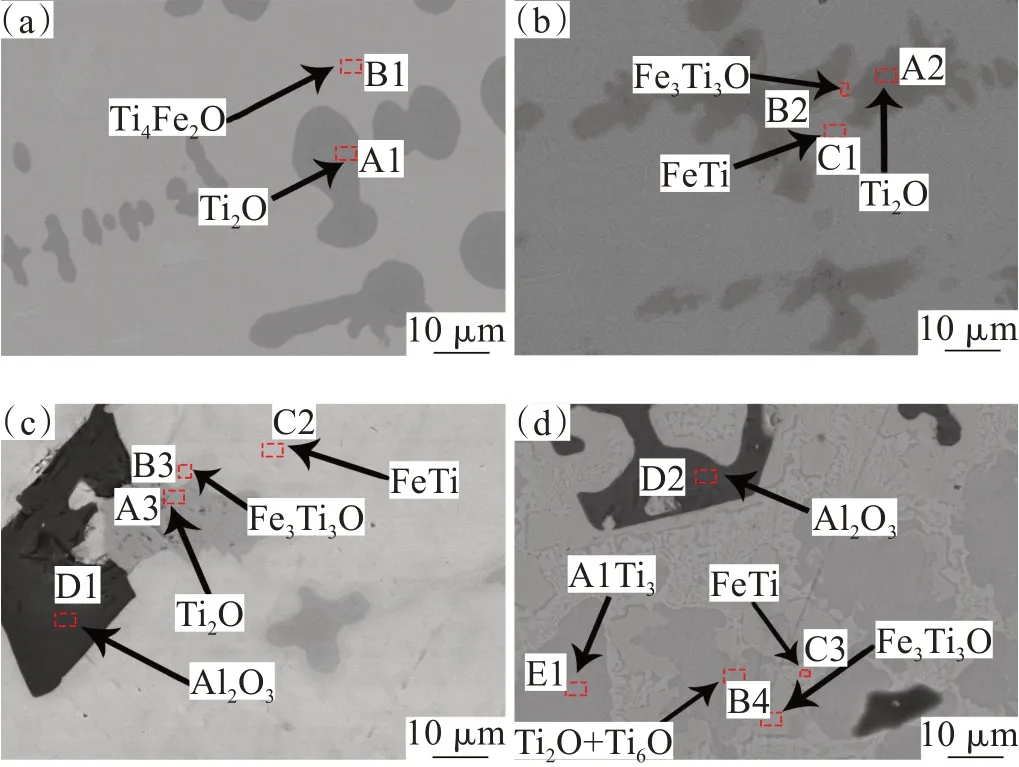
图3 60TixAlyFe5O合金样品的微观组织:(a) 60Ti5Al30Fe5O;(b) 60Ti10Al25Fe5O;(c) 60Ti15Al20Fe5O;(d) 60Ti20Al15Fe5OFig.3 Microstructure of 60TixAlyFe5O alloy samples:(a) 60Ti5Al30Fe5O;(b) 60Ti10Al25Fe5O;(c) 60Ti15Al20Fe5O;(d) 60Ti20Al15Fe5O
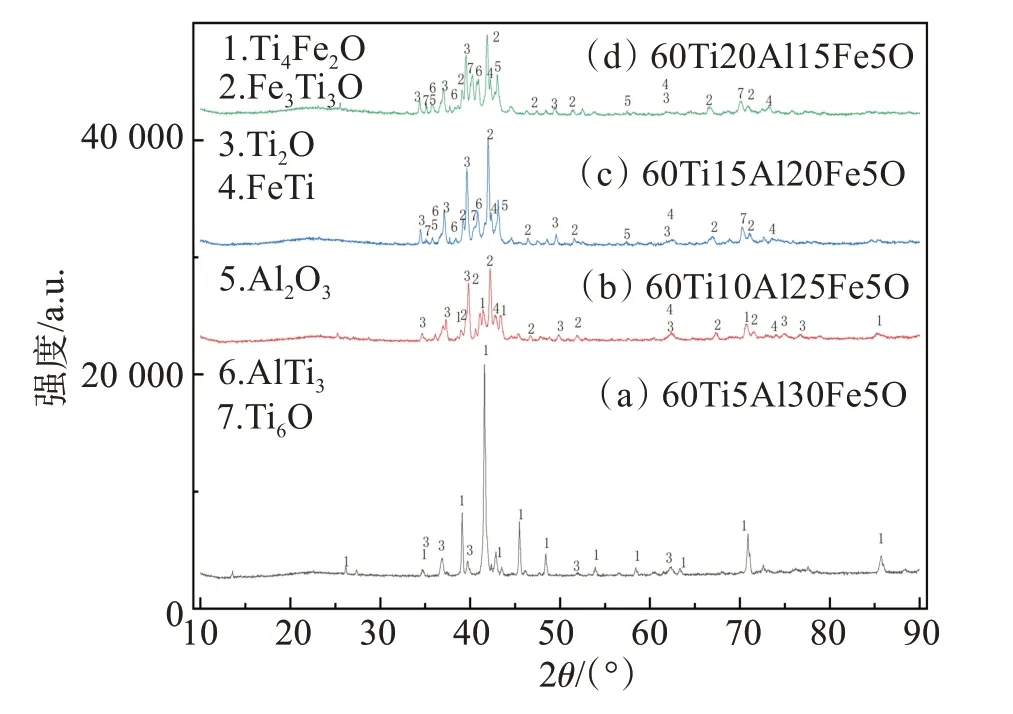
图4 60TixAlyFe5O合金样品的XRD谱Fig.4 XRD patterns of 60TixAlyFe5O alloy samples
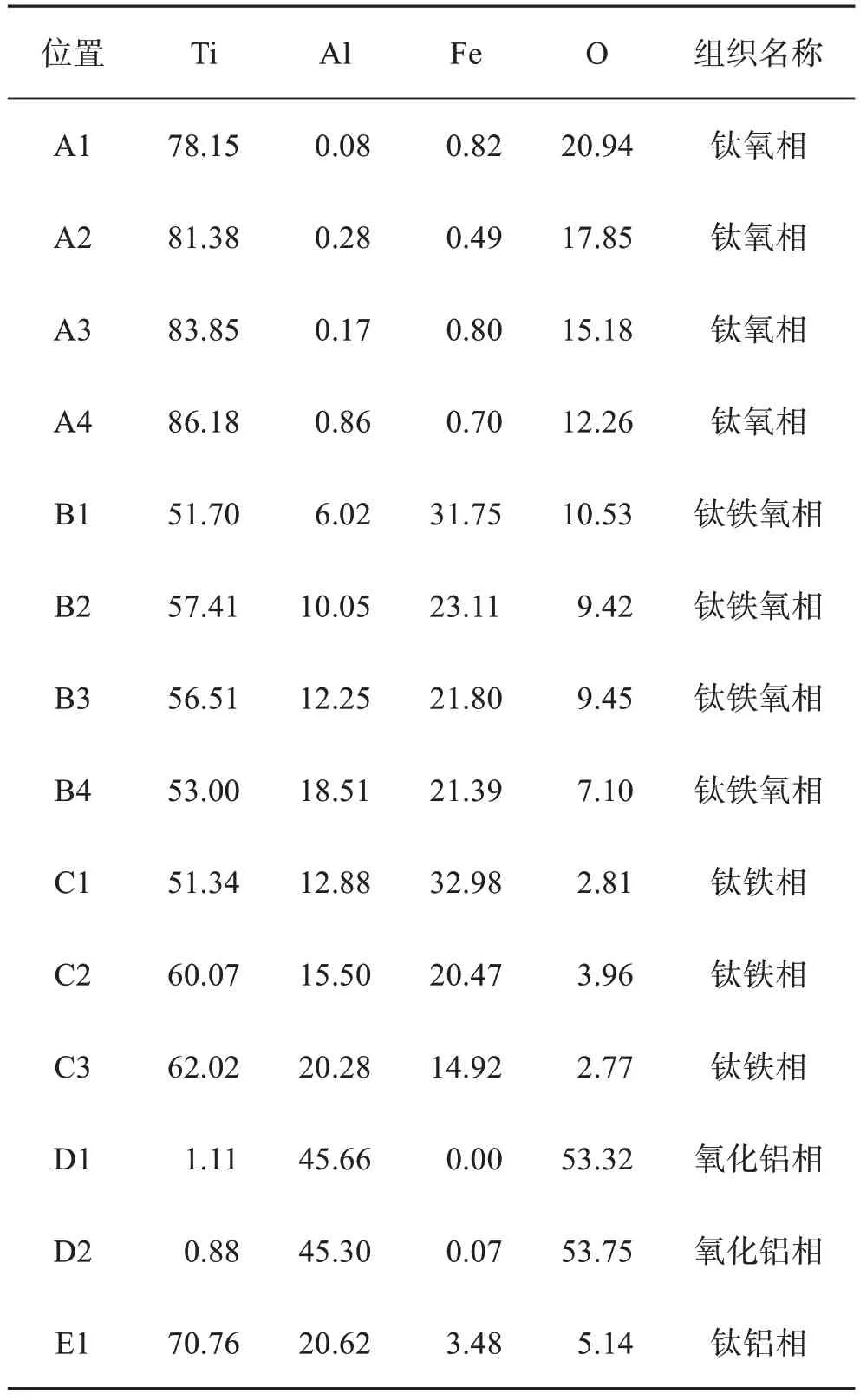
表2 60TixAlyFe5O合金样品的微区分析Table 2 Electron probe microanalysis of 60TixAlyFe5O alloy samples单位:%(质量分数)
根据图4中XRD谱图中标注的物相信息,对图3中的样品进行了物相标注。图3(a)中ω(Al)为5%,深色的为初晶钛氧相(Ti2O),浅色的为钛铁氧相(Ti4Fe2O)。图3 (b)中ω(Al)为10%,与图3(a)相比,出现新的钛铁氧相(Ti3Fe3O)包围着钛氧相,增加了钛铁新相(FeTi)。图3 (c)中ω(Al)为15%,与图3(b)相比,增加了一个Al2O3新相。图3 (d)中ω(Al)为20%,与图3(c)相比,增加了一个钛铝新相(AlTi3),伴随Ti2O一起出现了Ti6O相。特别说明,本文所说的钛氧相实际上指Ti2O、Ti6O及其混合物(也用TixO表示),而且在高温时属于α-Ti固溶体,所以严格意义上是不能称为单一纯相,但为了描述方便,仍笼统称为钛氧相。钛铁氧相、钛铁相、钛铝相也是同样情况,下面分别讨论。
2.1.2 钛氧相的析出
图3(a)中钛氧相为初晶体,残余熔体以钛铁氧相凝固析出。根据表2中A1、B1数据,钛氧相的特征为ω(Al)和ω(Fe)都小于1%,钛氧相ω(O)是钛铁氧相的2倍,钛铁氧相中含有6.02%Al。由于合金成分为60Ti5Al30Fe5O,所以熔体的钛氧摩尔比与Ti4Fe2O相的相同,都为4,因此理论上钛氧相的钛氧摩尔比也应该接近4。根据图5中的Ti-O相图[23]可知,钛氧摩尔比为4的熔体中析出的高温钛氧相为图5中粗虚线位置的αTi固溶体,该固溶体在室温时可分解为Ti2O、Ti3O等固溶体。但是,钛氧相的ω(O)是钛铁氧相的一倍左右,因此可推测Ti4Fe2O相中的钛氧摩尔比大于4,而钛氧相的小于4,也就是钛氧相的成分位于图5中粗虚线和右侧Ti2O相成分之间,对应的成分范围为: 85.69%<ω(Ti)<92.29%, 7.71%<ω(O)<14.312%。因此图3(a)中析出的αTi固溶体(即钛氧相)的ω(Ti)和ω(O)比原始熔体的高,它的析出属于富集Ti、O的过程,显然残留的熔体中ω(Ti)、ω(O)在降低,而ω(Fe)、ω(Al)在浓缩提高。随着残留熔体中ω(Al)的增高,被Al原子吸引的O原子更难进入固溶体,而熔体中ω(Ti)的降低,也进一步阻碍Ti原子进入固溶体,最后达到平衡无法析出钛氧固溶体。
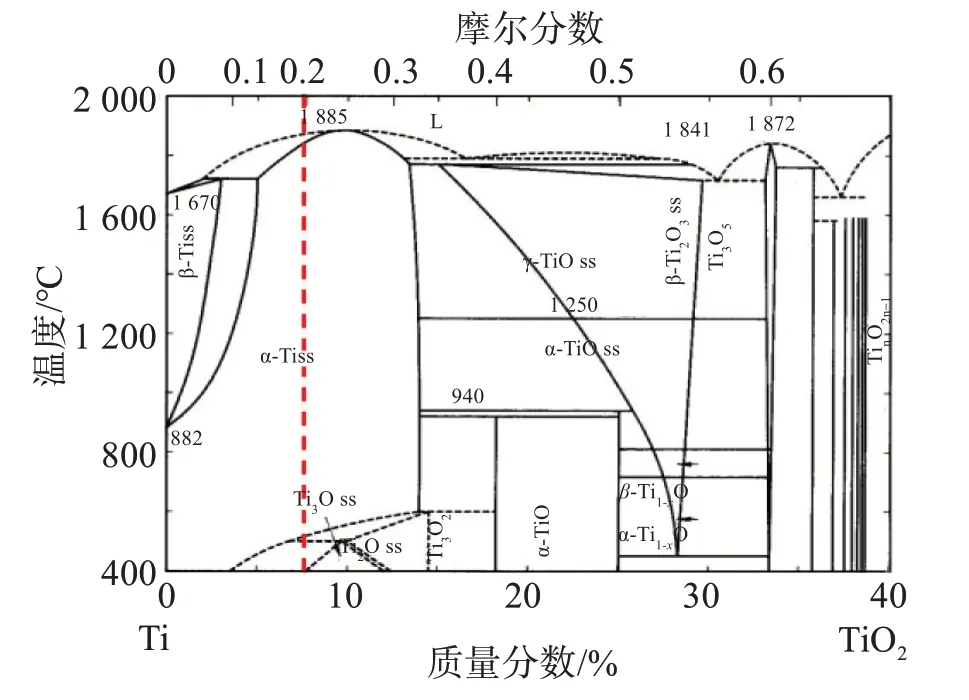
图5 Ti-O相图Fig.5 Ti-O phase diagram
比较图3中4幅图和表2的A1~A4的数据,可以分析熔体中ω(Al)对钛氧相的影响。随着ω(Al)的升高,钛氧相中的ω(O)从20.94%降低到12.26%、ω(Ti)从78.15%增高到86.18%,对应的熔化温度范围为1 770~1 885 ℃。熔体中ω(Al)的增加使得与Al亲和的O更难进入钛氧相,使得Al、O浓度在残留熔体中升高,而Ti原子只能结合更少的O原子析出。钛氧相中固溶的Al、Fe始终小于1%,证明ω(Al)增加不会影响Al、Fe在钛氧相中的固溶度,因此Al、Fe元素在钛氧相析出的过程中只能保留在残留熔体中,使得其浓度升高,活度增加,这是钛氧相析出过程的一个明显特征。这个现象也证明了文献[24]关于“Al和O溶解在hcp Ti中时,两者之间存在很强的近邻排斥”的结论。图3(d)中ω(Al)=20%时室温组织和XRD图谱中检测出Ti2O和Ti6O相,从生成物的角度证明了钛氧相脱氧的过程。可以预测随着ω(Al)继续增加,钛氧相将进一步脱氧。根据上述分析,钛氧相的析出过程可写作:
2.1.3 钛铁氧相的析出
图3(a)中当熔体停止析出钛氧相后,残留熔体在快速降温条件下析出了钛铁氧相,因此可以判断钛铁氧相析出顺序是在钛氧相之后。表2数据显示,随着ω(Al)增高,钛铁氧相中ω(Ti)略有增高趋势且始终小于原始熔体,Al的固溶度从6.02%增至18.51%,ω(Fe)呈降低趋势且低于原始熔体,ω(O)略有下降趋势。XRD图谱没有检测到四元化合物,说明Ti4Fe2O和Fe3Ti3O相中可以固溶大量的Al,用(Ti4Fe2O(Al))ss、(Fe3Ti3O(Al))ss表示。当ω(Al)=10%时,(Ti4Fe2O(Al))ss转变成(Fe3Ti3O(Al))ss,理论上ω(O)从5.01%降至4.89%,与实际趋势符合。虽然在析出过程中残留熔体中ω(Al)、ω(Fe)因为浓缩效应在提高,但是由于本实验中ω(Ti)、ω(O)固定,残留熔体中ω(Al)+ω(Fe)=35%,ω(Al)增高必然使得ω(Fe)降低。残留熔体中析出的钛铁氧相的ω(Al)、ω(Fe)也相应变化。钛铁氧相中钛铁摩尔比波动范围为2~3,不符合1~2的理论值范围。但是表2中B1行的钛铁比为1.9,接近理论值,而B4行的钛原子与铝原子铁原子之和的比为1.0。考虑到Fe、Al原子半径比较接近,因此可以推断钛铁氧相中可以固溶一部分铝,当Fe原子不足时Al原子可以置换占位。根据上述分析,钛铁氧相析出的过程可以写作:
2.1.4 钛铁相的析出
图3(b)中在钛铁氧相的外围钛铁相作为填充相出现,因此可以判断钛铁相析出顺序是在钛铁氧相之后。表2数据显示,随着ω(Al)增高,钛铁相中ω(Ti)从51.34%增加到62.02%,Al的固溶度从12.88%增至20.28%,ω(Fe)从32.98%降至14.92%,ω(O)在2.77% ~ 3.96%之间波动。根据表2数据可计算钛铁相中钛铁摩尔比为1.82~4.89,大于理论值1。根据Fe-Ti相图[25]可知,在上述钛铁摩尔比范围内,室温时TiFe相和αTi相混合共存,高温时对应TiFe相和βTi相[26]混合共存,对应的熔化温度范围为1 085 ~ 1 400 ℃。而表2显示钛铁相中仍然有高达3.96%的ω(O),所以钛铁相中过量的Ti可能是含有O的αTi固溶体,在室温时αTi固溶体又分解成TixO相。因此图3中的钛铁相不仅存在TiFe相,还混有TixO相。钛铁相的析出过程可以写作:
2.1.5 Al2O3相的析出
本实验熔炼过程中样品的温度为1 800 ~2 000 ℃,而Al2O3的熔点是2 054 ℃,因此如果Al2O3相能够析出,则应以固相存在。图3(a)和图3(b)中没有找到Al2O3相,说明在高温熔融状态下没有析出,而且在冷却过程中也没有析出。而图3(c)和图3(d)明显出现Al2O3相,根据Al2O3的粗大粒径和平直相界,可判断Al2O3是从液相中反应形核长大的,可能是在熔炼时反应析出,也可能是冷却过程析出。考虑到冷却过程一般不超过5 s,Al2O3相在冷却过程中不太可能长到图3中所示尺寸(大于60 μm),但可能在原有基础上长大,因此Al2O3相最可能是熔炼时反应析出的。表2中D1、D2数据显示,Al2O3相几乎不含Ti和Fe,可近似认为纯相。根据图5相图可知相关钛氧相的熔点最高为1 885 ℃,低于Al2O3的熔点,因此可以判定Al2O3相先于钛氧相析出。因为Al2O3相最先从熔体析出,反应式如下:
根据化学反应平衡理论,可知:
式(7)中:Kw为平衡常数,c为活度。体系临界析出Al2O3固相时其活度为1,所以通过提高熔体中Al浓度,从而提高Al的活度,让平衡朝右边进行,生成Al2O3固相,实现降低残留熔体中O的浓度,这就是铝热法脱氧的基本原理。组成一定的Ti-Al-Fe-O体系在一定温度下临界析出Al2O3固相时的成分点是稳定不变的,把此时熔体的ω(O)作为脱氧极限是值得推荐的。铝热法的其他因素(CaO溶剂、杂质元素)对合金熔体脱氧深度的影响程度可以与脱氧极限成分比较,从而获得合理可靠的评估。
文献[21]采用金属熔体共存假设模型对Ti-Al-Fe-O金属熔体的脱氧极限进行了定义,该模型认为熔体中存在包括Ti、Al、Fe、O、Al2O3、TiO、TiO2等19种原子和分子组元,当反应式(2)平衡(ΔG=0)时熔体中Al2O3达到一定平衡浓度(质量作用浓度,即活度),该浓度小于1。从Al2O3相的角度看,本文认为临界析出固相时(Al2O3活度为1)达到脱氧极限,而文献[21]认为在液相时(Al2O3在熔体中,活度小于1)就达到了脱氧极限。因此本文的脱氧极限显然要高于文献[21]的。文献[21]的定义具有很好的参考意义,但是很难通过实验获得具体的成分点。
2.1.6 AlTi3相的析出
图3(d)中析出了AlTi3相,且晶粒粗大。根据表2数据可知,AlTi3相中ω(Ti)为70.76%,ω(Al)为20.26%,ω(Fe)为3.48%,ω(O)为5.14%,钛铝摩尔比为1.92,小于理论值3。根据Al-Ti相图[25]可知AlTi3相钛铝摩尔比范围1.60~3.46,且AlTi3在高温时转变为βTi,其对应熔化温度范围为1 600~1 680 ℃。该温度范围显然小于钛氧相,因此AlTi3相应该在钛氧相之后析出。虽然无法获得B4钛铁氧相的熔点,但是可以通过Ti-Fe相图和钛铁摩尔比大致估计出该合金熔点为1 170 ℃。B4中钛铁氧相的ω(O)比E1中AlTi3相的略高,但B4中含有21.39%的固溶铝而AlTi3只固溶3.48%的铁,前者使钛铁氧相熔点升高而后者使其降低,如果两者对熔点的影响可以抵消,那么还是AlTi3相的熔点更高。因此AlTi3相先于钛铁氧相析出。根据以上分析,可以把AlTi3相的析出过程写作:
2.1.7 Ti-Al-Fe-O熔体快冷相的析出小结
成分为60Ti20Al15Fe5O的熔体中相的析出先后顺序为:Al2O3、钛氧相、钛铝相、钛铁氧相、钛铁相,而且析出相中的ω(O)按照析出顺序逐步降低。
60TixAlyFe5O熔体当x=5时,仅有初晶Ti2O相和Ti4Fe2O相出现;随着x增大,Ti2O相中脱氧程度提高;x=10时,Ti4Fe2O相转变为Ti3Fe3O,同时出现FeTi相;x≥15时,出现Al2O3固相;x=20时,出现AlTi3相。
2.2 Ti-Al-Fe-O系熔体Al2O3析出曲线
2.2.1 Al2O3临界析出实验结果
图3和图4的实验结果表明:60TixAlyFe5O熔体中临界析出Al2O3时,ω(Al)在10%~15%之间。为了获得Al2O3临界析出时的精确ω(Al),在初步确定的范围内以步长Δx=1从x=11增至14,同样采用SEM和XRD联合分析, 得到Al2O3临界析出时的ω(Al)范围为12%~13%。同理,继续在此基础上,以步长Δx=0.25从x=12.25增至12.75,获得最终的Al2O3临界析出ω(Al)为12.25%~12.50%之间,取其平均值12.38%。图6和图7分别显示了不同步长时的临界析出样品的微观组织图和XRD图谱。需要指出的是,随着临界析出实验精度提高,Al2O3含量逐渐减少,在XRD图谱中无法测得Al2O3的特征峰,但在SEM图中仍能找到。

图6 60TixAlyFe5O合金样品微观组织:(a) 60Ti12Al23Fe5O;(b) 60Ti13Al22Fe5O;(c) 60Ti12.25Al22.75Fe5O;(d) 60Ti12.5Al22.5Fe5OFig.6 Microstructure of 60TixAlyFe5O alloy samples:(a) 60Ti12Al23Fe5O;(b) 60Ti13Al22Fe5O;(c) 60Ti12.25Al22.75Fe5O;(d) 60Ti12.5Al22.5Fe5O

图7 60TixAlyFe5O合金样的XRD图谱Fig.7 XRD patterns of 60TixAlyFe5O alloy samples
采用同样的实验方法,共获得了Al2O3临界析出时Ti-Al-Fe-O系熔体的7组成分,如图8所示,ω(O)不变且温度为(1 900±100) ℃时,曲线下部为均匀的液相,曲线上部为液相和Al2O3固相。
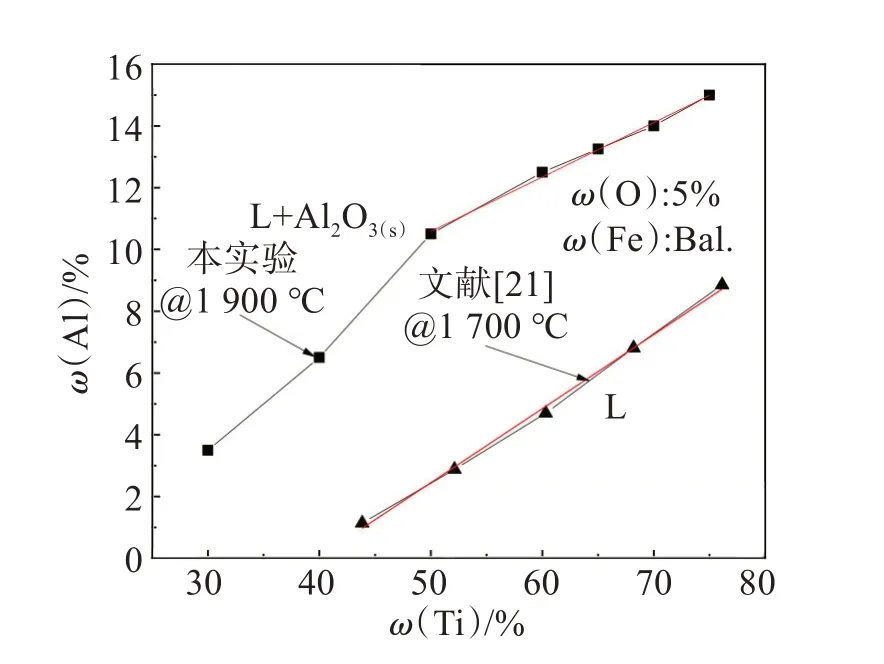
图8 Ti-Al-Fe-O系熔体中Al2O3析出曲线Fig.8 Precipitation curve of Al2O3 in melts of Ti-Al-Fe-O system
文献[21]对1 700 ℃的Ti-Al-Fe-O体系进行了脱氧极限的计算,根据文献[21]的数据,读取ΔG=0与曲线族的交点成分,对交点成分插值获得脱氧极限为5%时成分数据点,把这些数据点作成Ti-Al曲线列入图8中,与本实验数据进行对比。
2.2.2 Al2O3相临界析出曲线的分析
图8中上部曲线为本实验结果,随着ω(Ti)从30%提高到75%,熔体中析出Al2O3相对应的ω(Al)从3%逐步升高到15%。ω(Ti) =50%时,曲线出现转折,呈现两段线性关系。当ω(Ti)<50%时,直线斜率较大。ω(Ti)>50%时,直线斜率较小,其线性回归方程为:
式(9)的线性相关系数大于0.995。析出曲线在ω(Ti)=50%时出现拐点说明:ω(Ti)>50%,熔体为Ti基溶液,ω(Ti)对Al2O3的析出平衡影响相对较小,且影响程度是线性的;ω(Ti)<50%, 熔体为Fe基溶液,ω(Ti)的增加对Al2O3的析出平衡影响相对较大。曲线整体范围内,ω(Ti)的变化对ω(Al)析出平衡的影响是非线性的。
图8中下部曲线为文献[21]给出的ω(Al)和ω(Ti)的关系,随着ω(Ti)从43.85%增加到76.16%,ω(Al)从1.14%增加到8.85%,两者呈近似线性关系。通过线性拟合,线性相关度为0.966,线性方程为:
本实验与文献[21]给出的曲线变化趋势是一致的,说明为了使Ti-Al-Fe-O体系达到同样的脱氧极限,ω(Ti)越高需要的配Al量越大,也就是Al脱氧难度增加,氧化铝析出变困难,无论生成相是固相还是液相。体系中增加Ti元素,导致O元素与Al元素结合机会降低,必须增加Al元素才能再次达到反应平衡。因此,体系中随着Ti活度的增加,Al元素的活度降低。本实验中当ω(Ti)=65%时,为了获得5%的脱氧极限ω(Al)必须大于13%,由此可见高钛铁实现低铝低氧的目标十分困难。值得指出的是:式(10)中,当ω(Ti)=0时,ω(Al)为负值,显然是不可能的,说明模型在ω(Ti)趋向低含量时存在偏差扩大的趋势。
本实验与文献[21]的曲线存在的主要区别是:①前者在ω(Ti)>50%时呈线性关系,后者全范围内是线性的; ②Ti-Al-Fe-O熔体中ω(O)=5%且ω(Ti)相同条件下,前者析出Al2O3相所需的ω(Al)比后者高。经分析认为:上述①的原因可能是实验的误差(比如温度和冷却条件变化)和理论模型的缺陷(比如模型不包括三元化合物组元缺乏实验基础)。上述②的原因是脱氧极限的定义差别和两者的温度差别。铝热反应的温度降低将使平衡常数变小,因此当体系的ω(Ti)、ω(O)一定且达到脱氧极限时,降温将使平衡时体系的ω(Al)降低。
3 结 论
在(1 900±100) ℃下Ti-Al-Fe-O系熔体中快冷析出规律如下:
1)成分为60Ti20Al15Fe5O的熔体中快冷相的析出顺序为Al2O3相、钛氧相、钛铝相、钛铁氧相、钛铁相,而且析出相的ω(O)按照析出顺序逐步降低。
2)Ti-Al-Fe-O系中采用Al2O3析出曲线作为脱氧极限,达到同样的脱氧极限前提下,Ti-Al-Fe-O系熔体中ω(Ti)越高,平衡所需的ω(Al)越高。
3)脱氧极限为5%且ω(Ti)>50%时析出曲线上的ω(Ti)与ω(Al)关系遵循:ω(Al) =0.017 635+0.176 35ω(Ti)。

