钕铁硼油泥稀土和铁同步浸出与分步提取研究
林辉阳, 刘子帅*, 黎文庆, 刘海平,唐学昆, 周贺鹏, 罗仙平
(江西理工大学,a.江西省矿冶环境污染与控制重点实验室; b.国家市场监管重点实验室(稀土产品检测与溯源);c.国家稀土功能材料创新中心;d.离子型稀土资源开发及应用教育部重点实验室;e.稀有金属资源高效开发与利用重点实验室,江西 赣州 341000)
钕铁硼永磁材料因性能优异被广泛应用于汽车、家电、风电、消费电子等领域。我国钕铁硼产量和消费量均为全球第一[1]。近年来,随着电子信息产业、风电和新能源汽车等领域蓬勃发展,钕铁硼磁体需求量越来越高[2]。然而,在钕铁硼磁体加工过程中因磨削、切割等操作产生了大量钕铁硼油泥,这些油泥含有丰富的稀土、铁等有价金属,是宝贵的稀土二次资源[3]。从钕铁硼油泥中回收有价金属对于实现稀土资源循环利用、创造节约型社会具有重要意义。
钕铁硼废料回收常用的方法主要包括盐酸优溶法[4]、复盐沉淀法[5]、硫化物除杂法[6]、全萃取法[7]、直接还原-渣金熔分法[8]等。盐酸优溶法是目前钕铁硼废料回收工业应用最为广泛的方法,其原理是钕铁硼废料经氧化焙烧后加入适量盐酸,控制浸出液pH为1左右,使得氧化稀土优先溶解,而氧化铁溶解率低,实现稀土和铁选择性浸出分离的目的,浸出液再进行净化富集或沉淀,得到相应稀土产品[9-10]。总体而言,目前钕铁硼废料回收研究较多,且主要集中于稀土的回收以及与铁的高效分离,但对钕铁硼废料中有价金属铁的回收研究较少。非稀土金属铁在钕铁硼废料中占比最高,对于我国铁矿石长期依靠进口以及提高钕铁硼废料综合利用率而言,钕铁硼废料回收研究不仅要集中于选择性分离稀土和铁,同时需综合回收稀土和铁。为此,本文拟以钕铁硼废料为研究对象,研究钕铁硼废料稀土和铁同步浸出与分步提取新工艺,为提高稀土二次资源综合利用提供新方法。
1 实验部分
钕铁硼油泥由江西赣州某资源回收公司提供。首先对其进行洗涤除油,然后在低温下进行氧化焙烧,得到实验用钕铁硼废料。对其化学性质分析,XRD结果见图1,主要化学成分见表1。结果表明,钕铁硼废料中主要物相为Fe2O3和RE2O3,其中铁的品位为50.28%,稀土总含量为25.65%。
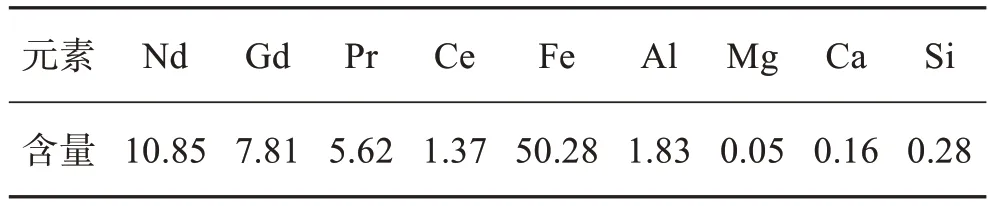
表1 钕铁硼废料的化学成分Table 1 Chemical components of NdFeB waste单位:%(质量分数)
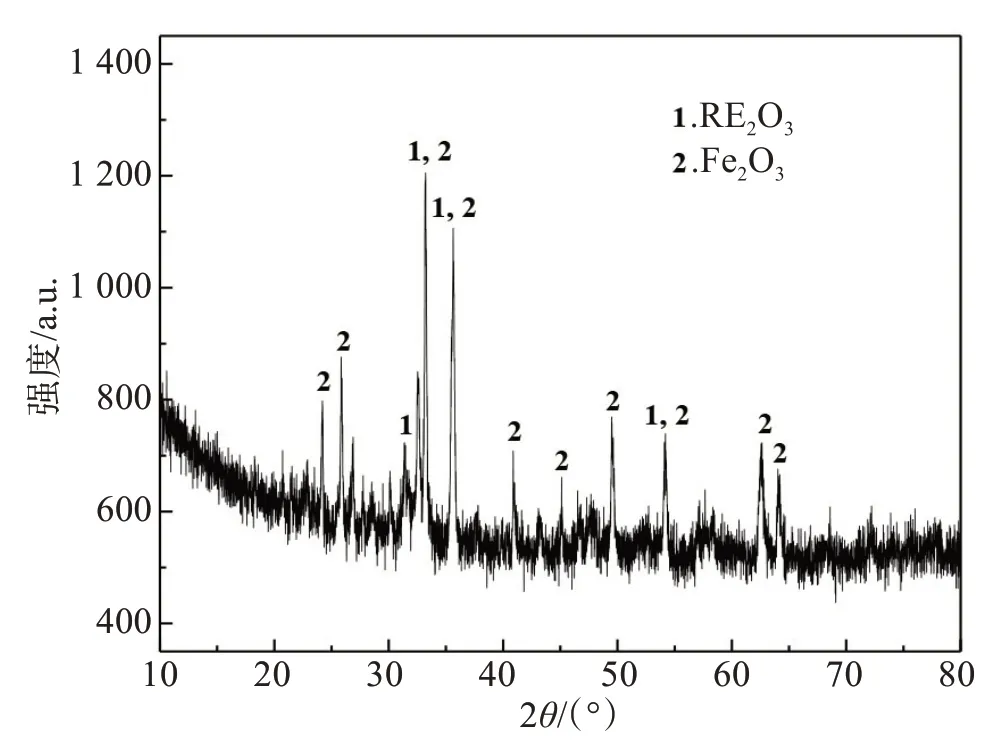
图1 钕铁硼废料XRD像Fig.1 XRD of NdFeB waste
2 实验部分
2.1 实验方法
1)将钕铁硼油泥加入洗涤剂洗涤,脱除大部分油污。然后将含少量油的钕铁硼油泥置于马弗炉中焙烧,得到焙烧熟料。
2)将焙烧熟料与盐酸按照一定比例混合,在一定温度和时间下稀土和铁的同步浸出,固液分离,得到含稀土和铁的浸出液。
3)向浸出液中加入适量草酸,在一定温度和时间下沉淀稀土,固液分离,得到草酸稀土和稀土沉淀后液;将草酸稀土用去离子水洗涤,烘干,得到草酸稀土产品。
4)向稀土沉淀后液中分别加入适量草酸和还原铁粉,在指定温度和时间下沉淀铁,固液分离,得到草酸亚铁和沉铁废水;将草酸亚铁用去离子水洗涤,烘干,得到草酸亚铁产品。
2.2 检测方法
采用单通道扫描电感耦合等离子体发射光谱仪(ⅠCP,ULTⅠMA 2,JOBⅠN YVON,法国)测定稀土的品位和浓度。采用重铬酸钾滴定法测定铁的品位和浓度(GB/T 6730.65—2009)。采用电感耦合等离子体发射光谱仪(ⅠCP—OES,ⅠRⅠS Ⅰntrepid ⅠⅠ,热电公司,美国)测定其他离子的品位和浓度。采用X射线衍射仪(XRD,D8 Advance,德国布鲁克)测定物相组成。采用场发射扫描电子显微镜(SEM,∑ⅠGMA,德国卡尔蔡司公司)测定微观形貌。
3 结果与讨论
3.1 氧化焙烧实验
3.1.1 焙烧温度对稀土和铁同步浸出的影响
未经任何处理的钕铁硼废料中稀土和铁主要以金属态存在,直接对其进行盐酸浸出,将产生大量氢气,对于生产存在巨大安全隐患。因此,通常需对钕铁硼废料进行氧化焙烧处理,将其中的金属态转化为氧化物再进行浸出,可解决安全隐患问题。为此,固定焙烧时间120 min、浸出剂HCl浓度6 mol/L、液固比(mL/g,下同) 6∶1、浸出时间90 min、浸出温度90 ℃,研究了不同焙烧温度对稀土和铁的浸出率的影响,实验结果见图2。
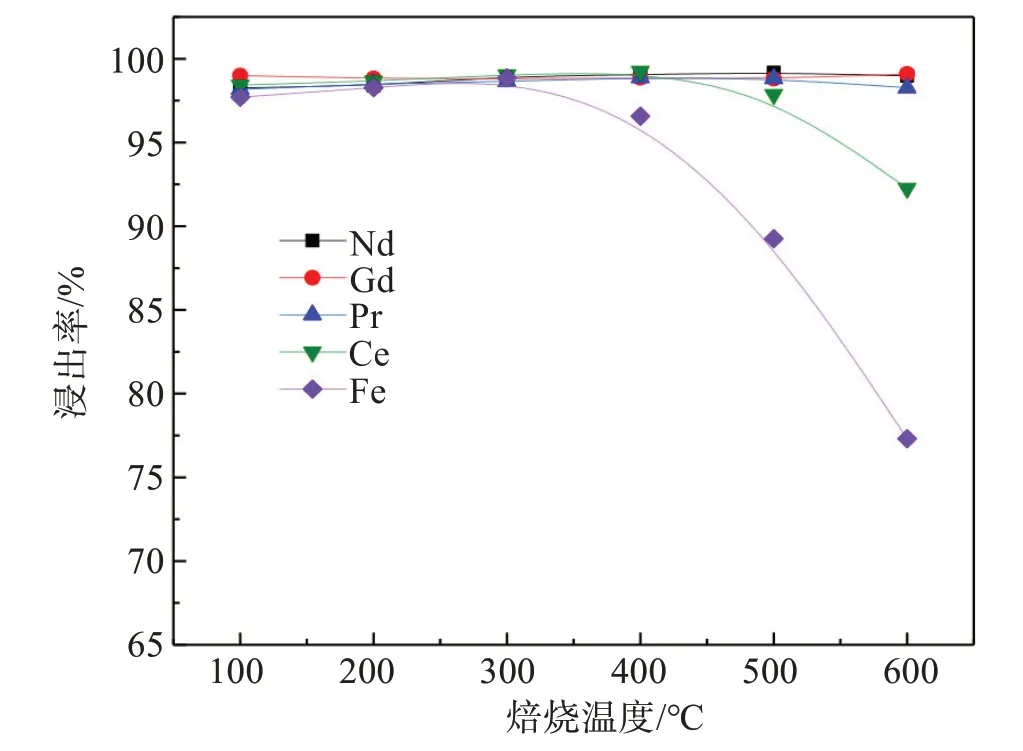
图2 焙烧温度对稀土和铁浸出的影响Fig.2 Effect of roasting temperature on leaching of rare earth elements and iron
由图2结果可知,当焙烧温度从100 ℃升高至300 ℃时,稀土和铁的浸出率均为98%左右,表明该温度下稀土和铁几乎被同步浸出。然而,当焙烧温度高于300 ℃时,铁浸出率开始降低,进一步提高温度至500 ℃以上时,铁浸出率急剧下降。此外,当焙烧温度超过500 ℃时,铈的浸出率也呈下降趋势。为进一步查明焙烧时铁和稀土的物相变化,分别对不同温度下获得的焙烧熟料和浸出渣进行XRD分析,结果分别见图3。
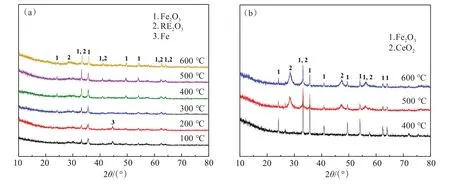
图3 焙烧熟料(a)和浸出渣(b)的XRD谱Fig.3 XRD of roasted slag (a) and leached residue (b)
由图3(a)结果可知,不同温度的焙烧熟料物相主要为Fe2O3和RE2O3,但100 ℃和200 ℃物相出现了金属铁的特征峰,表明温度过低铁的氧化焙烧不充分;此外实验过程也发现,当100 ℃和200 ℃焙烧熟料浸出时有大量气泡产生,这主要是由于金属铁与盐酸反应生成了氢气。然而,当温度升高至500 ℃以上时,铁和铈浸出率均大幅下降,而图3(b)浸出渣中铁和铈的物相仍以氧化物形式存在。
为了进一步解释高温焙烧时铁和铈浸出率降低的原因,分别对不同温度下获得的焙烧熟料和浸出渣进行SEM分析,结果见图4—图5。结果表明,当焙烧温度为100~300 ℃时,钕铁硼废料表面呈疏松状,而当焙烧温度升高至400 ℃时,钕铁硼废料表面开始聚团为致密结构,而当焙烧温度升高至500℃以上时,钕铁硼废料呈致密的球状结构。表明温度过高铁会产生烧结现象[11],从而降低铁的浸出率。而铈浸出率降低的原因可能是铈在高温焙烧过程中物相由金属Ce氧化为Ce2O3,再进一步被氧化为CeO2[12],从而难溶于盐酸,导致铈浸出率降低。

图4 不同温度的焙烧熟料SEM像:(a)100 ℃;(b)200 ℃;(c)300 ℃;(d)400 ℃;(e)500 ℃;(f)600 ℃Fig.4 SEM of roasted slag at different temperatures:(a)100 ℃;(b)200 ℃;(c)300 ℃;(d)400 ℃;(e)500 ℃;(f)600 ℃

图5 不同焙烧温度的浸出渣SEM像:(a) 500 ℃;(b) 600 ℃Fig.5 SEM of leached residue at different roasting temperatures:(a) 500 ℃;(b) 600 ℃
综合上述分析,确定钕铁硼废料焙烧温度为300 ℃。
3.1.2 焙烧时间对稀土和铁同步浸出的影响
焙烧时间对稀土和铁的氧化率有重要影响。固定焙烧温度300 ℃、浸出剂HCl浓度6 mol/L、液固比6∶1、浸出时间90 min、浸出温度90 ℃,考察不同焙烧时间对稀土和铁同步浸出的影响,实验结果见图6。
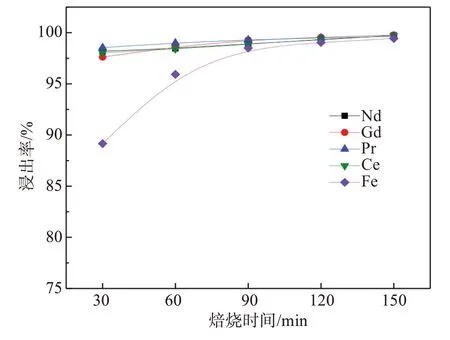
图6 焙烧时间对稀土和铁浸出的影响Fig.6 Effect of roasting time on leaching of rare earth elements and iron
由图6结果可知,随着焙烧温度的升高,稀土和铁的浸出率均同步提高。当焙烧时间从30 min增加到60 min时,铁浸出率较低,主要原因是焙烧时间较短,部分稀土和铁金属未被氧化,浸出时产生大量气泡。稀土金属化学性质极其活泼,更易溶解,而铁的化学性质不及稀土金属及其氧化物活泼,因此焙烧时间不足影响铁的浸出率。当焙烧时间提高至90 min时,稀土和铁的浸出率均约为98%,进一步提高焙烧时间,稀土和铁的浸出率增幅不大,因此确定焙烧时间为90 min。
3.2 稀土和铁同步浸出实验
3.2.1 盐酸浓度对稀土和铁同步浸出的影响
盐酸是钕铁硼废料回收最常用的浸出剂。固定焙烧温度300 ℃、焙烧时间90 min、液固比6∶1、浸出时间90 min、浸出温度90 ℃,考察不同盐酸浓度对稀土和铁同步浸出的影响,实验结果见图7。
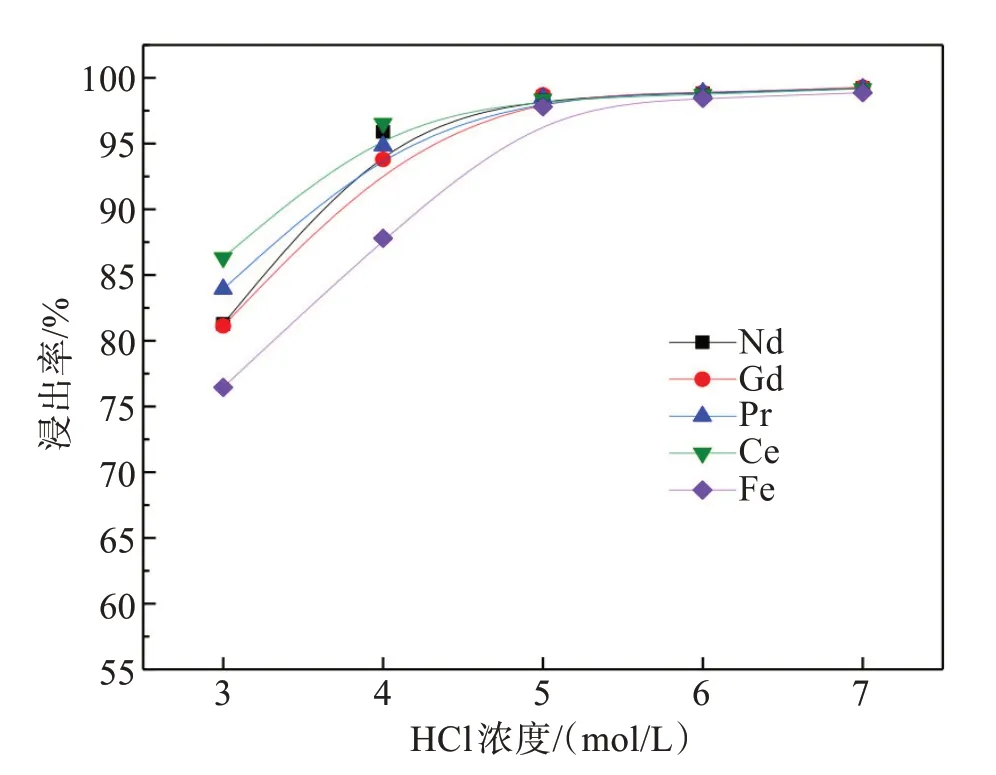
图7 盐酸浓度对稀土和铁浸出的影响Fig.7 Effect of concentrations of hydrochloric acid on leaching of rare earth elements and iron
图7结果表明,随着盐酸浓度提高,稀土和铁浸出率均同步提高。当盐酸浓度从3 mol/L提高至5 mol/L时,Nd、Gd、Pr、Ce、Fe浸出率分别由81.28%、81.13%、83.94%、86.31%、76.45%提高至98.55%、98.70%、98.50%、98.39%、97.80%,进一步提高盐酸浓度,稀土和铁浸出率增幅变缓。因此,确定较优的盐酸浓度为5 mol/L。
3.2.2 液固比对稀土和铁同步浸出的影响
固定焙烧温度300 ℃、焙烧时间90 min、盐酸浓度5 mol/L、浸出时间90 min、浸出温度90 ℃,考察不同液固比对稀土和铁同步浸出的影响,实验结果见图8。
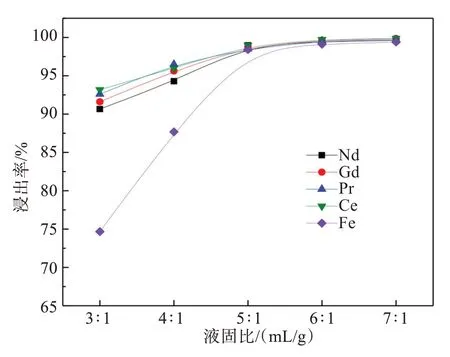
图8 液固比对稀土和铁同步浸出的影响Fig.8 Effect of liquid-solid ratios on Co-leaching of rare earth elements and iron
图8结果可知,随着液固比的增大,稀土和铁浸出率均同步提高。当液固比为3∶1时,稀土浸出率约为90%,而铁仅为74.66%,表明氧化铁化学活性远低于氧化稀土活性,稀土优先浸出,铁的浸出速率更低,这也是钕铁硼废料回收实现盐酸优溶法的原理[12]。当液固比提高至5∶1时,稀土和铁浸出率均提高至98%左右,进一步提高液固比时,稀土和铁浸出率变化不大。因此,确定液固比为5∶1。此时稀土和铁的浸出率分别为98.80%和98.41%。
3.3 稀土选择性沉淀实验
草酸具有良好的配位还原能力,可与多种高价金属阳离子形成配合物以及相应沉淀物。由于草酸稀土盐的溶度积常数极低(10-31~10-33)[13-14],因此草酸是稀土常用的沉淀剂。同时,草酸根易与Fe(Ⅲ)形成多种配合物、与Fe(Ⅱ)形成FeC2O4沉淀(Ksp=10-7)[15-16],因此可通过控制草酸用量及沉淀条件实现稀土和铁的选择性沉淀分离。
3.3.1 草酸用量对稀土和铁选择性沉淀分离的影响
固定稀土沉淀时间30 min,沉淀温度90 ℃,研究不同草酸与稀土的摩尔比对稀土和铁选择性沉淀分离的影响,结果见图9。
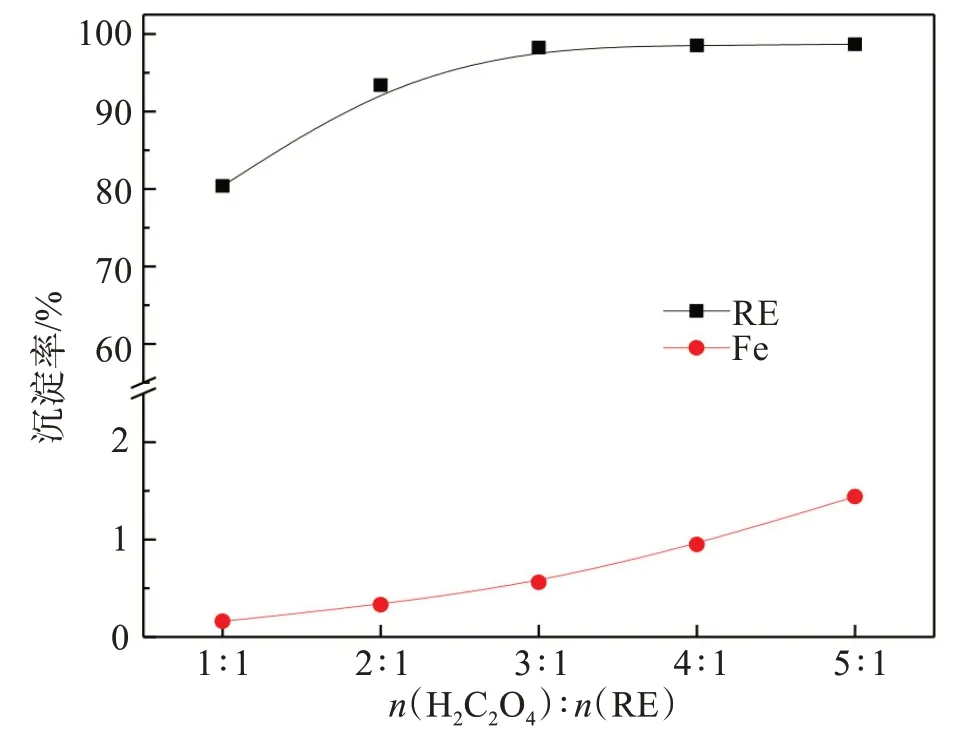
图9 草酸用量对稀土和铁选择性沉淀分离的影响Fig.9 Effect of oxalic acid dosage on selective separation of rare earth elements and iron
由图9结果可知,随着草酸用量增大,稀土和铁沉淀率均逐步提高。当草酸与稀土摩尔比由1∶1增大至3∶1时,稀土沉淀率由80.39%提高至98.25%,铁共沉淀率由0.16%提高至0.56%,进一步提高草酸用量,尽管稀土沉淀率变化不大,但铁沉淀率由0.56%大幅提高至1.44%。为了保证草酸稀土盐的纯度,确定草酸与稀土的摩尔比为3∶1。
3.3.2 沉淀温度对稀土和铁选择性沉淀分离的影响
温度对草酸稀土盐的溶解度有重要影响。固定稀土沉淀时间30 min,n(H2C2O4)∶n(RE3+)=3∶1,研究不同沉淀温度对稀土和铁选择性沉淀分离的影响,结果见图10。

图10 沉淀温度对稀土和铁选择性沉淀分离的影响Fig.10 Effect of precipitation temperature on selective separation of rare earth elements and iron
由图10结果可知,随着沉淀温度的升高,稀土沉淀率呈先上升后下降趋势,铁共沉淀则依次降低。当沉淀温度为60 ℃时,稀土沉淀率达98.43%,铁沉淀率仅为0.46%。进一步提高沉淀温度,稀土沉淀率反而开始下降,其原因可能是温度过高,草酸稀土盐溶度积增大,导致稀土沉淀降低。因此,确定稀土沉淀温度为60 ℃。
3.3.3 稀土产品表征
在n(H2C2O4) ∶n(RE3+)=3∶1、沉淀温度60 ℃、沉淀时间30 min的较优条件下,稀土几乎被完全沉淀,而铁共沉淀较低,实现了稀土和铁选择性沉淀分离,稀土总回收率为97.24%。对草酸稀土产品分别进行了XRD(图11)和SEM表征(图12)。图11结果表明,草酸稀土主要成分为RE2(C2O4)3·3H2O,其形貌主要为片状结构。对其进行化学成分分析,表2结果表明,草酸稀土纯度为98.34%。
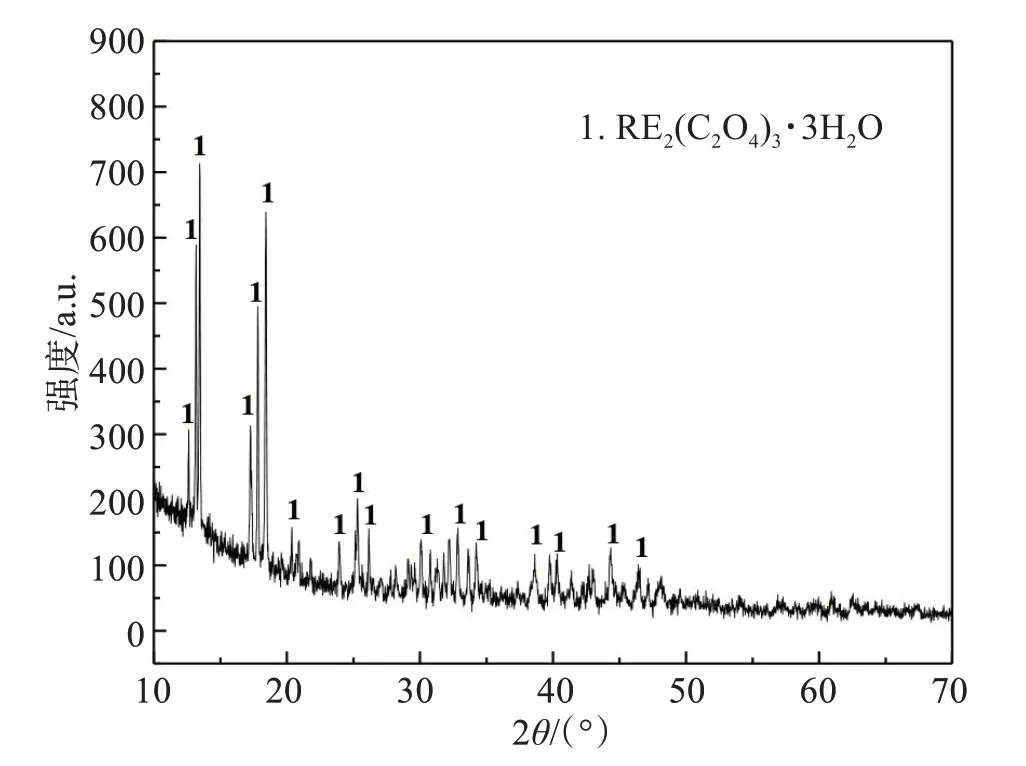
图11 草酸稀土XRD检测结果Fig.11 XRD results of RE2(C2O4)3·3H2O

图12 草酸稀土SEM结果Fig.12 SEM results of RE2(C2O4)3·3H2O
3.3.4 稀土和铁选择性沉淀机理
在稀土和铁共存的盐酸溶液中,稀土主要以阳离子RE3+形式存在,而铁主要以FeCl4-阴离子形式存在[17]。为了确定稀土和铁选择性沉淀机理,对共浸出液进行了紫外可见光光度测试(UV-Vis),结果见图13。
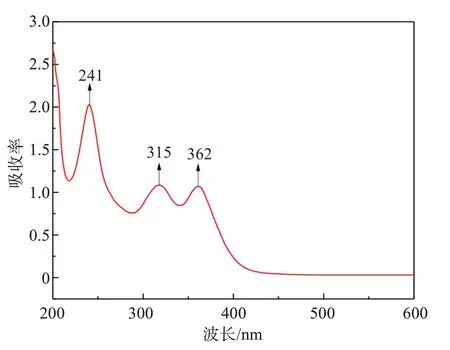
图13 稀土-铁共浸出液紫外可见光测试结果Fig.13 UV-vis spectrum of Fe-RE-Cl solution
图13结果表明,在波长241、315、362 nm处有强烈的凸出峰,而这些峰值均属于FeCl4-配合物的特征峰,而稀土离子未见明显特征峰,表明共浸出液稀土和铁确实以RE3+阳离子和FeCl4-阴离子形式存在,说明在浸出过程中发生Fe3+的配位反应,反应方程式如下:
由于草酸稀土盐的溶度积常数非常低,仅为10-31~10-33,而草酸亚铁的溶度积常数为10-7,当草酸加入共浸出液中,稀土迅速与草酸根发生沉淀,从而生成草酸稀土盐,反应方程式如下:
由于配位阴离子FeCl4-稳定常数为25.4,而Fe3+与C2O42-的三配位、二配位、一配位的稳定常数分别为20.2、16.2和9.4[18]。因此,当少量草酸加入稀土和铁的共浸出液中,Fe3+尚不能被C2O42-络合为配位离子, 更不能被C2O42-还原为Fe2+。因此, 当n(H2C2O4)∶n(RE3+)=3∶1的草酸加入浸出液中,稀土离子被迅速沉淀,而Fe3+以FeCl4-配位阴离子稳定存在于溶液中,从而实现了稀土和铁的选择性沉淀分离。
3.4 铁还原沉淀实验
为实现铁的综合回收,需对铁进行还原处理。尽管草酸有较好的还原能力,但其与Fe3+优先形成Fe-C2O4配合物,如Fe(C2O4)33-、Fe(C2O4)2-、FeC2O4+等[19]。铁粉还原沉淀是回收铁和草酸根的有效方法,通过还原铁粉将Fe3+还原为Fe2+、同时破坏三价铁配合物结构,从而与释放的C2O42-形成FeC2O4沉淀。
3.4.1 草酸用量对铁沉淀的影响
固定沉淀温度30 ℃、 沉淀时间30 min、n(Fe)∶n(Fe3+)=1∶1,研究草酸用量对铁沉淀的影响,结果见图14。
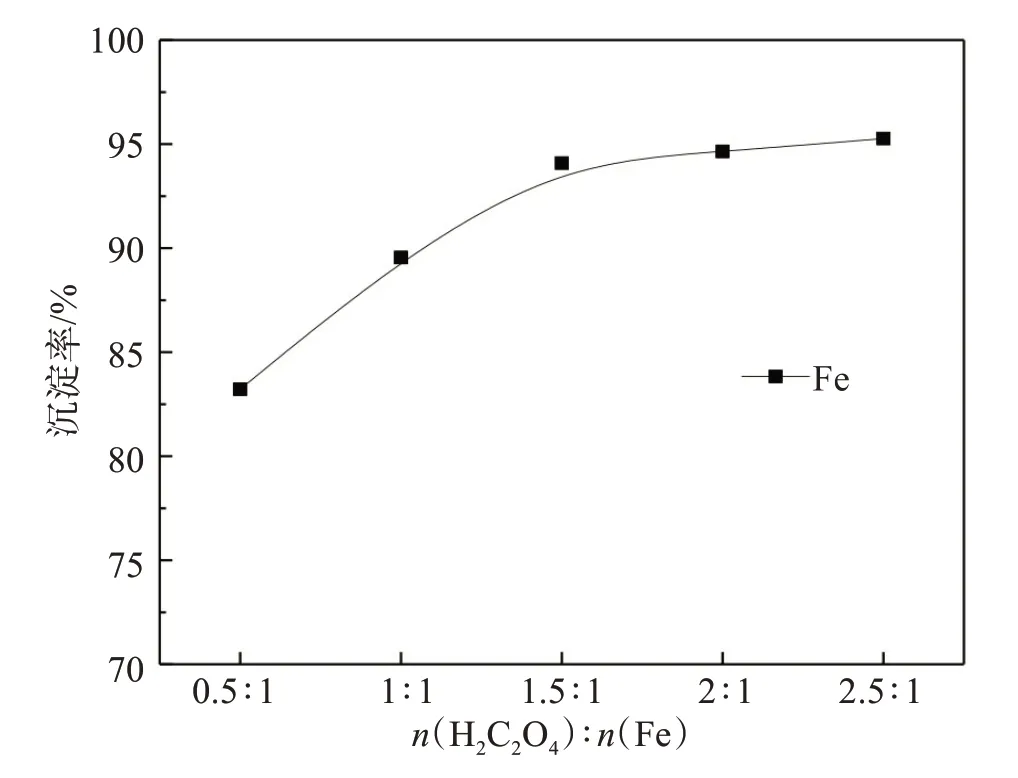
图14 草酸用量对铁沉淀的影响Fig.14 Effect of oxalic acid dosage on iron precipitation
由图14结果可知,随着摩尔比n(H2C2O4) ∶n(Fe)增大,铁沉淀率依次增大。当n(H2C2O4)∶n(Fe)=1.5时,铁沉淀率为94.08%,进一步增大草酸用量,铁沉淀率增幅变缓,因此,确定草酸与稀土沉淀后液中全铁摩尔比为1.5∶1。
3.4.2 还原铁粉用量的影响
固定沉淀温度30 ℃、 沉淀时间30 min、n(H2C2O4)∶n(Fe)=1.5∶1,研究还原铁粉用量对铁沉淀的影响,结果见图15。
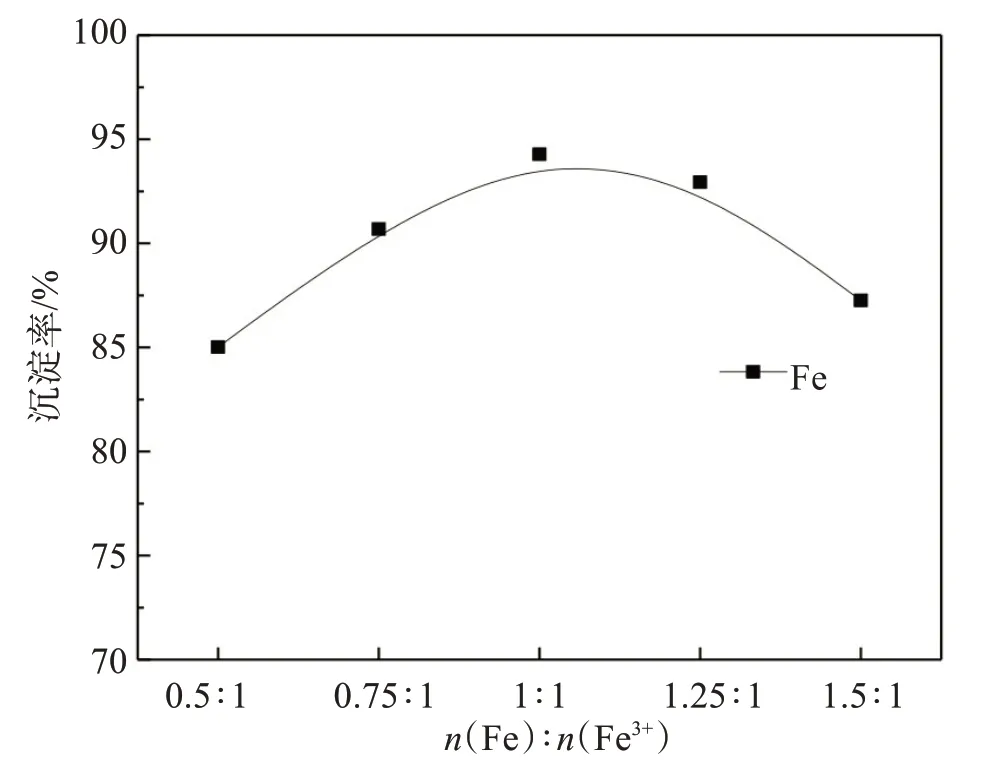
图15 还原铁粉用量对铁沉淀的影响Fig.15 Effect of iron powder dosage on iron precipitation
由图15结果可知,随着还原铁粉与溶液中三价铁摩尔比的增大,铁沉淀率呈先上升后下降趋势。当还原铁粉与三价铁摩尔比为1∶1时,铁沉淀率达到较高的94.28%,进一步提高还原铁粉用量,铁沉淀率反而降低。这是由于铁粉用量过量时,过量的铁溶解在溶液中,导致沉铁后液中铁浓度升高,从而降低铁沉淀率。
尽管FeCl4-稳定常数高于Fe-C2O4配合物,当大量草酸加入至稀土沉淀后液中,部分FeCl4-与草酸根发生配位反应,进而生成Fe(C2O4)33-、Fe(C2O4)2-、FeC2O4+等配合物。当还原铁粉进一步加入溶液中,还原铁粉将FeCl4-、Fe(C2O4)33-、Fe(C2O4)2-、FeC2O4+等配合物还原为Fe2+,从而生成FeC2O4沉淀,反应方程式如下:
因此,对于钕铁硼油泥,通过低温氧化焙烧-盐酸浸出,可实现稀土和铁的同步浸出;对于稀土和铁的共浸出液,通过加入适量草酸,可优先沉淀稀土;然后分别加入适量草酸和还原铁粉,可还原沉淀铁,从而实现了稀土和铁的分步提取。
3.4.3 草酸亚铁产品表征
在n(H2C2O4) ∶n(Fe)=1.5∶1、n(Fe) ∶n(Fe3+)=1∶1、沉淀温度30 ℃、沉淀时间30 min的较优条件下,铁沉淀率为94.28%,铁总回收率为92.34%。对草酸亚铁产品分别进行了XRD和SEM表征。由图16和图17结果表明,草酸亚铁主要成分为FeC2O4·2H2O,其形貌主要为粒状结构。对其进行化学成分分析,表3结果表明,草酸亚铁纯度为99.22%。
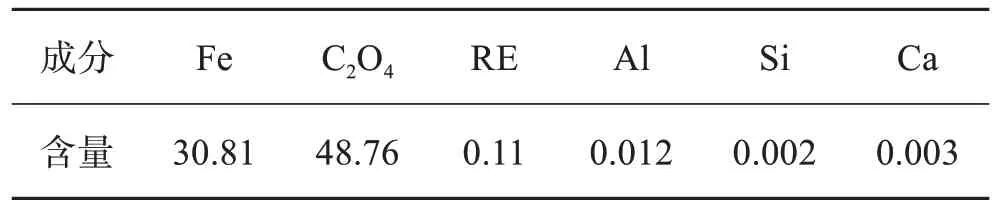
表3 草酸亚铁化学成分分析Table 3 Composition of FeC2O4·2H2O单位:%(质量分数)

图16 草酸亚铁XRD结果Fig.16 XRD results for FeC2O4·2H2O

图17 草酸亚铁SEM结果:(a) ×10;(b) ×15Fig.17 SEM results for FeC2O4·2H2O:(a) ×10;(b) ×15
4 结 论
1)钕铁硼油泥是一种宝贵的稀土二次资源,通过对其进行低温氧化焙烧、盐酸共浸、草酸沉淀稀土、还原沉淀铁等工艺研究,本文提出了一种钕铁硼油泥稀土和铁同步浸出与分步提取的新工艺。与传统钕铁硼废料回收工艺相比,该工艺不仅有效回收了稀土元素,而且综合回收了非稀土金属铁,具有资源综合利用率高、固体废弃物量少等优点。
2)在焙烧温度300 ℃、焙烧时间90 min、盐酸浓度5 mol/L、液固比(mL/g) 5∶1、浸出时间90 min、浸出温度90 ℃条件下,稀土和铁实现了同步浸出,其浸出率分别为98.80%和98.41%。研究表明,焙烧温度过低时,铁未氧化完全,产生大量氢气;焙烧温度过高时,铁因烧结现象难以完全溶解,而稀土铈被氧化为CeO2也难以溶解。
3)综合上述各种沉淀条件参数,在n(H2C2O4) ∶n(RE3+)=3∶1、沉淀温度60 ℃、沉淀时间30 min的较优化参数下,稀土沉淀率可达98.43%,而铁共沉淀率仅为0.5%,最终获得了纯度为98.34%的草酸稀土产品,稀土总回收率为97.24%。在共浸出液中,稀土和铁分别以RE3+阳离子和FeCl4-阴离子形式存在,由于草酸稀土盐溶度积常数极低,而FeCl4-配合物非常稳定,加入草酸沉淀,实现了稀土和铁的选择性分离。
4)在n(H2C2O4)∶n(Fe)=1.5∶1、n(Fe)∶n(Fe3+)=1∶1、沉淀温度30℃、沉淀时间30 min的较优工艺条件下,铁沉淀率为94.28%,获得了纯度为99.22%的草酸亚铁产品,铁总回收率为92.34%。在还原铁粉和草酸共同作用下,FeCl4-、FeC2O4+均被还原并生成FeC2O4沉淀。

