生物3D 打印丹酚酸B-海藻酸钠-明胶皮肤支架促进糖尿病大鼠创面愈合
秦立昊,李静燕,张嘉伟,柏益飞,刘婷婷,唐蛰雨,薛同庆,贾中芝*
1南京医科大学附属常州第二人民医院介入血管科,江苏 常州 213003;2大连医科大学研究生院,辽宁 大连 116044;3淮安市淮安医院(淮安市肿瘤医院)疼痛与介入血管外科,江苏 淮安 223000
糖尿病溃疡创面是临床上常见的慢性病,其创面修复已经成为临床棘手的难题[1-2]。丹酚酸B(salvianolic acid B,SAB)的化学式为C36H30O16,主要是从丹参的根及枝干中提取的活性物质,具有抗氧化、抗炎、抗细胞凋亡等功能[3]。研究证实SAB在糖尿病肾病、糖尿病视网膜病变的防治中发挥着重要作用[4-5]。近年来,生物3D 打印技术逐渐用于制备人工皮肤[6-8]。目前,尚无使用SAB作为生物墨水制备人工皮肤支架的报道。
本研究首次使用SAB 作为生物墨水,与海藻酸钠、明胶混合制备人工皮肤支架,并通过动物实验,探讨SAB-海藻酸钠-明胶皮肤支架对糖尿病大鼠创面的治疗作用,以期为糖尿病溃疡创面的修复提供一种可供选择的人工皮肤支架。
1 材料和方法
1.1 材料
SAB、明胶(100G强度)、海藻酸钠(上海麦克林公司),SD大鼠(苏州敬微宇生物科技公司),链脲佐菌素(MedChemExpress 公司,美国),高糖高脂大鼠饲料(南京协同生物公司),4%中性缓冲福尔马林固定液(广州维格斯生物公司),苏木素染液、中性树胶、4’,6-二脒基-2-苯基吲哚染色试剂、组织自发荧光淬灭剂、抗荧光淬灭封片剂、HE 染液套装、Masson 染液套装、环保型脱蜡液、通用型组织固定液、双硫键还原检测法蛋白定量检测试剂盒、丙二醛(malondialdehyde,MDA)测试盒(武汉赛维尔公司),二甲苯(上海国药集团化学试剂有限公司),活性氧(reactive oxygen species,ROS)染液(上海西格玛奥德里奇贸易有限公司),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测试盒、过氧化氢酶(catalase,CAT)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测试盒(南京建成有限公司)。
3D 生物打印机(RegenHU 公司,瑞士),透皮扩散仪(上海邦亿公司),血糖仪(ContourTS 公司,德国),光学显微镜(Olympus公司,日本),自动组织脱水机、PBM-B 型包埋机和包埋冷台(常州普瑞斯星医疗器械公司),徕卡轮转切片机(Leica 公司,德国),病理组织漂烘仪(常州中威电子仪器公司),组织摊片机(金华科迪仪器设备有限公司),动物实验手术器械盒(上海医疗仪器有限公司),酶标检测仪(BioTeK公司,英国),台式高速冷冻离心机(北京大龙公司),高速组织研磨仪、涡旋混合器(武汉赛维尔公司)。
动物实验经南京医科大学附属苏州第二人民医院动物伦理委员会审批通过([2022]KY120-01)。
1.2 方法
1.2.1 皮肤支架的制备
将一定量的SAB 溶于10 mL 去离子水,并加入装有0.4 g 海藻酸钠粉末及1.0 g 明胶颗粒的烧杯中,置于40 ℃水浴中搅拌30 min;按SAB 占海藻酸钠与明胶总重的百分比制成0%、0.5%、1.0%、1.5%的生物墨水。
使用RegenHU 3D 打印机,将以上制备的生物墨水加入热熔挤压式针筒中,加热至40 ℃并保持恒温,气压0.25 MPa,针尖距离接收板1 mm,打印速度5 mm/s,针头25 G,按照1.2 cm×1.2 cm 打印4 层,间距0.8 mm,最终制备出SAB含量为0%、0.5%、1.0%、1.5%的SAB-海藻酸钠-明胶皮肤支架。扫描电镜观察支架形貌。
1.2.2 皮肤支架的药物释放
将含有不同含量SAB 的皮肤支架浸泡在37 ℃5 mL 的磷酸盐缓冲液(PBS)中,100 r/min 间断振荡。在多个时间点(0.5、1.0、2.0、4.0、8.0、10.0、12.0、24.0、48.0、72.0 h)收集混合溶液,采用高效液相色谱法对SAB 进行定量分析。根据上海麦克林公司的SAB标准参考品(99.0%)计算SAB的累积释放量。
1.2.3 糖尿病大鼠模型的构建
SPF 级雄性SD 大鼠,8 周龄,体重约150 g。高糖高脂饲料诱导喂养4周,一次性腹腔注射1%链脲佐菌素30 mg/kg(0.1 mol/L 柠檬酸缓冲液配制,pH 4.5)。用药72 h后,自大鼠尾缘静脉微量采血检测随机血糖,若血糖值>16.7 mmol/L,则视为2 型糖尿病大鼠造模成功。
1.2.4 动物分组及干预
36只2 型糖尿病大鼠随机分为6组(每组6只):空白对照组、凡士林纱布组以及皮肤支架组(0%SAB、0.5%SAB、1.0%SAB、1.5%SAB组)。大鼠采用1%戊巴比妥钠麻醉,备皮,使用无菌手术刀在大鼠背部皮肤上切出边长为0.8 cm 的正方形,深度达肌层。空白对照组创面不采取任何处理,仅用无菌纱布包扎,凡士林纱布组采用凡士林纱布覆盖创面,其余各组以含不同比例SAB的皮肤支架覆盖创面。于第7、14天观察创面愈合、渗出等情况,并拍照记录,判断创面恢复情况。
1.2.5 组织学检查及氧化应激水平检测
第7、14 天时,分别随机处死3 只大鼠,获取组织标本,包括创面及创面周围组织。采用ROS荧光染色,抗氧化酶SOD、GSH-PX、CAT 及氧化应激产物MDA 检测评估创面氧化应激水平;HE 染色观察创面修复情况及肉芽组织的生长情况;Masson染色观察创面胶原蛋白沉积情况。
1.3 统计学方法
采用GraphPad Prism 8.0 软件进行数据分析及作图。符合正态分布的数据采用均数±标准差(±s)表示。两样本均数比较采用独立样本t检验,多组样本均数比较采用单因素方差分析(one-way ANOVA),各组之间的两两比较采用SNK 法,P<0.05 为差异有统计学意义。
2 结果
2.1 皮肤支架的形貌
肉眼观:4 个不同含量SAB 组的皮肤支架均呈网格状,孔径均匀(图1A);扫描电镜:4个不同含量SAB 组皮肤支架均为多孔网状立体结构,孔隙均匀(图1B)。
2.2 皮肤支架的体外药物释放
各组SAB 累积释放量均随释放时间延长逐渐增加,其中1.5%SAB 组皮肤支架在各个时间点的SAB释放量均高于其他3组(图2)。
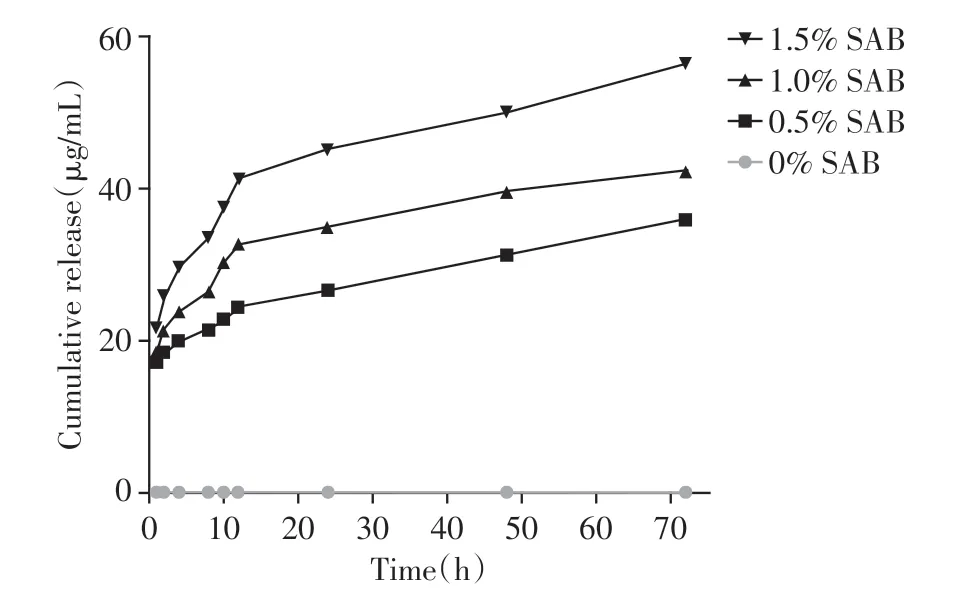
图2 不同规格SAB-海藻酸钠-明胶皮肤支架的SAB体外释放曲线Figure 2 In vitro release curves of SAB-sodium alginategelatin skin scaffolds with different specifications
2.3 创面修复
创面修复趋势及创面面积定量分析(图3)可见,第7天时,各组创面均无明显渗出,0.5%SAB组、1.0%SAB 组、1.5%SAB 组可见创面结痂,0.5%SAB组、1.0%SAB组的创面面积小于其他组(P<0.05);第14 天时,各组创面面积均缩小,0.5%SAB 组、1.0%SAB 组的创面面积小于其他组(P<0.05),其中1.0%SAB组的创面愈合最好。

图3 在第7、14天时各组创面修复大体观及创面面积定量分析Figure 3 General view of wound repair and quantitative analysis of wound area in each group on day 7 and 14
2.4 创面组织ROS表达水平
在第7、14 天时,各组创面组织均有ROS 表达(图4);对各组ROS 的表达水平进行定量分析(图5)。第7天时,1.0%SAB组ROS表达水平显著低于其他组(P<0.001);第14天时,1.0%SAB组ROS表达水平显著低于空白对照组、凡士林纱布组、0%SAB组及0.5% SAB 组(P<0.01),1.0%SAB 组和1.5%SAB 组ROS表达水平差异无统计学意义(P=0.136)。
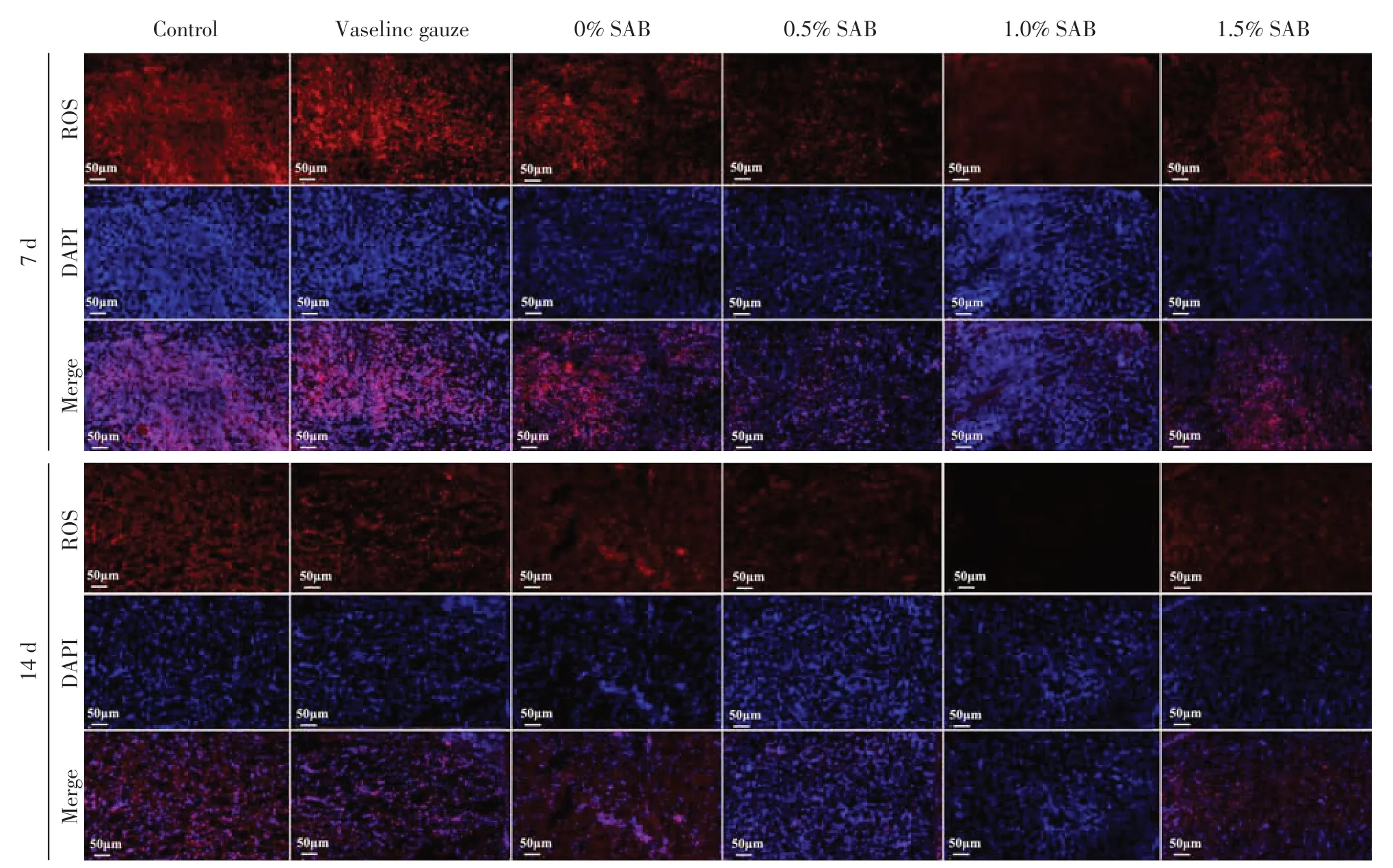
图4 各组创面组织在第7、14天时ROS的表达水平Figure 4 The levels of ROS in the wound tissue of each group on day 7 and 14
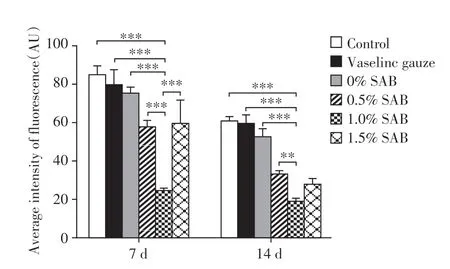
图5 各组大鼠创面组织ROS表达水平的定量分析Figure 5 Quantitative analysis of ROS levels in rat wound tissue of each group
2.5 创面组织SOD、GSH-PX、CAT 及MDA 的表达水平
第7、14 天时,各组创面组织均有SOD、GSHPX、CAT及MDA的表达(图6)。第7天时,1.0%SAB组SOD、GSH-PX 及CAT 表达水平均高于其他组(P<0.05,图6A、C、E),MDA水平低于空白对照组、凡士林纱布组及0%SAB 组(图6G);第14 天时,1.0%SAB 组SOD、GSH-PX 及CAT 表达水平均高于空白对照组、凡士林纱布组及0%SAB 组(P<0.05,图6B、D、F),MDA 表达水平低于空白对照组、凡士林纱布组(P<0.05,图6H)。
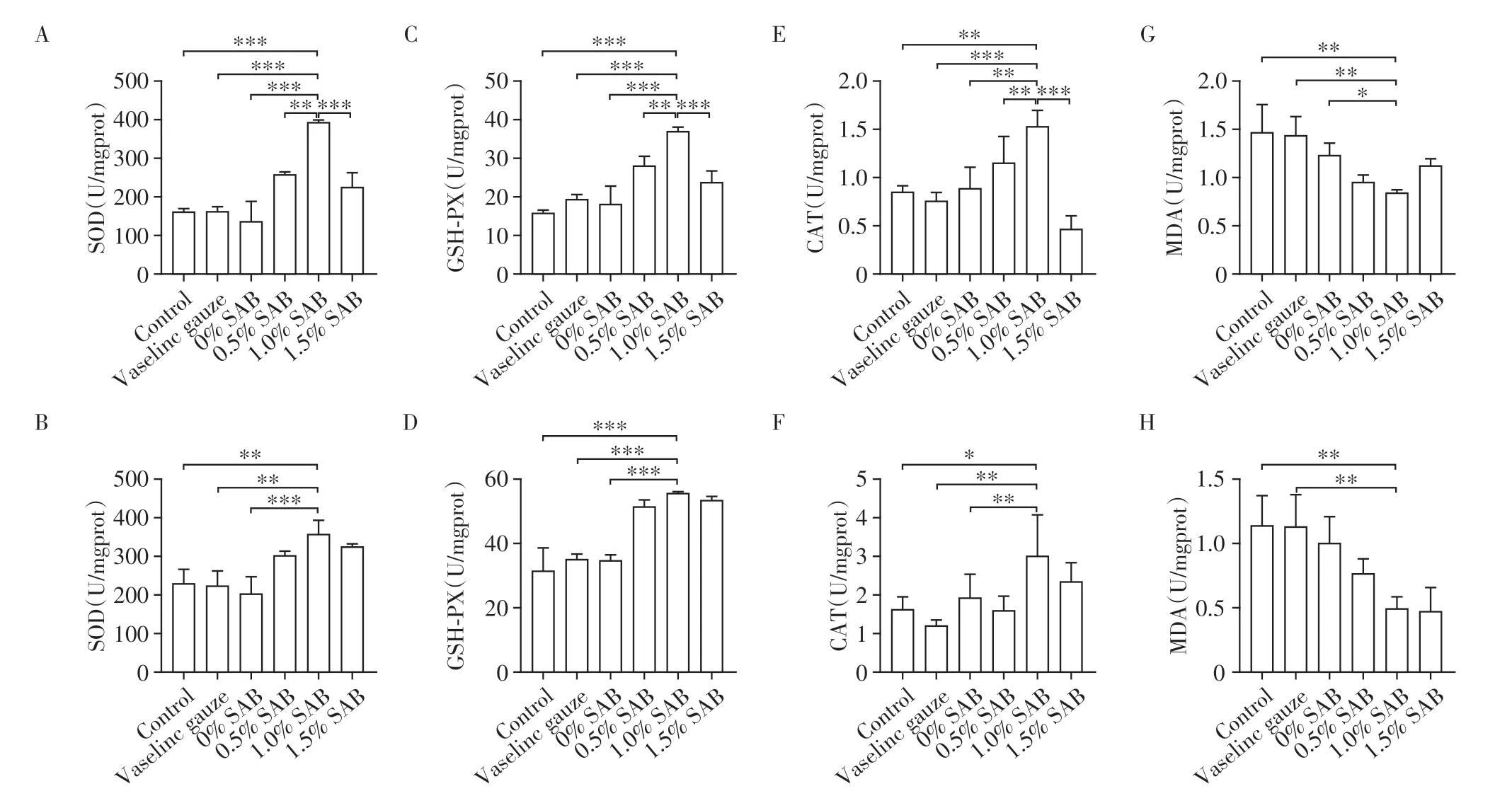
图6 第7、14天时各组大鼠创面组织SOD、GSH-PX、CAT及MDA的表达水平Figure 6 The expression levels of SOD,GSH-PX,CAT and MDA in rat wound tissues of each group on day 7 and 14
2.6 创面修复的组织学形态
HE 染色结果显示,第7 天时,各组创面组织修复尚可,未见明显组织坏死,创缘可见大量炎症细胞浸润;第14天时,各组创面进一步修复,创缘可见结痂并出现新生肉芽组织,其中1.0%SAB组新生肉芽组织较多,各组创缘及新生肉芽组织内见大量炎症细胞浸润(图7)。
Masson染色结果显示,第7天时,各组创面均有胶原纤维沉积,但排列松散稀疏,0.5%SAB组、1.0%SAB 组、1.5%SAB 组胶原纤维沉积多于其他组(P<0.05,图8);第14 天时,各组胶原沉积充分,排列整齐致密,胶原纤维束变粗,部分相互交织形成网状结构,0.5%SAB 组、1.0%SAB 组、1.5%SAB 组胶原纤维沉积高于其他组(P<0.05,图8)。
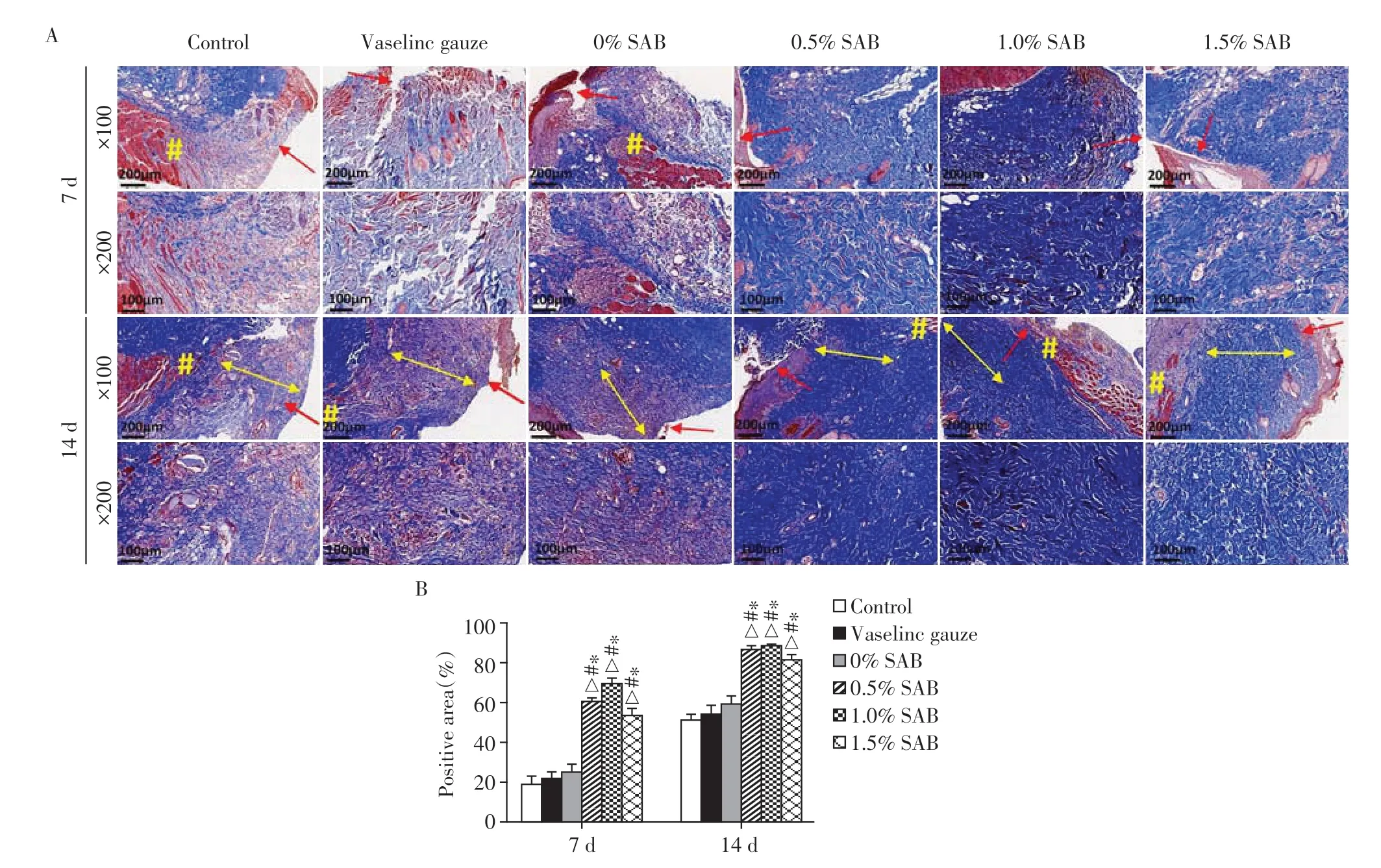
图8 第7、14天时各组创面胶原纤维沉积情况Figure 8 The deposition of collagen fibers on the wound tissues of each group on day 7 and 14
3 讨论
近年来,糖尿病溃疡创面的治疗已经成为临床面临的巨大挑战,创面敷料是创面管理的重要组成部分[9-15]。随着生物3D 打印技术的快速发展,可以通过该技术获得个性化的人工皮肤支架,不但可以提供利于细胞黏附及组织再生的微环境,而且支架的三维结构有利于细胞获得足够的氧气和营养物质,生物3D打印皮肤支架作为糖尿病溃疡创面的暂时性敷料具有明显优势。生物墨水的制备是生物3D 打印皮肤支架的关键,以海藻酸钠-明胶为生物墨水的人工皮肤支架具有体内外生物相容性[16]。SAB 是丹参的水溶性成分之一,具有抗氧化、抗炎、神经保护、抗纤维化等作用[17-18]。本研究在海藻酸钠-明胶基础上成功制备了不同SAB 含量的SAB-海藻酸钠-明胶皮肤支架,并在动物实验中探讨了其治疗糖尿病创面的疗效。
高血糖状态导致ROS在创面组织集聚,并且抑制抗氧化酶[19],氧化还原稳态失衡导致创面愈合变缓。SAB可以提供氢原子以发挥强大的抗氧化作用,并且具有一定的自由基清除能力[20]。此外,SAB可以上调各种抗氧化酶如SOD、GSH-PX的表达[20]。本研究发现1.0%SAB 组皮肤支架具有较强的抗氧化能力,7 d及14 d的ROS及MDA水平低于其他组,并且SOD、GSH-PX、CAT 水平显著高于其他组。这说明1.0%SAB支架能抑制氧化应激引起的ROS 增多,可以显著改善糖尿病创面的氧化应激反应。此外本研究还发现1.5%SAB 支架抗氧化能力低于1.0%SAB,这可能是因为SAB 的药理学作用与其浓度有关,因此筛选出最佳浓度来发挥SAB促进创面愈合的作用至关重要[21-22]。
胶原蛋白沉积在促进糖尿病溃疡创面的修复过程中发挥着重要作用。胶原蛋白可以维持新生肉芽组织的弹性及强度,为创面修复创造一个良好的环境,因此,胶原蛋白沉积直接影响糖尿病足溃疡创面修复的进程[21]。一项分析SAB 浓度对细胞胶原蛋白合成影响的研究发现,SAB 在所有测试浓度下都能刺激胶原蛋白的合成,提示SAB具有较强的促进胶原蛋白合成的能力[22]。也有研究证明SAB能抑制肝脏或心肌的病理性纤维化,从而抑制Ⅲ型胶原的合成,这表明SAB在生理和病理生理过程中对胶原蛋白的合成具有不同的作用[22]。本研究发现第7、14天时,0.5%、1.0%、1.5%SAB组的皮肤支架促进胶原蛋白沉积的效果优于其他各组,提示SAB-海藻酸钠-明胶皮肤支架能促进胶原沉积,加速创面愈合。
本研究发现1.0%SAB组支架促进创面愈合的效果最佳,可能与SAB存在一定毒性有关。有研究表明SAB 促进创面愈合最有效的浓度为25 μg/mL,而75 μg/mL SAB抑制创面愈合[21]。其原因为75 μg/mL SAB抑制了促细胞迁移的蛋白酶、细胞因子的分泌,影响细胞增殖,从而阻碍了创面中新生组织的生长,创面愈合能力也因此下降[22]。本研究显示,1.0%SAB 组支架促进创面愈合的能力和抗氧化作用优于高剂量的1.5%SAB组支架。一方面,可能由于1.5%SAB抑制细胞迁移及增殖而愈合效果较差;另一方面,抗氧化剂的作用并不是随着剂量的增加而增加,例如低剂量的维生素具有抗氧化作用,而高剂量的维生素C 则会产生氧化作用,损害细胞[23]。相关研究也表明,SAB 在低剂量时可通过抑制ROS 产生发挥抗氧化作用,在高剂量时可通过促进ROS产生促进氧化损伤[24-26]。因此1.0%SAB组支架抗氧化性能最佳,ROS 水平最低,进一步促进了创面的愈合。
本研究尚有以下不足之处:①仅进行了体内验证,未进行体外实验研究,下一步将进行细胞实验,从细胞层面证明其作用;②仍需进一步研究各实验组皮肤支架的体外时间-降解曲线;③本研究并未对相关机制进行探讨,后续将对相关信号通路开展研究。
综上,本研究采用生物3D打印技术成功制备了SAB-海藻酸钠-明胶皮肤支架,并初步验证了含有1.0%SAB的SAB-海藻酸钠-明胶皮肤支架促进创面修复的作用较为理想,其在第7、14天时不但可以抑制ROS 的产生,上调各种抗氧化酶的表达,抑制创面组织内氧化应激反应,还可以促进胶原沉积,最终促进糖尿病大鼠创面的修复,有望成为一种理想的糖尿病溃疡创面修复的生物皮肤支架。
致谢:
感谢3D 打印与再生医学研究室赵红斌教授为本课题的顺利实施提供的帮助。

