基于天冬氨酸转氨酶-血小板计数比的列线图模型对肝细胞癌射频消融治疗后复发的预测价值
季亚香,奚 静,刘春艳,吴 萍,章晓兰,宋 蒨
手术切除和肝移植是肝细胞癌(hepatocellular carcinoma,HCC)的主要治疗方式。近年来,B 超或CT引导下射频消融(radiofrequency ablation,RFA)成为了一种可替代的新型治疗方法。研究表明,RFA 与手术切除对早期HCC 的疗效相似[1-3]。但RFA 治疗后肿瘤复发仍然是亟待解决的问题。寻找敏感、可靠的预测标志物对降低HCC 复发具有重要的意义。除了肿瘤数量、肿瘤大小等生物学特征外,全身炎症反应与肝功能状况也与HCC 复发及预后密切相关。有学者提出,血清天冬氨酸转氨酶(AST)与血小板计数(PLT)比值指数(AST-platelet ratio index,APRI)可作为慢性肝炎患者HCC 进展的风险预测因子[4-5]。有研究报道,术前APRI 与HCC 肝切除术后并发症及肝功能衰竭有关,APRI 是接受手术治疗的HCC 患者一项有价值的预后标志物[6-10]。本研究探讨APRI 与RFA 后HCC 复发的关系,并基于APRI 与肿瘤生物学特征开发了预测HCC 复发的列线图模型,以帮助临床医生制定个性化治疗策略。
1 材料与方法
1.1 研究对象
纳入2017 年1 月至2020 年12 月江苏大学附属武进医院初诊为HCC 并接受RFA 作为一线治疗的患者204 例,年龄为(57.4±11.2)岁,男139 例(68.1%),女65 例(31.9%)。纳入标准:①经影像学证实无血管侵犯或肝外远处转移;②肝功能Child-Pugh A 级或B 级;③无HCC 治疗史,包括手术切除、经导管肝动脉化疗栓塞、系统化疗等。排除标准:①消融不完全者;②复发性HCC;③伴有其他未控制的血液系统疾病或恶性肿瘤;④临床病理资料缺失或失访者。本研究经医院医学伦理审查委员会批准,所有患者在RFA 治疗之前均签署书面知情同意书。
1.2 数据收集与定义
通过医院电子病历系统收集患者资料,包括年龄、性别、HBV/HCV 感染史、肝硬化、肝功能Child-Pugh 分级、肿瘤个数、肿瘤最大直径、实验室检查指标(AST、ALT、Alb、TBil、PLT、AFP)等。
APRI 主要基于血清AST 与PLT 获得,计算公式:APRI=[AST(U/L)/正常值上限(U/L)]/PLT(×109/L)。血清白蛋白-胆红素分级(ALBI) 计算公式:ALBI=lg[血清总胆红素值(μmol/L)]×0.66-血清白蛋白(g/L)×0.085。ALBI 分级标准[11],1 级:ALBI≤-2.60,2 级:-2.60<ALBI<-1.39,3 级:ALBI ≥-1.39。
1.3 RFA 治疗与随访
采用MedSphere 公司S-1500 型射频消融仪,消融功率为90~200 W,消融时间10~15 min。理想的消融边缘应完全覆盖肿瘤及肿瘤周围边缘超过0.5 cm,病灶消融治疗后立即行增强CT 扫描,确认病灶是否已完全消融,如果有肿瘤残余则补充消融治疗,以实现对病灶的完全消融。
RFA 术后前两年内每3 个月对患者随访1 次,之后每6 个月随访1 次,直至观察到肿瘤复发或末次随访为止。每次随访内容包括肝胆脾超声、腹部强化CT 或肝脏磁共振成像(MRI)以及实验室检查,如血常规、肝功能、血清AFP 等。主要观察结果为无复发生存期(recurrence-free survival,RFS),即以患者首次接受RFA 治疗的时间为起点,至出现HCC 复发的时间段。截止末次随访时仍无复发者定义为删失。HCC 复发包括局部肿瘤进展、肝内复发和肝外转移,所有复发患者均通过肝脏强化CT 或MRI 扫描证实。
1.4 统计学方法
采用SPSS 24.0 软件处理数据,R 4.2.1 软件用于列线图模型的构建与校正曲线的绘制。正态分布的计量资料以均数±标准差表示,比较采用独立样本t检验,偏态分布的计量资料以中位数及四分位数间距表示,比较采用Mann-WhitneyU检验。计数资料以例数(%)表示,比较采用χ2检验或Fisher’s精确检验。通过受试者工作特征(receiver operation characteristics,ROC)曲线确定APRI 预测HCC 复发的最佳截断值,采用Kaplan-Meier 法绘制生存曲线并计算中位RFS。Cox 回归分析RFA 治疗后HCC复发的影响因素,并选择模型中的显著变量建立列线图。P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象的一般特征
204 例患者中,150 例(73.5%)有HBV/HCV 感染,149 例(73.0%)伴有肝硬化,肿瘤最大直径为(1.91±0.84) cm,AST 为63.0(42.0~91.0) U/L,ALT 为48.0(34.0~69.0) U/L,血小板计数为(182.9±81.7)×109/L,血清总胆红素为(16.5±8.0) μmol/L,血清白蛋白为(38.1±4.5)g/L。随访时间为18.2(11.1~26.2) 个月,RFA 后HCC 复发117 例(57.4%),其中1 年内复发77 例,2 年内复发108 例。APRI 预测HCC 复发的最佳截断值为0.501,APRI 的曲线下面积(area under curve,AUC)为0.678 (95%CI:0.603~0.752),诊断敏感度为71.8%,特异度为54.0%。
复发与无复发组患者基线特征比较见表1。与无复发组相比,复发组肿瘤直径更大、AFP 和AST更高、白蛋白更低、ALBI 分级和APRI 更高。两组患者的性别、年龄、HBV/HCV 感染、肝硬化、肝功能Child-Pugh 分级等差异无统计学意义(P>0.05)。
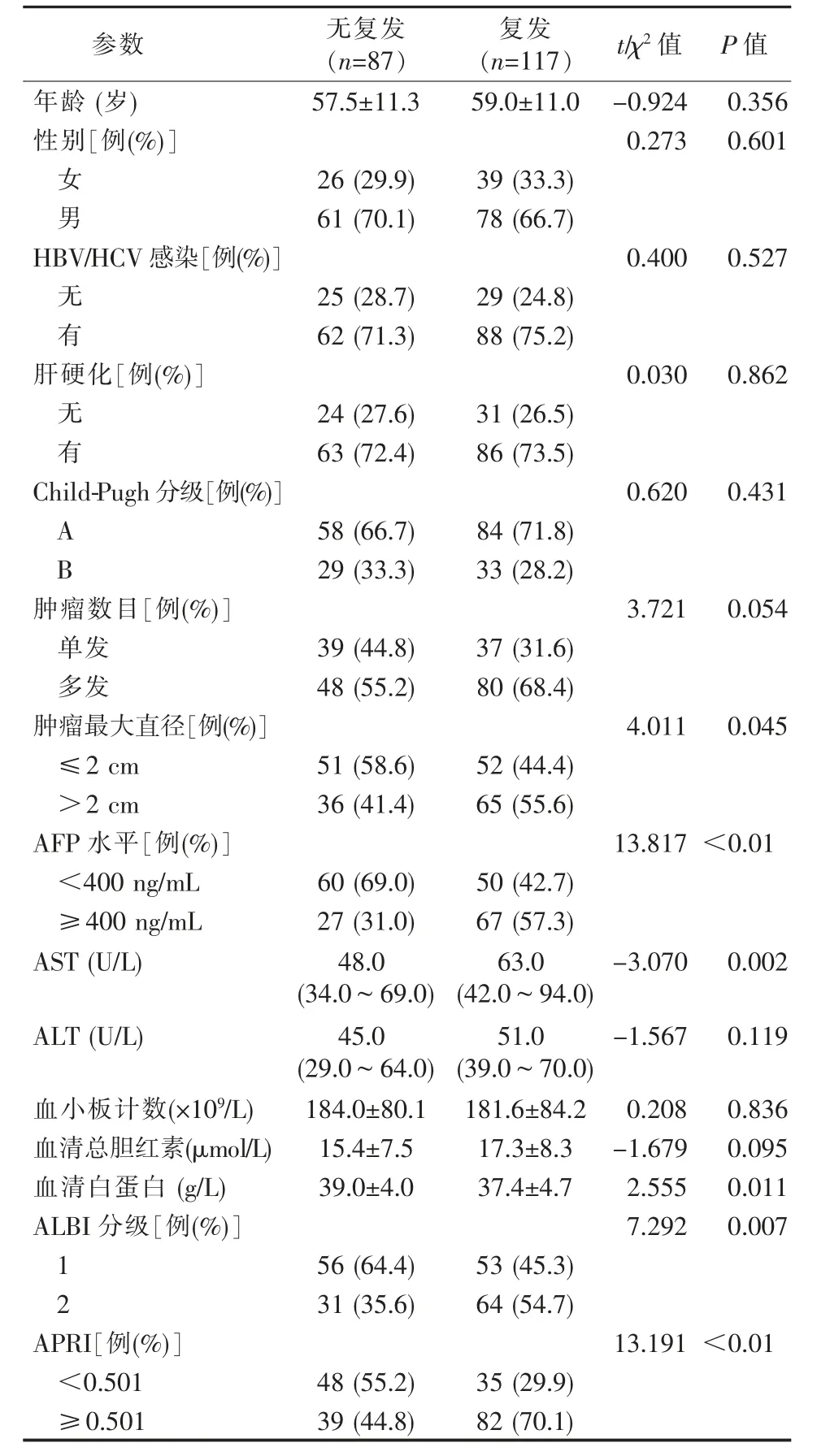
表1 射频消融后复发与无复发患者的基线特征比较
2.2 RFA 治疗后HCC 复发的影响因素
全组患者的中位RFS 为16.0 个月(95%CI:11.7~20.5),1 年、2 年和3 年RFS 率分别为57.1%、40.4%和31.2%。根据APRI 的最佳截断值将所有HCC患者分为高APRI 组(≥0.501)121 例,低APRI 组(<0.501)83 例。生存曲线显示,高APRI 组患者中位RFS 为11.5 个月(95%CI:6.9~15.1),低APRI 组患者中位RFS 未达到,差异有统计学意义(χ2=12.929,P<0.01),见图1①。此外,高ALBI 分级亦与HCC 不良预后显著相关,ALBI 1 级与2 级患者中位RFS 分别为26.0 个月 (95%CI:16.9~36.2) 和12.0 个月(95%CI:7.8~16.1),差异有统计学意义(χ2= 8.234,P=0.004),见图1②。
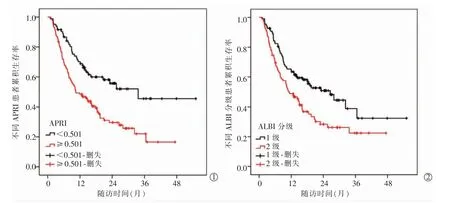
图1 Kaplan-Meier 曲线展示不同APRI、ALBI 分级与患者生存的关系
单因素Cox 分析示肿瘤数目、 肿瘤最大直径、血清AFP 水平、APRI 和ALBI 分级与RFA 治疗后HCC 复发具有显著相关性。将以上5 个显著变量拟合到多因素分析中,结果发现多发肿瘤、肿瘤最大直径>2 cm 、 血清AFP≥400 ng/mL 以及高APRI指数是HCC 复发的独立风险因素,而ALBI 分级无预后意义,见表2。
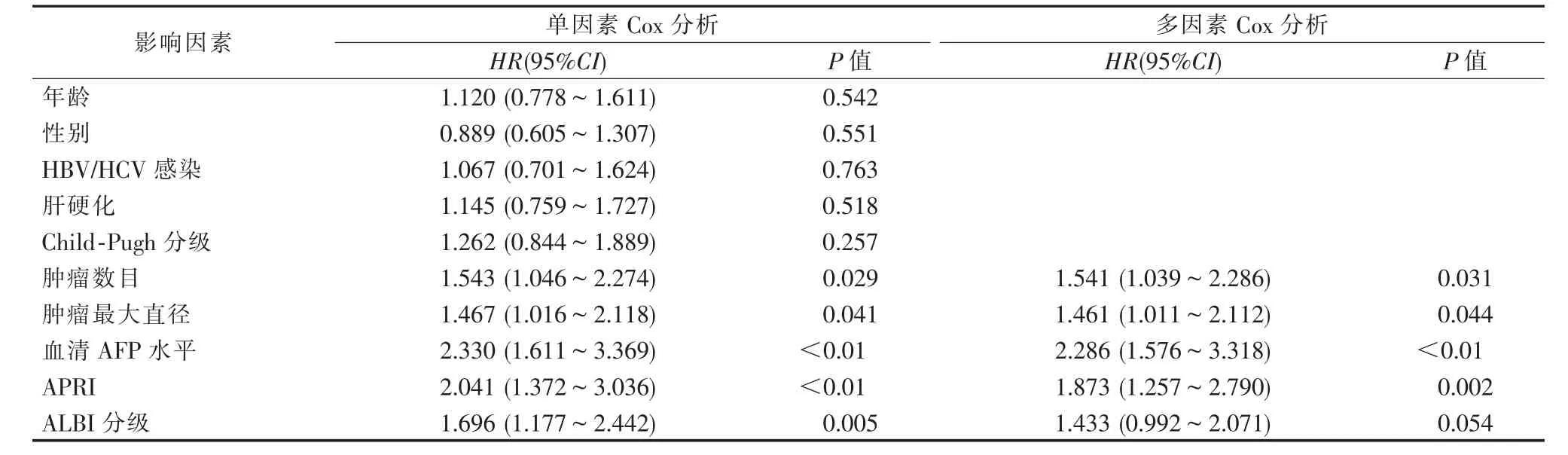
表2 Cox 回归分析RFA 治疗后HCC 复发的影响因素
2.3 列线图模型的建立与评价
构建预测RFA 治疗后HCC 个体复发的列线图模型,见图2。基于多因素Cox 回归模型中的回归系数,将肿瘤数目、 肿瘤最大直径、 血清AFP 水平和APRI 指数分别赋予一个评分,而4 个变量得分的加权代表了HCC 复发风险。结果该列线图模型预测HCC 复发的C 指数为0.769(95%CI:0.676~0.862),预测RFA 治疗后1 年、2 年和3 年RFS 的AUC 值分别为0.707、0.719 和0.707。此外,校正曲线展示模型预测的1 年、2 年和3 年RFS 与实际概率之间具有良好一致性,进一步证实列线图模型对HCC复发的预测价值,见图3。

图2 预测RFA 治疗后HCC 复发的列线图

图3 列线图预测HCC 患者RFA 治疗后1 年、2 年和3 年RFS 的校正曲线
3 讨论
本研究中,204 例接受RFA 治疗的HCC 患者中有57.4%出现了肿瘤复发,多数患者在2 年内复发。目前,将RFA 治疗后2 年内复发定义为早期复发,与原发肿瘤的侵袭性生物学行为密切相关。本研究的结果表明,肿瘤数目、肿瘤最大直径以及血清AFP 水平是HCC 复发的独立危险因素,这在之前的研究中已被证实[12-13]。
除了肿瘤的侵袭性,宿主自身炎症反应与肝脏储备功能亦与HCC 的发生发展及临床预后密切相关。APRI 最初主要用于慢性乙型、丙型肝炎患者肝纤维化与肝硬化的诊断[14]。AST 主要存在于肝细胞的线粒体中,当肝细胞受损时AST 可以释放到血清中,因此AST 常被用作衡量肝细胞损伤程度的指标。此外,AST 还是肝脏炎症的生物学标志物[15]。PLT 可促进肝细胞再生,其减少与肝硬化严重程度相关;另一方面,PLT 在肿瘤微环境中发挥着重要作用,可以促进和调节肿瘤血管生成[16-18]。合并肝硬化者发生HCC 的风险高达80%,越来越多的证据表明,反复的肝细胞坏死与肝细胞再生可能是导致治疗后HCC 复发的重要因素[19]。因此,结合AST 和PLT 的APRI 可能从肝功能储备和炎症反应两方面反映HCC 患者的预后。尽管在不同研究中APRI 的最佳截断值不尽相同,但均表明高APRI 是HCC 患者预后不良的独立预测因素[20-21]。Lee 等[22]在对HBV 相关HCC 患者术后随访过程中发现,HCC 复发者的APRI 值持续高于非复发者。Zhu 等[23]对351 例接受经动脉化疗栓塞的HCC 患者进行了回顾性研究,将APRI 的截断值设定为0.50,结果发现高APRI 患者的DFS 明显短于低APRI 者。在一项荟萃分析中,发现高APRI 患者的总体生存与无病生存风险比分别为1.77(95%CI:1.53~2.05)和1.59(95%CI:1.47~1.71),表明APRI 升高与HCC 患者不良预后存在显著相关性[24]。
列线图可以通过整合不同预后变量实现对各种癌症患者的复发风险与预后结局的个体化预测[25]。基于多元Cox 回归分析确定的4 个风险因素(肿瘤数目、肿瘤最大直径、血清AFP 水平和APRI),建立了预测RFA 治疗后HCC 复发的列线图模型。该模型对HCC 复发展示了良好的预测表现,能够较好地区分高、低风险个体,有助于临床医生制定RFA治疗后随访策略与个体化治疗。
本研究存在以下局限性:为回顾性研究,不能避免选择性偏倚的可能; 没有严格区分早期复发和晚期复发,亦没有区分肝内局部复发、肝内转移和肝外转移等复发类型,而不同的复发时间与复发类型可能具有不同的风险预测因素和病理生理机制[26-27];由于样本量有限,未对列线图模型进行内、外部验证。因此,有必要进一步开展相关研究,以证实该模型对RFA 治疗后HCC 复发的预测价值。
综上所述,高APRI 是RFA 治疗后HCC 复发的独立预测指标。整合APRI 与肿瘤生物学特征(肿瘤数目、肿瘤最大直径及血清AFP 水平)的列线图模型有望实现对HCC 复发风险的个体化分层,帮助临床医生跟踪疾病进展并做出有效的临床决策。

