甘蔗糖蜜促进类球红细菌辅酶Q10 的糖转化效率
葛 燕, 栗 波, 刘爱军, 肖慈英, 陈必钦, 朱志春, 梁剑光, 庄英萍, 王泽建
(1.常州大学药学院, 江苏 常州 213164;2.华东理工大学生物反应器工程国家重点实验室, 上海 200237;3.河北欣港药业有限公司, 石家庄 051530;4.内蒙古金达威药业有限公司, 呼和浩特 010000)
辅酶Q10(Coenzyme Q10, CoQ10),是一种亲酯性分子,在有氧呼吸的电子传递链中充当电子载体,产生三磷酸腺苷(ATP),并广泛存在于生物中[1-2]。辅酶Q10是一种强抗氧化剂,通过直接清除自由基或再生生育酚水平来保护膜磷脂和蛋白质不受脂质过氧化的影响[3]。此外,辅酶Q10在胆固醇代谢、氨基酸代谢、维持溶酶体pH 值等方面发挥作用,已被证明直接影响许多基因的表达[4]。医学研究表明,补充辅酶Q10对糖尿病患者、心血管衰竭患者以及患有阿尔兹海默症和帕金森病等神经系统疾病的患者有益[5-7]。
辅酶Q10的生物合成方法具有成本低、生产过程简单、生物活性较高的特点,被认为是最有前景的方法,主要生产菌株有酵母菌属、假单胞菌属、土壤杆菌属、红曲酶属等[8]。辅酶Q10发酵优化策略主要有分子优化策略、氧调控策略和培养基优化策略。Zhu等[9]通过在类球红细菌中共同表达gpa-1 和vgb 基因,调节了细胞内的氧化还原电位和摄氧量,产生了协同效应,提高了辅酶Q10的产量和生物量,在补料分批发酵中,辅酶Q10产量达到600 mg/L。Wang 等[10]通过调节供氧水平和连续补料硫酸铵,将在线氧摄取速率(OUR)恒定控制在(45±2.2) mmol/(L·h),辅酶Q10产量达到(2 584±82) mg/L,较对照组提高了15.4%。
培养基优化是提高微生物代谢水平和产物积累较有效的方法[11],其中碳源和氮源对菌体生长代谢影响较大。甘蔗糖蜜(Cane Molasses,CM)是制糖产业的副产品,其中含有40%~60%的糖(葡萄糖、蔗糖和果糖),氮含量(质量分数)约为8.7%。此外,甘蔗糖蜜中还含有一定量的氨基酸(天冬氨酸、谷氨酸、甘氨酸、丙氨酸),有机酸(苹果酸、柠檬酸、草酸等),无机盐(Na+、Mg+、K+、P+等金属离子)和维生素(胆碱、泛酸、烟酸)等物质,可以为菌体生长提供能量、提供物质合成所需的碳骨架和前体[12-15]。文献[16]发现甘蔗糖蜜可以作为酵母菌株生长和代谢所必需的碳源,有效提高乙醇的产量。与葡萄糖和其他碳源相比,甘蔗糖蜜中含有大量的糖,是通过生物转化生产生物产品的廉价原料[17]。Gomes 等[18]利用甘蔗糖蜜中的混合糖来生产丁醇,既降低了原材料的成本,又提高了丁醇的产量。
糖转化率是影响辅酶Q10产量的关键,是生产中的主要组成部分,降低糖消耗量是提升生产效率的关键。甘蔗糖蜜能够用于菌体的生长和能量的维持,实现替代糖的功能,用于菌体的生长且利用效率更高。甘蔗糖蜜具有成本低、污染物含量少、全年可用性等优点,已经被用于乳酸、丁酸、乙醇、柠檬酸等多种工业化产品的生产[19]。Wechgama 等[20]采用正交试验设计优化了培养基,提高了甘蔗糖蜜生产丁醇的效率,并且使糖转化率提高到了90.50%,甘蔗糖蜜中含有大量的可发酵糖,有效地降低了生产成本。综上所述,甘蔗糖蜜的添加有利于生产成本的降低,然而目前鲜有关于甘蔗糖蜜对辅酶Q10发酵的影响的报道,本研究首次考察了甘蔗糖蜜对辅酶Q10发酵的影响。
本文选用类球红细菌作为出发菌株生产辅酶Q10,首先研究了不同碳源底物、甘蔗糖蜜浓度、玉米浆干粉对类球红细菌菌体生长和辅酶Q10合成的影响,通过正交试验优化了甘蔗糖蜜、葡萄糖、磷酸二氢钾的最佳配比,并在30 L 发酵罐上对甘蔗糖蜜添加工艺进行中试验证。本文对提高辅酶Q10发酵效价和降低发酵成本具有重要的现实意义。
1 实验部分
1.1 原料和试剂
1.1.1 菌株 类球红细菌(Rhodobacter sphaeroides),由内蒙古金达威药业有限公司提供。
1.1.2 实验仪器 SBA-40E 型生物传感分析仪(山东省科学院生物研究所);30 L 发酵罐(上海国强生化工程装备有限公司);安捷伦1260 型液相色谱仪(美国Agilent 公司);MAX300-LG 型尾气质谱仪(美国Extrel 公司);752 型紫外可见分光光度计(上海菁华科技仪器公司)。
1.1.3 培养基
(1)平板培养基(g/L):酵母提取物15,磷酸氢二钾1,氯化钠2,七水硫酸亚铁0.1,七水硫酸镁0.5,硫酸锰溶液(10 g/L)3 mL,氯化钴溶液(10 g/L)1 mL,氯化胆碱溶液(0.404 g/L)1 mL,琼脂粉20,pH 7.0~7.2。
(2)种子培养基(g/L):硫酸铵4,酵母粉2,味精1,玉米浆粉1,葡萄糖15,磷酸氢二钾1,磷酸二氢钾1,硫酸亚铁0.2,硫酸镁3.6,氯化钠2,硫酸锰溶液1(0 g/L)2 mL,氯化钴溶液(10 g/L)1.5 mL,pH 7.1~7.2。
(3)发酵培养基(g/L):葡萄糖30,硫酸铵3,味精3,玉米浆干粉4,磷酸二氢钾1,硫酸镁12,硫酸亚铁1.2,氯化钠2.5,酵母膏1,碳酸钙2.5,GLT-309 消泡剂0.2 mL。
1.1.4 培养方法
(1)摇瓶培养:从平板上挑取颜色鲜艳、形态饱满的单菌落接入装有50 mL 一级种子培养基的500 mL摇瓶中,在32 ℃、260 r/min 下避光培养28 h,按1%接种量将一级种子液接入装有200 mL 二级种子培养基的2 L 摇瓶中,在32 ℃、260 r/min 培养21 h;按10%接种量将二级种子液接入装有45 mL 发酵培养基的500 mL 摇瓶中,在32 ℃、260 r/min 下培养48 h。
(2)发酵罐培养:30 L 发酵罐装液量为20 L,按10%接种量接入到发酵罐中,初始转速400 r/min,通气量3 L/min,压力0.05 MPa,温度32 ℃,发酵过程中用氨水调控pH 为6.5,补料控制糖质量浓度在(5.0±0.1) g/L,培养96 h,每4~6 h 取样检测OD700、菌体干重(DCW)、残糖、pH、效价等参数,并镜检观察菌体形态变化,每12 h留样测效价,分别研究甘蔗糖蜜和玉米浆干粉对类球红细菌产辅酶Q10的影响。
1.2 检测方法
1.2.1 菌体浓度测定 OD700:取1 mL 发酵液,用去离子水稀释至合适倍数,一级种子稀释约20 倍,二级种子稀释约20~50 倍,发酵液稀释50~100 倍,使用紫外可见分光光度计在700 nm 波长处测吸光度。DCW:取10 mL 发酵液,在4 000 r/min条件下离心10 min,弃去上清后,将沉淀放入烘箱,于105 ℃下烘干称量。
1.2.2 葡萄糖浓度测定 取5 mL 发酵液,在4 000 r/min离心5 min,取上清液稀释至合适倍数,吸取25 μL 稀释液,用葡萄糖测定仪进行检测。
1.2.3 总糖浓度测定 用DNS(二硝基水杨酸)法测总糖。二硝基水杨酸与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,该产物在煮沸条件下显棕红色,且在一定浓度范围内颜色深浅与还原糖含量成比例。具体操作方法是取离心上清液,按照估计的总糖进行浓度稀释。混匀后取稀释液1 mL 加入10 mL离心管,加入750 μL盐酸和750 μL去离子水,搅拌均匀,沸水浴20 min。水解完毕后,冷却至室温,继续加入750 μL、6 mol/L 的氢氧化钠溶液,使溶液pH至7.4 左右,加入750 μL 去离子水,1.5 mL DNS 溶液,沸水浴5 min,最后加入4.5 mL 去离子水,混匀。在波长540 nm 处检测吸光度。
1.2.4 辅酶Q10含量测定 通过高效液相色谱法测定发酵液中的辅酶Q10含量,具体色谱条件为:C18 色谱柱(4.6mm×150 mm,5 μm,不锈钢柱),检测波长275 nm,流动相为无水乙醇与无水甲醇混合液(乙醇与甲醇体积比为35∶65),进样量20 μL,流速1.1 mL/min,柱温35 ℃。
样品处理方法:避光处理;吸取1 mL发酵液,置于10 mL 容量瓶中,加6 mol/L 盐酸溶液10 μL,轻微振摇,再加无水丙酮2 mL,φ为30%双氧水200 μL,用无水乙醇定容至刻度。再将容量瓶置超声器中超声提取45 min(容量瓶的塞子放小纸片,排气、超声过程水温不宜过高,35 ℃以下),取出,摇匀。用0.45 μm针筒过滤器过滤,弃去初滤液,收集续滤液,用高效液相色谱仪分析。
1.2.5 糖转化率(Yp/s) 糖转化率的计算公式如下:
其中, TiterQ10为辅酶Q10产量,mg/L; ρG0为初始糖的质量浓度, g/L; ρGt为最终糖的质量浓度, g/L;经检测发酵2 d 培养基体积量挥发较少,可忽略不计。
1.2.6 OUR 检测 发酵过程中采用质谱仪对OUR进行在线测定,并使用Biostar 软件对数据进行采集以及在线处理。OUR 的具体计算公式如式(2):
其中,Fin为进气流量(mmol/L);V为发酵液体积(L);φinert,in, φO2,in, φCO2,in, φO2,out和 φCO2,out分别表示进气中惰性气体、氧气、二氧化碳和尾气中氧气、二氧化碳的体积分数,pin为进气气压(Pa),tin为温度(℃),h为进气的相对湿度(%)。上述变量除tin、h外均由反应器在线参数检测获得,tin、h为离线测定所得[21]。
1.2.7 二氧化碳释放速率(CER)测定 GER 计算公式如式(3)所示:
2 结果与讨论
2.1 不同碳源对类球红细菌Q10 发酵过程的影响
碳源在微生物培养基中具有重要作用,为微生物生长提供物质基础,并为产物合成提供碳架。不同碳源进入糖酵解所需的酶不同,会影响微生物对碳源的利用效率和产物的转化效率。因此,本研究考察了不同种类碳源(葡萄糖、蔗糖、果糖、麦芽糖、乳糖)摇瓶发酵对类球红细菌生长和辅酶Q10合成的影响,结果如图1 所示。

图1 不同碳源对类球红细菌发酵过程的影响Fig.1 Effects of different carbon sources on the fermentation process of Rhodobacter sphaeroides
摇瓶结果(图1(a))可以看出,单糖更利于类球红细菌生长,尤其是葡萄糖作为碳源最适合类球红细菌菌体生长,发酵48 h 葡萄糖组菌体浓度可达到29.00 g/L,辅酶Q10质量浓度292.00 mg/L,单位菌体产量10.07 mg/g(表1)。类球红细菌对果糖的利用效果低于葡萄糖,这是因为果糖需要先转化为果糖-6-磷酸,再转化为葡萄糖-6-磷酸,中间需要果糖激酶等一系列酶催化,导致菌体生长缓慢。从糖耗(图1(b))可以看出,二糖可以被缓慢利用,但是类球红细菌对二糖利用效果明显低于单糖,二糖的菌体浓度只能生长到16 g/L 左右,这是因为二糖水解为单糖需要一系列酶的作用,其中,蔗糖转化为葡萄糖和果糖需要蔗糖酶,麦芽糖和乳糖分别需要麦芽糖酶和乳糖酶转化为葡萄糖,而类球红细菌相关酶的活力较低,导致菌体对糖的消耗比较缓慢,菌体生长缺乏有效碳源,菌体浓度较低,摇瓶内未达到氧限制状态,而辅酶Q10的合成是在氧限制的条件下,所以二糖组几乎没有产物的合成和积累。

表1 葡萄糖组和果糖组发酵参数Table 1 Fermentation parameters of cane molasses group and corn steep powder group
2.2 不同质量浓度甘蔗糖蜜对类球红细菌发酵过程生理参数影响
本研究将玉米浆干粉(Corn Steep Powder,CSP)全部替换为氮含量相等的甘蔗糖蜜(4 g/L 玉米浆干粉和5 g/L 甘蔗糖蜜中氮的质量浓度基本相等),并研究了不同甘蔗糖蜜质量浓度(5、10、15、20、25、30 g/L)对类球红细菌生长和辅酶Q10合成的影响,结果如图2 所示。

图2 不同质量浓度甘蔗糖蜜对类球红细菌发酵过程的影响Fig.2 Effects of different mass concentrations of cane molasses on the fermentation process of Rhodobacter sphaeroides
由图2(a)看出,添加5 g/L 甘蔗糖蜜组和对照组的DCW 皆可达到33 g/L,且添加5 g/L 甘蔗糖蜜组的辅酶Q10产量仅比对照组少3%(图2(b)),说明甘蔗糖蜜可以替代玉米浆干粉作为类球红细菌生产辅酶Q10的合适氮源。随着甘蔗糖蜜添加质量浓度的添加,菌体浓度呈先增长后降低的趋势,辅酶Q10产量也呈现相同的趋势。当甘蔗糖蜜添加质量浓度为20 g/L 时,DCW 和辅酶Q10产量均达到最高,分别为35 g/L 和343 mg/L,Q10产量较对照组提高了19.6%。当添加的甘蔗糖蜜质量浓度超过20 g/L 时,辅酶Q10的产量会稍微下降。从菌体的产物得率Yp/c结果(图2(c))可知,甘蔗糖蜜添加组的Yp/c基本高于对照组,且在低质量浓度糖蜜范围下Yp/c与对照组相近,而随着甘蔗糖蜜质量浓度的增加,Yp/c与总效价的变化趋势相似,先上升后下降,其中,添加20 g/L 甘蔗糖蜜条件下Yp/c达到9.87 mg/g,比对照组高14.2%。由图2(d)知,添加甘蔗糖蜜有利于糖转化率的提高,当甘蔗糖蜜添加质量浓度为20 g/L 时,糖转化率达到最高(6.87 mg/g),较对照组提高了19.6%,葡萄糖得到了高效的利用。
甘蔗糖蜜中的糖类物质可以被菌体利用,为菌体生长提供能量,甘蔗糖蜜中丰富的氮源有利于菌体生长中氨基酸、蛋白质、核酸及含氮代谢物的合成,当添加一定量的甘蔗糖蜜时,有利于促进菌体生长,菌体生长越好,产量就越高。当甘蔗糖蜜添加质量浓度过高时,糖蜜中的金属离子和其他的微量元素浓度过高会影响菌体生长代谢,进而抑制辅酶Q10的合成。以上实验证明,辅酶Q10的合成过程中,甘蔗糖蜜质量浓度为20 g/L时最利于菌体生长和产物合成,辅酶Q10的效价和糖转化率可以得到显著提高,有效地减少了对葡萄糖的利用,且甘蔗糖蜜价格低廉,可以降低生产成本,适合在生产中使用。
2.3 正交试验
为探索碳源与氮源及无机盐组分的最优化搭配,本研究在单因素碳源实验的基础上,通过设计正交试验选取对类球红细菌产辅酶Q10影响较大的3 个因素:甘蔗糖蜜、葡萄糖、磷酸二氢钾的质量浓度,考察对辅酶Q10发酵的影响。各因素选取3 个试验水平,以糖转化率为考察指标。正交试验考察结果(表2)直观数据分析及相应方差统计结果(表3)显示,葡萄糖质量浓度对辅酶Q10糖转化率的影响最为显著(p<0.05),磷酸二氢钾的质量浓度对类球红细菌产辅酶Q10的糖转化率影响最小。不同因素组合对辅酶Q10的影响和正交试验的效应曲线分别如图3和图4 所示。从菌体干重(图3(a))及其效应曲线图(图4(a))可知,菌体浓度与甘糖蜜和葡萄糖的初始添加量呈正相关,当添加的甘蔗糖蜜质量浓度为30 g/L、葡萄糖质量浓度为70 g/L 时,菌体浓度达到最大,但是随着葡萄糖质量浓度的增加,耗糖速率也在增加(图3(d)、4(d)),不利于糖转化率的提升,增加了生产成本。正交试验结果(表2)显示,在 30 g/L 的初始糖质量浓度下,辅酶Q10的糖转化率最高,达到了 12.71 mg/g;随着初始糖质量浓度的增加,糖转化率显著下降,当初始糖质量浓度为 50 g/L,糖转化率降到了 7.9 mg/g。甘蔗糖蜜质量浓度影响统计结果显示(图3(b)、4(b)、4(c)),甘蔗糖蜜质量浓度对辅酶Q10产量影响较大,20 g/L 为甘蔗糖蜜的最适添加的质量浓度,当添加的质量浓度超过 20 g/L 时,由于甘蔗糖蜜中金属离子等其他物质的积累,对辅酶 Q10的合成以及糖转化率的提升没有促进作用。

表2 正交试验结果表Table 2 Table of orthogonal experiment results
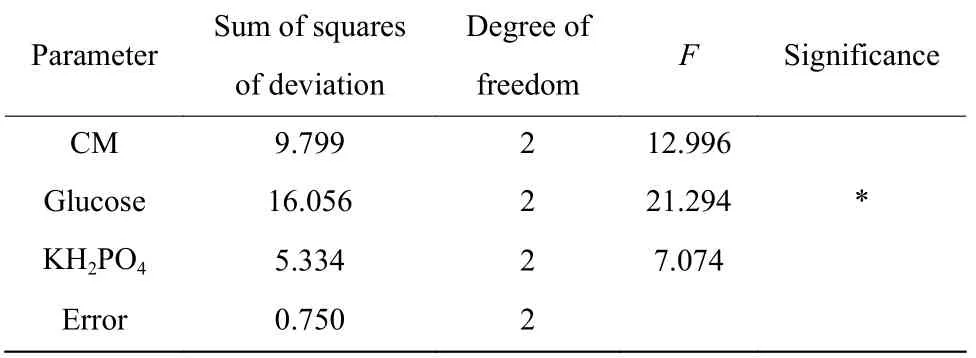
表3 方差分析表Table 3 Analysis of variance table
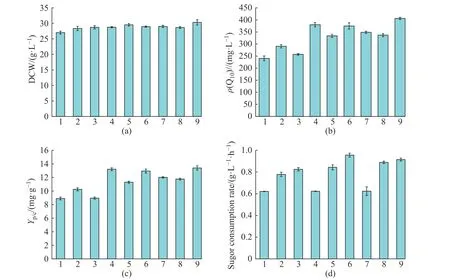
图3 正交试验中不同组合对辅酶Q10 发酵的影响Fig.3 Effect of different combinations on Coenzyme Q10 fermentation in orthogonal experiment

图4 正交试验效应曲线图Fig.4 Curves of the effects of orthogonal experiments
结合图4 和表2 可知,最优组合是A2B1C2,即甘蔗糖蜜质量浓度为20 g/L,葡萄糖质量浓度为30 g/L,磷酸二氢钾质量浓度为1 g/L 时,糖转化率最高,达到12.71 mg/g,辅酶Q10效价达到380.1 mg/L,糖转化率得到了较大的提升,且耗糖速率为0.62 g/(L·h),有效地降低了糖耗,有利于降低生产成本。
2.4 甘蔗糖蜜添加工艺对辅酶Q10 合成的影响
为进一步分析甘蔗糖蜜对辅酶Q10发酵过程动态代谢的影响,结合摇瓶发酵培养基优化实验结果,在30 L 发酵罐中考察了甘蔗糖蜜对辅酶Q10发酵过程中菌体生长和产物合成的影响,并与玉米浆工艺进行了对比分析。
30 L 发酵罐培养过程在线和离线相关参数的变化(图5)显示:在发酵前期,玉米浆干粉组菌体生长较快,且辅酶Q10效价高于甘蔗糖蜜组。在发酵后期(76 h 后),甘蔗糖蜜为氮源能够更好地维持菌体活力,辅酶Q10合成速率能够维持,96 h 发酵产量最高达到3 311 mg/g,比玉米浆干粉组高15.4%。OUR 作为能够直接反应细胞呼吸代谢情况的生理参数,可以体现出发酵过程中菌体生长的状态。从两组实验OUR 变化可以看出(图5(c)):在发酵60 h 前,甘蔗糖蜜组较平稳,玉米浆干粉组波动较大;在发酵后期,玉米浆干粉组OUR 呈现持续下降的趋势,而甘蔗糖蜜组能维持较为稳定的OUR 水平,且明显高于玉米浆实验组,这说明甘蔗糖蜜的添加明显起到了维持菌体活力的作用。二氧化碳释放速率(CER)变化(图5(d))与OUR 表现出了同样的趋势,甘蔗糖蜜组优于玉米浆干粉组,这些都表明甘蔗糖蜜的添加有利于菌体呼吸代谢。从单位产量(图5(e))和辅酶Q10合成速率(图5(f))也可以看出,甘蔗糖蜜的添加有利于维持后期菌体活力以及辅酶Q10的合成。通过甘蔗糖蜜组和玉米浆干粉组发酵过程参数的最大值(表4)可看出,与玉米浆相比,甘蔗糖蜜的糖耗(Ys/p)从112.78 kg/kg 降低到99.74 kg/kg,糖转化率提高了13.9%。糖耗得到显著降低,这是因为甘蔗糖蜜中含有的还原糖可以被菌体生长利用,从而降低了葡萄糖的消耗,并且提高了发酵后期葡萄糖转化为辅酶Q10的效率,在提高产量的同时,进一步降低了生产成本。

表4 甘蔗糖蜜组和玉米浆干粉组发酵过程参数的最大值Table 4 Fermentation process maximum parameters of cane molasses group and corn steep powder group
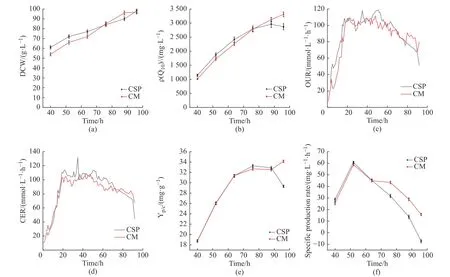
图5 甘蔗糖蜜组和玉米浆干粉组发酵过程代谢参数差异Fig.5 Difference of metabolic parameters between sugarcane molasses group and corn pulp dry powder group during fermentation
30 L 发酵罐的实验结果表明,添加甘蔗糖蜜可有效提高辅酶Q10的产量,有利于菌体代谢活力的维持,并能有效提升辅酶Q10对葡萄糖的转化率。此外,甘蔗糖蜜中含有氨基酸、有机酸、含氮化合物、维生素、K+、甜菜碱等能够维持菌体的代谢活力,可为辅酶Q10合成提供前体,促进辅酶Q10的合成。
3 结 论
(1)考察了不同碳源对辅酶Q10的影响,发现葡萄糖为碳源最适于菌体生长和辅酶Q10的合成,同时,类球红细菌可以利用二糖生长菌体,但利用率低于单糖。
(2)首次考察了添加不同质量浓度的甘蔗糖蜜对辅酶Q10发酵的影响,当甘蔗糖蜜添加质量浓度为20 g/L时,辅酶Q10产量达到343 mg/L,糖转化率提升了19.6%。
(3)通过正交试验探究了甘蔗糖蜜、葡萄糖、磷酸二氢钾的质量浓度对类球红细菌产辅酶Q10的影响,研究结果表明,当甘蔗糖蜜质量浓度为20 g/L、葡萄糖质量浓度为30 g/L、磷酸二氢钾质量浓度为1 g/L 时,辅酶Q10产量提高了10.8%,且糖转化率达到12.71 mg/g,较优化前提高了85.0%。
(4)在30 L 发酵罐上考察了糖蜜添加工艺对辅酶Q10合成的影响,研究发现玉米浆干粉有利于前期菌体的生长和辅酶Q10的合成,而甘蔗糖蜜有利于维持菌体代谢活力和辅酶Q10的合成速率,促进后期辅酶Q10的合成,Q10产量最高达到3 311 mg/L,较对照组提高了15.4%,同时糖耗降低了11.8%,糖转化率为10.10 mg/g,提高了13.9%。
(4)添加一定量的甘蔗糖蜜有利于辅酶Q10的合成和糖转化率的提升,降低生产成本,为放大生产提供了理论依据。后续可以通过结合代谢物组学和转录组学深入研究甘蔗糖蜜在类球红细菌中的代谢机理,从而更全面深入地了解甘蔗糖蜜对辅酶Q10的发酵影响。

