氯化钙/聚乙烯醇涂膜处理对脆红李生理生化的影响
李 东,郝 旺,雷 雨,李静雅,张诗琪,李 甜
(四川轻化工大学生物工程学院 四川宜宾 643002)
脆红李是蔷薇科(Rosaceae)李属(Prunus)核果类水果,是我国选育的晚熟李品种,主要种植在川、渝、黔等西南地区[1],因其具有酸甜可口、水分饱满、营养丰富的特点而深受消费者的喜爱[2]。每年上市集中在5~8 月,该季节气温较高,加之脆红李为呼吸跃变型水果,生理代谢旺盛,采后快速软化腐烂,货架期短[3],严重制约脆红李的贮运和销售。亟需解决脆红李采后保鲜问题,提高脆红李的经济价值。
Ca2+作为信号传导离子,在维持果实质构和植物激素的代谢过程中起到重要作用,影响着果实的成熟衰老[4]。果实采后通过浸钙处理可提高果肉组织内的Ca2+含量,Ca2+与果胶酸残基交联加强细胞壁及细胞膜的结构,降低了纤维素酶、果胶酯酶、聚半乳糖醛酸酶、β-半乳糖苷酶和果胶裂解酶等对其底物的分解性[5],从而保持果实的硬度,增强多酚氧化酶、过氧化氢酶、超氧化物歧化酶等抗氧化酶的活性[6-7]。乙烯的生物合成依赖于1-氨基环丙烷-1-羧酸氧化酶(1-Aminocyclopropane-1-carboxylic acid oxidase,ACO)将乙烯前体物质1-氨基环丙烷-1-羧酸(1-Aminocyclopropane-1-carboxylic acid,ACC)转化为乙烯。高Ca2+含量能对细胞壁及质膜起到保护作用,使ACC 与ACO区域性分隔导致两者不能接触,降低乙烯的生成[8]。
聚乙烯醇(Polyvinyl alcohol,PVA)是一种无毒、无害,可自然降解的高分子乙烯基聚合物[9]。PVA 聚合度、醇解度越高,其黏度越高,所成膜的机械性能越优异,并具有良好的气体阻隔性[10]。PVA 分子结构中存在大量羟基,具有良好的水溶性、生物相容性[11]。2003 年第61 次食品添加剂安全评估会议上,联合国粮食及农业组织、联合国世界卫生组织食品添加剂联合专家委员会(JECFA)对聚乙烯醇进行安全性评估[12],聚乙烯醇被美国农业部批准用于包装肉类和家禽产品[13]。因其极性、稳定性、成膜性较强,易与其它材料共混的特点,而被应用于食品保鲜膜的研发中,且能达到隔绝外界空气、抗菌、保鲜的效果[14]。
目前将浸钙或涂膜的保鲜处理单独应用于草莓[15]、蓝莓[16]、苹果[17]、芒果[18]、樱桃[19]等水果贮藏保鲜的案例屡见不鲜,而将两者联合应用于水果保鲜的研究鲜有报道。李子采后浸钙处理可通过增加胞浆钙浓度,加强细胞壁和质膜结构来维持果实硬度;高Ca2+含量可降低ACC 含量和乙烯形成酶(EFE)活性来影响低乙烯的生物合成[20];还可抑制纤维素酶、果胶酯酶等的活性[5],减缓李子软化衰老。经聚乙烯醇涂膜处理的李子能有效降低呼吸速率,减少水分散失,抵抗外界微生物对李子的侵害,从而降低李子的腐烂率,延长其贮藏寿命。本研究针对贮藏期李子内、外环境的变化,尝试将浸钙与涂膜两种保鲜方式结合,旨在探索出一种高效的脆红李采后贮藏保鲜方案,为李子的采后复合保鲜贮藏技术的开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原材料 以晚熟脆红李为试材,采自四川省茂县。挑选八成熟、大小颜色均匀、无病虫害、无机械损伤的果实进行试验。
1.1.2 试剂 聚乙烯醇,四川莱特聚信药用辅料公司;愈创木酚、邻苯二酚、硫代巴比妥酸、2,6-二氯靛酚、聚乙烯吡咯烷酮、多聚半乳糖醛酸、纳他霉素、三氯乙酸,上海麦克林生化科技有限公司;曲拉通X-100,上海易恩化学技术有限公司;玉米淀粉、氯化钙、聚乙二醇6000、过氧化氢、3,5-二硝基水杨酸、乙酸钠、草酸、抗坏血酸,成都科隆化学品有限公司,以上试剂均为分析纯级。
1.2 仪器与设备
GQ-300 气调保鲜箱,广州标际包装设备有限公司;N5000PLUS 紫外-可见分光光度计,上海佑科仪器仪表有限公司;TG16 高速离心机,上海卢湘仪离心机仪器有限公司;JJ-2B 组织捣碎机,金坛区指前镇旭日实验仪器厂;3051H 果蔬呼吸测定仪,浙江托普云农科技股份有限公司;YH-100001 电子天平,五鑫衡器有限公司;XA-XT PLUS 质构分析仪,英国Stable Micro System 公司;DZKW-4 电热恒温水浴锅,北京中兴伟业世纪仪器有限公司;LB80T 糖度计,广州速为电子科技有限公司。
1.3 样品处理
1.3.1 氯化钙浸泡处理 根据预试验的结果,选择质量分数为2%的氯化钙溶液浸泡20 min 作为处理水平。参考王艳颖等[6]的方法,准确称取20 g氯化钙于烧杯中,配制质量分数为2%的氯化钙溶液1 000 mL。将每个处理组(1 kg)的脆红李放入氯化钙溶液中浸泡20 min 后取出自然沥干,转入4 ℃环境贮藏。
1.3.2 涂膜液的配制及浸泡涂膜处理 根据预试验的结果,选择配方为1% PVA、1.5%玉米淀粉、0.03%纳他霉素(Natamycin,NATA)的涂膜剂作为处理水平。参考Cano 等[21]的方法,并加以改进。准确称取PVA 10 g、玉米淀粉15 g 加入1 000 mL 蒸馏水中,在85 ℃下搅拌直至溶解。待溶液冷却至常温后,加入0.15 g 那他霉素,再加入5 g 甘油作增塑剂,搅拌均匀,冷却后定容至1 000 mL,备用。待涂膜液冷却至常温后,将筛选的脆红李进行浸泡涂膜处理。每组脆红李在涂膜液中浸泡30 s 后捞出置于通风处1 h,自然风干后转入4 ℃环境贮藏。
1.3.3 浸钙+涂膜的保鲜处理 将经严格筛选的脆红李先放入2%氯化钙浸泡20 min,取出自然风干后,再放入上述聚乙烯醇复合涂膜液中浸泡30 s,进行浸泡涂膜处理。对照组脆红李,放入蒸馏水中浸泡20 min,自然风干后,同上述处理组脆红李转入4 ℃环境贮藏。
1.4 脆红李生理生化指标测定方法
1.4.1 呼吸强度(Respiration rate)测定 参考张强等[22]的方法,采用气流法测定,放入果蔬呼吸强度测定仪进行测定,结果以每小时每千克果实释放的二氧化碳质量表示,单位:mg/h·kg,每组重复测定3 次。
1.4.2 硬度测定 参考陈鸥等[23]的方法,硬度的测定采用TA.XT Plus 质构测定仪。测定为TPA 模式,采用P/36R 探头沿果实赤道等距离测定3 次。测定参数:预压速率2 mm/s,下压速率1 mm/s,压后回升速率2 mm/s,回升距离5 cm,触发力值0.1 N,试样受压变形5 mm。由质地特征曲线得到表征果实硬度的评价参数,硬度单位:N,重复3 次。
1.4.3 可溶性 固形物(Soluble solid content,SSC)含量的测定 SSC 测定参考刘慧等[24]的方法,采用糖度计LB80T 测定,重复3 次。
1.4.4 总酸(Titratable acid,TA)含量测定 TA测定参考曹建康等[25]的方法,采用NaOH 滴定法,结果以苹果酸计,重复3 次。
1.4.5 丙二醛(malondialdehyde,MDA)含量测定参考殷健东[26]的方法并加以改进,采用分光光度计法测定,取上清液分别测定A450nm、A532nm、A600nm的吸光值。结果以每克果实样品(鲜重)中的MDA含量表示,单位nmol/g FW,重复3 次。
1.4.6 多聚半乳糖醛酸酶(Plygalacturonase,PG)活性测定 参考曹建康等[25]的方法并加以改进。PG 活性以每小时每克果实组织样品(鲜重)在37℃催化多聚半乳糖醛酸生成半乳糖醛酸的质量表示,单位μg/h·g FW。
1.4.7 过氧化物酶(Peroxidase,POD)活性测定参考Bi 等[27]的方法并加以改进。采用愈创木酚法测定POD 活性,每隔1 min 监测POD 在波长470 nm 处吸光度的增加量,每个处理组测5 min,得到6 组数据,重复3 次。结果以每克果实样品(鲜重)每分钟吸光度增加1 时为一个酶活性单位(U),POD 活性单位:U/g FW。
1.4.8 多酚氧化酶(Polyphenol oxidase,PPO)活性测定 采用邻苯二酚法测定PPO 活性,每隔1 min 监测PPO 在波长420 nm 处吸光度的增加量,每个处理组测5 min,得到6 组数据,重复3 次。结果以每克果实样品(鲜重)每分钟吸光度增加1 时为一个酶活性单位(U),PPO 活性单位:U/g FW。
1.5 数据统计与分析
利用SPSS 25 软件对数据进行分析,利用Duncan's 多重比较进行差异显著性分析(P<0.05)和Pearson 相关系数进行相关性分析,结果均以平均值±标准偏差显示。运用Origin 2021 进行制图。
2 结果与分析
2.1 不同保鲜处理对脆红李呼吸强度的影响
如图1 所示,对照组的脆红李呼吸强度变化呈现双峰波动的趋势,第12 天时脆红李的呼吸强度迅速下降至6.7723 mg/h·kg 为贮藏期最低值,在贮藏期的第18 天到达峰值为30.1274 mg/h·kg,之后对照组的脆红李呼吸强度逐渐下降。浸钙组脆红李在30 d 的贮藏期中呼吸强度的变化趋势与对照组相似,在第12 天时呼吸强度的最低值仅为3.4578 mg/h·kg 且第18 天时的峰值显著低于对照组(P<0.05)。与对照组相比,涂膜组的脆红李呼吸强度变化趋势有所区别,在贮藏期的第0~12天,涂膜组的脆红李呼吸强度逐渐下降至最低值3.7543 mg/h·kg,第6 天时该组脆红李呼吸强度得到抑制(P<0.05)。浸钙+涂膜组的脆红李呼吸强度的变化趋势与浸钙组相似,在第6 天时有小幅上升,第12 天下降至最低值,第18 天达到峰值为19.9898 mg/h·kg,之后逐渐降低至4.9758 mg/h·kg。经过保鲜处理的脆红李呼吸高峰均得到有效抑制(P<0.05)。

图1 不同保鲜处理下脆红李呼吸强度的变化Fig. 1 Changes in respiratory intensity of plum fruit under different preservation treatments
2.2 不同保鲜处理对脆红李硬度的影响
如图2 所示,对照组脆红李硬度随着贮藏时间的延长而降低,在贮藏期的前6 d 迅速降低了30.5 N。浸钙组脆红李硬度在整个贮藏期内也呈下降趋势,而在前18 天内浸钙组的脆红李硬度显著高于对照组(P<0.05)。涂膜组脆红李的硬度变化趋势与对照组大致相似,呈现先快速降低,后缓慢降低的趋势。浸钙+涂膜组脆红李的硬度在前12 d 的硬度明显高于对照组(P<0.05),在第12 天时浸钙+涂膜组的脆红李硬度为38.09 N,而对照组的脆红李硬度为19.81 N。

图2 不同保鲜处理对脆红李硬度的影响Fig. 2 The effects of different preservation treatments on the hardness of plum fruit
2.3 不同保鲜处理对脆红李可溶性固形物含量的影响
如图3 所示,对照组脆红李的可溶性固形物含量随着贮藏时间的延长逐渐增加,呈上升趋势。浸钙组脆红李的可溶性固形物含量也呈上升趋势,第6 天时明显高于其它组的脆红李(P<0.05),而在6~12 d 之间仅增加0.1°Brix,之后缓慢上升,在第24 天时,出现下降的现象,较第18 天低了0.5°Brix。之后逐渐增加至19.83°Brix。涂膜组的脆红李,在第12 天时可溶性固形物含量增加明显,达到17.13°Brix,之后缓慢降低至14.7°Brix,24 d 后快速上升至18.73°Brix。浸钙+涂膜组脆红李在0~18 d 内逐渐上升至16.4°Brix,18~24 d 内出现下降趋势,24 d 后又开始上升,30 天时达到13.8°Brix。
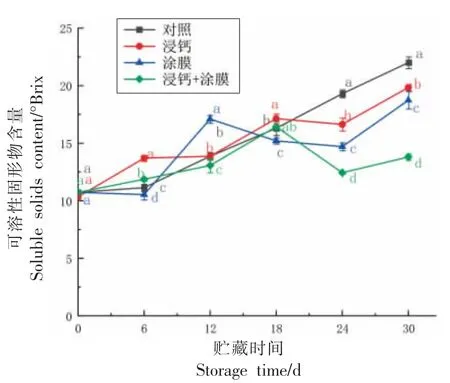
图3 不同保鲜处理下脆红李SSC 含量的变化Fig. 3 Varies of the SSC content of plum fruit under freshness preservation
2.4 不同保鲜处理对脆红李总酸含量的影响
如图4 所示,对照组的脆红李总酸含量下降明显,30 d 内从1.18%降低至0.58%。浸钙组脆红李总酸含量在前18 d 呈下降趋势,在第18~24 天出现上升的趋势,之后又下降至0.71%。涂膜组脆红李总酸含量下降趋势与对照组相似,且各时期的总酸含量差距不大。浸钙+涂膜组脆红李第6 天时总酸含量增加至1.19%,第6~24 天总酸含量逐渐降低,且降低速率逐渐放缓,24 d 后,与浸钙组变化类似,总酸含量下降至0.71%。

图4 不同保鲜处理下脆红李TA 含量的变化Fig. 4 Varies of the TA content of plum fruit under freshness preservation
2.5 不同保鲜处理对脆红李丙二醛含量的影响
如图5 所示,对照组脆红李丙二醛(MDA)的含量随着贮藏时间的延长逐渐增加,且贮藏过程中对照组丙二醛含量显著高于试验处理组(P<0.05),在第30 天时,对照组的丙二醛含量高达60.9 nmol/g FW 是浸钙处理组脆红李的1.36 倍。浸钙组脆红李的丙二醛含量虽与贮藏时间呈正相关的关系,但在整个贮藏期内浸钙处理后的脆红李丙二醛含量显著低于对照组(P<0.05)。涂膜组脆红李的丙二醛含量也呈现逐渐上升的趋势,虽然在贮藏期内涂膜组的丙二醛含量较对照组低,但都比其余的处理组高。浸钙+涂膜组脆红李丙二醛含量变化,呈现缓慢上升的趋势,在12~24 d 丙二醛的累积得到抑制,24 d 后增加迅速最终达到44.5 nmol/g FW。

图5 不同保鲜处理对脆红李MDA 含量的影响Fig. 5 Effects of different preservation treatments on MDA content of plum fruit
2.6 不同保鲜处理对脆红李多聚半乳糖醛酸酶活性的影响
如图6 所示,对照组脆红李的多聚半乳糖醛酸酶活性,呈现先上升达到峰值后下降的变化趋势,在第24 天达到峰值198.63 μg/h·g FW。浸钙组脆红李的多聚半乳糖醛酸酶活性在第12 天时为9.57 μg/h·g FW,较第6 天有小幅降低,在12~24 d 里逐渐升高,24 d 时达到峰值71.34 μg/h·g FW,后迅速降低为29.00 μg/h·g FW。涂膜组脆红李的多聚半乳糖醛酸酶活性变化趋势为:先缓慢增加,12 d 后迅速增加,第18 天时达到173.94 μg/h·g FW 后维持在这个水平一段时间,24 d 时达到峰值175.24 μg/h·g FW,之后突然下降。在0~18 d 范围内浸钙+涂膜组的脆红李多聚半乳糖醛酸酶活性也呈现先增加后降低的趋势,与对照组相比显著降低(P<0.05),在24~30 d 内出现平台期,在第30 天才到达峰值70.72 μg/h·g FW。

图6 不同保鲜处理对脆红李PG 活性的影响Fig. 6 Effects of different preservation treatments on the activity of plum fruit PG
2.7 不同保鲜处理对脆红李过氧化物酶活性的影响
如图7 所示,对照组脆红李的过氧化物酶活性单峰变化趋势为:在0~12 d 过氧化物酶活性逐渐增加达到峰值5.64 U/g FW,12~18 d 内下降,18~24 d 内有小幅上升,之后快速下降至3.81 U/g FW,明显高于1.36 U/g FW 的初始值。浸钙组脆红李过氧化物酶活性在0~12 d 内迅速上升至峰值5.64 U/g FW,第12~24 天内逐渐降低至3.07 U/g FW,24~30 天内出现上升趋势30 d 时达到3.61 U/g FW。涂膜组脆红李在各个时期过氧化物酶活性显著低于对照组(P<0.05)。浸钙+涂膜组的脆红李过氧化物酶活性变化趋势虽与对照组类似,但在第18 天其酶活性降低幅度较大至1.84 U/g FW。

图7 不同保鲜处理对脆红李POD 活性的影响Fig. 7 Effects of different preservation treatments on the activity of plum fruit POD
2.8 不同保鲜处理对脆红李多酚氧化酶活性的影响
如图8 所示,对照组脆红李的多酚氧化酶活性呈现单峰变化趋势,在第6 天到达峰值0.58 U/g FW,6~12 d 内迅速下降,12 d 后缓慢降低。浸钙组、涂膜组的脆红李多酚氧化酶活性的变化趋势在0~24 d 内与对照组相似,在第18 天和第24 天均低于对照组的多酚氧化酶活性(P<0.05),在24 d 后出现缓慢上升。浸钙+涂膜组的脆红李0~24 d内多酚氧化酶活性变化趋势虽与对照组类似,但在12 d 后各个时期测得的多酚氧化酶活性显著低于对照组(P<0.05),且在24 d 后与浸钙组、涂膜组的情况相似,出现上升的趋势。

图8 不同保鲜处理对脆红李PPO 活性的影响Fig. 8 Effects of different preservation treatments on PPO activity of plum fruit
2.9 脆红李各贮藏时期理化指标的相关性分析
如表1 所示,采用SPSS 软件的多变量分析方法对脆红李多个生理生化指标进行相关性分析,采用双侧检验判别相关指标的显著性。由相关性分析结果表1 可知,脆红李可溶性固形物含量与果实总酸含量、硬度、PPO 活性呈现极显著的负相关关系(P<0.01),与丙二醛的累积、POD 活性呈现正相关性(P<0.05)。果实的总酸含量与果实硬度、PPO 活性普遍呈极显著性正相关关系(P<0.01),与丙二醛含量、PG、POD 活性呈显著负相关关系(P<0.05)。果实硬度与PG、POD 活性、丙二醛含量呈现极显著的负相关性(P<0.01),与PPO 活性呈现显著的正相关关系(P<0.05)。其中脆红李贮藏过程中丙二醛含量变化与PG、POD 活性呈现显著正相关关系(P<0.05),与PPO 活性呈极显著的负相关关系(P<0.01)。

表1 脆红李各贮藏时期理化指标的相关性分析Table 1 Correlation analysis of physicochemical indexes in different storage periods of crisp red plum
3 讨论
李子为呼吸跃变型水果,在其成熟衰老过程中会产生呼吸高峰。试验结果表明,各种保鲜处理并不能延后呼吸高峰的到来,而与对照组相比,经过保鲜处理的李子呼吸高峰的呼吸强度得到抑制(P<0.05)。贮藏期的前期脆红李呈现呼吸跃变的情况,此现象与Bi 等[27]、王艳颖等[6]对李果实的研究结果相一致,在第6 天出现呼吸强度上升,可归因于低温、浸钙、涂膜等保鲜处理对脆红李产生低温胁迫或高浓度钙离子胁迫,使得脆红李产生抗胁迫作用,导致新陈代谢加速,呼吸强度上升。然而,经聚乙烯醇涂膜处理后的脆红李,呼吸强度明显受到抑制。12 d 时脆红李已适应4 ℃的低温环境,脆红李内部生理生化反应得以减缓,使得12 d时显著降低。聚乙烯醇涂膜处理能减少李子与贮藏环境的气体交换,有效抑制呼吸速率,降低果实的新陈代谢,延缓果实衰老从而延长贮藏时间。
水果中可溶性固形物(SSC)包括可溶性糖、果胶、有机酸等,是能直接反映水果成熟度和品质状况的重要指标[28],3 个处理组在贮藏期的可溶性固形物含量变化呈现先上升后下降趋势,与陈力维等[29]、陈欧等[23]的研究结果相一致。在贮藏期前18 d 内,脆红李处于后熟阶段,可溶性固形物含量随着贮藏时间的延长而上升,贮藏后期脆红李转入衰老阶段,该时期,由于自身的呼吸作用、新陈代谢增强,糖类、有机酸等代谢物被消耗,出现降低的情况。空白对照组在贮藏后期果实迅速软化,细胞壁、细胞膜等结构崩解大量果胶、纤维素被分解为糖类导致SSC 含量上升迅速。由此可知浸钙的保鲜处理能有效减少可溶性固形物含量的消耗,延缓脆红李由后熟阶段转入衰老阶段。
总酸含量(TA)影响着李子的食用口感,也反映着果实内部有机酸含量的合成代谢变化情况。有机酸合成速度大于降解速度时,TA 含量呈上升趋势,反之,TA 含量下降[30]。贮藏前期随着呼吸作用逐渐增强,大量的有机酸被降解消耗,之后果实的成熟衰老程度加剧,果实内部可溶性固形物、水分等增加引起稀释作用,导致总酸含量降低的速率减缓,即李子内部的总酸含量与果实的呼吸强度、水分含量、可溶性固形物含量有密切关系。经过浸钙处理的李子总酸含量降低趋势和速度得以减缓,与张广燕等[31]对黑宝石李的研究相符。浸钙+涂膜处理显著延缓了李子总酸含量降低(P<0.05),维持较好的果实品质。
随着脆红李成熟衰老程度增加,多聚半乳糖醛酸酶(PG)作为主要分解果胶的酶,活性逐渐上升,相应地果实硬度降低。与Lin 等[32]的研究结论相符,多聚半乳糖醛酸是细胞壁多糖的重要成分,PG 可水解多聚半乳糖醛酸的1,4-α-D-半乳糖苷键,破坏细胞壁结构,分解果胶从而导致果实软化,因此多聚半乳糖醛酸酶活性与脆红李的硬度有着密切的关系。贮藏前期,经浸钙处理的脆红李硬度下降得到有效抑制,与Gao 等[7]的研究结果相一致,其作用机理是外源性钙处理增加胞浆钙,有助于维持细胞壁结构、刚性和完整性,维持了李子的硬度。贮藏第18 天后,各处理组的李子硬度迅速下降,PG 活性快速升高。涂膜处理虽降低了李子PG 活性峰值,但导致了活性峰值的提前。浸钙处理可降低脆红李PG 活性峰值但不能延缓峰值来临的时间,浸钙+涂膜的处理既降低了峰值,也延缓了峰值来临的时间。结果表明,脆红李的硬度与PG 活性呈极显著的负相关性(P<0.01)),浸钙+涂膜处理对PG 活性的抑制可缓解李子的软化,维持脆红李的硬度。
研究表明,钙参与调节各种酶的活性和与果实衰老相关的重要生物分子的代谢[7],适宜浓度的钙处理可以抑制李果的TA 的消耗,延缓硬度降低,保持较好的果实品质。然而,高浓度的钙处理会给李果实造成伤害,增加其腐烂率[31]。聚乙烯醇涂膜处理能减缓呼吸速率,减少水分散失,影响各种裂解酶、氧化酶进行生理代谢,减少活性氧、丙二醛(MDA)的产生,降低糖、酸物质的消耗保持果实品质。MDA 的累积会对李子细胞质膜和细胞器产生一定的伤害,加速细胞的衰老凋亡,导致脆红李的品质劣变[19]。经聚乙烯醇复合涂膜处理的脆红李有氧呼吸被抑制导致,MDA 累积得到显著抑制。过氧化物酶(POD)具有双重性,既能参与活性氧的生成,也可作为植物体的一种保护酶,使组织内积累的具有强氧化性的物质分解,从而起到减少氧化损害的作用[33]。贮藏第6 天时各个处理组的脆红李POD 活性均高于对照组。这可能是浸钙或涂膜的保鲜处理使脆红李感受到外界环境改变的刺激,POD 作出的应激反应,对果肉组织内的强氧化物质进行分解造成的结果。贮藏18 d 后浸钙、涂膜的保鲜处理可将POD 的活性维持在较低的水平,有利于脆红李的贮藏保鲜。植物体受到机械损伤或逆境胁迫时,多酚氧化酶(PPO)会大量激活将多酚类物质氧化成醌,醌类物质进一步聚合为棕褐色物质,产生褐变现象,使其失去商业价值[34]。贮藏前期未经保鲜处理的李子多酚类物质氧化迅速,果肉组织褐变严重,而经浸钙处理的脆红李,PPO 活性得到抑制,酚类物质含量损失减缓,从而导致贮藏后期李子中多酚类物质还未褐变完全,此时PPO 活性再次上升。研究表明,浸钙处理对PPO 活性有抑制作用,可在贮藏的各个时期延缓果实多酚氧化酶活性的上升,减缓酚类物质的氧化,降低果肉组织褐变。
在脆红李保鲜贮藏的过程中各生理生化指标件的变化有着密切的联系。随着贮藏时间的延长,果实的硬度普遍呈现下降趋势。脆红李硬度的变化与可溶性固形物含量、总酸含量、MDA 含量、PG、POD、PPO 活性有着显著的相关性。果实的硬度与丙二醛含量、PG、POD 活性呈现显著的负相关关系,果实的软化与果肉组织内PG、POD 活性密切相关,此与De Veau 等[5]的研究结果一致。
4 结论
研究表明,2%氯化钙浸泡处理在延缓了脆红李采后总酸含量降低,延迟果实硬度降低,抑制多聚半乳糖醛酸酶活性,降低丙二醛累积,抑制多酚氧化酶活性方面效果较好;聚乙烯醇涂膜处理在抑制脆红李呼吸强度,减缓可溶性固形物含量增加,抑制过氧化物酶活性上的作用更明显;与仅浸钙处理和仅涂膜处理相比,采后2%氯化钙浸泡+聚乙烯醇涂膜复合处理综合2 种单独处理的优势对脆红李保鲜效果最好,能够有效地延缓脆红李的衰老变质。
——α-葡萄糖醛酸酶的研究进展*

