清热化瘀方调控Th17 对小鼠心肌缺血再灌注损伤的影响
林文勇,施雪斐,张春伶,王栋元,牛振超,芦瑞霞,王 丹,阮小芬,王肖龙∗
(1.上海中医药大学附属曙光医院国家中医心血管病临床医学研究中心分中心,上海 201203; 2.上海中医药大学附属曙光医院心血管病研究所,上海 201203)
急性心肌梗死仍然是世界范围内发病和死亡的主要原因[1-2],早期再灌注是目前拯救心肌梗死患者危险心肌的最有效策略。然而,早期心肌再灌注却矛盾地诱发了心肌缺血再灌注(ischemia-reperfusion,I/R) 的损伤[3]。I/R 的病理过程包括产生过多的自由基、线粒体肿胀并激活促凋亡的级联反应和自噬功能障碍[4]。一系列的病理改变最终导致了心肌细胞凋亡的增加和梗死面积的扩大,加重心肌梗死患者的临床症状和不良预后[5]。因此,确定新的干预目标和辅助治疗策略以限制I/R 损伤是非常必要的。
清热化瘀方是曙光医院心内科王肖龙教授根据临床经验总结,发现急性心肌梗死患者以舌质红者居多,伴随炎症因子水平增高,因此提出急性心肌梗死应“热瘀同治”,在《金匮要略》 “三黄汤” 的基础上加味组成“清热化瘀方”。前期临床研究结果表明,清热化瘀方可以调控免疫微环境,对心肌梗死后心脏损伤起保护作用,T 辅助细胞17 (T helper cell 17,Th17) 可能是其抗心肌I/R 损伤的潜在靶点[6-8],但其作用机制尚不明确。因此,本实验拟采用小鼠冠状动脉结扎松解法建立心肌缺血再灌注损伤模型,研究清热化瘀方抗心肌缺血再灌注损伤的作用,以期为清热化瘀方治疗心肌I/R 损伤的临床应用提供科学依据。
1 材料
1.1 动物 无特定病原体的雄性C57BL/6 小鼠,8 周龄,体质量20~25 g,购自浙江维通利华实验动物技术有限公司[实验动物生产许可证号SCXK (浙) 2019-0001],饲养于上海中医药大学动物实验中心屏障系统内[实验动物使用许可证号SYXK (沪) 2020-0009],环境温度(25±2)℃,相对湿度(50±10)%,自由饮食,12 h/12 h 光照/黑暗循环。实验过程中所有操作均符合实验动物伦理委员会规定(伦理号PZSHUTCM210913015)。
1.2 药物与试剂 清热化瘀方由黄连6 g、黄芩10 g、制大黄9 g、牡丹皮12 g、陈皮18 g、茯苓30 g、甘草12 g、丹参30 g、葛根30 g 组成,该颗粒剂购自江阴天江药业有限公司(批号2106309),根据临床用量进行小鼠等效给药剂量换算,取适量蒸馏水将清热化瘀方配制成低、中、高剂量。戊巴比妥钠 (批号P3761,美国Sigma-Aldrich 公司); 2% 2,3,5 三苯基氯化四氮唑染液 (2,3,5-triphenyltetrazolium chloride,TTC )、苏 木 素 伊 红(hematoxylin-eosin,HE) 染液 (批号20210721、T8170,北京索莱宝科技有限公司); 乳酸脱氢酶 (lactic dehydrogenase,LDH) 试剂盒(批号20210722,南京建成生物工程研究所); 白介素-17 (interleukin-17,IL-17)、白介素-6 (IL-6) 试剂盒 (批号EK217/2-96、EK206/3-96,杭州联科生物技术有限公司); RIPA 裂解液、BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶制备试剂盒、蛋白上样缓冲液、ECL 化学发光试剂(批号ST505、P0012S、P0012A、P0015、P0018S,上海碧云天生物技术有限公司); 蛋白Marker (批号26616,美国Thermo Fisher Scientific 公司);RORγt、GAPDH 一抗、HRP-山羊二抗 (批号GB112204、GB12001、GB23303,武汉赛维尔生物科技有限公司);SYBR RT-qPCR Master Mix、RNA 抽取试剂盒(批号Q341-02、7E552A1,南京诺唯赞生物科技股份有限公司);GoScriptTMReverse Transcription (批号0000389033,美国Promega 公司); Percoll 细胞分离液(批号10243024,美国GE 公司); BB515-CD4、BV650-CD25、AF647-IL-17、PEFoxP3 荧光抗体(批号564419、563719、560437、560046,美国BD 公司)。
1.3 仪器 Vivid I 便携式心脏超声仪(美国GE 公司);Synergy H1 酶标仪(美国BioTek 公司); 5430R 高速冷冻离心机(德国Eppendorf 公司); ECG-101G 动物用心电图仪(邦健深圳邦健生物医疗设备股份有限公司); TM-2V45-B9L 体视解剖显微镜(上海丙林电子科技有限公司); 双通道小动物呼吸机(北京众实迪创科技发展有限责任公司); 高通量研磨仪(上海净信实业发展有限公司); 6100化学发光成像仪(上海勤翔科学仪器有限公司); 电泳仪和湿转仪(美国Bio-Rad 公司); StepOne Plus 荧光定量PCR 仪(美国ABI 公司); DxFLEX 流式细胞仪 (美国Beckman 公司)。
2 方法
2.1 分组与给药 将45 只小鼠按随机数字表分为假手术组、模型组和清热化瘀方低、中、高剂量组,每组9 只。造模前7 d,清热化瘀方低、中、高剂量组灌胃给予13、26、52 g/kg 清热化瘀方,假手术组和模型组灌胃给予等体积蒸馏水,每天1 次,连续7 d。末次灌胃30 min 后,模型组和清热化瘀方各剂量组小鼠进行心肌缺血再灌注损伤模型建立,假手术组小鼠仅开胸不结扎冠状动脉。
2.2 心肌缺血再灌注损伤模型建立 称定各组小鼠体质量,腹腔注射0.3%戊巴比妥钠溶液(15 mL/1 kg) 麻醉,气管插管成功后仰卧固定在操作台上,连接小动物呼吸机(频率110 bpm,潮气量1 mL,吸呼比1 ∶1) 和肢体导联心电图仪。脱去前胸毛发,在左侧胸骨旁第三肋间逐层打开胸腔并暴露心脏,在体式解剖显微镜下观察左冠状动脉,于左心耳下缘1 mm 处以10-0 缝合线自左冠状动脉下方穿过并取PE-10 细管置于绳结中结扎,以心电图ST 段抬高和心脏前壁至心尖组织广泛发白作为结扎成功的标志。心肌缺血30 min 后取出PE-10 细管进行复灌,以心电图ST 段回落和发白组织复红作为再灌注成功的标志。逐层关闭胸腔,脱机,将小鼠置于25 ℃环境中复苏。
2.3 心脏超声评估小鼠心功能 麻醉并固定小鼠于操作台上,待呼吸、心率平稳后,使用M 型超声于胸骨旁短轴切面测量收缩末期和舒张期末期左室内径,由超声系统自动计算出左室射血分数及左室短轴缩短率。
2.4 HE 染色观察心脏组织病理损伤 每组随机选取3 只小鼠,灌流后取心脏组织,滤纸吸去心脏表面水分,于4%多聚甲醛中固定48 h 后进行梯度脱水,石蜡包埋切片,脱蜡覆水,苏木精染色5 min,流水冲洗,返蓝,伊红染色1 min,冲洗,中性树胶封片,于显微镜下观察心脏组织病理损伤。
2.5 TTC 染色检测心肌梗死面积 每组随机选取3 只小鼠,灌流后取心脏组织,滤纸吸去心脏表面水分,放入-20 ℃冰箱中速冻15 min,按横截面方向将心脏切成片状,每片厚度1 mm。将切片放入2% TTC 溶液中,于37 ℃水浴锅内避光染色20 min,每5 min 翻动1 次使染色均匀。将切片用4%多聚甲醛固定24 h 后拍照,非梗死区域呈红色,梗死区域呈白色。通过Image J 软件计算梗死面积。
2.6 试剂盒法检测血清LDH 活性和IL-17、IL-6 水平 小鼠心肌缺血再灌注24 h 后,眼球取血,血液室温静置2 h,4 ℃、3 000 r/min 离心15 min,按试剂盒说明书检测血清LDH 活性和IL-17、IL-6 水平。
2.7 RT-qPCR 法检测心脏组织RORγtmRNA 表达 取适量小鼠心脏组织,按照试剂盒说明书提取总RNA 并逆转录为cDNA,进行实时荧光定量PCR 反应,条件为95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火延伸30 s,采用2-ΔΔCT法计算RORγtmRNA 相对表达量。引物由生工生物工程(上海) 股份有限公司设计并合成,序列见表1。

表1 引物序列
2.8 Western blot 法检测心脏组织RORγt 蛋白表达 取适量小鼠心脏组织,加入适量裂解液进行匀浆,4 ℃、12 000 r/min 离心30 min,取上清液,按BCA 试剂盒说明书检测各样品蛋白质浓度并调整样品浓度。SDS-PAGE 凝胶电泳分离蛋白质,湿转法将蛋白转移到聚偏二氟乙烯(PVDF) 膜上,5%脱脂牛奶封闭1 h,与一抗(1 ∶1 000) 在4 ℃下孵育过夜,次日与二抗(1 ∶5 000) 在室温下孵育1 h,用ECL 化学发光试剂显影蛋白质电泳条带,拍照并通过Image J 软件进行条带灰度值分析。以目的条带灰度值与内参条带灰度值的比值作为目的蛋白的相对表达量。
2.9 流式细胞术检测外周血中Th17 和Treg 细胞比例 将等体积的淋巴细胞分离液缓慢加入小鼠全血中,在室温下300×g离心10 min 获取小鼠外周淋巴细胞悬液。按照试剂盒说明书加入刺激和抑制剂培养7 h,分别加入5 μL CD4 和CD25荧光抗体,4 ℃避光孵育30 min,用Fix/Perm 试剂透化后加入5 μL IL-17 和FoxP3 荧光抗体,4 ℃避光孵育30 min,将细胞重悬并通过流式细胞仪检测。CD4+IL-17+细胞代表Th17细胞,而CD4+CD25+Foxp3+细胞代表Treg 细胞。
2.10 统计学分析 通过SPSS 17.0 软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析,方差齐采用LSD 方法检验; 方差不齐采用Dunnett’s T3 法检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 清热化瘀方对I/R 损伤小鼠心功能的影响 如表2 所示,与假手术组比较,模型组小鼠左室射血分数和左室短轴缩短率降低(P<0.05),左室收缩末内径和舒张末内径无明显变化(P>0.05); 与模型组比较,清热化瘀方中剂量组左室射血分数和左室短轴缩短率升高(P<0.05),左室收缩末内径和舒张末内径无明显变化(P>0.05),清热化瘀方低、高剂量组左室射血分数和左室短轴缩短率均有提升,但均无统计学差异(P>0.05)。结果表明,清热化瘀方中剂量组对于I/R 损伤具有保护作用。
表2 各组小鼠心功能比较(±s,n=3)
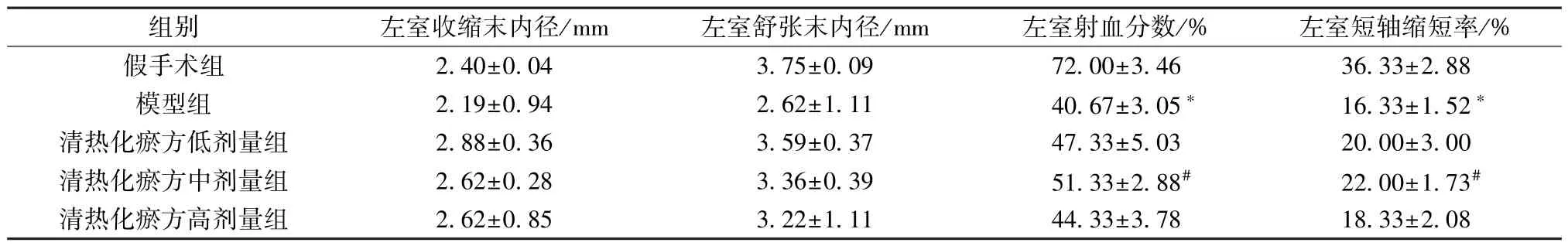
表2 各组小鼠心功能比较(±s,n=3)
注: 与假手术组比较,∗P<0.05; 与模型组比较,#P<0.05。
组别左室收缩末内径/mm左室舒张末内径/mm左室射血分数/%左室短轴缩短率/%假手术组2.40±0.043.75±0.0972.00±3.4636.33±2.88模型组2.19±0.942.62±1.1140.67±3.05∗16.33±1.52∗清热化瘀方低剂量组2.88±0.363.59±0.3747.33±5.0320.00±3.00清热化瘀方中剂量组2.62±0.283.36±0.3951.33±2.88#22.00±1.73#清热化瘀方高剂量组2.62±0.853.22±1.1144.33±3.7818.33±2.08
3.2 清热化瘀方对I/R 损伤小鼠心脏组织病理改变的影响 如图1 所示,假手术组小鼠心肌组织的结构正常,心肌排列整齐有序,细胞间隙分明,肌膜完整; 模型组小鼠心肌组织损伤增加,结构异常,心肌细胞排列紊乱,细胞间质水肿增加,炎性细胞浸润; 清热化瘀方各剂量组小鼠心肌细胞结构异常,病理改变减轻。

图1 各组小鼠心脏组织病理形态(HE,×200)
3.3 清热化瘀方对I/R 损伤小鼠心肌梗死面积的影响 如图2、表3 所示,与假手术组比较,模型组小鼠心肌梗死面积增大(P<0.05); 与模型组比较,清热化瘀方各剂量组小鼠心肌梗面积均减小(P<0.05); 与清热化瘀方中剂量组比较,清热化瘀方高剂量组心肌梗死面积增大 (P<0.05)。结果表明,清热化瘀方可以缩小小鼠心脏梗死面积。
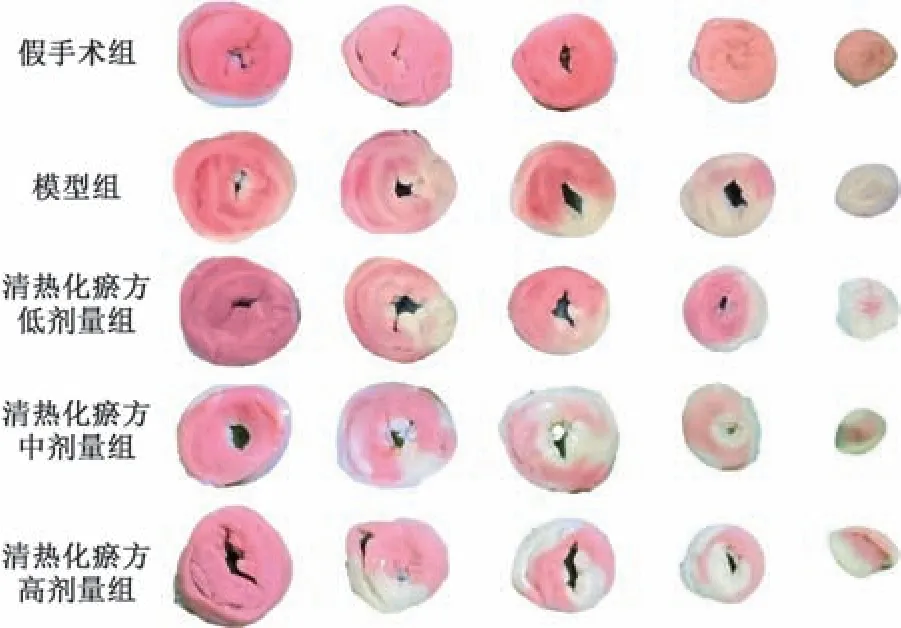
图2 各组小鼠心脏组织TTC 染色
表3 各组小鼠心脏梗死面积比较(±s,n=3)

表3 各组小鼠心脏梗死面积比较(±s,n=3)
注: 与假手术组比较,∗P<0.05; 与模型组比较,#P<0.05; 与清热化瘀方中剂量组比较,&P<0.05。
组别梗死面积/%假手术组2.00±1.08模型组36.60±2.98∗清热化瘀方低剂量组25.07±1.72#清热化瘀方中剂量组21.13±2.31#清热化瘀方高剂量组29.23±1.61#&
3.4 清热化瘀方对I/R 损伤小鼠血清LDH 活性和IL-17、IL-6 水平的影响 如表4 所示,与假手术组比较,模型组小鼠血清LDH 活性升高(P<0.05); 与模型组比较,清热化瘀方各剂量组小鼠血清LDH 活性均降低(P<0.05),提示清热化瘀方可以减少细胞的损伤和LDH 释放。与假手术组比较,模型组小鼠血清IL-17、IL-6 水平升高(P<0.05);与模型组比较,清热化瘀方各剂量组小鼠血清IL-17、IL-6水平均降低(P<0.05); 与清热化瘀方高剂量组比较,清热化瘀方低、中剂量组小鼠血清IL-6 水平降低(P<0.05)。
表4 各组小鼠血清LDH 活性和IL-17、IL-6 水平比较(±s,n=6)

表4 各组小鼠血清LDH 活性和IL-17、IL-6 水平比较(±s,n=6)
注: 与假手术组比较,∗P<0.05; 与模型组比较,#P<0.05; 与清热化瘀方高剂量组比较,ΔP<0.05。
组别LDH/(U·L-1)IL-17/(pg·mL-1)IL-6/(pg·mL-1)假手术组501.77±103.330.59±0.1328.54±9.76模型组1 475.43±178.28∗1.26±0.36∗93.37±16.24∗清热化瘀方低剂量组982.20±124.94#0.85±0.12#52.21±11.32#Δ清热化瘀方中剂量组891.61±136.58#0.74±0.05#47.66±9.37#Δ清热化瘀方高剂量组936.35±73.20#0.76±0.15#81.37±11.14#
3.5 清热化瘀方对I/R 损伤小鼠心脏组织RORγtmRNA 表达的影响 如表5 所示,与假手术组比较,模型组小鼠心脏组织RORγtmRNA 表达升高,但差异无统计学意义(P>0.05); 与模型组比较,清热化瘀方各剂量组小鼠心脏组织RORγtmRNA 表达降低(P<0.05)。
表5 各组小鼠心脏组织RORγt mRNA 表达比较(±s,n=3)
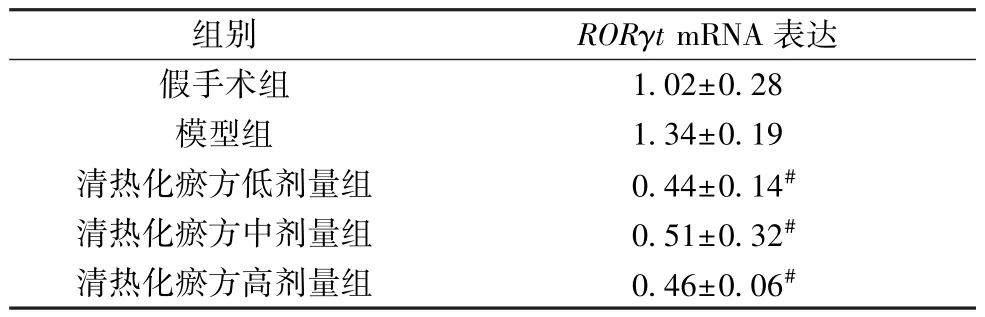
表5 各组小鼠心脏组织RORγt mRNA 表达比较(±s,n=3)
注: 与模型组比较,#P<0.05。
组别RORγt mRNA 表达假手术组1.02±0.28模型组1.34±0.19清热化瘀方低剂量组0.44±0.14#清热化瘀方中剂量组0.51±0.32#清热化瘀方高剂量组0.46±0.06#
3.6 清热化瘀方对I/R 损伤小鼠心脏组织RORγt 蛋白表达的影响 如图3、表6 所示,与假手术组比较,模型组小鼠心脏组织RORγt 蛋白表达升高(P<0.05); 与模型组比较,清热化瘀方各剂量组小鼠心脏组织RORγt 蛋白表达降低(P<0.05); 与清热化瘀方高剂量组比较,清热化瘀方低、中剂量组小鼠心脏组织RORγt 蛋白表达降低(P<0.05)。
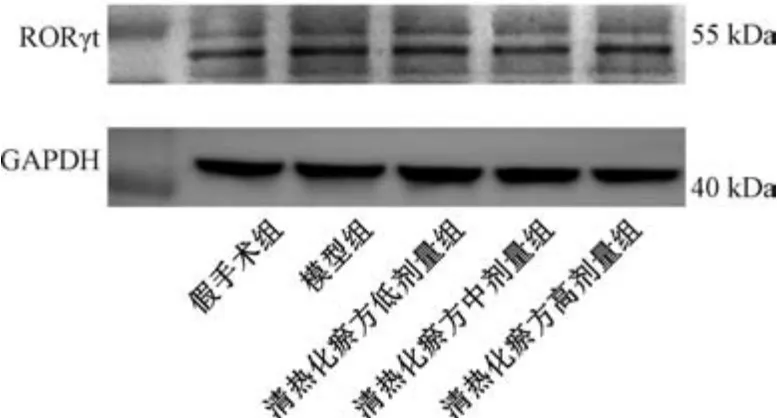
图3 各组小鼠心脏组织RORγt 蛋白条带图
表6 各组小鼠心脏组织RORγt 蛋白表达比较(±s,n=3)
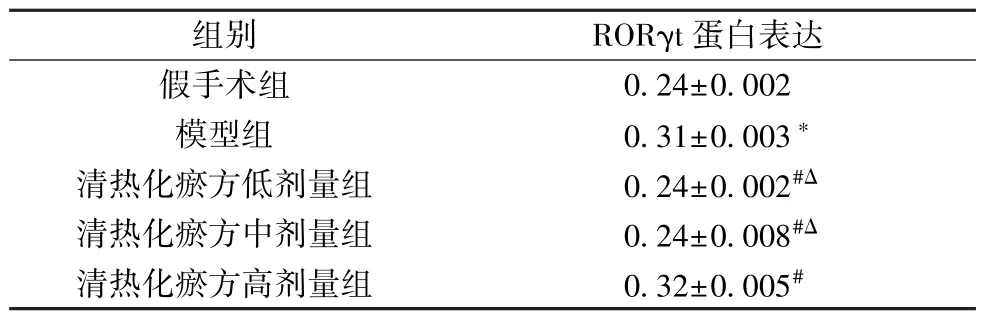
表6 各组小鼠心脏组织RORγt 蛋白表达比较(±s,n=3)
注: 与假手术组比较,∗P<0.05; 与模型组比较,#P<0.05; 与清热化瘀方高剂量组比较,ΔP<0.05。
组别RORγt 蛋白表达假手术组0.24±0.002模型组0.31±0.003∗清热化瘀方低剂量组0.24±0.002#Δ清热化瘀方中剂量组0.24±0.008#Δ清热化瘀方高剂量组0.32±0.005#
3.7 清热化瘀方对I/R 损伤小鼠外周血中Th17、Treg 细胞比例和Th17/Treg 平衡的影响 如图4~5、表7 所示,与假手术组比较,模型组小鼠外周血中Th17 细胞占比和Th17/Treg 比值升高(P<0.05),Treg 细胞占比降低,但无统计学意义(P>0.05); 与模型组比较,清热化瘀方低剂量组小鼠Th17 细胞占比降低(P<0.05),高剂量组Treg 细胞占比升高 (P<0.05),低、中剂量组Th17/Treg 比值降低(P<0.05)。结果表明,清热化瘀方可能通过恢复Th17 和Treg 细胞的平衡对心肌I/R 损伤起修复作用。
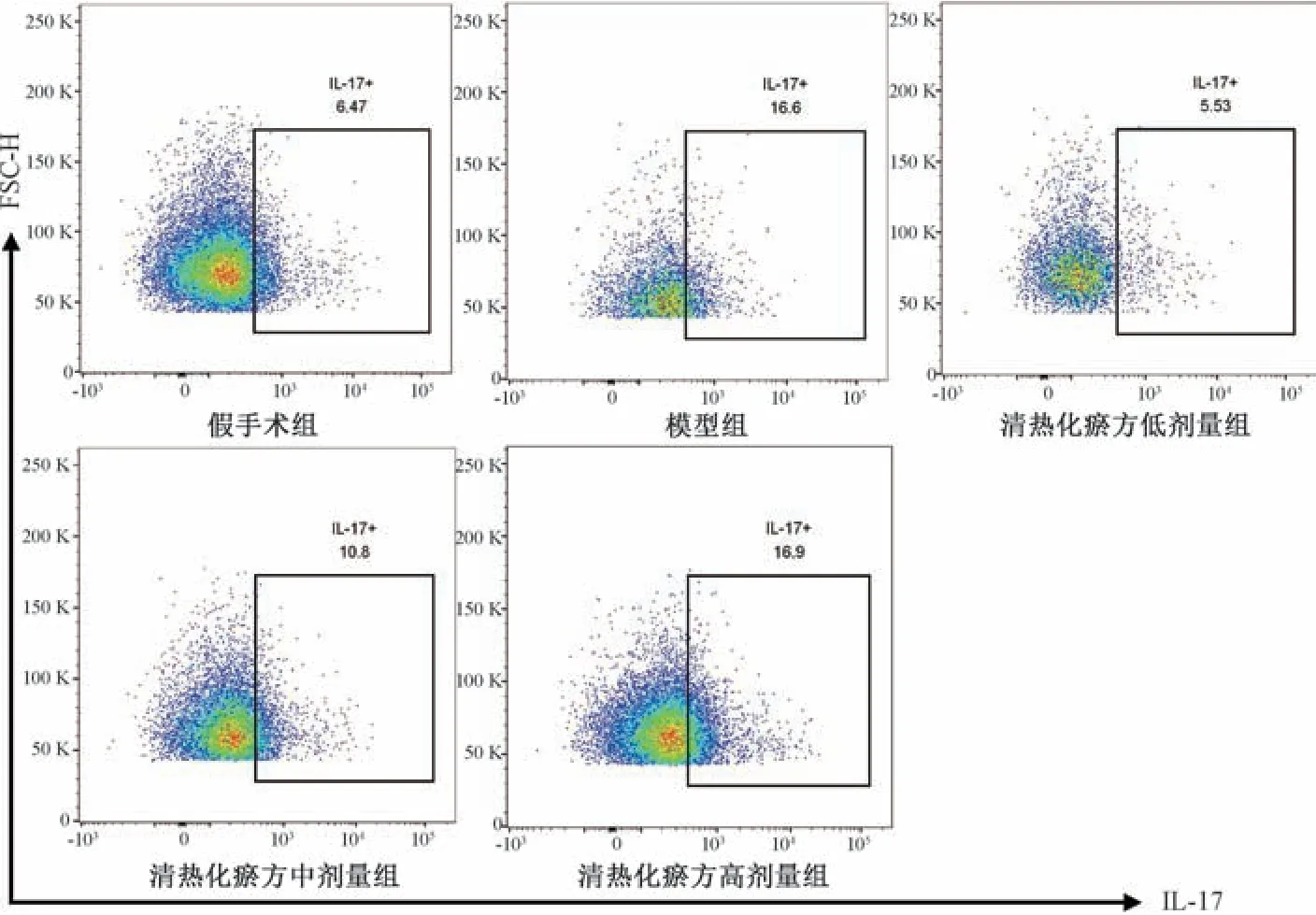
图4 各组小鼠外周血中Th17 细胞比例
表7 各组小鼠外周血中Th17、Treg 细胞比例和Th17/Treg 比值比较(±s,n=3)

表7 各组小鼠外周血中Th17、Treg 细胞比例和Th17/Treg 比值比较(±s,n=3)
注: 与假手术组比较,∗P<0.05; 与模型组比较,#P<0.05。
组别Th17/%Treg/%Th17/Treg假手术组4.66±1.735.06±2.310.96±0.18模型组12.76±4.44∗3.90±1.373.26±0.15∗清热化瘀方低剂量组 5.58±0.15#4.64±1.281.25±0.28#清热化瘀方中剂量组10.60±0.435.75±0.481.84±0.08#清热化瘀方高剂量组15.20±1.476.68±0.20#2.27±0.27
4 讨论
心肌I/R 损伤是在开展介入治疗之后才被提出并逐渐受到关注,因此古代并无此病。随着研究不断深入,I/R 与热毒学说的关系越来越受到重视[9]。《金匮要略心典》 曰: “毒者,邪气蕴结不解之谓。” 邪聚则日久成毒,毒聚则日久成疾,体现了外邪致病的变化规律。而热邪蕴结成毒者,虽然临床上表现出热瘀并重,但实则热重于瘀。杨超等[10]从血液成分和流变分析了 “热毒血瘀” 的表征,发现缺血、缺氧、血瘀和变性的根本原因在于炎症反应。
清热化瘀方由9 味中药组成,该方中君药黄连和黄芩清热泻火; 臣药大黄清热解毒、活血化瘀,牡丹皮清热活血; 佐药陈皮健脾化痰,诸药合用,共奏清热解毒、活血化瘀之效。现代药理学研究表明,黄芩具有减轻心肌缺血再灌注损伤的作用,还能抗炎、抗氧化、抑制心肌纤维化及抑制平滑肌细胞的增殖[11]; 黄芩中的有效成分黄芩素被证实具有抑制TNF-α、IL-1β、IL-6 和PAI-1 等炎症因子及NF-κB 信号通路的表达,减少心肌细胞损伤的作用[12-14]。黄连素可以通过下调TNF-α、IL-1β、IL-6 水平,增加血液中NO 水平保护冠心病大鼠血管内皮细胞[15]。清热化瘀法治疗心肌I/R 损伤具有较好的应用前景。
本研究发现,清热化瘀方可以提高小鼠左心功能,缩小心肌梗死面积,降低外周血中损伤标志物LDH 活性和炎性因子IL-6、IL-17 水平,恢复Th17/Treg 平衡,提示清热化瘀方对小鼠心肌缺血再灌注损伤有保护作用。在生理条件下,T 细胞亚群之间维持着相对动态平衡,这种自稳态在疾病的发生发展中起重要作用[16],T 细胞缺失的小鼠疾病模型已经证明了T 细胞在缺血[17]和心肌梗死[18-19]中的关键作用。Th17 细胞是第3 个被发现并被描述的T 辅助细胞亚群,以分泌IL-17 为主的促炎细胞,关键性地参与到炎症反应中[20]。Th17 的分化离不开IL-6,IL-6 可直接作用于T细胞,通过信号转导gp130 的酪氨酸残基诱导STAT3 激活。STAT3 可以诱导Th17 细胞特异性转录因子RORγt 的表达,促进Th17 细胞的分化[21]。Th17 分泌的炎症因子IL-17 能促进急性心肌梗死后的炎症反应,引起心肌肥大和心室重构[22]。与Th17 细胞促炎相对应的,Treg 细胞是另一群起炎症抑制作用并维持机体免疫稳态的重要T 细胞亚群,越来越多的研究表明Treg 细胞在I/R 损伤后的心脏修复中发挥重要作用[23]。因此,识别和开发一种激活Treg 细胞增殖或抑制Th17 细胞分化的选择性免疫调节制剂或将成为抗I/R 损伤的潜在治疗策略。本研究发现,清热化瘀方可恢复Th17/Treg 平衡。
综上所述,清热化瘀方对于心肌I/R 损伤的保护作用可能与调节Th17 细胞及Th17/Treg 免疫平衡有关,更确切的调控机制还有待进一步研究。

