新生儿内源性眼内炎的临床特征
蒋弘杨 邓铂林 董文韬
眼内炎是一种罕见的视觉破坏性疾病,通常是外源性的,由眼部手术、创伤或邻近组织的直接感染导致[1-5]。新生儿眼内炎大多数是内源性的,由围产期住院期间传播的内源性病原体引起,如污染的血管内导管,呼吸设备或护理人员,其特征是来自体内病灶的病原微生物通过血行播散,穿过血脑屏障接种到眼内组织[5-7]。新生儿内源性眼内炎(neonatal endogenous endophthalmitis,NEE)是新生儿败血症的严重并发症,早期诊断和积极治疗是避免视力丧失的关键[8]。关于新生儿眼内炎的现有文献很少。我们对一组NEE 患者的临床资料进行了回顾分析,旨在为NEE的早期诊断和治疗提供依据。现将结果报告如下。
资料与方法
一、一般资料
回顾性病例研究。选取2010年7月至2022年7月在四川省人民医院眼科就诊的NEE患者21例(27只眼)为研究对象。包括男性9 例(12 只眼),女性12 例(15 只眼);出生孕周(30±4.6)周(23~38 周);出生体重(1 463.6±920.4)g(640~3 800 g)。
1.纳入标准:研究期间内所有临床确诊为NEE,发病年龄在1岁以下的患者。2.排除标准:(1)临床资料不完整;(2)既往因NEE 在其他医院进行过治疗。本研究经四川省人民医院医学伦理委员会批准。研究符合《赫尔辛基宣言》的宗旨。所有患者父母均获知情并签署书面知情同意书。
二、检查方法
所有患儿均行眼前节、眼底以及实验室检查。详细收集患者年龄、性别、出生体重、出生孕周、专科检查、实验室检查、治疗方案等临床资料。参照文献[9],以首次检查时的眼部症状将NEE 被分为以下两种类型:局灶型,表现为眼前节正常,眼底可见黄白色局限性病灶;暴发型,以角膜混浊、前房渗出、前房积脓等为主要表现。随访5~23个月,观察患儿眼部病变特征、全身合并疾病、致病菌及治疗转归情况。
结 果
21 例(27 只眼)NEE 眼中,双眼6(28.6%)例;单眼15例(71.4%),其中右眼9例,左眼6例。足月、早产儿分别为2、19 例,其中出生孕周在32 周以下的患者15例(71.4%),出生体重在2 000 g以下的患者16 例(76.2%)。NEE 平均发病时间为患儿出生后(4±4.6)周(1~20周),17例(81%)在出生后4周内发病。以首次检查时的眼部症状将NEE分型:局灶型2 只眼(7.4%),均在常规眼底筛查时发现视网膜黄白色团块状病灶,大小约1个视乳头直径,玻璃体腔清,眼前节检查未见明显异常;暴发型25 只眼(92.6%),均在发现眼睑红肿、结膜充血、角膜混浊、前房积脓等明显感染症状后转诊至眼科进行治疗。由于屈光介质混浊,眼底通常无法观察。B 超检查可见玻璃体致密混浊,视网膜在位(图1)。

图1 暴发型新生儿内源性眼内炎典型表现
一、NEE常见全身合并证
21例NEE患者相关全身合并症依次是:败血症(47.6%,10/21)、脑膜炎(33.3%,7/21)、休克(28.6%,6/21)、呼吸障碍(23.8%,5/21)、脑室内出血(14.3%,3/21)、癫痫(4.8%,1/21)、弥散性血管内凝血(4.8%,1/21)、高胆红素血症(4.8%,1/21)、动脉导管未闭(4.8%,1/21)。
二、NEE致病菌培养情况
在21例NEE患者中有19例(90.5%)培养阳性,包括血培养17例(81%)、玻璃体培养4例(19%)、脑脊液培养2例(9.5%)、结膜分泌物培养2例(9.5%)、房水培养1 例(4.8)。致病菌中包括细菌14 例(73.7%),其中革兰氏染色阴性菌11 例(57.9%),阳性菌3 例(15.8%);真菌5 例(26.3%)。最常见的致病菌依次为铜绿假单胞菌(31.6%,6/19)、白色念珠菌(26.3%,5/19)、肺炎克雷伯菌(15.8%,3/19)、B 组链球菌(15.8%,3/19)。见表1。
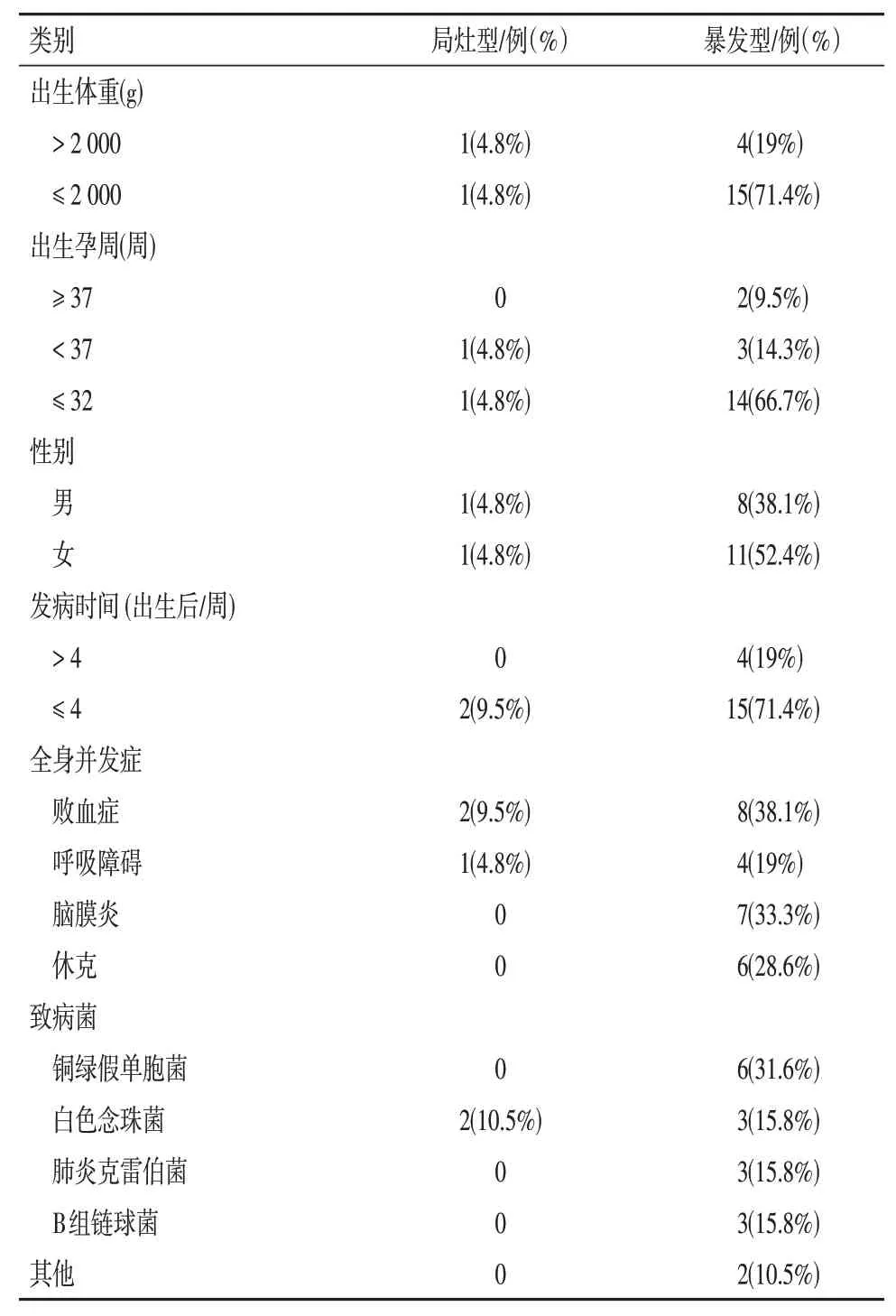
表1 新生儿内源性眼内炎的临床特征
三、NEE的治疗
21 例(27 只眼)NEE 患者中,20 例(95.2%)接受了静脉注射抗生素/抗真菌药物。全身联合玻璃体腔内注射抗生素/抗真菌药物是最常见的治疗方法(18 只眼,66.7%),其中6 只眼(22.2%)使用全身联合玻璃体腔内注射抗生素/抗真菌药物治疗;12只眼(44.4%)在抗生素/抗真菌药物治疗后接受了手术治疗,包括保留晶体的玻璃体切除术6 只眼(22.2%)、晶状体切除联合玻璃体切除术4只眼(14.8%)、晶状体切除术只眼(7.4%)。9 只眼(33.3%)仅接受全身抗生素/抗真菌药物治疗。
四、NEE的转归
21 例(27 只眼)NEE 患者中,14 例(17 只眼)(63%)最终死亡或丧失视力(包括眼球萎缩、角膜穿孔等)。7 例(10 只眼)(37%)的最终视力得以保留(视网膜在位或存在光感及以上视力)。见表2。

表2 新生儿内源性眼内炎的结局分析
讨 论
NEE 在新生儿重症监护病房(NICU)的发病率为0.139%[7]。近年来,NEE 呈下降趋势,风险因素包括围产期感染、败血症、极低出生体重、早产、呼吸系统疾病等[5]。本研究共纳入患者21 例,19 例(90.5%)为早产儿。71.4%的患者出生孕周在32 周以下,76.2%的患者出生体重在2000 g 以下。这些早产儿免疫功能低下,通常存在各种系统性疾病,包括败血症(47.6%)、脑膜炎(33.3%)、休克(28.6%)和呼吸障碍(23.8%)。这与之前的研究类似[5],表明当新生儿合并这些全身疾病,我们应该警惕NEE的发生。
成人眼内炎通常表现视力下降、畏光、疼痛、角膜混浊、前房积脓、玻璃体混浊、眼球运动受限等[10,11]。本研究中NEE 通常表现为角膜混浊和前房积脓,多因白瞳症而转诊。临床表现为白瞳症的病例较多,如先天性白内障、视网膜母细胞瘤,必须对可疑病例进行详细的临床检查[12]。Jalali 等[9]将眼内炎分为两种类型:暴发型眼内炎和局灶型眼内炎。暴发型眼内炎是最常见的眼内炎类型,其特征为角膜混浊、前房渗出、前房积脓。本研究结果证实大多数(92.6%)病例在被发现时表现为暴发型NEE。如果进行B 超检查,通常会发现无视网膜脱离的致密玻璃体混浊。局灶型眼内炎表现为局部玻璃体混浊、视网膜炎、视网膜黄白色病灶。本研究中2例局灶型NEE表现为视网膜上黄白色团块状病症。有研究表明眼内炎病灶最初局限于脉络膜或视网膜,依次穿过Bruch膜、视网膜、玻璃体,最终到达眼前段[13-15]。新生儿不能表达眼睛疼痛或视力下降,这使得早期诊断NEE 更加困难[16,17]。当病变局限于视网膜时,只有眼底筛查才能检测到病变。本研究结果表明,绝大多数(81%)NEE 在出生后4周内发病,这期间大部分患者都因为各种全身并发症在NICU 住院。专业的局限性致使新生儿医师早期无法发现NEE 的眼底改变。只有在炎症累积眼前节时表现为明显的眼外观异常时引起重视。因此,对高危因素患者进行眼部检查至关重要,新生儿科医师应将其作为系统检查的一部分[18]。
本研究结果表明90.5%的NEE 患者培养阳性,主要取材于血液(81%)。细菌感染是NEE 的主要原因,其中铜绿假单胞菌最常见。这与O'Keefe等[19]研究结果一致。铜绿假单胞菌是一种毒力非常强的革兰氏阴性杆菌,占新生儿眼部侵袭性感染的75%以上,即使在早期全身使用足量抗生素,通常也无法防止眼内感染恶化,导致快速、严重的视力损害[19,20]。白色念珠菌是第二常见的致病菌。在真菌中,只有念珠菌可引起NEE[21]。在有念珠菌感染的情况下,几乎所有的NEE病例都是由念珠菌引起的[5]。值得注意的是,如果有念珠菌败血症病史的早产儿急性发展为白内障,应考虑念珠菌晶状体脓肿。在这种情况下,如果不及时进行晶状体切除,抗真菌药物可能无法到达感染灶,最终发展为眼内炎[22]。此外,念珠菌眼内炎易于复发,需要长期随访[23]。
到目前为止,对于NEE 尚无明确的治疗指南,在成人眼内炎中,静脉注射万古霉素和第三代头孢或氨基糖苷类药物联合使用被认为是最合适的治疗方法。由于静脉注射抗生素在眼内的积累很差,因此常联合使用玻璃体腔内注射抗生素,它可以最大限度地提高眼内抗生素的水平,并避免与全身治疗相关的毒性。通常选用万古霉素(1 mg/0.1 ml)和头孢他啶(2.25 mg/0.1 ml)联合注射[24]。在真菌性眼内炎中,伏立康唑(5 mg/0.1 ml)是玻璃体内注射的首选药物[25]。对于新生儿,眼内注射抗生素的剂量没有明确的标准,通常是成人剂量的一半。本研究中,绝大部分NEE患者接受了全身联合玻璃体腔内注射抗生素或抗真菌药物治疗,47.6%的患者在随后接受了手术治疗。关于是否进行手术治疗是有争议的。研究表明,如果玻璃体腔内注射抗生素后出现显著恶化或无治疗反应,则应进行玻璃体切除术[25-27]。玻璃体切除可去除玻璃体腔中的细菌、炎性细胞和其他毒性组织碎屑,促进抗生素更好地扩散。然而NEE 感染的眼睛通常在短时间内迅速萎缩,容易错过最佳手术时机。本研究中,12 只眼接受了手术治疗,7 只眼(58.3%)获得满意的结果。因此,我们认为,早期玻璃体切除联合玻璃体腔内注射抗生素可能是NEE 最有效的治疗方案。在经抗生素治疗无效,出现危及生命的脓毒症和眼内炎情况下,需要及时进行眼球摘除以控制感染[5,28]。
NEE患者预后极差。本研究结果再次表明NEE重在预防[29]。对危重新生儿,儿科医生通常专注于监测心肺等重要器官,而忽略眼睛检查。由于大多数患者在4周内患病,我们建议在2~4周内进行筛查,以防止感染并发症和有害的视功能损伤[30]。
本研究回顾性的分析了NEE 的临床特征和治疗转归。结果表明NEE 通常发生在出生后4 周内,以白瞳症为主要表现,早期玻璃体切除联合玻璃体内注射抗生素可能是NEE 最有效的治疗方案。目前尚无关于NEE治疗方式的明确共识,期待进一步研究来制定相关治疗指南。

