鳄梨蒂腐病毛色二孢属真菌对6 种杀菌剂的敏感性
徐璐茜, 高银洁, 叶倩倩, 贺 瑞, 王 萌, 杨 叶*,
(1.海南大学 南繁学院 (三亚南繁研究院),海南 三亚 572025;2.海南大学 热带农林学院,海口 570228;3.海南大学 生命健康学院,海口 570228)
鳄梨Persea americanaMill.又名牛油果、油梨、酪梨,属于樟科 (Lauraceae) 鳄梨属 (Persea)果树,是一种重要的热带和亚热带经济水果,兼具果、粮、油性质。因其果实富含促进健康的营养物,兼具食用及保健等功能,深受全球消费者的喜爱[1-3]。截至2020 年全球鳄梨种植面积达到77.2 万hm²,全球的市场规模达到了716 亿元,预计2026 年将达到901 亿元[4]。2020 年我国鳄梨栽培面积为2.3 万 hm²,产量为12.9 万吨,云南、广西和海南是国内鳄梨的主要产地[5-6]。目前,国内鳄梨产业总体上还处于起步阶段,国内市场主要依靠进口。海关数据显示,2010—2018 年,中国鳄梨进口量从 1.93 吨飙升至4.39 万吨,是所有进口水果中增长幅度最大的品种, 2017 年和 2018年我国鳄梨进口额均在 1 亿美元以上[6]。
采后鳄梨果实的保鲜期短,且容易被病菌感染而导致腐烂,是目前制约鳄梨产业化的主要因素之一。据报道,由于管理措施不当,鳄梨果实中由真菌性病害导致的采前和采后损失可高达80%[7]。蒂腐病 (stem-end rot) 也称焦腐或黑腐病,在世界上所有鳄梨种植区都有发现,也是危害鳄梨果实的重要采后病害之一[8]。可侵染鳄梨导致蒂腐病的病原体有多种,主要是葡萄座腔菌科(Botryosphaeriaceae) 的毛色二孢属 (Lasiodiplodiaspp.),如L.theobromae和L.pseudotheobromae[9-11];另外,葡萄座腔菌科的Diplodia mutila、Diaporthe rudis和Neofusicoccum luteumin等也能引起鳄梨蒂腐病的发生[11-13]。Lasiodiplodiaspp.病菌具有潜伏侵染的特性,在鳄梨发育过程中通过果柄基部自然孔洞或机械伤口入侵果实,潜伏至采摘后果实后熟过程中才发病;早期症状为果梗基部出现褐色不规则小斑点,随着果实成熟病斑迅速扩展,后期果皮变色坏死、果肉软化腐烂[8-9,14]。同时该病原菌还可引起多种热带和亚热带水果蒂腐病的发生,如:芒果、番荔枝、番石榴、山竹、百香果、菠萝蜜和龙眼等[15-20]。
目前针对采后蒂腐病的防治措施包括:采前和采后的杀菌处理、物理处理、生物防治、农业技术和果实成熟抑制等[15]。蒂腐病菌在鳄梨各发育阶段都可能存在[7],因此,从鳄梨开花到果实收获期间应用杀菌剂,均可大幅度降低果实上初始病原菌数量,从而有效控制鳄梨采后腐烂[15]。甲基苯并咪唑氨基甲酸酯抑制剂(MBCs)作用于β-微管蛋白合成,抑制细胞有丝分裂,具有广谱内吸的特点,对多种真菌病害具有保护和治疗活性,除了单剂,生产上常与其他杀菌剂混合或复配使用[21]。14α-脱甲基酶抑制剂类杀菌剂(DMIs)作用于14α-脱甲基酶,阻断病原菌甾醇的生物合成,具有广谱及持效期长等特点[22]。甲氧基丙烯酸酯类杀菌剂(QoIs)作用于线粒体呼吸链,通过阻断细胞色素bc1 复合体的电子传递而抑制ATP 的合成,具有高效、内吸和广谱的特点[23]。其中,MBCs 的多菌灵、苯菌灵和甲基硫菌灵,DMIs 的咪鲜胺、抑霉唑等杀菌剂,在国外很早就被用于控制鳄梨、芒果等热带水果的采后病害[24-27];而QoIs 的嘧菌酯等对由Botryosphaeria引起鳄梨蒂腐也具有良好的防效[25-26]。上述3 大类型的内吸性杀菌剂在国内也已被广泛应用于热带水果采前和采后病害的防治。针对鳄梨,有研究指出,咪鲜胺、甲基硫菌灵、苯醚甲环唑等杀菌剂对炭疽病具有良好的抑菌效果[28];本课题组调查发现,鳄梨生产上有使用这些杀菌剂防治炭疽病等病害。值得注意的是,虽然鳄梨在采前没有专门针对蒂腐病进行防治,但是生产上大量使用的各类杀菌剂也可能导致鳄梨蒂腐病原群体产生潜在的抗药性风险。
虽然中国鳄梨生产规模化发展迅速,但尚无相关登记注册药剂,针对鳄梨蒂腐病的研究也几乎为空白,缺乏系统的药剂筛选及抗药性监测资料。2021 年本课题组对海南省部分鳄梨果园的调查显示,蒂腐病的发病率通常在30%左右,个别果园的鳄梨发病率高达60%以上。因此,针对鳄梨蒂腐病菌进行对杀菌剂的敏感性测定,建立敏感性基线,开展抗药性监测和抗性风险评估,对杀菌剂的田间科学使用,以及鳄梨蒂腐病的有效防治均具有重要意义。本研究拟针对MBCs 杀菌剂多菌灵和甲基硫菌灵,DMIs 杀菌剂咪鲜胺和苯醚甲环唑以及QoIs 杀菌剂吡唑醚菌酯和嘧菌酯,进行鳄梨蒂腐病菌的室内敏感性测定,确定杀菌剂的抑菌活性,评估潜在的抗药性风险,以期为指导鳄梨蒂腐病的科学防治提供理论依据,也为延缓田间杀菌剂抗性的产生提供参考。
1 材料与方法
1.1 供试病原菌
供试的101 个鳄梨蒂腐病菌菌株分属Lasiodiplodia的5 个种,由海南大学植物保护学院杀菌剂生物学实验室分离鉴定并保存。供试菌株中,采自海南省白沙县的有52 株、儋州市40 株,云南省孟连县9 株;5 种蒂腐病菌分别为L.pseudotheobromae(58 株),L.theobromae(27 株),L.mahajangana(9 株),L.euphorbiaceicola(2 株),Lasiodiplodiaspp.(5 株),其中,L.pseudotheobromae和L.theobromae为优势种。
1.2 药剂及配制
供试6 种杀菌剂原药分别为MBCs 杀菌剂多菌灵 (纯度97.2%) 和甲基硫菌灵 (97%),DMIs 杀菌剂苯醚甲环唑 (96.1%) 和咪鲜胺 (97%),QoIs 杀菌剂吡唑醚菌酯 (96%) 和嘧菌酯 (96.5%),均为海南正业中农高科技有限公司提供。99%水杨羟肟酸(SHAM),上海麦克林生化科技有限公司。首先将多菌灵、甲基硫菌灵、苯醚甲环唑和咪鲜胺分别溶解并配制成1 × 103μg/mL 的母液,吡唑醚菌酯、嘧菌酯和水杨羟肟酸(SHAM)分别配制成5 × 105μg/mL 的母液备用,溶剂见表1。
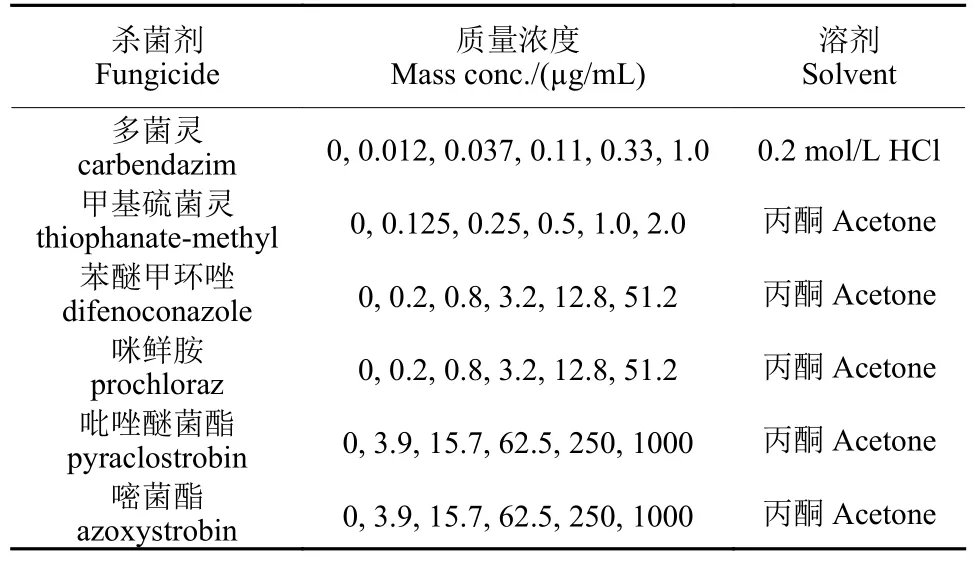
表1 本研究中所使用杀菌剂的最终浓度Table 1 The fungicide final concentrations used in the study
1.3 试验方法
1.3.1 敏感性测定 采用菌丝生长速率法测定101 株鳄梨蒂腐病菌对6 种杀菌剂的敏感性。在PDA 培养基中分别加入不同量的杀菌剂母液,配制得到不同浓度的含药培养基平板,最终试验浓度详见表1。此外,吡唑醚菌酯和嘧菌酯处理组中分别加入水杨羟肟酸母液使其终浓度为100 μg/mL,其作用是降低旁路呼吸途径对QoIs 杀菌剂的影响。对照培养基中仅含有等量的溶剂。每处理3 个重复,试验重复2 次。然后将培养3 d 后的菌丝块 (直径5 mm) 转移到含药PDA 平板上,于恒温培养箱28 ℃培养36 h 后,测量菌落直径并计算抑制率(I,%)。
式中:Dc和Dt分别为对照组和处理组菌落直径,cm。
1.3.2CYP51和Cytb基因克隆及序列分析
1.3.2.1 基因组DNA 提取 选取1.3.1 节中测得的对苯醚甲环唑和咪鲜胺抗性和敏感的菌株、对吡唑醚菌酯表现高水平抗性和敏感的菌株进行试验。各供试菌株于空白PDA 培养基上28 ℃培养3 d 后,从菌落边缘打取菌饼转接至铺有75 mm无菌玻璃纸的空白PDA 平板中央,28 ℃培养36 h后,用无菌载玻片刮取菌丝,加入液氮充分研磨,根据DNA 提取试剂盒说明书提取基因组DNA。
1.3.2.2 靶标基因克隆及测序 设计引物LtCYP51-F:5′-CCCTCCGTCTCCCTACACCT-3′,LtCYP51-R:5′-TTCTCCCTCCTCTCCCAAA-3′,用于扩增CYP51基因片段。PCR 扩增体系:总体系为40 μL,其中2 × Phanta Max Master Mix 20 μL,模板 DNA 0.8 μL,引物各1.6 μL,ddH2O 16 μL。PCR 扩增程序:95°C 预变性 3 min,35 个循环 (95°C 预变性30 s,58°C 退火 50 s,72°C 聚合 90 s),最后72°C 延伸5 min。设计引物Cytb1-F:
5′-TTATGGGTCATACAGAGC3- ′,Cytb1-R:5′-TA CAATAGCAGGCGGAGT -3′,用于扩增Cyt b基因片段,该片段含甲氧基丙烯酸酯类抗性潜在基因突变位点 (F129L、G137R、G143A)。PCR 扩增体系:总体系为40 μL,其中2 × Phanta Max Master Mix 20 μL,模板 DNA 0.8 μL,引物各1.6 μL,ddH2O 16 μL。PCR 扩增程序:95°C 预变性3 min,35 个循环 (95°C 预变性30 s,55°C 退火50 s,72°C 聚合 90 s),最后72°C 延伸 5 min。上述所有PCR 产物运用凝胶电泳检测,通过DNA 回收试剂盒纯化,将纯化后的DNA 送天一辉远生物科技有限公司(广州)测序,测序结果分别采用BLAST 和DNAMAN 进行比对分析。
1.3.3CYP51和Cyt b基因表达量测定 使用Primer 6.0 软件设计实时荧光定量 (qRT-PCR) 引物,以actin基因作为内参基因,测定CYP51和Cyt b基因的表达量,设计引物见表2。针对1.3.2.1节所选菌株,先将PDA 培养基上培养3 d 的菌株于菌落边缘取菌饼转移至PDB 培养液中,28 ℃、145 r/min 下培养24 h,然后分别采用终浓度为10 μg/mL 的苯醚甲环唑、咪鲜胺以及100 μg/mL 的吡唑醚菌酯含药培养液继续培养12 h,以加入等量溶剂的PDB 为对照。参照RNA 提取试剂盒说明书提取上述各处理菌株的RNA,使用Vazyme HiScriptRIII RT SuperMix for qPCR (+ g DNA wiper) 试剂盒对RNA Sample 进行逆转录。反应程序: 4 × g DNA wiper Mix 4 μL,RNA 样品500 ng,加入RNase-free ddH2O 至16 μL,42 ℃条件下孵育5 min;加入5 × HiScript qRT Super Mix 4 μL,37 ℃条件下孵育15 min,85 ℃条件下孵育5 s。cDNA 产物置于 -20 ℃环境中保存。qRT-PCR 反应体系:2 × ChamQ SYBR qPCR 10 μL,ddH2O 8.2 μL,引物各0.4 μL,cDNA 1 μL,总体系20 μL。qRT-PCR 扩增程序:95 ℃,30 s 预变性;95 ℃,5 s,42 个循环,变性;60 ℃,30 s,42 个循环,退火/延伸。相对基因表达量参照 2-ΔΔCT方法计算[29]。每次试验含3 个生物学重复与3 个技术重复。

表2 qRT-PCR 分析特异性引物Table 2 Specific primers for qRT-PCR analysis
1.4 数据处理
将供试药剂浓度转换为浓度对数,抑制率转换为几率值,使用probit 分析求回归方程y= a +bx并计算EC50值。所有数据均采用Levene 检验进行方差分析。敏感性分布采用Shapiro-Wilk 检验正态性,当P> 0.05 时为正态分布;采用基于log10转换的EC50值构建直方图,通过箱形图识别异常值,绘制鳄梨蒂腐病菌对6 种杀菌剂的敏感性分布图,并进行正态分析[29-30]。以EC50值大于敏感性基线的5 倍为抗性菌株。统计分析均采用SPSS 软件 (V 21.0)和Tukey 检验进行。
2 结果与分析
2.1 MBCs 杀菌剂多菌灵和甲基硫菌灵的毒力及敏感性基线
多菌灵和甲基硫菌灵对供试101 个鳄梨蒂腐病菌菌株的EC50值范围分别为0.01~0.19 μg/mL和0.02~2.19 μg/mL,2 种药剂对蒂腐病菌均表现出很好的抑制活性。不同种类鳄梨蒂腐病菌对多菌灵的敏感性差异较小,平均EC50值在0.06~0.09 μg/mL 之间,对甲基硫菌灵的敏感性则存在较大差异,平均EC50值为0.50~1.03 μg/mL (表3)。

表3 不同种类鳄梨毛色二孢属菌株对多菌灵和甲基硫菌灵的敏感性Table 3 Sensitivity of different species of Lasiodiplodia spp.on avocado to carbendazim and thiophanate-methyl
58 个L.pseudotheobromae菌株对多菌灵和甲基硫菌灵的敏感性均呈单峰曲线;依据箱形图,多菌灵和甲基硫菌灵各删除一个异常值后,所得敏感性频率分布曲线经Shapiro-Wilk 检验均呈正态分布(W= 0.970,df= 57,P= 0.171 和W= 0.986,df= 58,P= 0.761) (图1A 和1B),剔除异常值后平均EC50值分别为(0.06 ± 0.03)和(0.69 ± 0.47)μg/mL,该平均EC50值可分别作为鳄梨蒂腐病菌对多菌灵和甲基硫菌灵的敏感性基线。参照所得敏感性基线,本研究中暂未发现对多菌灵和甲基硫菌灵已产生抗性的菌株。

图1 鳄梨蒂腐病菌对6 种杀菌剂的敏感性频率分布Fig.1 Frequency distribution of the sensitivity of Lasiodiplodia spp.to 6 fungicides
2.2 DMIs 杀菌剂苯醚甲环唑和咪鲜胺的毒力及敏感性基线
苯醚甲环唑和咪鲜胺对供试101 株鳄梨蒂腐病菌的EC50值范围分别为0.04~9.64 μg/mL 和0.002~6.44 μg/mL。其中,苯醚甲环唑和咪鲜胺EC50值小于5 μg/mL 的菌株分别占92%和96%,表明2 种药剂对大部分鳄梨蒂腐病菌均表现出很好的抑制活性。苯醚甲环唑和咪鲜胺对不同种类鳄梨蒂腐病菌的EC50值范围分别为1.01~1.78 和0.80~1.34 μg/mL,其中L.pseudotheobromae和L.theobromae由于菌株数量较多,EC50值的范围也较大 (表4)。
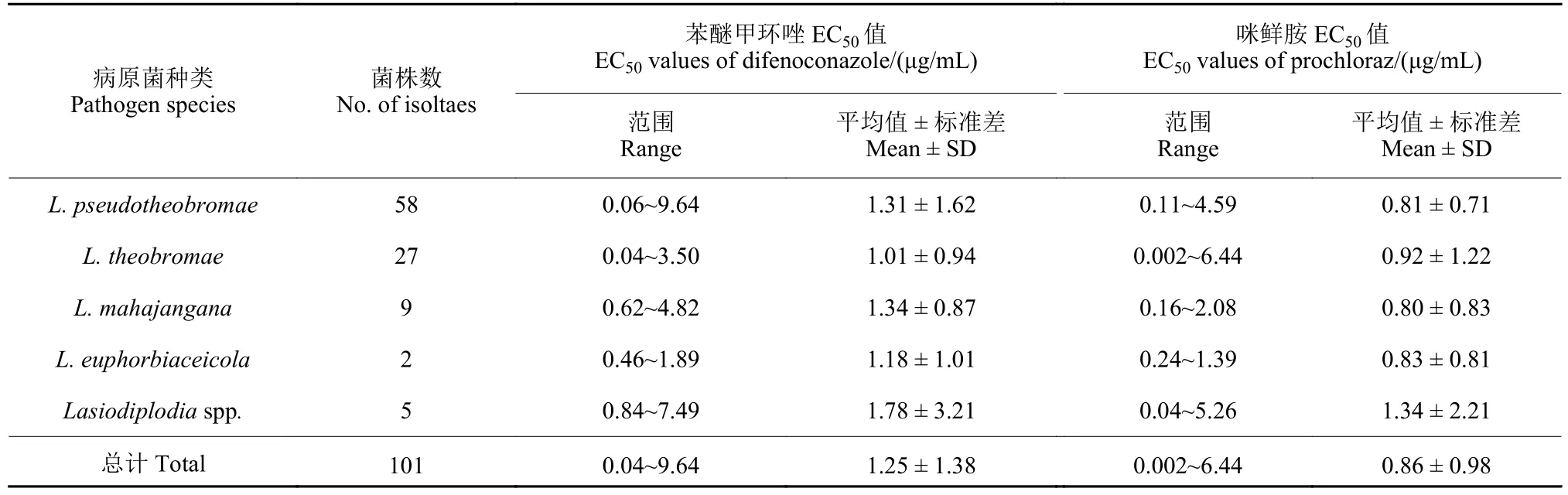
表4 不同种类鳄梨毛色二孢属菌株对苯醚甲环唑和咪鲜胺的敏感性Table 4 Sensitivity of different species of Lasiodiplodia spp.on avocado to difenoconazole and prochloraz
58 个L.pseudotheobromae菌株对苯醚甲环唑和咪鲜胺的敏感性均呈单峰曲线;敏感性频率经Shapiro-Wilk 检验均呈正态分布(W= 0.976,df=58,P= 0.302 和W= 0.980,df= 58,P= 0.462)(图1C 和1D),未出现异常值,苯醚甲环唑和咪鲜胺的平均EC50值分别为 (1.31 ± 1.62) 和 (0.81 ±0.71) μg/mL,可将该平均EC50值分别作为鳄梨蒂腐病菌对苯醚甲环唑和咪鲜胺的敏感性基线。参照该敏感性基线,发现对苯醚甲环唑表现敏感性降低的鳄梨蒂腐病菌有8 株,对咪鲜胺表现敏感性降低的菌株有7 株。
2.3 QoIs 杀菌剂吡唑醚菌酯和嘧菌酯的毒力及敏感性分析
101 株鳄梨蒂腐病菌中,有1 个菌株在吡唑醚菌酯和嘧菌酯质量浓度高达1000 μg/mL 时抑制率均低于10%,无法准确计算其EC50值,因此统计时删除了该菌株。吡唑醚菌酯和嘧菌酯对其余100 株病原菌的EC50值范围分别在0.14~1292.96 μg/mL 和14.55~4789.25 μg/mL 之间,平均EC50值分别为371.03 和622.86 μg/mL。其中优势种L.pseudotheobromae和L.theobromae的菌株数量多,EC50值范围较大。吡唑醚菌酯和嘧菌酯EC50值大于10 μg/mL 的菌株分别占供试菌株的91%和100%,表明供试绝大部分菌株对这2 种杀菌剂的敏感性均极低。不同种类鳄梨蒂腐病菌对吡唑醚菌酯和嘧菌酯的EC50平均值差异较大,但是5 种病原菌群体均对2 种药剂表现出极低的敏感性 (表5)。

表5 不同种类鳄梨毛色二孢属菌株对吡唑醚菌酯和嘧菌酯的敏感性Table 5 Sensitivity of different species of Lasiodiplodia spp.on avocado to pyraclostrobin and azoxystrobin
吡唑醚菌酯和嘧菌酯对57 个L.pseudotheobromae菌株的EC50平均值分别高达375.07 和721.32 μg/mL (表5),经Shapiro-Wilk 检验其敏感性频率均为非正态分布 (W= 0.881,df= 57,P=0.00 和W= 0.954,df= 57,P= 0.03) (图1E 和1F)。
2.4 杀菌剂靶标基因序列分析
2.4.1CYP51基因序列及比对 使用特异性引物LtCYP51-F 与LtCYP51-R 扩增鳄梨蒂腐病菌对苯醚甲环唑和咪鲜胺不同抗性及敏感菌株CYP51基因的编码区,扩增出一段长约1700 bp 的序列,包含3 个内含子,该序列共编码了510 个氨基酸。将碱基序列在GenBank中进行BLAST 搜索,结果显示与L.theobromae(Genebank No.MK107983.1)的CYP51同源性为99%~100%。对不同菌株的氨基酸序列比对结果表明,除苯醚甲环唑的1 个敏感菌株在第207 位与其他菌株相比存在差异外,其余菌株的序列完全一致;这些表现低水平抗性的菌株,其CYP51基因与敏感菌株及标准菌株相比并没有发现点突变 (图2)。

图2 苯醚甲环唑和咪鲜胺不同抗性及敏感菌株CYP51 基因氨基酸序列比对Fig.2 Sequence alignment of CYP51 gene in different resistance and susceptible isolates of difenoconazole and prochloraz
2.4.2Cyt b基因序列及比对 使用特异性引物Cytb1-F/Cytb1-R 扩增得到长度为466~481 bp 的Cyt b基因部分序列,无内含子,可编码155~160 个氨基酸。将供试菌株的Cyt b基因序列在GenBank 中进行BLAST 搜索,结果显示与L.theobromae菌株MCC2345 (Genebank No.MH880818.1) 同源性为99%~100%。将供试菌株的序列与MCC2345 菌株进行比对发现,这些表现高水平抗性的菌株,其Cyt b基因序列与敏感菌株相比也并未发现任何点突变 (图3)。

图3 吡唑醚菌酯和嘧菌酯不同抗性及敏感菌株Cyt b 基因序列比对Fig.3 Sequence alignment of Cyt b gene in the resistant and sensitive isolates of pyraclostrobin and azoxystrobin
2.5 杀菌剂靶标基因表达量分析
2.5.1CYP51基因表达量 在10 μg/mL 苯醚甲环唑处理下,所有菌株CYP51基因相对表达量均明显上调;其中,抗性菌株该基因的平均相对表达量为7.83,是敏感菌株的2.3 倍,即抗性菌株的相对表达量显著高于敏感菌株 (图4A) (P< 0.05)。在10 μg/mL 咪鲜胺胁迫下,所有菌株CYP51基因的相对表达量均大幅上调;其中,抗性菌株的平均相对表达量为26.07,是敏感菌株的8.2 倍,抗性菌株的相对表达量更远远高于敏感菌株 (图4B)(P< 0.05)。

图4 苯醚甲环唑 (A) 及咪鲜胺 (B) 处理后抗性(R)与敏感(S)菌株CYP51 基因的相对表达量Fig.4 Relative expression of CYP51 gene in the sensitive (S) or resistant (R) isolates after treatment with difenoconazole (A) and prochloraz (B)
2.5.2Cyt b基因表达量 经100 μg/mL 吡唑醚菌酯处理后,抗性菌株Cyt b基因平均相对表达量是对照的5.30 倍,而敏感菌株平均相对表达量是对照的5.55 倍。 即在100 μg/mL 吡唑醚菌酯胁迫下,虽然所有菌株Cyt b基因相对表达量均明显升高,但抗性菌株与敏感菌株表现一致,二者之间没有明显的差异 (图5) (P< 0.05)。
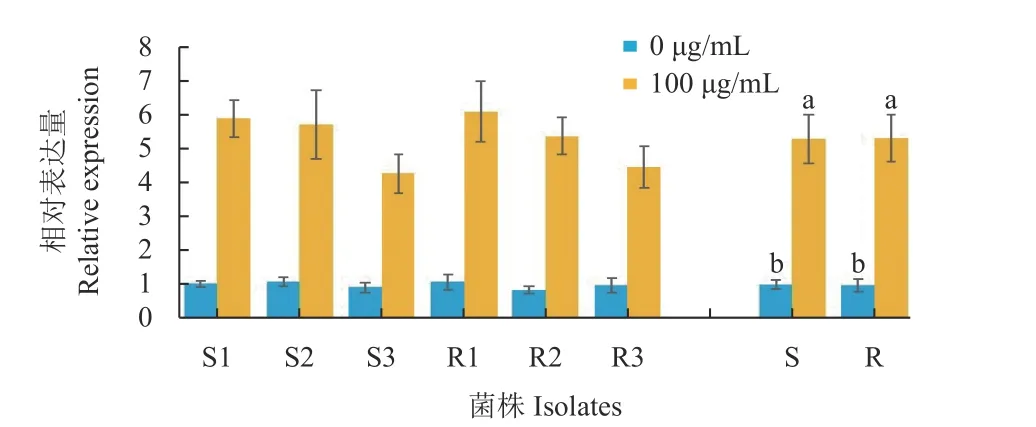
图5 吡唑醚菌酯处理后抗性菌株 (R) 与敏感菌株 (S)Cyt b 基因的相对表达量Fig.5 Relative expression of Cyt b gene in the sensitive(S) or resistant (R) isolates after treatment with pyraclostrobin
3 结论与讨论
本研究供试的 101 个菌株除了 5 个未鉴定到种外,其他96 个菌株分别被划归为 4 个种,包括L.pseudotheobromae、L.theobromae、L.mahajangana和L.euphorbiaceicola。针对6 种杀菌剂,采用菌丝生长速率法对上述101 个鳄梨蒂腐病菌菌株进行了敏感性测定,结果表明:不同药剂处理对菌丝的抑制活性存在明显差异,不同种鳄梨蒂腐病菌及同种不同菌株之间也均存在一定差异。所有供试鳄梨毛色二孢属菌株对MBCs 杀菌剂多菌灵和甲基硫菌灵均表现为高度敏感,没有出现敏感性下降的抗药性亚群体,且敏感性呈正态分布,可根据多菌灵和甲基硫菌灵的平均EC50值建立其敏感性基线,作为监测田间鳄梨毛色二孢属蒂腐病菌,尤其优势种L.pseudotheobromae对多菌灵和甲基硫菌灵敏感性变化的参考标准。本研究中的绝大多数鳄梨蒂腐病菌菌株对DMIs杀菌剂苯醚甲环唑和咪鲜胺也呈现出较高的敏感性,敏感性频率分布均呈单峰曲线和正态分布,同样根据其平均EC50值建立敏感性基线,作为田间抗药性监测的参考标准。
据报道,MBCs 和DMIs 杀菌剂对采后病害往往具有高效,多菌灵、甲基硫菌灵、咪鲜胺和苯醚甲环唑在田间的应用可大幅度降低柑橘、芒果蒂腐病发生率[15,31]。咪鲜胺还是一种世界公认的采后防腐杀菌剂,采前和采后应用均可控制鳄梨和芒果等果实的采后腐烂[27]。本研究表明,上述4 种杀菌剂对Lasiodiplodiaspp.鳄梨蒂腐病菌均有明显抑制活性,其中多菌灵效果最好。相比较而言,DMIs 杀菌剂对鳄梨蒂腐病菌的抑制效果低于MBCs 杀菌剂,该结果与前人的研究结果类似[27]。病原菌抗药性的产生除了与杀菌剂本身化学结构及作用机理有关外,还与杀菌剂施加选择压力的频率和持续时间有关。虽然MBCs 杀菌剂普遍具有高抗性风险,但菌株敏感性分布因杀菌剂使用历史和使用水平的不同而存在差异。有研究表明,巴西木瓜、海南芒果蒂腐病菌L.theobromae对该类杀菌剂产生了抗性,对一些抗药性菌株的EC50值甚至超过了1000 μg/mL[32-34]。本研究中也有少数供试菌株出现了对苯醚甲环唑或咪鲜胺敏感性下降的现象。因此,在鳄梨蒂腐病菌尚未产生抗药性之前,虽然上述杀菌剂、尤其是MBCs杀菌剂是控制鳄梨蒂腐病的优先选择,但在应用中还须密切监测其抗性变化情况,以防止田间抗性种群的形成并导致药剂防治失效。
据文献报道,QoIs 杀菌剂吡唑醚菌酯和嘧菌酯能够显著抑制病原菌菌丝生长,明显降低由可可毛色二孢L.theobromae引起的蒂腐病或枝枯病的发生[35-36]。然而本研究发现,供试菌株对这2 种杀菌剂的敏感性均极低,且敏感性呈非正态分布。由于不同菌株EC50值差异极大,本研究试验不断调整供试药剂浓度进行了多次测定及重复试验,结果是一致的。另外,由于L.mahajangana和L.euphorbiaceicola菌株数量太少,主要针对L.pseudotheobromae和L.theobromae进行不同种类病原菌之间比较时发现,二者的EC50值分布相似,平均EC50值也接近,从而排除了病原菌种类的影响。100 个菌株中,吡唑醚菌酯和嘧菌酯EC50值大于10 μg/mL 的分别有92 株(91%) 和100 株(100%),平均EC50值分别高达371.03 μg/mL和622.86 μg/mL,初步认为鳄梨蒂腐病菌群体呈现严重的抗药性分化。QoIs 也是高抗性风险杀菌剂,本研究表明此类药剂不宜用于鳄梨蒂腐病的防治。在木瓜和芒果上也有过类似的报道,发现蒂腐病菌L.theobromae对该类杀菌剂产生了严重抗性[32,37]。鉴于该类杀菌剂在国内鳄梨生产上的应用水平较低,使用年限也不长,出现如此严重抗性的原因还有待进一步研究。总的来说,鳄梨蒂腐病菌对杀菌剂的潜在抗性风险不容忽视,生产上在应用杀菌剂时必须严格控制剂量和用药频次,尽量降低药剂的选择压以防止和延缓田间群体抗药性的产生及发展。
大量研究已证实,病原菌对杀菌剂抗药性的产生常常与靶标基因的突变有关。例如:DMIs 杀菌剂的靶标基因CYP51和QoIs 杀菌剂靶标基因Cyt b的点突变,将导致药剂与病原菌亲和力降低,从而产生抗药性[38-41]。本研究发现存在对DMIs 药剂敏感性下降的菌株 (低抗菌株),以及对QoIs 药剂敏感性极低的菌株 (高抗菌株),因而针对上述菌株进一步进行了靶标基因的克隆、测序及比较。结果表明,无论是对咪鲜胺表现低水平抗性菌株 (EC50> 5 μg/mL) 的CYP51基因,还是对吡唑醚菌酯表现高水平抗性菌株 (EC50> 500 μg/mL) 的Cyt b基因,其基因序列均没有发现任何点突变。研究显示,病原菌抗药性的产生也有可能与靶标基因的过表达相关。如:对DMIs 抑制剂的抗性主要与CYP51基因的点突变或过量表达相关[38],对QoIs 抑制剂的抗性则在很大程度上取决于靶标基因Cyt b点突变或基因表达水平变化[42]。本研究针对靶标基因CYP51和Cyt b基因的测定结果表明:在苯醚甲环唑和咪鲜胺胁迫下,其抗性菌株靶标基因CYP51表达水平显著高于敏感菌株;但是在吡唑醚菌酯胁迫下,抗性菌株靶标基因Cyt b表达水平与敏感菌株之间没有差异。有研究指出,在很少或从未使用过该类杀菌剂的历史背景下,大量马铃薯早疫病菌Alternaria solani菌株对QoIs 杀菌剂即表现为不敏感,其原因并非由于产生抗药性所致[43]。因此,本研究中鳄梨蒂腐病菌对供试2 个QoIs 杀菌剂表现出如此低的敏感性,其原因是自身的耐药性还是由于产生了非靶标抗性,是一个值得关注的问题,还需进一步研究探明。
据我们所知,本研究是国内首次针对鳄梨蒂腐病菌进行的杀菌剂敏感性测定和抗药性报道,研究结果将有助于国内鳄梨蒂腐病科学防控策略的制定,并对我国鳄梨产业的健康持续发展具有重要意义。总的来说,鳄梨商业化种植在国内的发展历史较短,病虫害防治等生产管理技术相对落后,严重影响了其规模化种植及品质的提高。鉴于目前国内对鳄梨病虫害防治的深入研究较少,缺乏科学的综合防治措施,因此在本研究结果基础上,后续应扩大调查范围,采集更多的菌株就鳄梨蒂腐及其他病害展开研究,建立抗药性的长期监测体系势在必行。

