肿瘤相关巨噬细胞PKM2表达对食管癌细胞恶性表型的影响
刘 清, 谭依依, 陈 娇, 彭天元, 王 薇, 卢晓梅
(新疆医科大学第一附属医院临床医学研究院, 省部共建中亚高发病成因与防治国家重点实验室, 乌鲁木齐 830011)
食管癌是世界范围内最常见的恶性肿瘤之一,我国主要的病理类型是食管鳞癌,其发生可能与饮食习惯、生活方式等非遗传因素相关[1]。食管癌早期症状不明显,大多数患者就诊时已处于中晚期,常伴有转移,造成食管癌患者普遍预后较差[2]。研究发现,部分早期食管癌患者生存时间不足5年,并于术后半年内死于食管癌的广泛转移[3]。因此,掌握食管癌患者浸润转移情况,探索食管癌的分子水平异常与浸润转移的关联对于改善患者预后具有重要的意义。
肿瘤的浸润转移是肿瘤细胞和肿瘤微环境之间复杂的相互作用的结果[4]。肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)作为肿瘤微环境中重要的间质细胞成分,是影响肿瘤细胞侵袭、转移的重要靶点[5]。TAMs浸润是食管癌发生侵袭、转移的重要因素,食管癌微环境中TAMs浸润增多,并且与淋巴结转移以及临床分期呈显著正相关,高浸润TAMs的患者预后差,但TAMs浸润调控食管癌侵袭转移的相关机制目前仍不明确[6-7]。近来研究发现TAMs显示出类似肿瘤细胞糖酵解的代谢模式[8],作为糖酵解的关键酶,M2型丙酮酸激酶(Pyruvate kinase M2,PKM2)调控食管癌在内的多种肿瘤的发生和进展[9],然而PKM2调控TAMs糖酵解对食管癌细胞侵袭、转移影响的报道较少。本研究旨在探讨食管癌中PKM2表达对TAMs表型分化的影响,明确TAMs调控食管癌细胞迁移、侵袭恶性表型的机制。
1 材料与方法
1.1 试剂和仪器食管癌细胞株KYSE150和人单核细胞白血病细胞株THP-1(武汉普诺赛生命科技有限公司)。RPMI-1640培养液和青-链霉素(美国HyClone公司),胎牛血清(美国Gibco公司),干扰/过表达PKM2慢病毒(上海吉凯公司),佛波酯(PMA)、白介素4(IL4)和白介素13(IL13,美国MCE公司),Trizol试剂(美国life公司),反转录试剂盒(RevertAid First Strand cDNA试剂盒,美国Thermo公司),荧光定量PCR引物(生工生物工程上海股份有限公司),基质胶(美国BD公司),PKM2抗体(美国CST公司),CD163抗体(武汉proteintech公司),葡萄糖检测试剂盒(A154-1-1)和乳酸检测试剂盒(C012-2-1,南京建成公司)。荧光倒置显微镜(日本Olympus公司),Nano-Drop ND-2000超微量分光光度计(美国Thermo公司),荧光定量PCR仪、酶标仪(美国BioRad公司),DM3000图像采集系统(日本Leica公司)。
1.2 细胞培养KYSE150细胞在RPMI-1640培养液中培养,添加10%胎牛血清和1%青-链霉素。THP-1细胞在RPMI-1640培养液中培养,除添加15%胎牛血清和1%青-链霉素之外,添加0.05 mmol/L β-巯基乙醇,所有细胞均放置于37℃、5%CO2的恒温细胞培养箱中进行培养。
1.3 细胞转染于对数生长期收集THP-1细胞,按照5×105个/mL计数后将细胞接种于6孔板上,随机分为PKM2敲低组(PKM2 KD组)、PKM2敲低对照组(PKM2 KD NC组)、PKM2过表达组(PKM2 OE组)和PKM2过表达对照组(PKM2 OE NC组)。将携带绿色荧光的干扰/过表达PKM2的慢病毒按照感染复数(Multiplicity of infection,MOI)=20转染至THP-1细胞,待绿色荧光稳定表达后,使用PMA诱导THP-1细胞向巨噬细胞分化,24 h待细胞贴壁后继续使用IL4和IL13诱导48 h,使细胞分化为TAMs。
1.4 实时荧光定量PCR(qRT-PCR)慢病毒转染并诱导分化后收集细胞沉淀,使用Trizol法提取细胞总RNA。按照质量2 000 ng RNA反转录为cDNA,之后进行qRT-PCR实验。引物序列见表1。所有样本均设置3个复孔,以β-actin为内参,通过2-ΔΔCt法计算mRNA相对表达量。

表1 引物序列表
1.5 细胞迁移和侵袭检测Transwell实验检测共培养后食管癌KYSE150细胞的迁移和侵袭(铺基质胶)变化。在Transwell小室的下室中接种转染后的THP-1细胞并诱导为TAMs,在上室中按照5×105个/mL的量接种KYSE150细胞悬液100 μL,24 h后使用甲醇固定、0.1%结晶紫染色,PBS洗涤后在显微镜下随机选取3~5个视野观察穿过小室的细胞数,并计算分析。
1.6 裸鼠皮下荷瘤实验选取雌性BALB/c裸鼠,购自斯贝福(北京)生物技术有限公司[动物许可证号:SCXK(京)2019-0010],构建裸鼠皮下荷瘤模型,实验分为5组,分别为:模型对照组(TAMs细胞与KYSE150细胞)、CO-PKM2 KD NC组(转染PKM2 KD NC慢病毒的TAMs细胞与KYSE150细胞)、CO-PKM2 KD组(敲低PKM2的TAMs细胞与KYSE150细胞)、CO-PKM2 OE NC组(转染PKM2 OE NC慢病毒的TAMs细胞与KYSE150细胞)、CO-PKM2 OE组(过表达PKM2的TAMs细胞与KYSE150细胞)。上述细胞与基质胶1∶1混合后,在裸鼠右侧腋窝皮下注射200 μL细胞混合液。待成瘤后每4天测量各组裸鼠的皮下瘤块直径。4周后腹腔注射混合麻醉剂(10 mL/kg)麻醉后,摘眼球取血,全血静置、离心后得到血清样本,-80℃保存。处死小鼠后,取完整瘤块组织拍照、测量体积并称重,固定于4%多聚甲醛。本实验经新疆医科大学实验动物伦理委员会审批通过(审批号:IACUC-2023011021)。
1.7 免疫组化实验(IHC)固定后的瘤体组织经取材、包埋、切片后,进行免疫组化实验检测蛋白表达和定位。组织切片于60℃恒温烤箱内烤1 h,常规脱蜡、水化、抗原修复、去除内源性过氧化物酶,一抗孵育过夜(PKM2,1∶100;CD163,1∶100),次日二抗孵育后显色、复染、透明、封片,每张切片分别随机选取5个高倍镜视野进行观察并采集图像。按照阳性细胞比例(0:无阳性肿瘤细胞,1:<25%阳性肿瘤细胞,2:26%~50%阳性瘤细胞,3:51%~75%阳性肿瘤细胞,4:>75%阳性肿瘤细胞)和染色强度(0:无染色,1:淡黄色,2:浅褐色,3:深褐色)的乘积进行评分。
1.8 ELISA实验收集各组裸鼠血清,通过试剂盒法检测葡萄糖和乳酸水平。在酶标仪上读取吸光度值后,根据公式:血清葡萄糖/乳酸含量(mmol/L)=(样本OD值-空白OD值)/(校准OD值-空白OD值)×标准品浓度×样本稀释倍数,对结果进行统计分析。
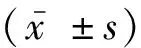
2 结果
2.1 慢病毒转染后TAMs细胞中PKM2的表达情况通过qRT-PCR检测转染PKM2敲低/过表达慢病毒并诱导为TAMs后(图1),细胞水平PKM2及巨噬细胞表型标志物的表达情况,结果显示,转染PKM2干扰慢病毒后,与PKM2 KD NC组相比,PKM2 KD组细胞内PKM2表达水平显著降低(1.02±0.20vs0.42±0.24),PKM2 KD组细胞内M1型巨噬细胞标记物NOS2表达明显上调(0.90±0.11vs1.67±0.13)(P均<0.05),M2型巨噬细胞标记物CD163轻微下调(1.21±0.13vs0.73±0.32)(P>0.05),肿瘤相关巨噬细胞标记物CCL5表达下调(0.98±0.07vs0.70±0.13)(P<0.05)。转染PKM2过表达慢病毒后,与PKM2 OE NC组相比,PKM2 OE组细胞内PKM2表达水平显著升高(1.08±0.10vs1.71±0.12),PKM2 OE组NOS2表达明显下调(0.88±0.14vs0.22±0.05)(P均<0.05),CD163(0.94±0.05vs1.08±0.60)轻微上调(P>0.05),CCL5表达上调(0.95±0.07vs1.26±0.15)(P<0.05),见图2。

图1 荧光显微镜下观察细胞内PKM2干扰/过表达慢病毒转染效率(放大倍数10×10)

注:与PKM2 KD NC组相比, *P<0.05, **P<0.01; 与PKM2 OE NC组相比, △P<0.05, △△P<0.01。
2.2 TAMs细胞中PKM2的表达对食管癌KYSE150细胞迁移和侵袭的影响将KYSE150细胞与敲低PKM2表达的TAMs共培养后,与PKM2 KD NC组相比,PKM2 KD组KYSE150细胞迁移和侵袭能力均显著下降(91.00±5.89vs69.00±4.12,58.00±2.50vs37.00±5.74)(P均<0.001)。将KYSE150细胞与过表达PKM2的TAMs共培养后,与PKM2 OE NC组相比,PKM2 OE组KYSE150细胞迁移和侵袭能力均显著增强(82.00±7.55vs110.00±6.95,57.00±4.16vs79.00±3.42)(P均<0.01),见图3。
2.3 裸鼠荷瘤模型分析通过裸鼠荷瘤模型验证以上研究结果,结果发现敲低PKM2的TAMs细胞与KYSE150细胞混合接种后,与CO-PKM2 KD NC组相比,CO-PKM2 KD组裸鼠皮下移植瘤体积和重量有所减小,差异无统计学意义(P均>0.05),瘤体内PKM2和CD163表达下降(P均>0.05),血清葡萄糖和乳酸水平显著下降(P均<0.05)。过表达PKM2的TAMs细胞与KYSE150细胞混合接种后,与CO-PKM2 OE NC组相比,CO-PKM2 OE组裸鼠皮下移植瘤体积和重量有所增大,差异无统计学意义(P均>0.05),瘤体内PKM2和CD163表达上调(P均>0.05),血清葡萄糖和乳酸水平显著升高(P均<0.05)。见表2、图4~6。

图4 裸鼠皮下荷瘤模型瘤体重量和体积比较
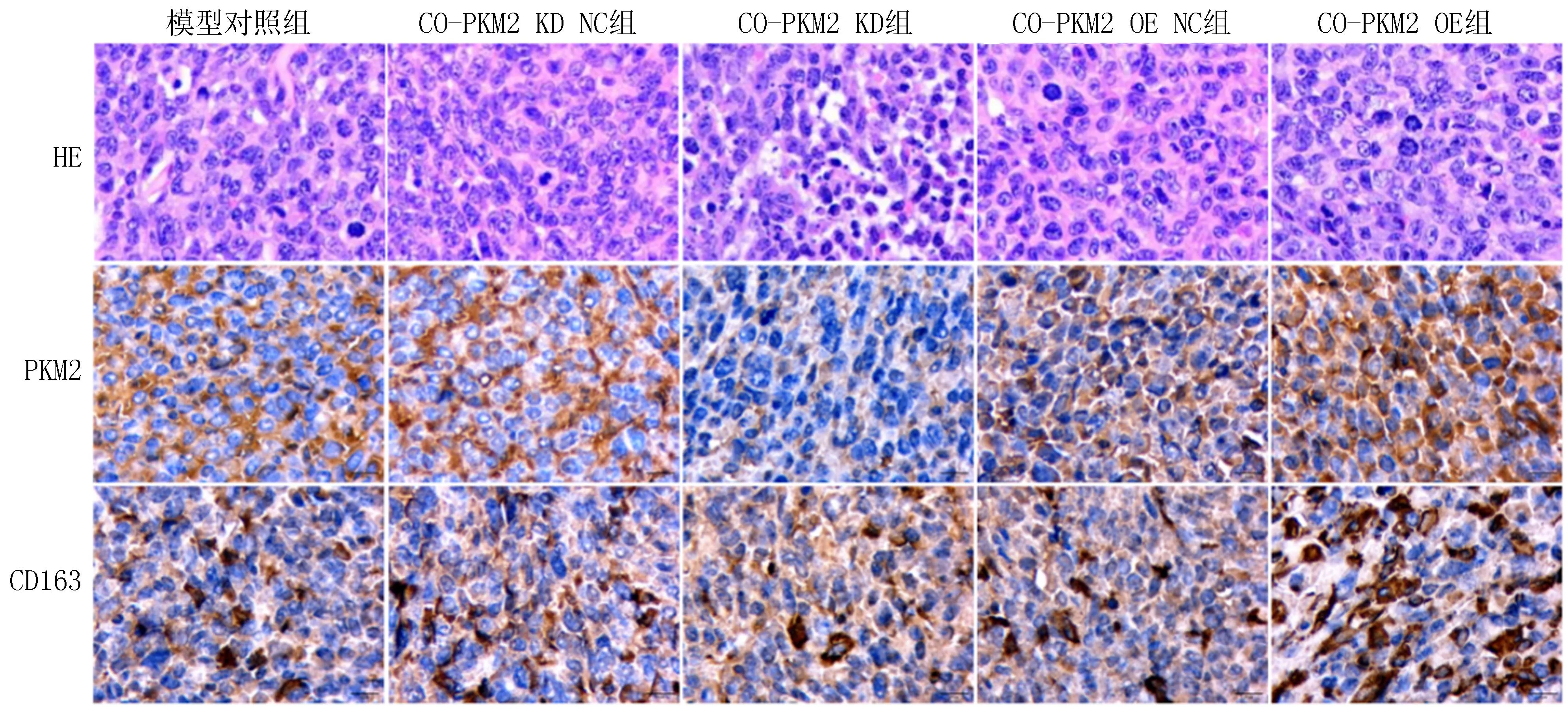
图5 免疫组化检测各组肿瘤组织PKM2、CD163表达(放大倍数10×40)

注: *P<0.05。

表2 各组肿瘤组织PKM2、CD163表达强度评分对比[M(P25,P75)]
3 讨论
肿瘤细胞恶性表型变化导致的肿瘤侵袭和转移,不仅由肿瘤细胞本身变化引起,还受肿瘤微环境中多种因素的调控[10]。TAMs作为肿瘤微环境中重要的间质细胞成分,分泌多种生长因子,促进肿瘤血管及淋巴管新生,上调丝氨酸蛋白酶、组织蛋白酶等的表达,破坏基底膜,溶解细胞外基质,从而增强肿瘤细胞的侵袭性[11]。研究表明,食管癌微环境中TAMs浸润增多,高浸润TAMs的患者预后差,将TAMs与食管癌细胞共培养,食管癌细胞侵袭能力显著增强[12]。Hu等[13]检测了100例食管癌临床样本中TAMs标记物CD163的表达,结果发现癌巢中TAMs浸润数量显著增多,且TAMs浸润与淋巴结转移以及临床分期呈显著正相关。以上研究均表明TAMs浸润是食管癌发生侵袭、转移的重要因素,但其相关机制目前仍不明确。
近来研究发现TAMs显示出类似肿瘤细胞糖酵解的代谢模式。在胰腺导管腺癌中,通过不同培养基诱导TAMs分化形成后,其糖酵解水平升高,乳酸生成增多,进一步阻断TAMs糖酵解途径,血管网络新生、肿瘤细胞外渗受到显著抑制,上皮间质转化(Epithelial-mesenchymal transition,EMT)作用减弱,肿瘤转移显著减少,说明TAMs糖酵解水平是影响胰腺导管腺癌浸润、转移的重要因素[14]。有关TAMs糖酵解对食管癌恶性表型的影响值得深入研究。
PKM2是有氧糖酵解的关键酶,在多种肿瘤细胞系和癌组织中特异性高表达,在肿瘤的新陈代谢和恶性增殖中发挥重要作用[15-16]。在肿瘤中PKM2调控巨噬细胞糖酵解对肿瘤细胞侵袭、转移的影响鲜见报道。在肝癌相关研究中[17],将THP-1细胞与敲低PKM2的肝癌细胞来源的外泌体共培养后,与对照组比较,THP-1细胞表达M1型巨噬细胞标记物NOS2和HLA-DRA显著增多,表达M2型巨噬细胞标记物CD163和MRC1,以及TAMs标记物CCL5和IL-10均显著减少,说明在肝癌中,微环境PKM2表达是调控TAMs表型分化的重要因素。本研究在细胞水平,通过转染干扰或过表达PKM2的慢病毒至TAMs中,发现敲低PKM2后M1型巨噬细胞标记物NOS2表达上调,M2型巨噬细胞标记物CD163和肿瘤相关巨噬细胞标记物CCL5表达下调;过表达PKM2后NOS2表达下调,CD163和CCL5表达上调,即PKM2表达能够促进TAMs表型分化。
PKM2在食管癌中显著高表达,并与食管癌患者预后不良显著相关[18]。然而,微环境中PKM2的表达是否影响食管癌细胞的恶性表型尚未见报道。本研究进一步将食管癌细胞与敲低或过表达PKM2的TAMs共培养,观察共培养对食管癌细胞迁移、侵袭能力的影响,发现与敲低PKM2的TAMs共培养后,食管癌细胞迁移和侵袭能力显著下降,与过表达PKM2的TAMs共培养后,食管癌细胞迁移和侵袭能力显著增强,说明TAMs细胞中PKM2的表达能够影响食管癌细胞的迁移和侵袭能力。裸鼠成瘤模型验证该结果,发现敲低PKM2的TAMs细胞与食管癌细胞混合接种后,皮下荷瘤体积和重量较对照组减小,PKM2和CD163表达下降,且反映糖代谢水平的血清葡萄糖和乳酸水平显著下降;而过表达PKM2的TAMs细胞与食管癌细胞混合接种后,皮下荷瘤体积和重量较对照组增大,PKM2和CD163表达上调,血清葡萄糖和乳酸水平显著升高,说明PKM2可能通过调控TAMs糖代谢水平,从而影响食管癌的进展。
综上,本研究发现PKM2作为微环境中重要的调控因子,能够促进TAMs的表型分化,是促进食管癌细胞侵袭转移恶性表型的重要因素。本研究结果为微环境影响肿瘤细胞恶性表型的机制研究提供了新的思路。

