基于目标设置的多学科团队肺康复训练在慢性阻塞性肺疾病患者中的应用效果
赵虹,秦立志,景艳色,李亚妹
作者单位:050041 河北省石家庄市,河北省胸科医院呼吸内科
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是目前最常见的慢性呼吸系统疾病,是全球第三大致死原因[1-2]。研究表明,2002—2004年,我国40岁以上人群COPD患病率约为8.2%[3],10年后该数据已上升至13.6%[4]。COPD患者呼吸道症状明显、通气受限,这会严重影响其工作和生活[5],且高昂的医疗费用会给患者及社会造成巨大的经济负担[6]。此外,COPD是一种伴随患者终身的慢性疾病,因而康复治疗对患者尤为重要。
肺康复训练(pulmonary rehabilitation,PR)是通过全面评估慢性呼吸系统疾病患者心肺功能而制定的个体化综合干预方案,包括但不限于运动训练、教育和行为改变,从而改善患者的身心健康,以形成长期、稳定的有利于健康的生活方式和习惯[7]。研究表明,PR是改善COPD患者预后的有效干预措施,其可降低患者再入院率,改善患者短期和长期生活质量[8]。2020年慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)《慢性阻塞性肺疾病诊断、治疗与预防全球策略》[9]也强调了PR在COPD患者管理中的突出作用。然而,对于不同疾病严重程度的COPD患者,如何制定适当的PR方案仍有待商榷。
目标设置是现代康复方法的一个基本和有效的组成部分,首先设置符合患者实际健康情况和康复需求的目标,然后患者将自己的行为结果与既定的目标相对照,从而及时调整和修正相应的行为[10];相比于传统PR,基于目标设置的多学科团队(multidisciplinary team,MDT)PR通过MDT为患者提供定时的评估以及后续的计划,有助于为患者制定更为个体化的PR方案。本研究旨在探讨基于目标设置的MDT PR在COPD患者中的应用效果,以期为COPD患者选择合适的PR方案提供参考。
1 对象与方法
1.1 研究对象
本研究为一项前瞻性、单中心、单盲的随机对照研究。选取2022年6—12月河北省胸科医院呼吸与危重症医学科收治的COPD患者203例为研究对象。纳入标准:(1)年龄≥35岁;(2)符合COPD的诊断标准,即存在慢性咳嗽、咳痰、呼吸困难等症状,吸入支气管舒张剂后第1秒用力呼气容积(forced expiratory volume in one second,FEV1)/用力肺活量(forced vital capacity,FVC)<0.70[11];(3)处于疾病稳定期,最近3个月内没有因急性加重而住院;(4)签署知情同意书。排除标准:(1)合并活动性肺结核、肺纤维化、肺癌、COVID-19或气胸者;(2)行动能力缺失,难以配合完成相关检查者;(3)合并微生物感染、冠状动脉综合征及心力衰竭者;(4)合并骨科、神经肌肉疾病,无法配合运动测试者。通过计算机生成随机序列,然后将患者分为试验组(102例)和对照组(101例),分组信息使用不透明的密封信封分发。本研究经河北省胸科医院伦理委员会批准(No.2022058)。
1.2 干预方法
对照组患者接受常规PR,包括有氧运动(主要包括步行和举哑铃)、自我饮食营养管理。
试验组患者接受基于目标设置的MDT PR,具体内容如下:(1)组建MDT。组建由2名呼吸科医生、2名肺康复护士、1名康复师、1名营养师、1名心理治疗师组成的MDT,其中呼吸科医生、肺康复护士、康复师负责PR相关的知识培训与监督患者完成PR,营养师主要负责营养管理,心理治疗师主要负责对患者进行健康教育及心理疏导。(2)设置目标。共需要完成6轮目标设置,1个月为1轮。MDT根据《中国慢性呼吸道疾病呼吸康复管理指南(2021年)》[12],采用相应的评价准则及时评估目标,并基于评估结果给出下一轮目标。主要的目标设置方案如下:①呼吸康复目标设置。患者主要通过有氧运动训练(步行)和抗阻运动训练(举哑铃)来实现呼吸康复,具体目标如下:第一轮步行速度目标为出院前最后1次6分钟步行试验(6-minute walking test,6MWT)中步行速度的80%,每次持续时间为40 min(共两轮,每轮20 min),4次/周,每周增速0.25 km/h;第二轮步行速度的起始值为上一轮6MWT中最后一周步行速度的80%,依次类推,当患者步行速度达5 km/h时,维持该步行速度直至试验结束。第一轮抗阻运动的目标为举哑铃10次,隔日1次,每次分1~3组完成,每周增加3次;第二轮抗阻运动的起始值为上一轮举哑铃次数的80%,依次类推,当患者举哑铃次数达30次时,维持该次数直至试验结束。②营养目标设置。营养师首先采用营养风险筛查2002(nutritional risk screening 2002,NRS 2002)量表评估患者营养状况,然后根据评估结果设置营养目标:若患者评估结果为营养良好,则每日能量摄入量的最终目标值为30 kcal/kg,每日蛋白质摄入量的最终目标值为1.2 g/kg;若评估结果为营养不良,则每日能量摄入量的最终目标值为40 kcal/kg,每日蛋白质摄入量的最终目标值为1.8 g/kg。下一轮每周能量摄入量/蛋白质摄入量比上一轮增加25%。(3)PR的实施。患者出院前,MDT对其进行PR相关知识培训;患者出院后,MDT通过微信网络平台指导和监督患者完成有氧运动训练、抗阻运动训练和规范摄入能量、蛋白质,同时心理治疗师定期评估患者心理状态,对存在心理问题的患者及时进行心理教育及心理疏导,减少其不良情绪。
两组患者均干预6个月。
1.3 观察指标
(1)一般资料。收集患者一般资料,包括年龄、性别、BMI、吸烟情况、合并疾病(高血压、糖尿病、冠心病、慢性肾脏病、肿瘤)。(2)6分钟步行距离(6-minute walking distance,6MWD)。分别于干预前及干预1、2、4、6个月采用6MWT评估患者运动耐力,即患者在平坦无障碍的场所行走6 min,记录6MWD,6MWD越长表示患者运动耐力越好。(3)圣乔治呼吸问卷(St. George's Respiratory Questionnaire,SGRQ)评分。分别于干预前及干预1、2、4、6个月采用SGRQ[13]评估患者生活质量,SGRQ包括症状、活动及日常生活影响3个维度共50个条目,总分范围为0~100分,评分越低表示患者生活质量越高。(4)FEV1/FVC。分别于干预前及干预1、2、4、6个月采用日本捷斯特CHESTGRAPH肺功能仪(型号:HI-301)检查患者肺功能,记录FEV1/FVC。(5)汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)、汉密顿抑郁量表(Hamilton Depression Scale,HAMD)评分。分别于干预前及干预1、2、4、6个月采用HAMA[14]、HAMD[15]评估患者焦虑、抑郁情况,其中HAMA包括14个条目,总分64分,得分越高表示患者焦虑情绪越明显;HAMD包括24个条目,总分75分,得分越高表示患者抑郁情绪越明显。(6)急性加重情况及因急性加重再入院情况。统计患者干预6个月内急性加重情况及因急性加重再入院情况,其中急性加重定义为至少连续2天发生2种及以上主要症状(呼吸困难、痰液化脓、痰量较多)或任何1种主要症状加上至少1种轻微症状(感冒、喘息、喉咙痛、咳嗽)[16]。
1.4 统计学方法
采用SPSS 23.0统计学软件进行数据分析。计量资料以(±s)表示,两组间比较采用成组t检验,重复测量资料比较采用双因素重复测量方差分析;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
研究期间试验组有4例患者退出本研究,对照组有3例患者退出本研究,最终共196例患者完成本研究(试验组98例,对照组98例)。两组年龄、性别、BMI、吸烟者占比及合并高血压、糖尿病、冠心病、慢性肾脏病、肿瘤者占比比较,差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较Table 1 Comparison of general data between the two groups
2.2 6MWD、SGRQ评分
干预方法与时间在6MWD、SGRQ评分上存在交互作用(P<0.05);干预方法、时间在6MWD、SGRQ评分上主效应显著(P<0.05)。试验组干预1、2、4、6个月6MWD长于对照组,SGRQ评分低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组不同时间6MWD、SGRQ评分比较(±s)Table 2 Comparison of 6MWD and SGRQ score between the two groups at different time
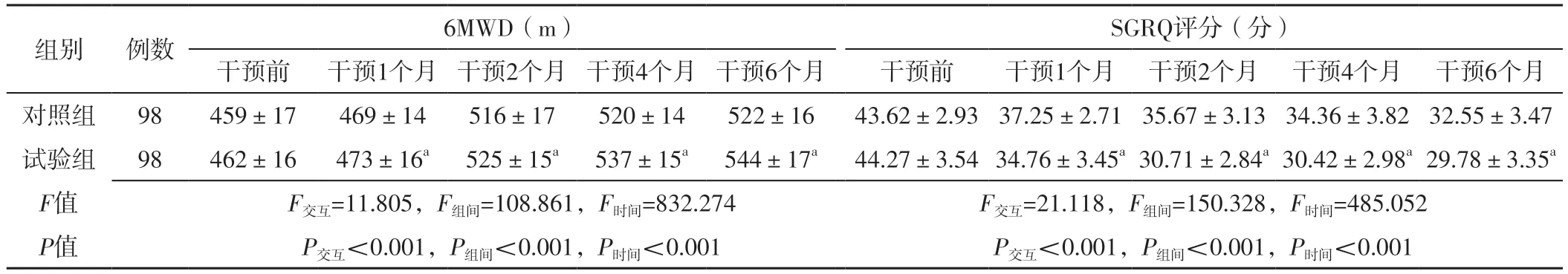
表2 两组不同时间6MWD、SGRQ评分比较(±s)Table 2 Comparison of 6MWD and SGRQ score between the two groups at different time
注:6MWD=6分钟步行距离,SGRQ=圣乔治呼吸问卷;a表示与对照组比较,P<0.05。
组别例数6MWD(m)SGRQ评分(分)干预前 干预1个月 干预2个月 干预4个月 干预6个月干预前干预1个月 干预2个月 干预4个月 干预6个月对照组98459±17469±14516±17520±14522±1643.62±2.93 37.25±2.71 35.67±3.13 34.36±3.82 32.55±3.47试验组98462±16473±16a 525±15a 537±15a 544±17a44.27±3.54 34.76±3.45a 30.71±2.84a 30.42±2.98a 29.78±3.35a F值F交互=11.805,F组间=108.861,F时间=832.274F交互=21.118,F组间=150.328,F时间=485.052 P值P交互<0.001,P组间<0.001,P时间<0.001P交互<0.001,P组间<0.001,P时间<0.001
2.3 FEV1/FVC及HAMA、HAMD评分
干预方法与时间在FEV1/FVC 上存在交互作用(P<0.05),在HAMA、HAMD评分上不存在交互作用(P>0.0 5);干预方法在FEV1/FVC 上主效应显著(P<0.05),在HAMA、HAMD评分上主效应不显著(P>0.05);时间在FEV1/FVC及HAMA、HAMD评分上主效应显著(P<0.05)。试验组干预4、6个月FEV1/FVC高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组不同时间FEV1/FVC及HAMA、HAMD评分比较(±s)Table 3 Comparison of FEV1/FVC,HAMA and HAMD scores between the two groups at different time

表3 两组不同时间FEV1/FVC及HAMA、HAMD评分比较(±s)Table 3 Comparison of FEV1/FVC,HAMA and HAMD scores between the two groups at different time
注:FEV1=第1秒用力呼气容积,FVC=用力肺活量,HAMA=汉密尔顿焦虑量表,HAMD=汉密尔顿抑郁量表;a表示与对照组比较,P<0.05。
组别例数FEV1/FVC(%)HAMA评分(分)干预前 干预1个月 干预2个月 干预4个月 干预6个月干预前 干预1个月 干预2个月 干预4个月 干预6个月对照组9854.4±9.9 55.4±10.4 56.3±9.4 58.5±8.5 60.7±10.36.3±3.26.2±3.05.5±3.25.3±3.25.1±3.0试验组9853.8±10.3 55.5±9.8 57.4±8.8 63.2±9.1a 65.4±8.2a6.8±3.66.3±3.45.3±2.25.0±2.14.2±2.4 F值F交互=3.532,F组间=4.910,F时间=36.395F交互=0.295,F组间=0.527,F时间=12.528 P值P交互=0.008,P组间=0.028,P时间<0.001P交互=0.876,P组间=0.469,P时间<0.001组别HAMD评分(分)干预前干预1个月干预2个月干预4个月干预6个月对照组5.56±4.265.46±4.134.82±3.354.34±3.214.06±3.22试验组5.24±3.235.05±3.074.43±3.034.15±3.354.07±3.14 F值F交互=0.782,F组间=0.123,F时间=10.484 P值P交互=0.533,P组间=0.726,P时间<0.001
2.4 急性加重情况及因急性加重再入院情况
对照组干预6个月内发生急性加重2例(2.04%),试验组干预6个月内发生急性加重3例(3.06%);两组干预6个月内急性加重者占比比较,差异无统计学意义(χ2=0,P=1.000)。两组干预6个月内均无患者因急性加重再入院。
3 讨论
运动能力是心血管疾病患者死亡的敏感预测指标[17]。在一般人群和各种肺部疾病患者中,运动能力受损、6MWD缩短与更高的COPD发病率和死亡风险相关[18]。不可逆的阻塞性肺通气功能障碍是COPD患者肺通气功能障碍的主要类型之一,因此大部分COPD患者的运动能力会明显下降[9]。而PR的主要目的是通过呼吸肌训练、呼吸技巧和运动训练等逐步提升患者的运动能力[19]。现有研究证明,PR可有效改善慢性呼吸道疾病患者的肺功能,提高运动能力、生活质量,并且能够降低患者死亡率[20]。据报道,6~8周的PR有助于提高COPD患者的运动能力[21]。研究显示,基于目标设置的PR有助于提高患者的运动耐力,减轻焦虑、抑郁情绪;相比于传统PR,基于目标设置的PR有助于为不同情况的患者制定个体化、更为适宜的PR强度,有助于减少不良事件的发生[22]。本研究结果显示,试验组干预1、2、4、6个月6MWD长于对照组,提示基于目标设置的MDT PR可有效提高患者的运动能力。分析原因,基于目标设置的MDT PR确立了每个运动训练阶段的目标,并根据患者的耐受性调整训练的时间、方式、强度,这激发了患者训练的积极性,从而有计划地提高其运动强度,进而提高运动能力。
本研究结果显示,试验组干预1、2、4、6个月SGRQ评分低于对照组,提示基于目标设置的MDT PR可有效提高COPD患者的生活质量。据报道,体力活动和生活质量之间存在较强的相关性[23]。基于目标设置的MDT PR通过设置体力活动目标,可逐步改善患者肺部气流受限状态,促使其独立完成一些日常活动,从而提高生活质量。
本研究结果显示,试验组干预4、6个月FEV1/FVC高于对照组,提示基于目标设置的MDT PR可有效改善COPD患者肺功能。基于目标设置的MDT PR根据患者实际情况设置个体化的呼吸训练方案及目标,引导患者维持训练动力,逐步提升呼吸功能,实现肺功能的改善。研究表明,PR可以通过提高自然杀伤细胞和细胞毒性T细胞的活性增强巨噬细胞的吞噬能力,刺激抗炎细胞因子的产生,从而有效提高机体免疫应答能力,增加肺部对损伤的应激能力,这为PR改善肺功能的分子机制提供了依据[24]。
心理状况不佳可能是COPD患者病情急性加重的风险因素[25],因为伴有抑郁和焦虑的患者可能治疗依从性较低,导致未来病情恶化的风险增加[26]。但本研究结果显示,干预方法在HAMA、HAMD评分上主效应不显著,分析原因,入组的患者大部分没有明显的焦虑、抑郁情绪,且由于难以对患者情绪设置具体的目标值,所以试验组仅是进行定期的心理辅导,在患者基线情绪较为良好的前提下,基于目标设置的MDT PR并未显示出优势。
本研究结果还显示,两组干预6个月内急性加重者占比比较,差异无统计学意义;两组干预6个月内均无患者因急性加重再入院;提示基于目标设置的MDT PR在COPD患者中应用的安全性较好。
4 结论
综上所述,基于目标设置的MDT PR可以有效提高COPD患者运动耐力、生活质量,改善患者肺功能,且短期安全性较好,但尚未发现其可以有效减轻患者焦虑、抑郁情绪。既往研究分析了COPD患者PR过程中的主观积极度,结果显示,一部分患者需要监督才能够完成PR,而持续的PR是患者获得良好预后的保证[27-28]。传统PR在很大程度上依赖于患者的主观能动性,相比之下,基于目标设置的MDT PR对于主观能动性低的患者可能更为有效,但这会在一定程度上增加医疗负担,包括增加医务人员的工作负荷和患者的经济负担,因此确定哪些患者更适合基于目标设置的MDT PR对临床工作者尤为重要。此外,本研究尚存在一定局限性:首先,尽管纳入的患者和退出本研究的患者在人口统计学和临床特征方面没有差异,但是仍不能排除潜在偏倚;其次,本研究仅针对短期内一家医院的患者,样本量较小,可能限制研究结果的外推性。为了解决这些局限性,有必要进行进一步的多中心、前瞻性、长期观察性研究和随机对照试验。
作者贡献:赵虹、秦立志进行文章的构思、设计、可行性分析及文献/资料收集、整理;赵虹撰写论文;赵虹、秦立志、景艳色进行论文的修订;李亚妹负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

