2021—2022年我国部分地区猪轮状病毒分子流行病学调查
何晓明,田小艳,王东东,刘桂武,李春梅,叶敏慧
(温氏食品集团股份有限公司,广东 云浮 527400)
轮状病毒(rotavirus,RV)隶属呼肠孤病毒科,是各种幼龄动物非细菌性腹泻的主要病原之一[1]。在我国,猪轮状病毒(porcine rotavirus,PoRV)感染非常普遍,PoRV感染后,使仔猪机体免疫力急剧下降,从而诱发多种腹泻病原混合感染,导致仔猪死亡率上升或生长缓慢、停滞[2]。猪轮状病毒的基因组是由11个独立片段的双股正链RNA(dsRNA)组成。分别编码6种结构蛋白(VP1~VP4,VP6和VP7)和6种非结构蛋白(NSP1~NSP6),其中,第11节段有的编码2种蛋白(NSP5和NSP6)[3]。PoRV的11个基因之间均易发生重配事件[4]。病毒粒子有3层衣壳,呈20面体对称,最外层为VP7和VP4,VP7和VP4的特异性可将轮状病毒分为2个血清型,分别是G型(VP7)和P型(VP4)[5],且G型与P型之间会产生不同的组合,不同组合型的PoRV毒株诱导的交叉保护性低[6]。根据2013年分类方法,以及外衣壳蛋白VP4、VP7和VP6基因序列,将轮状病毒分为G、P和I基因型[7]。轮状病毒基因群、基因型多样,且不同国家和地区流行类别不同。目前,在人和动物PoRV中已鉴定出35种G基因型、50种P基因型[8]和18种I基因型。
本研究拟对2021—2022年采自广东、广西、江西、湖南、云南和贵州6个省份的规模化猪场腹泻样品进行PoRV检测,对阳性场样品进行VP4和VP7基因测序,采用生物信息学软件进行氨基酸序列分析和系统进化分析,了解猪群PoRV的感染情况和流行趋势,丰富PoRV分子流行病学资料,为有效防控PoRV提供科学依据,为新型疫苗研发提供参考依据。
1 材料与方法
1.1 病料样品
2021—2022年来自广东、广西、江西、湖南、云南和贵州6省规模化猪场送检的腹泻样品,共计86个猪场,6 472份样品。按1∶1体积比加入无菌PBS并震荡混匀,反复冻融3次,4 ℃ 5 000 r/min离心5 min,取上清液置于-20 ℃保存备用。
1.2 主要试剂
核酸提取试剂盒购自杭州博日科技股份有限公司,HiScript®Ⅱ One Step RT-PCR Kit、DL2000 plus DNA Marker购自南京诺唯赞生物科技股份有限公司。
1.3 引物设计
用于检测猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV),猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV),PoRV,猪德尔塔冠状病毒(porcine deltcoronavirus,PDCoV)和猪急性腹泻综合征冠状病毒(swine acute diarrhea syndrome coronavirus,SADS-CoV)的引物均参照文献[9-10]合成。同时,根据GenBank上登录的PoRV VP7和VP4基因序列分别设计VP7、VP4基因特异性扩增引物。所有引物均由生工生物工程(上海)股份有限公司合成。引物信息见表1。

表1 引物信息
1.4 临床样品RT-PCR检测
吸取备用检测样品300 μL,使用博日抽提试剂盒及配套核酸提取仪,按操作说明书进行操作,提取的核酸于-20 ℃保存。使用HiScript®Ⅱ One Step RT-PCR Kit进行配置反应体系,2×PCR Master Mix 12.5 μL,One Step Enzyme Mix 1.25 mL,20 μmol/L上下游引物各0.5 μL,RNA 5 μL,RNase-free ddH2O 5.25 μL,混合均匀。PCR反应条件为:50 ℃ 30 min,94 ℃ 3 min;94 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸10 min。取5 μL PCR产物经1.2%琼脂凝胶电泳,判定结果。
1.5 PoRV VP7和VP4基因扩增、测序
对PoRV阳性感染猪场的RT-PCR检测条带较亮样品的核酸进行VP7、VP4基因的扩增,反应体系为:2×PCR Master Mix 12.5 μL,One Step Enzyme Mix 1.25 μL,上、下游引物各0.5 μL,模板5 μL,ddH2O 5.25 μL。反应条件为:94 ℃ 5 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 1.2 min,30个循环;72 ℃延伸 10 min。反应结束后,取5 μL PCR产物经1.2%琼脂凝胶电泳,将阳性扩增产物送生工生物工程(上海)股份有限公司进行测序。
1.6 PoRV VP7和VP4基因型鉴定及序列分析
将测序获得的VP7和VP4基因的核苷酸序列在NCBI BLAST在线分析,精准确定相应毒株的基因型,采用Lasergene软件、MEGA11.0等软件进行分析。本研究中所使用的82个参考序列 (表2)均从 GenBank 获得。

表2 参考序列
2 结果
2.1 腹泻样本PoRV的检测
2021—2022年间,共检测了86个种猪场的6 472份腹泻样品,所有样品均未检测到TGEV和SADS-CoV病原。PEDV、PoRV和PDCoV猪场阳性率分别为:11.63%(10/86)、65.12%(56/86)和4.65%(4/86),样品阳性率分别为:11.80%(764/6 472)、27.89%(1 805/6 472)和2.92%(189/6 472),提示PoRV可能是引起这些猪场腹泻的主要病因。此外,几种腹泻病毒还呈现不同程度的混合感染,如PoRV和PEDV的混合感染率为4.57%(296/6 472),PoRV和PDCoV的混合感染率为0.32%(21/6 472)。
2.2 PoRV VP7基因分型及系统进化分析
将本研究中测序获得的76株PoRV VP7基因序列与GenBank中已知G基因型的代表毒株通过MEGA11.0软件进行遗传进化分析,结果显示(图1):共检测到8种基因型,其中G9为优势基因型(42.10%),G5、G26、G3、G4、G1、G2和G11 各占26.32%、9.21%、6.58%、6.58%、3.95%、2.63%和2.63%。云南省猪场检测到除G4型以外的7种基因型,YNLSTC猪场在2年内监测到3种G型,分别为G1、G3和G5;其余监测猪场暂未检测到不同的G基因型;广东省猪场检测到的毒株以G9(11/21)和G5(8/21)为主;江西省猪场检测到的毒株以G9(9/15)为主;广西省猪场检测到的毒株以G9(4/15)为主;湖南省猪场检测到G9(5/7)和G26(2/7)两种基因型。由于轮状病毒各G型毒株之间氨基酸的同源性较低,仅对测序获得的32株G9优势基因型和9株参考G9基因型的氨基酸进行同源性分析,VP7基因之间氨基酸同源性为72.1%~100%(图2)。测序所获得的32株P[13]基因与GenBank上美国参考毒株RVA-Pig-wt-USA-Indiana119-1-2014-G9同源性仅为72.1%~74.9%。从氨基酸同源性结果来看,监测的猪场目前暂未发现感染美国流行的G9基因型毒株。江西的JXJGC20210102、JXJGC20221027和广东的GDHSYEC20221011、GDCWC20221010共4个毒株同其他G9毒株的同源性最高只有89.9%。

△为本研究中的毒株,▲为NCBI中代表毒株;GZ为贵州省毒株,YN为云南省毒株,JX为江西省毒株,HN为湖南省毒株,GX为广西省毒株,GD为广东省毒株。下同。

图2 G9型毒株VP7基因氨基酸同源性性比较
2.3 PoRV VP4基因分型及系统进化分析
将本研究中测序获得的35株PoRV VP4基因序列与NCBI中已知P基因型的代表毒株通过MEGA11.0软件进行遗传进化分析(图3),结果显示:共检测到5种P基因型,以P[13]型为主,占57.14%,其次为P[7]、P[23]、P[3]和P[6]型,占比分别为20%、14.29%、5.71%和2.86%。广东省猪场检测到 P[6]、P[7]、P[13]和P[23]共4种基因型,云南省和江西省猪场检测到P[7]和P[13]2种基因型毒株,广西省猪场检测到P[13]和P[23]2种基因型毒株,湖南省猪场检测到P[3]和P[13]2种基因型毒株,贵州省检测到P[7]和P[23]2种基因型毒株。由于轮状病毒各P型毒株之间的同源性较低,仅对20株P[13]优势基因型和5株参考P[13]基因型的氨基酸进行氨基酸同源性分析,VP4基因之间氨基酸同源性为72.5%~100%(图4),测序所获得的20株P[13]基因与GenBank上的P[13]型参考毒株RVA-Murine-tc-CHN-SCLS-M-2018同源性在89.3%~97.2%之间,与参考毒株RVA-Pig-wt-BRA-SUI26A-2008同源性在72.5%~76.5%之间,从氨基酸同源性结果来看,猪场P[13]基因型毒株与鼠源轮状病毒较高,推测可能是鼠源轮状病毒通过老鼠感染了猪群。
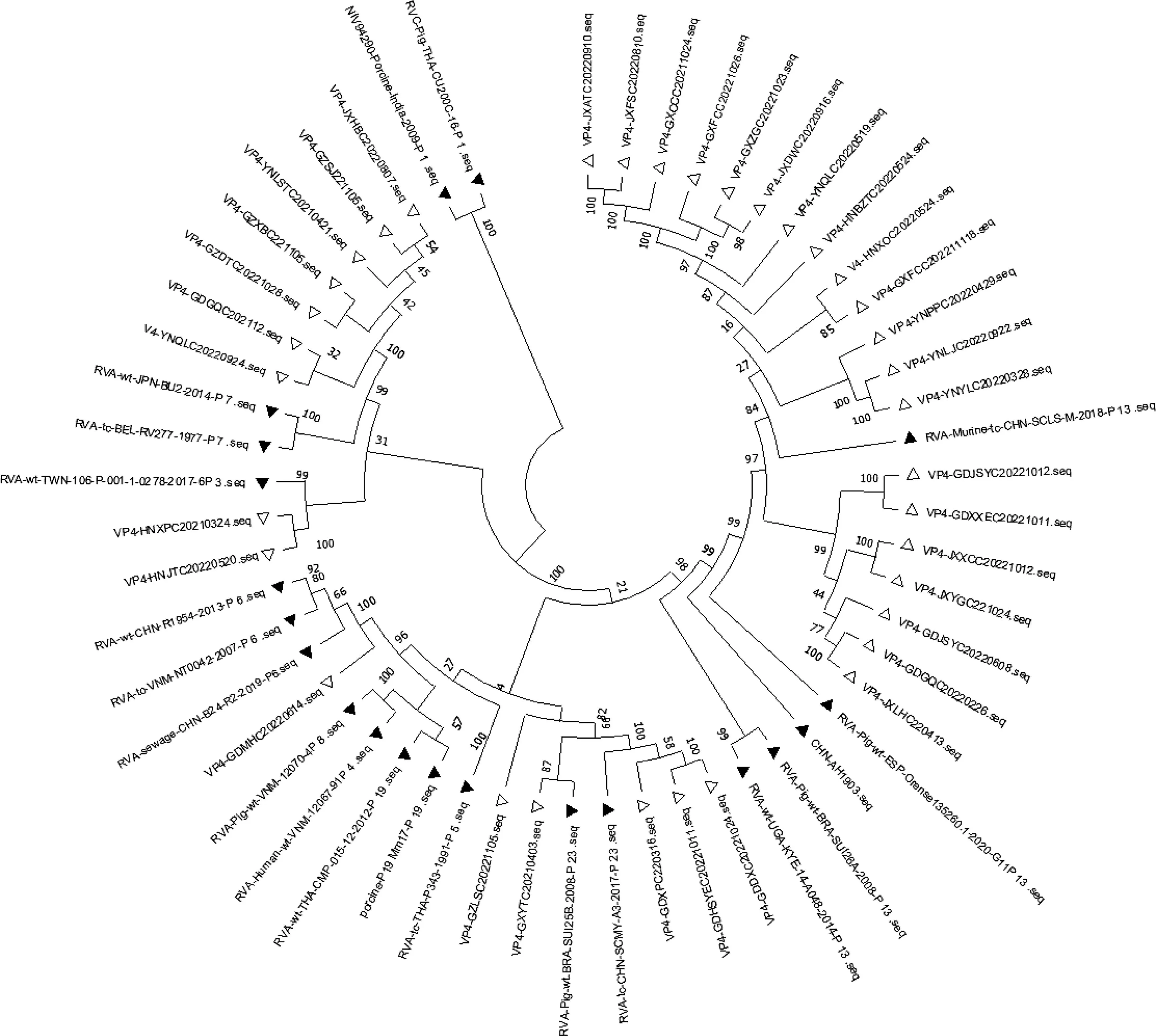
图3 基于PoRV VP4序列(810 bp)利用邻近法构建的遗传进化树

图4 P[13]型毒株VP4基因氨基酸同源性比较
2.4 PoRV G/P基因型分型
35份样本成功鉴定出G/P组合基因型,共包括15种G/P基因型组合,G9P[13](28.57%)为优势组合基因型,其他基因型为G5P[13](11.43%)、G4P[13](8.57%)、G9P[23](8.57%)、 G26P[13](5.71%)、G1P[7](5.71%)、G26P[3](5.71%)、G5P[7](5.71%)、G3P[7](2.86%)、G11P[23](2.86%)、G5P[23](2.86%)、G11P[7](2.86%)、G3P[13](2.86%)、G5P[6](2.86%)和G4P[7](2.86%),其中G11P[7]为国内首次鉴定的基因型组合,PoRV的基因型详细分布见表3。

表3 猪场PoRV感染基因型的分布
3 讨论
本研究通过对2021—2022年贵州、云南、江西、湖南、广西和广东6个省共86个规模化猪场的6 472份仔猪腹泻粪便样本进行了腹泻相关病毒检测,PoRV、PEDV和PDCoV阳性率分别为27.89%、11.80%和2.92%,猪场阳性率分别为65.12%、11.63%和4.65%;PoRV和PEDV的混合感染率为4.57%,PoRV和PDCoV的混合感染率为0.32%。本研究结果表明PoRV在不用地区猪场中感染严重且分布广泛,有必要继续加强对不同猪场PoRV的监测,为PoRV感染的防控提供了重要的科学依据。
VP7和VP4分别决定轮状病毒的G型和P型,且G型与P型之间会产生不同的组合,不同组合型的轮状病毒毒株诱导的交叉保护性低[3,5]。目前PoRV在全球范围内广泛流行,基因型多样,加强对PoRV不同G/P基因型的监测和研究,对了解PoRV的遗传进化和疫苗研究非常重要。在本研究中,G9和G5为流行G基因型,分别占分型毒株的42.11%和26.32%;P[13]、P[7]和P[23]为流行P基因型,分别占分型毒株的57.14%、20%和14.29%,其中P[13]型PoRV最具多样性和复杂性;优势G/P组合基因型为G9P[13],占分型样本的28.57%。其中广东和云南的组合基因型最为复杂,存在6种不同的基因型组合,推测原因可能是广东和云南猪场PoRV感染率升高的同时,PoRV流行基因型之间重组频率也在逐渐增高,后期应加强对广东、云南地区猪群PoRV分子流行病学的监测,重视对猪群轮状病毒的防控与管理。本研究还在云南地区检测出了G11P[7],该组合基因型首次在国内出现。周群等[11]对2017—2019年四川省猪A群轮状病毒分子流行病学进行调查,揭示G9型和P[13]型为分别为优势G基因型和P基因型,G9P[23]为优势组合基因型。本研究结果也表明G9和P[13]型为主要的基因型,与周群等[11]的监测结果一致,但优势组合基因型为G9P[13],与2017—2019年四川地区优势基因型不同。
猪轮状病毒流行率不断增加,遗传多样性越来越复杂。因此,分子流行病学方面的研究应该不断更新,有助于更好地了解PoRV的流行病学特征,对PoRV感染的防控具有重大指导意义,也为新型疫苗候选株的筛选提供了参考。

